第八章常见的酸碱盐章末复习---2021-2022学年九年级化学科粤版(2012)下册(word版有答案)
文档属性
| 名称 | 第八章常见的酸碱盐章末复习---2021-2022学年九年级化学科粤版(2012)下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 161.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-06 10:41:05 | ||
图片预览


文档简介
第八章 常见的酸碱盐 章末复习
一、单选题
1.下列物质的用途主要利用其化学性质的是
A.液氮用作冷冻剂 B.干冰用于人工降雨
C.稀有气体作霓虹灯电光源 D.工业用高温煅烧石灰石制取二氧化碳
2.学化学,用化学。下列说法不正确的是
A.农业上常用熟石灰改良酸性土壤 B.氢氧化钠可直接用于配制生理盐水
C.工业上常用焦炭来冶炼金属 D.进入久未开启的地窖,应先做灯火试验
3.下列有关熟石灰的说法错误的是
A.熟石灰又称为消石灰 B.熟石灰是一种常见的碱
C.熟石灰的溶解度随温度升高而增大 D.熟石灰可以用来配制农药波尔多液
4.除去下列物质中的少量杂质,所选用的试剂或方法正的是
选项 物质 杂质 所用试剂或方法
A CO2 CO 通入过量氧气,点燃
B CaO CaCO3 高温煅烧
C N2 O2 放入燃着的蜡烛
D FeC12溶液 CuCl2 加入适量镁粉,过滤
A.A B.B C.C D.D
5.下列有关物质的化学式、名称、俗名完全对应的是
A.NaOH、氢氧化钠、烧碱 B.NaCl、氯化钠、食盐
C.H2O2、过氧化氢、双氧水 D.CaO、氧化钙、熟石灰
6.将一定质量的碳酸钙和铜粉置于一敞口容器中,加热煅烧使其完全反应。若反应前后容器内固体质量不变,则容器中铜和碳酸钙的质量比是
A.11 :14 B.20 :14 C.44 :25 D.16 :25
7.分类法是化学学习的常用方法,下列分类正确的是
A.碱:烧碱、生石灰、消石灰 B.混合物:空气、粗盐、海水
C.合金:生铁、黄铜、赤铁矿 D.盐:纯碱、酒精、硫酸铜
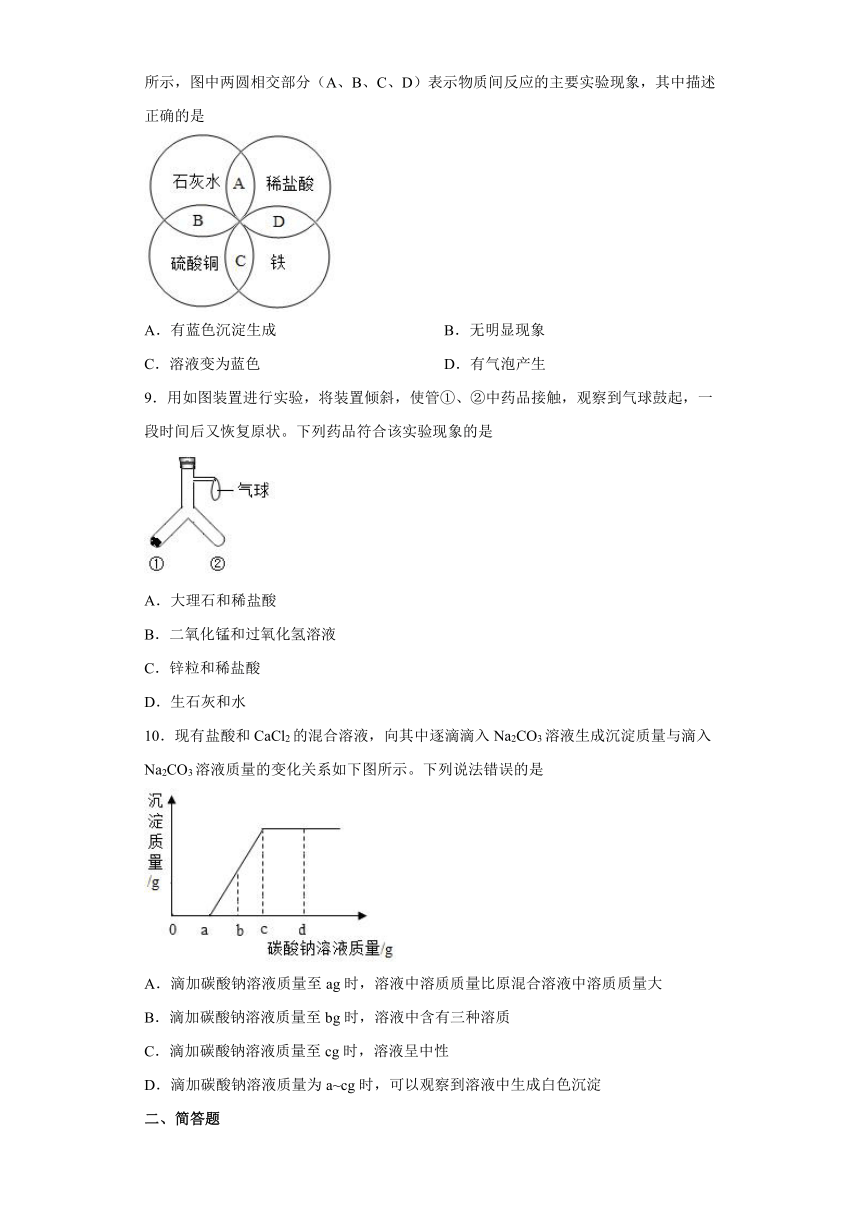
8.铁、盐酸、石灰水、硫酸铜是初中化学中常见的物质,四种物质间的反应关系如图所示,图中两圆相交部分(A、B、C、D)表示物质间反应的主要实验现象,其中描述正确的是
A.有蓝色沉淀生成 B.无明显现象
C.溶液变为蓝色 D.有气泡产生
9.用如图装置进行实验,将装置倾斜,使管①、②中药品接触,观察到气球鼓起,一段时间后又恢复原状。下列药品符合该实验现象的是
A.大理石和稀盐酸
B.二氧化锰和过氧化氢溶液
C.锌粒和稀盐酸
D.生石灰和水
10.现有盐酸和CaCl2的混合溶液,向其中逐滴滴入Na2CO3溶液生成沉淀质量与滴入Na2CO3溶液质量的变化关系如下图所示。下列说法错误的是
A.滴加碳酸钠溶液质量至ag时,溶液中溶质质量比原混合溶液中溶质质量大
B.滴加碳酸钠溶液质量至bg时,溶液中含有三种溶质
C.滴加碳酸钠溶液质量至cg时,溶液呈中性
D.滴加碳酸钠溶液质量为a~cg时,可以观察到溶液中生成白色沉淀
二、简答题
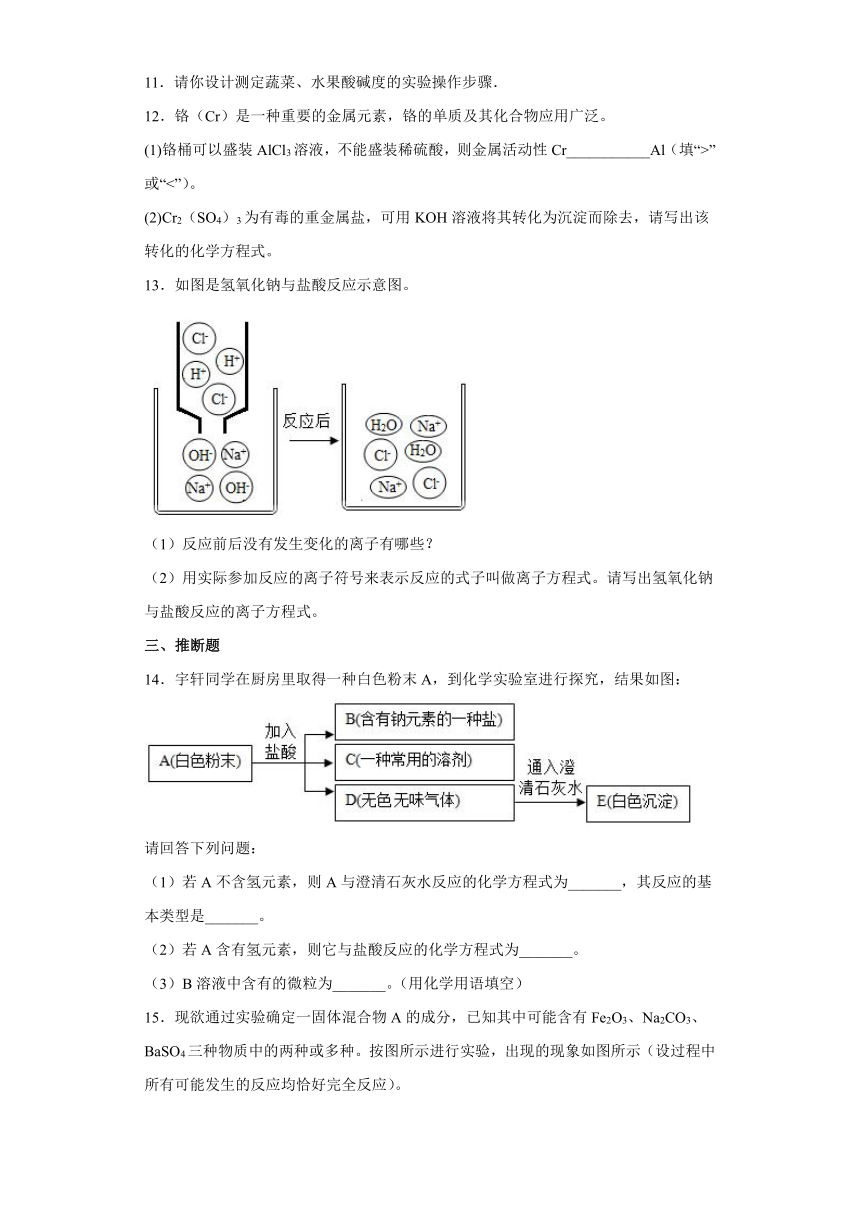
11.请你设计测定蔬菜、水果酸碱度的实验操作步骤.
12.铬(Cr)是一种重要的金属元素,铬的单质及其化合物应用广泛。
(1)铬桶可以盛装AlCl3溶液,不能盛装稀硫酸,则金属活动性Cr___________Al(填“>”或“<”)。
(2)Cr2(SO4)3为有毒的重金属盐,可用KOH溶液将其转化为沉淀而除去,请写出该转化的化学方程式。
13.如图是氢氧化钠与盐酸反应示意图。
(1)反应前后没有发生变化的离子有哪些?
(2)用实际参加反应的离子符号来表示反应的式子叫做离子方程式。请写出氢氧化钠与盐酸反应的离子方程式。
三、推断题
14.宇轩同学在厨房里取得一种白色粉末A,到化学实验室进行探究,结果如图:
请回答下列问题:
(1)若A不含氢元素,则A与澄清石灰水反应的化学方程式为_______,其反应的基本类型是_______。
(2)若A含有氢元素,则它与盐酸反应的化学方程式为_______。
(3)B溶液中含有的微粒为_______。(用化学用语填空)
15.现欲通过实验确定一固体混合物A的成分,已知其中可能含有Fe2O3、Na2CO3、BaSO4三种物质中的两种或多种。按图所示进行实验,出现的现象如图所示(设过程中所有可能发生的反应均恰好完全反应)。
试根据实验过程和发生的现象填写以下空白:
(1)气体B是_____(写化学式)。
(2)溶液C中,一定存在的阴离子是_____(写离子符号)。
(3)现象E为_____,步骤③所发生反应的化学方程式为_____。
(4)根据上述现象,固体混合物A中一定含有_____种物质。
16.已知A、B、C、D、E是初中化学中常见的五种物质,均含有同一种元素。其中A为单质,B和C含有的元素完全相同,D与其他四种物质属于不同的类别,E是一种重要建筑材料的主要成份,它们在一定条件下的转化关系如图所示(反应条件和部分反应物、生成物已省略),请回答:
(1)请写出图中各物质的化学式:
A:______B:______C:______D:______E:______。
(2)请写出下列反应的化学方程式:
A→C:______;B→E:______;
(3)请写出由A元素形成的两种单质的名称______。A的单质之间组成元素虽然相同,但性质、用途却有着明显的差异,其原因是______。
17.A~J是初中化学常见的物质,它们之间有如图所示的转化关系(部分反应条件已略去),其中A是一种液体,H是一种红色固体,化合物J只含两种元素,其溶液呈黄色。
请回答下列问题:
(1)A物质的化学式为________。
(2)反应①②③④中属于置换反应的是_________。
(3)物质G的一种用途________。
(4)写出反应④的化学方程式_________。
四、实验题
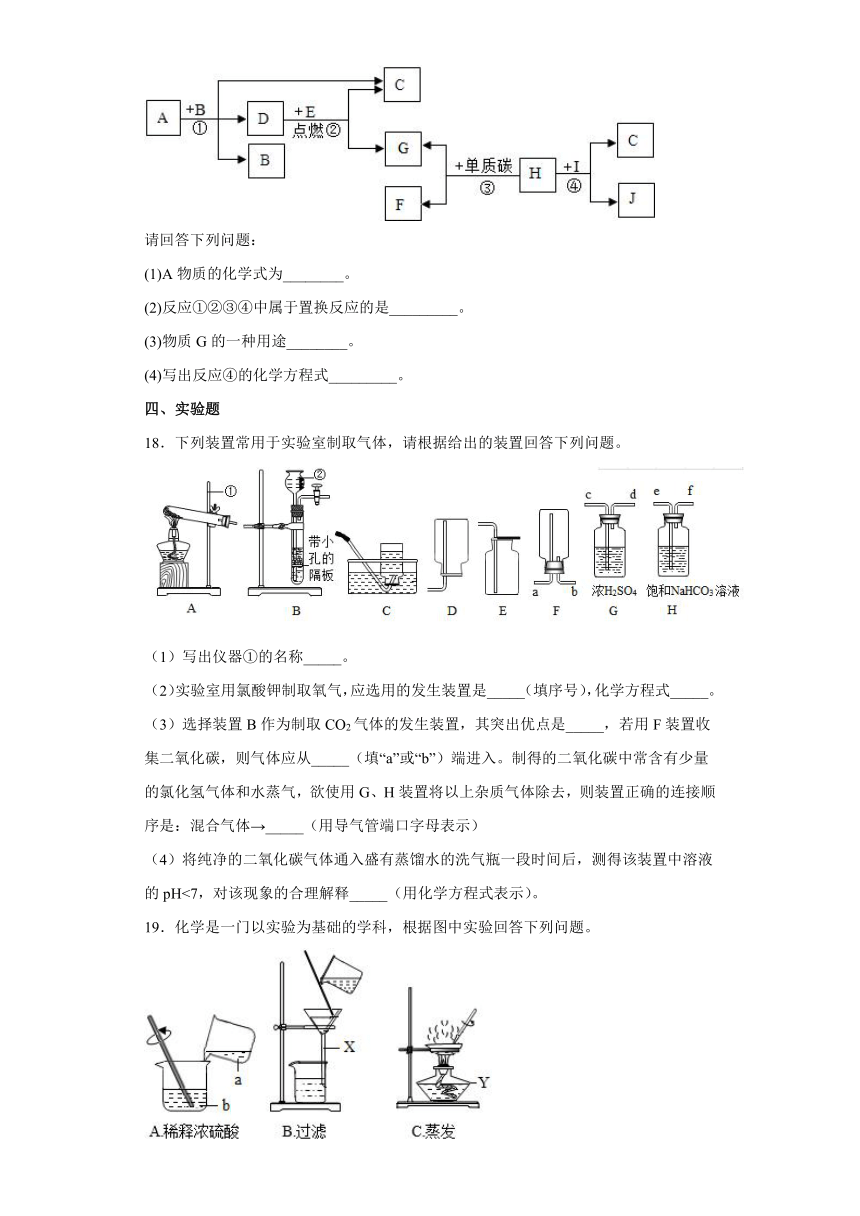
18.下列装置常用于实验室制取气体,请根据给出的装置回答下列问题。
(1)写出仪器①的名称_____。
(2)实验室用氯酸钾制取氧气,应选用的发生装置是_____(填序号),化学方程式_____。
(3)选择装置B作为制取CO2气体的发生装置,其突出优点是_____,若用F装置收集二氧化碳,则气体应从_____(填“a”或“b”)端进入。制得的二氧化碳中常含有少量的氯化氢气体和水蒸气,欲使用G、H装置将以上杂质气体除去,则装置正确的连接顺序是:混合气体→_____(用导气管端口字母表示)
(4)将纯净的二氧化碳气体通入盛有蒸馏水的洗气瓶一段时间后,测得该装置中溶液的pH<7,对该现象的合理解释_____(用化学方程式表示)。
19.化学是一门以实验为基础的学科,根据图中实验回答下列问题。
(1)填写仪器名称:X_____________;Y_____________。
(2)实验A的操作过程是_______________。
(3)A、B、C三个实验中都使用了玻璃棒,其中在实验C中的作用是___________。
20.某化学兴趣小组为验证硫酸的部分化学性质,进行了如下实验。
(1)实验一:向装有CuO的试管中加入一定量的稀硫酸,观察到氧化铜完全溶解并得到蓝色溶液,该反应的化学方程式为________;
实验二:向装有NaOH溶液的试管中加入一定量的稀硫酸,没有观察到明显现象;
(2)实验三:为了证明NaOH溶液和稀硫酸发生了反应,该组同学设计了如图一所示实验,传感器测定的pH和温度随溶液质量变化情况见图二、图三。
则B溶液是________,图三中的M与图二中X、Y、Z中的________数值相等;
(3)实验四:将实验一和实验二所得溶液混合得到蓝色沉淀,则实验二所得溶液的溶质为___。
五、计算题
21.尿素〔CO(NH2)2〕是化肥中最主要的一种,其含氮量高,在土壤中不残留任何有害物质,长期施用没有不良影响。
(1)尿素属于化肥中的______肥(填“氮”“钾”或“复合”)。
(2)CO(NH2)2中共含有______(写数字)种元素;
(3)CO(NH2)2的相对分子质量是______
(4)CO(NH2)2中C、H、N、O元素的质量比为______。
22.洁厕灵是常用的陶瓷清洗液,某同学对某品牌洁厕灵的有效成分的含量进行探究。他向一个锥形瓶中加入100 g该品牌的洁厕灵,再加入120 g溶质质量分数为7% 的NaHCO3溶液,二者恰好完全反应。(洁厕灵有效成分是HCl,洁厕灵中其他成分均不与NaHCO3反应。)
请计算:该品牌洁厕灵中HCl的质量分数是多少?
23.某超市卖的纯碱(Na2CO3)产品往往含有少量的杂质,化学兴趣小组的同学通过实验来测定该纯碱样品中纯碱的质量分数。他们取12g纯碱样品放入烧杯中,逐滴加入稀盐酸至不再产生气泡为止,共消耗盐酸100g,称得反应后溶液的质量为107.6g。计算:
(1)生成二氧化碳_______g。
(2)样品中纯碱的质量分数是多少?______(要求写出计算过程,结果精确到0.1%)
24.某化学课外小组对熟石灰样品进行检测,发现该样品中含有氢氧化钙和碳酸钙两种物质,为测定两种物质的含量,小组同学称取8.7g样品放入质量为41.3g的烧杯中,再向烧杯中加入稀盐酸,边加边搅拌且每步都充分反应。反应过程中产生气体质量的部分实验数据、烧杯及其中物质总质量变化的图象如下所示:
加入稀盐酸的质量/g 40 65 75
产生气体的质量/g 1.1 2.2 2.2
(1)8.7g样品与稀盐酸完全反应产生气体的质量是_______g。
(2)8.7g样品中碳酸钙的质量分数是_______。(结果精确至0.1%)
(3)以上三次的实验数据中,只有一次加入的稀盐酸与烧杯中物质恰好完全反应。
①如图图象中a的数值是_______。
②求该实验中所用稀盐酸的溶质质量分数______。(写出计算过程)
试卷第1页,共3页
参考答案:
1.D
2.B
3.C
4.B
5.A
6.C
7.B
8.D
9.D
10.B
11.取一片pH试纸放在表面皿或玻璃片上,用玻璃棒蘸取溶液滴在pH试纸上,变色后与标准比色卡对照,读出溶液pH值.
12.(1)<
(2)Cr2(SO4)3+6KOH=2Cr(OH)3↓+3K2SO4
13.(1)钠离子和氯离子;(2)H++OH﹣═H2O
14. 复分解反应 Na+、Cl- 、H2O
15. CO2 Cl- 产生红褐色沉淀 3
16.(1) CO2 CO2 CO H2CO3 CaCO3
(2)
(3) 氧气和臭氧或金刚石和石墨 一个臭氧分子比一个氧分子多一个氧原子或碳原子的排列方式不同
17.(1)H2O2
(2)③
(3)灭火(合理即可)
(4)
18. 铁架台 A 可以控制反应随时发生随时停止 b e→f→c→d CO2+H2O=H2CO3
19. 漏斗 酒精灯 稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散 搅拌,防止因局部受热不均匀而造成液滴飞溅
20.(1)
(2) 稀硫酸 Y
(3)硫酸钠和氢氧化钠
21.(1)尿素中含有氮元素,属于化肥中的氮肥。
(2)CO(NH2)2中共含有C、O、N、H,4种元素;
(3)CO(NH2)2的相对分子质量是12+16+(14+1×2)×2=60;
(4)CO(NH2)2中C、H、N、O元素的质量比为12:(1×4):(14×2):16=3:1:7:4。
22.解:设HCl的质量分数是x
答:该品牌洁厕灵中HCl的质量分数是3.65%。
23.(1)4.4
(2)解:设样品中纯碱的质量分数是x
解得x≈88.3%
答:样品中纯碱的质量分数是88.3%。
24.(1)2.2
(2)解:设样品中碳酸钙的质量为x
=
x=5g
样品中碳酸钙的质量分数=×100%≈57.5%
答:样品中碳酸钙的质量分数为57.5%。
(3) 100 解:由图可知,加入75g稀盐酸后生成1.1g二氧化碳,加入100g稀盐酸后生成2.2g二氧化碳,则生成1.1g二氧化碳消耗稀盐酸的质量=100g 75g=25g
设生成1.1g二氧化碳消耗的HCl的质量为y
=
y=1.825g
该实验中所用稀盐酸的溶质质量分数=×100%=7.3%
答:该实验中所用稀盐酸的溶质质量分数为7.3%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列物质的用途主要利用其化学性质的是
A.液氮用作冷冻剂 B.干冰用于人工降雨
C.稀有气体作霓虹灯电光源 D.工业用高温煅烧石灰石制取二氧化碳
2.学化学,用化学。下列说法不正确的是
A.农业上常用熟石灰改良酸性土壤 B.氢氧化钠可直接用于配制生理盐水
C.工业上常用焦炭来冶炼金属 D.进入久未开启的地窖,应先做灯火试验
3.下列有关熟石灰的说法错误的是
A.熟石灰又称为消石灰 B.熟石灰是一种常见的碱
C.熟石灰的溶解度随温度升高而增大 D.熟石灰可以用来配制农药波尔多液
4.除去下列物质中的少量杂质,所选用的试剂或方法正的是
选项 物质 杂质 所用试剂或方法
A CO2 CO 通入过量氧气,点燃
B CaO CaCO3 高温煅烧
C N2 O2 放入燃着的蜡烛
D FeC12溶液 CuCl2 加入适量镁粉,过滤
A.A B.B C.C D.D
5.下列有关物质的化学式、名称、俗名完全对应的是
A.NaOH、氢氧化钠、烧碱 B.NaCl、氯化钠、食盐
C.H2O2、过氧化氢、双氧水 D.CaO、氧化钙、熟石灰
6.将一定质量的碳酸钙和铜粉置于一敞口容器中,加热煅烧使其完全反应。若反应前后容器内固体质量不变,则容器中铜和碳酸钙的质量比是
A.11 :14 B.20 :14 C.44 :25 D.16 :25
7.分类法是化学学习的常用方法,下列分类正确的是
A.碱:烧碱、生石灰、消石灰 B.混合物:空气、粗盐、海水
C.合金:生铁、黄铜、赤铁矿 D.盐:纯碱、酒精、硫酸铜
8.铁、盐酸、石灰水、硫酸铜是初中化学中常见的物质,四种物质间的反应关系如图所示,图中两圆相交部分(A、B、C、D)表示物质间反应的主要实验现象,其中描述正确的是
A.有蓝色沉淀生成 B.无明显现象
C.溶液变为蓝色 D.有气泡产生
9.用如图装置进行实验,将装置倾斜,使管①、②中药品接触,观察到气球鼓起,一段时间后又恢复原状。下列药品符合该实验现象的是
A.大理石和稀盐酸
B.二氧化锰和过氧化氢溶液
C.锌粒和稀盐酸
D.生石灰和水
10.现有盐酸和CaCl2的混合溶液,向其中逐滴滴入Na2CO3溶液生成沉淀质量与滴入Na2CO3溶液质量的变化关系如下图所示。下列说法错误的是
A.滴加碳酸钠溶液质量至ag时,溶液中溶质质量比原混合溶液中溶质质量大
B.滴加碳酸钠溶液质量至bg时,溶液中含有三种溶质
C.滴加碳酸钠溶液质量至cg时,溶液呈中性
D.滴加碳酸钠溶液质量为a~cg时,可以观察到溶液中生成白色沉淀
二、简答题
11.请你设计测定蔬菜、水果酸碱度的实验操作步骤.
12.铬(Cr)是一种重要的金属元素,铬的单质及其化合物应用广泛。
(1)铬桶可以盛装AlCl3溶液,不能盛装稀硫酸,则金属活动性Cr___________Al(填“>”或“<”)。
(2)Cr2(SO4)3为有毒的重金属盐,可用KOH溶液将其转化为沉淀而除去,请写出该转化的化学方程式。
13.如图是氢氧化钠与盐酸反应示意图。
(1)反应前后没有发生变化的离子有哪些?
(2)用实际参加反应的离子符号来表示反应的式子叫做离子方程式。请写出氢氧化钠与盐酸反应的离子方程式。
三、推断题
14.宇轩同学在厨房里取得一种白色粉末A,到化学实验室进行探究,结果如图:
请回答下列问题:
(1)若A不含氢元素,则A与澄清石灰水反应的化学方程式为_______,其反应的基本类型是_______。
(2)若A含有氢元素,则它与盐酸反应的化学方程式为_______。
(3)B溶液中含有的微粒为_______。(用化学用语填空)
15.现欲通过实验确定一固体混合物A的成分,已知其中可能含有Fe2O3、Na2CO3、BaSO4三种物质中的两种或多种。按图所示进行实验,出现的现象如图所示(设过程中所有可能发生的反应均恰好完全反应)。
试根据实验过程和发生的现象填写以下空白:
(1)气体B是_____(写化学式)。
(2)溶液C中,一定存在的阴离子是_____(写离子符号)。
(3)现象E为_____,步骤③所发生反应的化学方程式为_____。
(4)根据上述现象,固体混合物A中一定含有_____种物质。
16.已知A、B、C、D、E是初中化学中常见的五种物质,均含有同一种元素。其中A为单质,B和C含有的元素完全相同,D与其他四种物质属于不同的类别,E是一种重要建筑材料的主要成份,它们在一定条件下的转化关系如图所示(反应条件和部分反应物、生成物已省略),请回答:
(1)请写出图中各物质的化学式:
A:______B:______C:______D:______E:______。
(2)请写出下列反应的化学方程式:
A→C:______;B→E:______;
(3)请写出由A元素形成的两种单质的名称______。A的单质之间组成元素虽然相同,但性质、用途却有着明显的差异,其原因是______。
17.A~J是初中化学常见的物质,它们之间有如图所示的转化关系(部分反应条件已略去),其中A是一种液体,H是一种红色固体,化合物J只含两种元素,其溶液呈黄色。
请回答下列问题:
(1)A物质的化学式为________。
(2)反应①②③④中属于置换反应的是_________。
(3)物质G的一种用途________。
(4)写出反应④的化学方程式_________。
四、实验题
18.下列装置常用于实验室制取气体,请根据给出的装置回答下列问题。
(1)写出仪器①的名称_____。
(2)实验室用氯酸钾制取氧气,应选用的发生装置是_____(填序号),化学方程式_____。
(3)选择装置B作为制取CO2气体的发生装置,其突出优点是_____,若用F装置收集二氧化碳,则气体应从_____(填“a”或“b”)端进入。制得的二氧化碳中常含有少量的氯化氢气体和水蒸气,欲使用G、H装置将以上杂质气体除去,则装置正确的连接顺序是:混合气体→_____(用导气管端口字母表示)
(4)将纯净的二氧化碳气体通入盛有蒸馏水的洗气瓶一段时间后,测得该装置中溶液的pH<7,对该现象的合理解释_____(用化学方程式表示)。
19.化学是一门以实验为基础的学科,根据图中实验回答下列问题。
(1)填写仪器名称:X_____________;Y_____________。
(2)实验A的操作过程是_______________。
(3)A、B、C三个实验中都使用了玻璃棒,其中在实验C中的作用是___________。
20.某化学兴趣小组为验证硫酸的部分化学性质,进行了如下实验。
(1)实验一:向装有CuO的试管中加入一定量的稀硫酸,观察到氧化铜完全溶解并得到蓝色溶液,该反应的化学方程式为________;
实验二:向装有NaOH溶液的试管中加入一定量的稀硫酸,没有观察到明显现象;
(2)实验三:为了证明NaOH溶液和稀硫酸发生了反应,该组同学设计了如图一所示实验,传感器测定的pH和温度随溶液质量变化情况见图二、图三。
则B溶液是________,图三中的M与图二中X、Y、Z中的________数值相等;
(3)实验四:将实验一和实验二所得溶液混合得到蓝色沉淀,则实验二所得溶液的溶质为___。
五、计算题
21.尿素〔CO(NH2)2〕是化肥中最主要的一种,其含氮量高,在土壤中不残留任何有害物质,长期施用没有不良影响。
(1)尿素属于化肥中的______肥(填“氮”“钾”或“复合”)。
(2)CO(NH2)2中共含有______(写数字)种元素;
(3)CO(NH2)2的相对分子质量是______
(4)CO(NH2)2中C、H、N、O元素的质量比为______。
22.洁厕灵是常用的陶瓷清洗液,某同学对某品牌洁厕灵的有效成分的含量进行探究。他向一个锥形瓶中加入100 g该品牌的洁厕灵,再加入120 g溶质质量分数为7% 的NaHCO3溶液,二者恰好完全反应。(洁厕灵有效成分是HCl,洁厕灵中其他成分均不与NaHCO3反应。)
请计算:该品牌洁厕灵中HCl的质量分数是多少?
23.某超市卖的纯碱(Na2CO3)产品往往含有少量的杂质,化学兴趣小组的同学通过实验来测定该纯碱样品中纯碱的质量分数。他们取12g纯碱样品放入烧杯中,逐滴加入稀盐酸至不再产生气泡为止,共消耗盐酸100g,称得反应后溶液的质量为107.6g。计算:
(1)生成二氧化碳_______g。
(2)样品中纯碱的质量分数是多少?______(要求写出计算过程,结果精确到0.1%)
24.某化学课外小组对熟石灰样品进行检测,发现该样品中含有氢氧化钙和碳酸钙两种物质,为测定两种物质的含量,小组同学称取8.7g样品放入质量为41.3g的烧杯中,再向烧杯中加入稀盐酸,边加边搅拌且每步都充分反应。反应过程中产生气体质量的部分实验数据、烧杯及其中物质总质量变化的图象如下所示:
加入稀盐酸的质量/g 40 65 75
产生气体的质量/g 1.1 2.2 2.2
(1)8.7g样品与稀盐酸完全反应产生气体的质量是_______g。
(2)8.7g样品中碳酸钙的质量分数是_______。(结果精确至0.1%)
(3)以上三次的实验数据中,只有一次加入的稀盐酸与烧杯中物质恰好完全反应。
①如图图象中a的数值是_______。
②求该实验中所用稀盐酸的溶质质量分数______。(写出计算过程)
试卷第1页,共3页
参考答案:
1.D
2.B
3.C
4.B
5.A
6.C
7.B
8.D
9.D
10.B
11.取一片pH试纸放在表面皿或玻璃片上,用玻璃棒蘸取溶液滴在pH试纸上,变色后与标准比色卡对照,读出溶液pH值.
12.(1)<
(2)Cr2(SO4)3+6KOH=2Cr(OH)3↓+3K2SO4
13.(1)钠离子和氯离子;(2)H++OH﹣═H2O
14. 复分解反应 Na+、Cl- 、H2O
15. CO2 Cl- 产生红褐色沉淀 3
16.(1) CO2 CO2 CO H2CO3 CaCO3
(2)
(3) 氧气和臭氧或金刚石和石墨 一个臭氧分子比一个氧分子多一个氧原子或碳原子的排列方式不同
17.(1)H2O2
(2)③
(3)灭火(合理即可)
(4)
18. 铁架台 A 可以控制反应随时发生随时停止 b e→f→c→d CO2+H2O=H2CO3
19. 漏斗 酒精灯 稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散 搅拌,防止因局部受热不均匀而造成液滴飞溅
20.(1)
(2) 稀硫酸 Y
(3)硫酸钠和氢氧化钠
21.(1)尿素中含有氮元素,属于化肥中的氮肥。
(2)CO(NH2)2中共含有C、O、N、H,4种元素;
(3)CO(NH2)2的相对分子质量是12+16+(14+1×2)×2=60;
(4)CO(NH2)2中C、H、N、O元素的质量比为12:(1×4):(14×2):16=3:1:7:4。
22.解:设HCl的质量分数是x
答:该品牌洁厕灵中HCl的质量分数是3.65%。
23.(1)4.4
(2)解:设样品中纯碱的质量分数是x
解得x≈88.3%
答:样品中纯碱的质量分数是88.3%。
24.(1)2.2
(2)解:设样品中碳酸钙的质量为x
=
x=5g
样品中碳酸钙的质量分数=×100%≈57.5%
答:样品中碳酸钙的质量分数为57.5%。
(3) 100 解:由图可知,加入75g稀盐酸后生成1.1g二氧化碳,加入100g稀盐酸后生成2.2g二氧化碳,则生成1.1g二氧化碳消耗稀盐酸的质量=100g 75g=25g
设生成1.1g二氧化碳消耗的HCl的质量为y
=
y=1.825g
该实验中所用稀盐酸的溶质质量分数=×100%=7.3%
答:该实验中所用稀盐酸的溶质质量分数为7.3%。
答案第1页,共2页
答案第1页,共2页
