第八章常见的酸碱盐练习题-2021-2022学年九年级化学科粤版(2012)下册(word版有答案)
文档属性
| 名称 | 第八章常见的酸碱盐练习题-2021-2022学年九年级化学科粤版(2012)下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 139.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-06 10:50:18 | ||
图片预览




文档简介
第八章 常见的酸碱盐 练习题
一、单选题
1.医药上含有氢氧化铝(Al(OH)3)的药剂常被用来治疗胃酸过多,那么氢氧化铝属于哪类物质
A.酸 B.碱 C.氧化物 D.盐
2.人的体液的pH如果超出正常范围,会导致生理机能失调或产生疾病。人体内几种体液的正常pH范围如表所示。其中酸性最强的是( )
体液名称 胃液 血液 唾液 乳汁
pH 0.9~1.5 7.35~7.45 6.6~7.1 6.4~6.7
A.胃液 B.血液 C.唾液 D.胆汁
3.2021年“世界水日”的主题为“珍惜水、爱护水”。下列关于水的说法正确的是
A.过滤能将硬水转化为软水 B.用明矾对自来水进行杀菌消毒
C.用肥皂水区别硬水与软水 D.有水生成的反应一定是中和反应
4.下列化学方程式书写不正确的是
A.
B.
C.
D.
5.下列用数轴表示的化学知识,不正确的是
A.常见物质的pH
B.物质在水中溶解性
C.生铁与钢的区分
D.重要金属材料使用史
6.下列实验现象的描述正确的是
A.一氧化碳还原氧化铁:红棕色固体逐渐变成银白色
B.硫酸铜溶液与氢氧化钠溶液反应:溶液中产生白色沉淀
C.镁带在空气中燃烧:发出耀眼的白光,产生大量白烟,放热
D.铜丝放入硝酸银溶液中:紫红色固体表面覆盖一层银白色的银,溶液由无色变为蓝色
7.工业上常用空气中的氮气生产硝酸,其反应方程式如下:
①N2+3H22NH3
②4NH3+5O24NO+6H2O
③2NO+O2═2NO2
④3NO2+H2O═2HNO3+NO(NO难溶于水)
下列说法错误的是
A.上述①②③④中反应前后均有元素化合价的变化
B.用H2O吸收NO2的过程中通入过量的O2可以提高硝酸的产量
C.反应②④都不属于四种基本反应类型中的任何一种,反应①③均属于化合反应
D.在密闭容器中,将46gNO2溶于64gH2O中形成HNO3溶液,其溶质的质量分数约为38.2%
8.下列四个图象中,能正确反映对应变化关系的是
A. 某温度时,向一定量的饱和石灰水中加入少量生石灰
B. 某温度下,向一定量饱和硝酸钾溶液中加入硝酸钾晶体
C. 向氢氧化钠溶液中不断滴加稀盐酸
D. 向装有等质量、等浓度稀盐酸的两只烧杯中分别加入足量的锌和铁
二、简答题
9.小马同学在用氢氧化钠溶液和稀盐酸做中和反应的实验时,滴加一些盐酸后没有看到现象,才想起来忘了加酚酞试液.于是,他赶忙补加了几滴酚酞试液,发现溶液是无色的.他认为酸碱发生了中和反应,溶液已是中性的了.小亮同学对此提出了质疑,认为溶液也可能是酸性的.理由是_____.小马同学实验得到的溶液究竟是中性的还是酸性的呢?
(1)小亮的实验是:取少量溶液,滴加几滴紫色石蕊试液,溶液变成_____色,表明溶液呈酸性.
(2)小华的实验是:取少量溶液,滴加到碳酸钠溶液中,看到_____,表明溶液呈酸性.反应的化学方程式是_____.
(3)请你也设计一个实验,证明溶液呈酸性.你的实验是:_____,观察到的现象是_____,表明溶液呈酸性.
10.请用化学原理或方程式解释下列问题。
(1)用稀盐酸除铁锈。
(2)将煤块加工成蜂窝状,有助于煤充分燃烧。
三、推断题
11.已知A、B、C、D、E是初中化学常见的化合物,其中B、C都是氧化物,D是一种碱,其相对分子质量为74,A、B、D、E属于不同类别的化合物。图中“—”表示相连的物质间能发生反应,“→”表示物质间存在转化关系。
(1)若A属于盐,则E属于______,C在生活中的一种用途是_________。
(2)若A属于酸,则D与E反应的化学方程式为___________。
12.A-F为初中化学中常见的六种物质,其中B能供给呼吸,C是最常用的溶剂,D是黑色固体,E的溶液呈蓝色,它们之间存在如图所示的关系(“一”表示两种物质可以相互反应,“→”表示反应能一步实现)。
(1) D的化学式为_____________________;
(2) B→D反应的基本反应类型是______________;
(3)写出D转化为E的化学方程式______________。
13.现有一包白色粉末,可能是由氯化钾、氢氧化钠、硝酸钠和硫酸铜中的一种或多种物质组成。为确定其成分,某兴趣小组同学进行了如下实验。
(1)写出生成蓝色沉淀的化学方程式为_____。
(2)通过以上实验,不能确定白色粉末中是否含有_____(填化学式)。
(3)请写出该白色粉末的一种可能的物质组成的成分_____(写化学式)。
14.A、B、C、D是初中化学常见的几种物质,它们之间有如图所示的转化关系,其中A是石灰石的主要成分。请回答:
(1)当B变到D时会放出大量的热,该反应的基本类型是______。
(2)写出反应①的化学方程式______。
(3)写出反应②的化学方程式______。
四、实验题
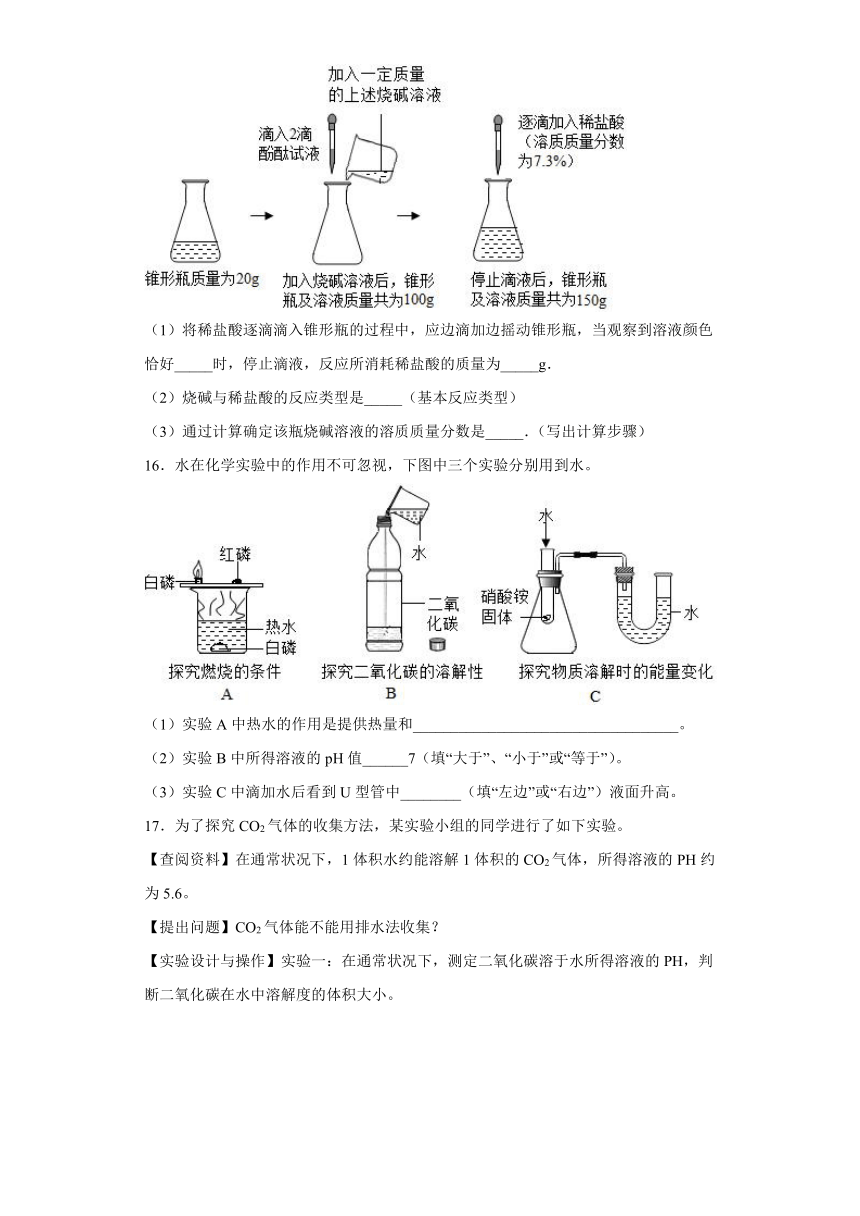
15.实验室有一瓶标签模糊的烧碱溶液,小李设计实验测定了其溶质质量分数,请根据如图所示的实验过程和提供的数据进行分析和计算.(注:滴入酚酞试液的质量忽略不计)
(1)将稀盐酸逐滴滴入锥形瓶的过程中,应边滴加边摇动锥形瓶,当观察到溶液颜色恰好_____时,停止滴液,反应所消耗稀盐酸的质量为_____g.
(2)烧碱与稀盐酸的反应类型是_____(基本反应类型)
(3)通过计算确定该瓶烧碱溶液的溶质质量分数是_____.(写出计算步骤)
16.水在化学实验中的作用不可忽视,下图中三个实验分别用到水。
(1)实验A中热水的作用是提供热量和___________________________________。
(2)实验B中所得溶液的pH值______7(填“大于”、“小于”或“等于”)。
(3)实验C中滴加水后看到U型管中________(填“左边”或“右边”)液面升高。
17.为了探究CO2气体的收集方法,某实验小组的同学进行了如下实验。
【查阅资料】在通常状况下,1体积水约能溶解1体积的CO2气体,所得溶液的PH约为5.6。
【提出问题】CO2气体能不能用排水法收集?
【实验设计与操作】实验一:在通常状况下,测定二氧化碳溶于水所得溶液的PH,判断二氧化碳在水中溶解度的体积大小。
(1)写出甲装置中的反应方程式______。
(2)开启弹簧夹K1,关闭弹簧夹K2、K3,然后打开活塞,滴加稀盐酸至甲中空气排尽。验证甲中空气已排尽的方法是______。
(3)关闭K1,打开K2、K3。待丙装置中收集半瓶气体时,关闭活塞K2和K3,充分振荡丙装置。最后用pH计测得丙、丁两装置中溶液的pH如右表。分析右表中数据可知,在丙和丁装置中所溶解的二氧化碳体积______(填“大于”“小于”“等于”)丙和丁装置中溶液的总体积。
物质 丁装置中溶液 丙装置中溶液
PH 6.50 5.60
(4)乙装置的作用是______。
实验二:用O2测量仪测得收集到的气体中的O2体积分数随时间的变化关系如下图(起始时氧气的体积分数都以21%计)。
【实验结论】分析图中数据可知,排水法收集到的CO2气体的纯度比排气法更高一些。
(5)实验室制备CO2气体时______(填“能”或“不能”)用排水法收集。
五、计算题
18.尿素〔CO(NH2)2〕是化肥中最主要的一种,其含氮量高,在土壤中不残留任何有害物质,长期施用没有不良影响。
(1)尿素属于化肥中的______肥(填“氮”“钾”或“复合”)。
(2)CO(NH2)2中共含有______(写数字)种元素;
(3)CO(NH2)2的相对分子质量是______
(4)CO(NH2)2中C、H、N、O元素的质量比为______。
19.农业生产上常用一定溶质质量分数的氯化钠溶液进行选种。实验小组取该溶液36g,向其中滴加硝酸银溶液至不再产生沉淀为止,过滤、洗涤、干燥后,用电子秤称得沉淀质量为14.35g。
(1)配制选种所用氯化钠溶液的步骤:计算、称量、 、溶解。
(2)计算该氯化钠溶液中溶质的质量分数(写出计算过程)。
20.取氯化钙和盐酸的混合溶液51.88g,逐滴滴加10.6%的碳酸钠溶液。所加入碳酸钠溶液的质量和混合溶液pH变化关系如图所示,回答下列问题:
(1)AB段PH增大的原因为_______。
(2)BC段反应的化学方程式为_______。
(3)计算充分反应至C点时所得溶液中溶质的质量分数______(写出计算过程,计算结果精确至0.1%)
21.鸡蛋壳的主要成分是碳酸钙。为了测定120g某鸡蛋壳中碳酸钙的质量,小群同学进行了如下实验:将鸡蛋壳洗净、干燥并捣碎后,称取120g放在烧杯里,然后往烧杯中加入足量的稀盐酸900g,充分反应后,称得反应剩余物为976g。(假设其他物质不与盐酸反应)
(1)产生二氧化碳气体多少克?
(2)计算120g鸡蛋壳中碳酸钙的质量为多少?
试卷第1页,共3页
参考答案:
1.B
2.A
3.C
4.A
5.B
6.C
7.D
8.A
9. 酚酞在酸性溶液中也是无色的 红 有气泡产生 Na2CO3+2HCl=2NaCl+H2O+CO2↑ 取少量溶液滴到pH试纸上(或取适量溶液,放入一根生锈的铁钉或取适量溶液,加入几粒锌粒) pH<7(或铁锈逐渐消失或有气泡产生)
10.(1)6HCl+Fe2O3=2FeCl3+3H2O
(2)增大了煤与氧气的接触面积
11.(1) 酸 作食品干燥剂(合理即可)
(2)(合理即可)
12. CuO 化合反应 (符合题意即可)
13.(1)2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
(2)NaNO3
(3)KCl、NaOH、CuSO4
14.(1)化合反应
(2)CaCO3CaO+CO2↑
(3)Ca(OH)2+CO2=CaCO3↓+H2O
15. 由红色变成无色 50g 复分解反应 5%
16. 使烧杯中的白磷与氧气隔绝 小于 左边
17.(1)
(2)将燃着的木条靠近导管A处,木条熄灭,说明A中空气己排尽。
(3)小于
(4)除去CO2气体中混有的HC1气体,防止影响丙、丁中溶液的PH
(5)能
18.(1)尿素中含有氮元素,属于化肥中的氮肥。
(2)CO(NH2)2中共含有C、O、N、H,4种元素;
(3)CO(NH2)2的相对分子质量是12+16+(14+1×2)×2=60;
(4)CO(NH2)2中C、H、N、O元素的质量比为12:(1×4):(14×2):16=3:1:7:4。
19.(1)量取;(2)16.25%(详见解析)
20.(1)AB段是碳酸钠和盐酸反应
(2)Na2CO3+CaCl2=CaCO3↓+2NaCl
(3)解:由图可知,与盐酸反应的碳酸钠的质量=20g×10.6%=2.12g
设碳酸钠与盐酸反应后生成的氯化钠的质量为x,生成二氧化碳的质量为y
= x=2.34g
= y=0.88g
由图可知,与氯化钙反应的碳酸钠的质量=(30g 20g)×10.6%=1.06g
设碳酸钠与氯化钙反应后生成的氯化钠的质量为m,生成碳酸钙沉淀的质量为n
= m=1.17g
= n=1g
C点时所得溶液中溶质的质量=2.34g+1.17g=3.51g
C点时所得溶液的质量=51.88g+30g 0.88g 1g=80g
C点时所得溶液中溶质的质量分数=×100%≈4.4%
答:C点时所得溶液中溶质的质量分数为4.4%。
21.(1)解:由质量守恒定律可知,生成二氧化碳的质量=120g+900g 976g=44g
答:生成二氧化碳的质量为44g。
(2)解:设碳酸钙的质量为x
=
x=100g
答:120g鸡蛋壳中碳酸钙的质量为100g。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.医药上含有氢氧化铝(Al(OH)3)的药剂常被用来治疗胃酸过多,那么氢氧化铝属于哪类物质
A.酸 B.碱 C.氧化物 D.盐
2.人的体液的pH如果超出正常范围,会导致生理机能失调或产生疾病。人体内几种体液的正常pH范围如表所示。其中酸性最强的是( )
体液名称 胃液 血液 唾液 乳汁
pH 0.9~1.5 7.35~7.45 6.6~7.1 6.4~6.7
A.胃液 B.血液 C.唾液 D.胆汁
3.2021年“世界水日”的主题为“珍惜水、爱护水”。下列关于水的说法正确的是
A.过滤能将硬水转化为软水 B.用明矾对自来水进行杀菌消毒
C.用肥皂水区别硬水与软水 D.有水生成的反应一定是中和反应
4.下列化学方程式书写不正确的是
A.
B.
C.
D.
5.下列用数轴表示的化学知识,不正确的是
A.常见物质的pH
B.物质在水中溶解性
C.生铁与钢的区分
D.重要金属材料使用史
6.下列实验现象的描述正确的是
A.一氧化碳还原氧化铁:红棕色固体逐渐变成银白色
B.硫酸铜溶液与氢氧化钠溶液反应:溶液中产生白色沉淀
C.镁带在空气中燃烧:发出耀眼的白光,产生大量白烟,放热
D.铜丝放入硝酸银溶液中:紫红色固体表面覆盖一层银白色的银,溶液由无色变为蓝色
7.工业上常用空气中的氮气生产硝酸,其反应方程式如下:
①N2+3H22NH3
②4NH3+5O24NO+6H2O
③2NO+O2═2NO2
④3NO2+H2O═2HNO3+NO(NO难溶于水)
下列说法错误的是
A.上述①②③④中反应前后均有元素化合价的变化
B.用H2O吸收NO2的过程中通入过量的O2可以提高硝酸的产量
C.反应②④都不属于四种基本反应类型中的任何一种,反应①③均属于化合反应
D.在密闭容器中,将46gNO2溶于64gH2O中形成HNO3溶液,其溶质的质量分数约为38.2%
8.下列四个图象中,能正确反映对应变化关系的是
A. 某温度时,向一定量的饱和石灰水中加入少量生石灰
B. 某温度下,向一定量饱和硝酸钾溶液中加入硝酸钾晶体
C. 向氢氧化钠溶液中不断滴加稀盐酸
D. 向装有等质量、等浓度稀盐酸的两只烧杯中分别加入足量的锌和铁
二、简答题
9.小马同学在用氢氧化钠溶液和稀盐酸做中和反应的实验时,滴加一些盐酸后没有看到现象,才想起来忘了加酚酞试液.于是,他赶忙补加了几滴酚酞试液,发现溶液是无色的.他认为酸碱发生了中和反应,溶液已是中性的了.小亮同学对此提出了质疑,认为溶液也可能是酸性的.理由是_____.小马同学实验得到的溶液究竟是中性的还是酸性的呢?
(1)小亮的实验是:取少量溶液,滴加几滴紫色石蕊试液,溶液变成_____色,表明溶液呈酸性.
(2)小华的实验是:取少量溶液,滴加到碳酸钠溶液中,看到_____,表明溶液呈酸性.反应的化学方程式是_____.
(3)请你也设计一个实验,证明溶液呈酸性.你的实验是:_____,观察到的现象是_____,表明溶液呈酸性.
10.请用化学原理或方程式解释下列问题。
(1)用稀盐酸除铁锈。
(2)将煤块加工成蜂窝状,有助于煤充分燃烧。
三、推断题
11.已知A、B、C、D、E是初中化学常见的化合物,其中B、C都是氧化物,D是一种碱,其相对分子质量为74,A、B、D、E属于不同类别的化合物。图中“—”表示相连的物质间能发生反应,“→”表示物质间存在转化关系。
(1)若A属于盐,则E属于______,C在生活中的一种用途是_________。
(2)若A属于酸,则D与E反应的化学方程式为___________。
12.A-F为初中化学中常见的六种物质,其中B能供给呼吸,C是最常用的溶剂,D是黑色固体,E的溶液呈蓝色,它们之间存在如图所示的关系(“一”表示两种物质可以相互反应,“→”表示反应能一步实现)。
(1) D的化学式为_____________________;
(2) B→D反应的基本反应类型是______________;
(3)写出D转化为E的化学方程式______________。
13.现有一包白色粉末,可能是由氯化钾、氢氧化钠、硝酸钠和硫酸铜中的一种或多种物质组成。为确定其成分,某兴趣小组同学进行了如下实验。
(1)写出生成蓝色沉淀的化学方程式为_____。
(2)通过以上实验,不能确定白色粉末中是否含有_____(填化学式)。
(3)请写出该白色粉末的一种可能的物质组成的成分_____(写化学式)。
14.A、B、C、D是初中化学常见的几种物质,它们之间有如图所示的转化关系,其中A是石灰石的主要成分。请回答:
(1)当B变到D时会放出大量的热,该反应的基本类型是______。
(2)写出反应①的化学方程式______。
(3)写出反应②的化学方程式______。
四、实验题
15.实验室有一瓶标签模糊的烧碱溶液,小李设计实验测定了其溶质质量分数,请根据如图所示的实验过程和提供的数据进行分析和计算.(注:滴入酚酞试液的质量忽略不计)
(1)将稀盐酸逐滴滴入锥形瓶的过程中,应边滴加边摇动锥形瓶,当观察到溶液颜色恰好_____时,停止滴液,反应所消耗稀盐酸的质量为_____g.
(2)烧碱与稀盐酸的反应类型是_____(基本反应类型)
(3)通过计算确定该瓶烧碱溶液的溶质质量分数是_____.(写出计算步骤)
16.水在化学实验中的作用不可忽视,下图中三个实验分别用到水。
(1)实验A中热水的作用是提供热量和___________________________________。
(2)实验B中所得溶液的pH值______7(填“大于”、“小于”或“等于”)。
(3)实验C中滴加水后看到U型管中________(填“左边”或“右边”)液面升高。
17.为了探究CO2气体的收集方法,某实验小组的同学进行了如下实验。
【查阅资料】在通常状况下,1体积水约能溶解1体积的CO2气体,所得溶液的PH约为5.6。
【提出问题】CO2气体能不能用排水法收集?
【实验设计与操作】实验一:在通常状况下,测定二氧化碳溶于水所得溶液的PH,判断二氧化碳在水中溶解度的体积大小。
(1)写出甲装置中的反应方程式______。
(2)开启弹簧夹K1,关闭弹簧夹K2、K3,然后打开活塞,滴加稀盐酸至甲中空气排尽。验证甲中空气已排尽的方法是______。
(3)关闭K1,打开K2、K3。待丙装置中收集半瓶气体时,关闭活塞K2和K3,充分振荡丙装置。最后用pH计测得丙、丁两装置中溶液的pH如右表。分析右表中数据可知,在丙和丁装置中所溶解的二氧化碳体积______(填“大于”“小于”“等于”)丙和丁装置中溶液的总体积。
物质 丁装置中溶液 丙装置中溶液
PH 6.50 5.60
(4)乙装置的作用是______。
实验二:用O2测量仪测得收集到的气体中的O2体积分数随时间的变化关系如下图(起始时氧气的体积分数都以21%计)。
【实验结论】分析图中数据可知,排水法收集到的CO2气体的纯度比排气法更高一些。
(5)实验室制备CO2气体时______(填“能”或“不能”)用排水法收集。
五、计算题
18.尿素〔CO(NH2)2〕是化肥中最主要的一种,其含氮量高,在土壤中不残留任何有害物质,长期施用没有不良影响。
(1)尿素属于化肥中的______肥(填“氮”“钾”或“复合”)。
(2)CO(NH2)2中共含有______(写数字)种元素;
(3)CO(NH2)2的相对分子质量是______
(4)CO(NH2)2中C、H、N、O元素的质量比为______。
19.农业生产上常用一定溶质质量分数的氯化钠溶液进行选种。实验小组取该溶液36g,向其中滴加硝酸银溶液至不再产生沉淀为止,过滤、洗涤、干燥后,用电子秤称得沉淀质量为14.35g。
(1)配制选种所用氯化钠溶液的步骤:计算、称量、 、溶解。
(2)计算该氯化钠溶液中溶质的质量分数(写出计算过程)。
20.取氯化钙和盐酸的混合溶液51.88g,逐滴滴加10.6%的碳酸钠溶液。所加入碳酸钠溶液的质量和混合溶液pH变化关系如图所示,回答下列问题:
(1)AB段PH增大的原因为_______。
(2)BC段反应的化学方程式为_______。
(3)计算充分反应至C点时所得溶液中溶质的质量分数______(写出计算过程,计算结果精确至0.1%)
21.鸡蛋壳的主要成分是碳酸钙。为了测定120g某鸡蛋壳中碳酸钙的质量,小群同学进行了如下实验:将鸡蛋壳洗净、干燥并捣碎后,称取120g放在烧杯里,然后往烧杯中加入足量的稀盐酸900g,充分反应后,称得反应剩余物为976g。(假设其他物质不与盐酸反应)
(1)产生二氧化碳气体多少克?
(2)计算120g鸡蛋壳中碳酸钙的质量为多少?
试卷第1页,共3页
参考答案:
1.B
2.A
3.C
4.A
5.B
6.C
7.D
8.A
9. 酚酞在酸性溶液中也是无色的 红 有气泡产生 Na2CO3+2HCl=2NaCl+H2O+CO2↑ 取少量溶液滴到pH试纸上(或取适量溶液,放入一根生锈的铁钉或取适量溶液,加入几粒锌粒) pH<7(或铁锈逐渐消失或有气泡产生)
10.(1)6HCl+Fe2O3=2FeCl3+3H2O
(2)增大了煤与氧气的接触面积
11.(1) 酸 作食品干燥剂(合理即可)
(2)(合理即可)
12. CuO 化合反应 (符合题意即可)
13.(1)2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
(2)NaNO3
(3)KCl、NaOH、CuSO4
14.(1)化合反应
(2)CaCO3CaO+CO2↑
(3)Ca(OH)2+CO2=CaCO3↓+H2O
15. 由红色变成无色 50g 复分解反应 5%
16. 使烧杯中的白磷与氧气隔绝 小于 左边
17.(1)
(2)将燃着的木条靠近导管A处,木条熄灭,说明A中空气己排尽。
(3)小于
(4)除去CO2气体中混有的HC1气体,防止影响丙、丁中溶液的PH
(5)能
18.(1)尿素中含有氮元素,属于化肥中的氮肥。
(2)CO(NH2)2中共含有C、O、N、H,4种元素;
(3)CO(NH2)2的相对分子质量是12+16+(14+1×2)×2=60;
(4)CO(NH2)2中C、H、N、O元素的质量比为12:(1×4):(14×2):16=3:1:7:4。
19.(1)量取;(2)16.25%(详见解析)
20.(1)AB段是碳酸钠和盐酸反应
(2)Na2CO3+CaCl2=CaCO3↓+2NaCl
(3)解:由图可知,与盐酸反应的碳酸钠的质量=20g×10.6%=2.12g
设碳酸钠与盐酸反应后生成的氯化钠的质量为x,生成二氧化碳的质量为y
= x=2.34g
= y=0.88g
由图可知,与氯化钙反应的碳酸钠的质量=(30g 20g)×10.6%=1.06g
设碳酸钠与氯化钙反应后生成的氯化钠的质量为m,生成碳酸钙沉淀的质量为n
= m=1.17g
= n=1g
C点时所得溶液中溶质的质量=2.34g+1.17g=3.51g
C点时所得溶液的质量=51.88g+30g 0.88g 1g=80g
C点时所得溶液中溶质的质量分数=×100%≈4.4%
答:C点时所得溶液中溶质的质量分数为4.4%。
21.(1)解:由质量守恒定律可知,生成二氧化碳的质量=120g+900g 976g=44g
答:生成二氧化碳的质量为44g。
(2)解:设碳酸钙的质量为x
=
x=100g
答:120g鸡蛋壳中碳酸钙的质量为100g。
答案第1页,共2页
答案第1页,共2页
