第6章常用的金属和盐测试题—2021-2022学年九年级化学沪教版(上海)下册(word版有答案)
文档属性
| 名称 | 第6章常用的金属和盐测试题—2021-2022学年九年级化学沪教版(上海)下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 203.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-06 12:23:33 | ||
图片预览



文档简介
第6章《常用的金属和盐》检测题
一、单选题
1.材料与人类生活密切相关。下列物品的主要成分不属于金属材料的是
A.易拉罐 B.青铜器
C.青花瓷 D.硬铝
2.下列实验操作中(括号内为杂质),不能达到实验目的的是
选项 物质 除杂方法
A MnO2(C) 在空气中灼烧
B N2(O2) 通过灼热的铜网
C CO2 (CO) 点燃
D CaO(CaCO3) 高温煅烧
A.A B.B C.C D.D
3.某同学整理的部分化学知识如下,你认为正确的选项是
A.水烧开后,壶盖被顶开,因为分子体积变大
B.釜底抽薪和熄灭酒精灯的灭火原理相同
C.金刚石和石墨的物理性质差别较大,这是因为碳原子的排列方式不同
D.真金不怕火炼,说明金的熔点高
4.下列关于物质的用途说法错误的是
A.镁条燃烧时产生耀眼白光,可用于制造烟花
B.加热氯酸钾和二氧化锰制氧气,二氧化锰起催化作用
C.铅是制作铅笔芯的主要材料
D.钛合金可用于制造人造骨
5.下列各组物质能验证、、三种金属活动性强弱的是
A.、、、稀盐酸 B.、溶液、溶液
C.、、溶液 D.、溶液、溶液
6.等质量的甲、乙两种金属,分别与足量等浓度的盐酸反应(已知甲、乙在生成物中化合价均为+2),生成氢气的质量和反应时间的关系如图所示,下列叙述正确的是
A.甲、乙两种金属中较活泼的是乙 B.产生氢气的速率:甲<乙
C.生成氢气的质量:甲<乙 D.相对原子质量较大的是乙
7.除去下列物质中所含的杂质,所用试剂和方法错误的是
选项 物质(括号内为杂质) 加入试剂和方法
A CO(CO2) 通过灼热的碳粉
B CO2(CO) 点燃
C CaO(CaCO3) 高温煅烧至固体质量不变
D CuO(Cu) 在氧气流中灼烧
A.A B.B C.C D.D
8.下列做法不正确的是( )
A.炒菜时油锅着火,立即盖上锅盖
B.铝耐腐蚀是因为表面形成致密的氧化膜
C.金刚石、石墨和C60充分燃烧都能生成CO2
D.正在使用的家用电器着火,立即用水浇灭
9.“祝融号”火星车探测发现火星地表被赤铁矿覆盖而呈橘红色,赤铁矿主要成分是
A.Fe3O4 B.Fe2O3 C.FeO D.FeCO3
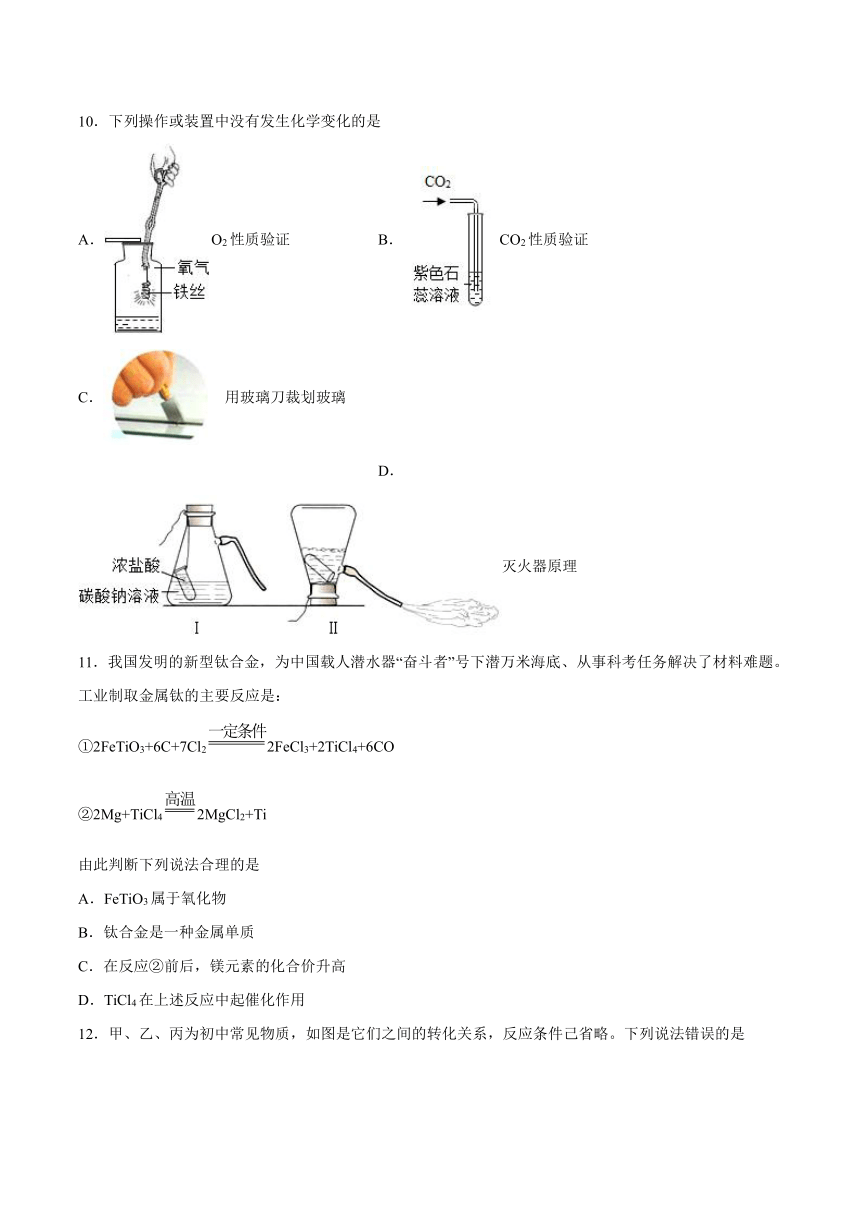
10.下列操作或装置中没有发生化学变化的是
A.O2性质验证 B.CO2性质验证
C.用玻璃刀裁划玻璃 D. 灭火器原理
11.我国发明的新型钛合金,为中国载人潜水器“奋斗者”号下潜万米海底、从事科考任务解决了材料难题。工业制取金属钛的主要反应是:
①2FeTiO3+6C+7Cl22FeCl3+2TiCl4+6CO
②2Mg+TiCl42MgCl2+Ti
由此判断下列说法合理的是
A.FeTiO3属于氧化物
B.钛合金是一种金属单质
C.在反应②前后,镁元素的化合价升高
D.TiCl4在上述反应中起催化作用
12.甲、乙、丙为初中常见物质,如图是它们之间的转化关系,反应条件己省略。下列说法错误的是
A.若甲为黑色粉末单质、乙为氧化物,则丙可能为CO2
B.若丙为浅绿色溶液,则甲可能是单质铁
C.若乙为有毒气体,反应开始前要先加热再通入乙
D.得到Cu的反应可能是置换反应
二、简答题
13.某化学小组向Cu(NO3)2和Zn(NO3)2的混合溶液中加入一定量的Mg粉,充分反应后过滤。
(1)若向滤渣中加入稀盐酸,有气泡冒出。请分析滤渣的成分。
(2)若滤液呈蓝色,则滤液中的溶质有哪些?(写化学式)
14.学思结合是我们学习化学知识的重要方法之一。请回答下列问题:
(1)为什么金刚石是正八面体形状的固体,而石墨是细鳞片状的固体?
(2)为什么臭氧(化学式为O3)和氧气的氧化性有所不同?
(3)为什么钢和生铁的性能不同?
三、推断题
15.甲、乙、丙是初中化学常见的物质,物质间的转化关系如图所示(“→”表示两种物质间的转化关系,部分反应物、生成物及反应条件已略去)。请回答下列问题。
(1)若甲发生分解反应生成乙和丙,则:
甲发生反应的化学方程式为______;乙→丙的化学方程式为______。
(2)若甲→乙发生的化学反应为化合反应,则:
甲→丙发生置换反应的化学方程式为______;丙→乙的化学方程式为______。
16.A-F是初中化学常见物质。其中A是黑色固体,B、C、D、F为无色气体,B转化为D可通过绿色植物光合作用完成,B、C组成元素相同,E是目前年产量最高的金属,它 们的转化关系如图。(“-”表示相连的物质能发生化学反应,“→”表示物质间的转化关系,部分反应物、生成物及反应条件均已略去),请回答:
(1)D 物质的名称:__________。
(2)反应②的化学方程式:__________。
(3)反应③的化学方程式:__________。实验现象:__________。
(4)反应①__________(填“一定”或“不一定”)是化合反应。
17.A、B、C、D都是初中化学中的常见物质,具有如图所示的转化关系(部分物质和反应条件已略去)
(1)若A是常温下呈液态的氧化物,常用作溶剂,D是氧化铜,则C物质为_______。
(2)若A是一种相对分子质量为100、白色难溶于水的固体,则B的化学式是_______;C和D反应的化学方程式为______。
四、实验题
18.暖贴发热是利用了铁粉生锈放出热量的原理,某小组同学设计并进行下列实验,探究铁生锈的条件及影响铁粉生锈速率的因素。
Ⅰ、探究铁生锈的条件
【设计实验】取3段光亮无锈的细铁丝,绕成螺旋状,进行如图所示的三个实验,实验要保证有足够长的时间来观察现象。
(1)对比实验______(填序号),可以得出铁生锈需要水。
(2)实验I中铁丝足量,时间足够长,打开止水夹后,观察到现象______。
Ⅱ、探究影响铁粉生锈速率的因素
【查阅资料】暖贴的发热材料主要有铁粉、活性炭、食盐、水等物质。
【猜想假设】①活性炭能加快铁粉生锈的速率。
②食盐能加快铁粉生锈的速率。
【进行实验】下表是2g铁粉、5g水与不同质量活性炭、食盐混合均匀10分钟温度记录。
实验编号 活性炭/g 食盐/g 温度上升值/℃
1 0 0 0.1
2 0.2 0 22.0
3 0 x 3.1
4 0.2 0.2 56.3
【解释与结论】
(3)上表中x的值为______。
(4)对比实验1和3,得出的结论是______。
(5)欲得出结论“活性炭与食盐同时存在会大幅度加快生锈速率”,需要对比1和______(填实验编号)。
【反思与评价】
(6)下列说法或做法正确的是______(填字母)。A.暖贴在使用前不需要密封保存
B.利用铁生锈的原理,可以测定空气中氧气含量
C.利用铁生锈的原理,铁粉还可用于食品保鲜
D.校内用钢架制作的自行车防雨棚应定期喷涂油漆防锈
19.金属材料广泛应用于生产生活中。
(1)生铁和______是两种常见的铁合金。用赤铁矿(主要成分是Fe2O3)冶炼铁的化学方程式为______。铁制品锈蚀,是铁与空气中的______发生了化学反应:防止铁锅锈蚀的一种方法是______。
(2)铝的抗腐蚀性很强,是因为铝在空气中能生成一层______,该反应的化学方程式为______。
五、计算题
20.碳酸钙在高温条件下生成氧化钙和二氧化碳( )。现有10g碳酸钙,高温煅烧一段时间后停止加热,剩余固体的质量是7.8g。
(1)反应中生成二氧化碳的质量是_________。
(2)利用化学方程式计算生成的氧化钙的质量。
(3)计算剩余固体中各元素的质量。
21.为测定某黄铜(假设合金中仅含铜、锌)中铜的质量分数,兴趣小组同学称取20g黄铜粉末于烧杯中,将80g稀硫酸分四次加入,充分反应后测得实验数据如下表。(提示:只有锌与稀硫酸反应)
实验次数 第一次 第二次 第三次 第四次
加入稀硫酸的质量/g 20 20 20 20
烧杯中剩余物的质量/g 35.9 59.8 79.7 99.7
生成氢气的质量/g 0.1 x 0.3 0.3
(1)黄铜属于______(填“纯净物”或“混合物”),上述表格中x的值为______g。
(2)该黄铜中铜的质量分数为多少?(写出计算过程)
(3)根据表中的数据,请画出产生氢气的质量随加入稀硫酸的质量的变化关系。
(4)同学们观察到反应一段时间后产生氢气的速率减慢,原因可能是______。
参考答案:
1.C 2.C 3.C 4.C 5.D 6.D 7.B 8.D 9.B 10.C 11.C 12.C
13.(1)一定含有Cu、Zn,可能含有Mg
(2)Cu(NO3)2、Zn(NO3)2、Mg(NO3)2
14.(1)碳原子排列方式不同
(2)分子构成不同
(3)含碳量不同
15.(1) 2H2O22H2O+O2↑ 2H2O2H2↑+O2↑(合理即可)
(2) C+2CuO2Cu+CO2↑(合理即可) C+CO22CO
16.(1)氧气
(2)/
(3) / 有气泡产生,溶液由无色变为浅绿色
(4)不一定
17.(1)氢气(或H2)
(2) CaO CO2Ca(OH)2=CaCO3↓H2O
18.(1)Ⅰ、Ⅱ
(2)左端液面上升至刻度线1
(3)0.2
(4)食盐会加快铁生锈
(5)2、3、4
(6)BCD
19.(1) 钢 水和氧气 洗完后保持铁锅干燥(合理即可)
(2) 致密氧化铝薄膜
20.(1)2.2g
(2)解:设生成的氧化钙的质量为x
x=2.8g
答:生成氧化钙的质量为2.8g
(3)由于反应没有完全,所以剩余固体是碳酸钙和氧化钙,剩余固体的质量是7.8g,氧化钙是2.8g,所以剩余碳酸钙7.8g-2.8g =5g。碳酸钙由钙、碳、氧元素组成,氧化钙由钙、氧元素组成。所以剩余固体中含钙、碳、氧元素。
钙元素的质量=
碳元素质量=
氧元素的质量=
答:生成的氧化钙的质量是2.8g,剩余固体中钙元素的质量4g,碳元素质量0.6g,氧元素的质量3.2g。
21.(1) 混合物 0.2
(2)解:设黄铜样品中锌的质量为x
x=9.75g
答:该黄铜中铜的质量分数为51.25%。
(3)
(4)稀硫酸的浓度降低,反应速率减慢
一、单选题
1.材料与人类生活密切相关。下列物品的主要成分不属于金属材料的是
A.易拉罐 B.青铜器
C.青花瓷 D.硬铝
2.下列实验操作中(括号内为杂质),不能达到实验目的的是
选项 物质 除杂方法
A MnO2(C) 在空气中灼烧
B N2(O2) 通过灼热的铜网
C CO2 (CO) 点燃
D CaO(CaCO3) 高温煅烧
A.A B.B C.C D.D
3.某同学整理的部分化学知识如下,你认为正确的选项是
A.水烧开后,壶盖被顶开,因为分子体积变大
B.釜底抽薪和熄灭酒精灯的灭火原理相同
C.金刚石和石墨的物理性质差别较大,这是因为碳原子的排列方式不同
D.真金不怕火炼,说明金的熔点高
4.下列关于物质的用途说法错误的是
A.镁条燃烧时产生耀眼白光,可用于制造烟花
B.加热氯酸钾和二氧化锰制氧气,二氧化锰起催化作用
C.铅是制作铅笔芯的主要材料
D.钛合金可用于制造人造骨
5.下列各组物质能验证、、三种金属活动性强弱的是
A.、、、稀盐酸 B.、溶液、溶液
C.、、溶液 D.、溶液、溶液
6.等质量的甲、乙两种金属,分别与足量等浓度的盐酸反应(已知甲、乙在生成物中化合价均为+2),生成氢气的质量和反应时间的关系如图所示,下列叙述正确的是
A.甲、乙两种金属中较活泼的是乙 B.产生氢气的速率:甲<乙
C.生成氢气的质量:甲<乙 D.相对原子质量较大的是乙
7.除去下列物质中所含的杂质,所用试剂和方法错误的是
选项 物质(括号内为杂质) 加入试剂和方法
A CO(CO2) 通过灼热的碳粉
B CO2(CO) 点燃
C CaO(CaCO3) 高温煅烧至固体质量不变
D CuO(Cu) 在氧气流中灼烧
A.A B.B C.C D.D
8.下列做法不正确的是( )
A.炒菜时油锅着火,立即盖上锅盖
B.铝耐腐蚀是因为表面形成致密的氧化膜
C.金刚石、石墨和C60充分燃烧都能生成CO2
D.正在使用的家用电器着火,立即用水浇灭
9.“祝融号”火星车探测发现火星地表被赤铁矿覆盖而呈橘红色,赤铁矿主要成分是
A.Fe3O4 B.Fe2O3 C.FeO D.FeCO3
10.下列操作或装置中没有发生化学变化的是
A.O2性质验证 B.CO2性质验证
C.用玻璃刀裁划玻璃 D. 灭火器原理
11.我国发明的新型钛合金,为中国载人潜水器“奋斗者”号下潜万米海底、从事科考任务解决了材料难题。工业制取金属钛的主要反应是:
①2FeTiO3+6C+7Cl22FeCl3+2TiCl4+6CO
②2Mg+TiCl42MgCl2+Ti
由此判断下列说法合理的是
A.FeTiO3属于氧化物
B.钛合金是一种金属单质
C.在反应②前后,镁元素的化合价升高
D.TiCl4在上述反应中起催化作用
12.甲、乙、丙为初中常见物质,如图是它们之间的转化关系,反应条件己省略。下列说法错误的是
A.若甲为黑色粉末单质、乙为氧化物,则丙可能为CO2
B.若丙为浅绿色溶液,则甲可能是单质铁
C.若乙为有毒气体,反应开始前要先加热再通入乙
D.得到Cu的反应可能是置换反应
二、简答题
13.某化学小组向Cu(NO3)2和Zn(NO3)2的混合溶液中加入一定量的Mg粉,充分反应后过滤。
(1)若向滤渣中加入稀盐酸,有气泡冒出。请分析滤渣的成分。
(2)若滤液呈蓝色,则滤液中的溶质有哪些?(写化学式)
14.学思结合是我们学习化学知识的重要方法之一。请回答下列问题:
(1)为什么金刚石是正八面体形状的固体,而石墨是细鳞片状的固体?
(2)为什么臭氧(化学式为O3)和氧气的氧化性有所不同?
(3)为什么钢和生铁的性能不同?
三、推断题
15.甲、乙、丙是初中化学常见的物质,物质间的转化关系如图所示(“→”表示两种物质间的转化关系,部分反应物、生成物及反应条件已略去)。请回答下列问题。
(1)若甲发生分解反应生成乙和丙,则:
甲发生反应的化学方程式为______;乙→丙的化学方程式为______。
(2)若甲→乙发生的化学反应为化合反应,则:
甲→丙发生置换反应的化学方程式为______;丙→乙的化学方程式为______。
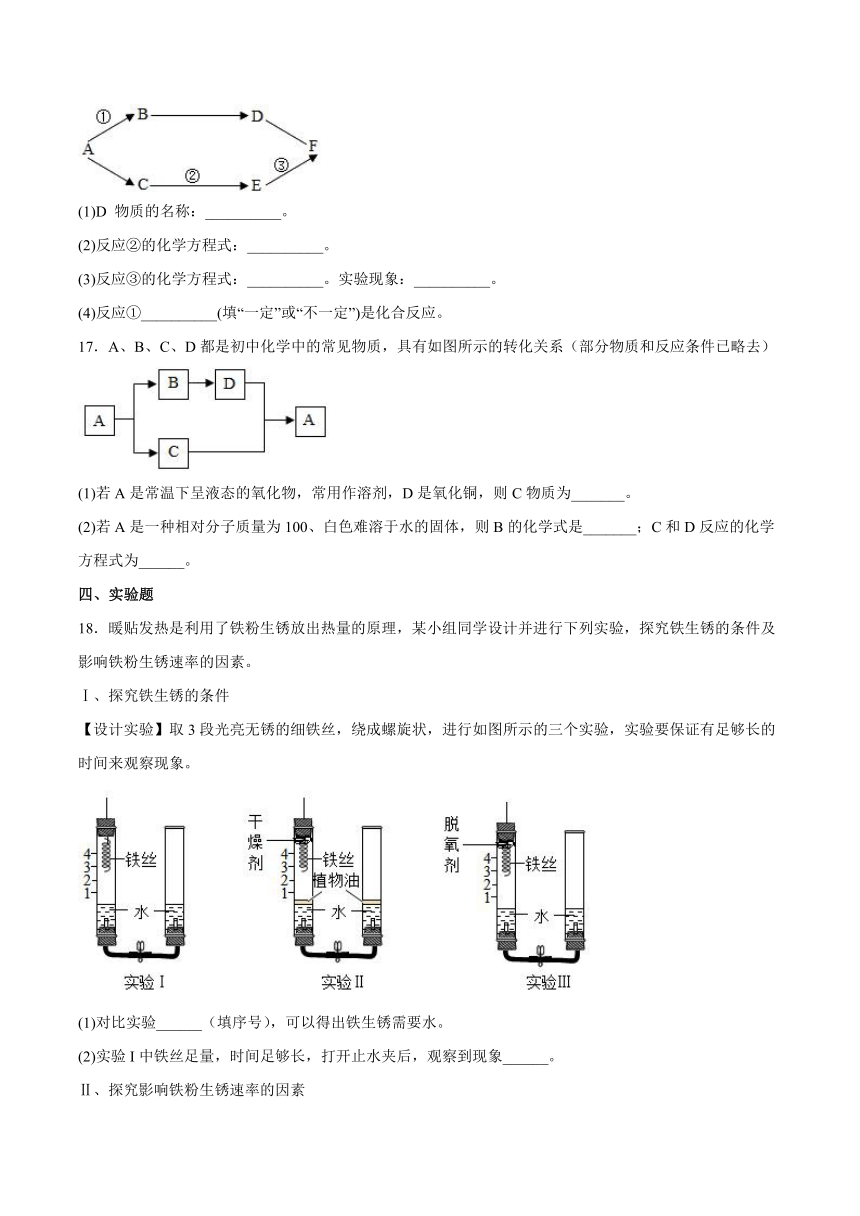
16.A-F是初中化学常见物质。其中A是黑色固体,B、C、D、F为无色气体,B转化为D可通过绿色植物光合作用完成,B、C组成元素相同,E是目前年产量最高的金属,它 们的转化关系如图。(“-”表示相连的物质能发生化学反应,“→”表示物质间的转化关系,部分反应物、生成物及反应条件均已略去),请回答:
(1)D 物质的名称:__________。
(2)反应②的化学方程式:__________。
(3)反应③的化学方程式:__________。实验现象:__________。
(4)反应①__________(填“一定”或“不一定”)是化合反应。
17.A、B、C、D都是初中化学中的常见物质,具有如图所示的转化关系(部分物质和反应条件已略去)
(1)若A是常温下呈液态的氧化物,常用作溶剂,D是氧化铜,则C物质为_______。
(2)若A是一种相对分子质量为100、白色难溶于水的固体,则B的化学式是_______;C和D反应的化学方程式为______。
四、实验题
18.暖贴发热是利用了铁粉生锈放出热量的原理,某小组同学设计并进行下列实验,探究铁生锈的条件及影响铁粉生锈速率的因素。
Ⅰ、探究铁生锈的条件
【设计实验】取3段光亮无锈的细铁丝,绕成螺旋状,进行如图所示的三个实验,实验要保证有足够长的时间来观察现象。
(1)对比实验______(填序号),可以得出铁生锈需要水。
(2)实验I中铁丝足量,时间足够长,打开止水夹后,观察到现象______。
Ⅱ、探究影响铁粉生锈速率的因素
【查阅资料】暖贴的发热材料主要有铁粉、活性炭、食盐、水等物质。
【猜想假设】①活性炭能加快铁粉生锈的速率。
②食盐能加快铁粉生锈的速率。
【进行实验】下表是2g铁粉、5g水与不同质量活性炭、食盐混合均匀10分钟温度记录。
实验编号 活性炭/g 食盐/g 温度上升值/℃
1 0 0 0.1
2 0.2 0 22.0
3 0 x 3.1
4 0.2 0.2 56.3
【解释与结论】
(3)上表中x的值为______。
(4)对比实验1和3,得出的结论是______。
(5)欲得出结论“活性炭与食盐同时存在会大幅度加快生锈速率”,需要对比1和______(填实验编号)。
【反思与评价】
(6)下列说法或做法正确的是______(填字母)。A.暖贴在使用前不需要密封保存
B.利用铁生锈的原理,可以测定空气中氧气含量
C.利用铁生锈的原理,铁粉还可用于食品保鲜
D.校内用钢架制作的自行车防雨棚应定期喷涂油漆防锈
19.金属材料广泛应用于生产生活中。
(1)生铁和______是两种常见的铁合金。用赤铁矿(主要成分是Fe2O3)冶炼铁的化学方程式为______。铁制品锈蚀,是铁与空气中的______发生了化学反应:防止铁锅锈蚀的一种方法是______。
(2)铝的抗腐蚀性很强,是因为铝在空气中能生成一层______,该反应的化学方程式为______。
五、计算题
20.碳酸钙在高温条件下生成氧化钙和二氧化碳( )。现有10g碳酸钙,高温煅烧一段时间后停止加热,剩余固体的质量是7.8g。
(1)反应中生成二氧化碳的质量是_________。
(2)利用化学方程式计算生成的氧化钙的质量。
(3)计算剩余固体中各元素的质量。
21.为测定某黄铜(假设合金中仅含铜、锌)中铜的质量分数,兴趣小组同学称取20g黄铜粉末于烧杯中,将80g稀硫酸分四次加入,充分反应后测得实验数据如下表。(提示:只有锌与稀硫酸反应)
实验次数 第一次 第二次 第三次 第四次
加入稀硫酸的质量/g 20 20 20 20
烧杯中剩余物的质量/g 35.9 59.8 79.7 99.7
生成氢气的质量/g 0.1 x 0.3 0.3
(1)黄铜属于______(填“纯净物”或“混合物”),上述表格中x的值为______g。
(2)该黄铜中铜的质量分数为多少?(写出计算过程)
(3)根据表中的数据,请画出产生氢气的质量随加入稀硫酸的质量的变化关系。
(4)同学们观察到反应一段时间后产生氢气的速率减慢,原因可能是______。
参考答案:
1.C 2.C 3.C 4.C 5.D 6.D 7.B 8.D 9.B 10.C 11.C 12.C
13.(1)一定含有Cu、Zn,可能含有Mg
(2)Cu(NO3)2、Zn(NO3)2、Mg(NO3)2
14.(1)碳原子排列方式不同
(2)分子构成不同
(3)含碳量不同
15.(1) 2H2O22H2O+O2↑ 2H2O2H2↑+O2↑(合理即可)
(2) C+2CuO2Cu+CO2↑(合理即可) C+CO22CO
16.(1)氧气
(2)/
(3) / 有气泡产生,溶液由无色变为浅绿色
(4)不一定
17.(1)氢气(或H2)
(2) CaO CO2Ca(OH)2=CaCO3↓H2O
18.(1)Ⅰ、Ⅱ
(2)左端液面上升至刻度线1
(3)0.2
(4)食盐会加快铁生锈
(5)2、3、4
(6)BCD
19.(1) 钢 水和氧气 洗完后保持铁锅干燥(合理即可)
(2) 致密氧化铝薄膜
20.(1)2.2g
(2)解:设生成的氧化钙的质量为x
x=2.8g
答:生成氧化钙的质量为2.8g
(3)由于反应没有完全,所以剩余固体是碳酸钙和氧化钙,剩余固体的质量是7.8g,氧化钙是2.8g,所以剩余碳酸钙7.8g-2.8g =5g。碳酸钙由钙、碳、氧元素组成,氧化钙由钙、氧元素组成。所以剩余固体中含钙、碳、氧元素。
钙元素的质量=
碳元素质量=
氧元素的质量=
答:生成的氧化钙的质量是2.8g,剩余固体中钙元素的质量4g,碳元素质量0.6g,氧元素的质量3.2g。
21.(1) 混合物 0.2
(2)解:设黄铜样品中锌的质量为x
x=9.75g
答:该黄铜中铜的质量分数为51.25%。
(3)
(4)稀硫酸的浓度降低,反应速率减慢
