第5章初识酸和碱检测题--2021-2022学年九年级化学沪教版(上海)下册(word版有答案)
文档属性
| 名称 | 第5章初识酸和碱检测题--2021-2022学年九年级化学沪教版(上海)下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 234.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-06 21:22:36 | ||
图片预览


文档简介
第5章《初识酸和碱》检测题
一、单选题
1.下列有关实验现象描述或数据记录正确的是
A.细铁丝在氧气中燃烧,火星四射,生成三氧化二铁
B.打开浓盐酸的瓶盖,瓶口看到白雾
C.用10mL的量筒量得液体体积为7.55mL
D.用pH试纸粗略测定某溶液的pH为8.5
2.推理是研究和学习化学的重要方法,以下推理正确的是
A.酸溶液中都含有氢离子,所以含有氢元素的化合物一定属于酸
B.酸和碱发生中和反应生成盐和水,生成盐和水的反应一定是中和反应
C.碱性溶液可以使无色酚酞变红,能使无色酚酞变红的溶液一定呈碱性
D.碳酸盐和酸反应有气体产生,和酸反应有气体产生的物质一定是碳酸盐
3.以下是同学们设计的几个实验方案,你认为合理的是
A.用25mL蒸馏水和25mL酒精配制50mL酒精溶液
B.将白醋滴在湿润的pH试纸上,测定其pH
C.向某固体中滴加稀盐酸,有气泡产生,该固体一定是碳酸盐
D.用托盘天平、烧杯、玻璃棒、量筒、滴管、药匙等仪器来配制16%KNO3溶液
4.正确的实验操作对人身安全和实验结果都非常重要。下列实验操作正确的是
A.倾倒液体 B.用滴管取液体
C.检查气密性 D.称量氢氧化钠
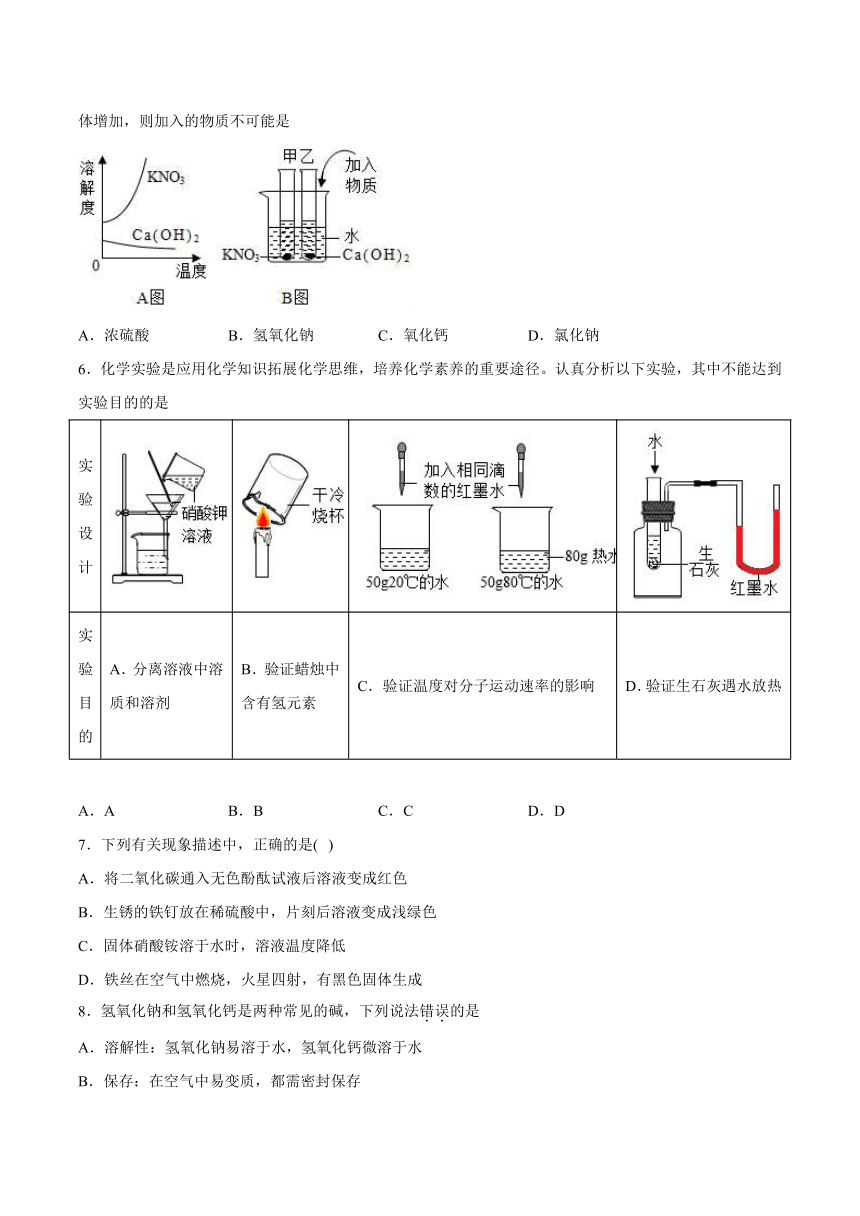
5.A图表示硝酸钾和氢氧化钙的溶解度随温度变化的情况。B图中甲、乙试管分别盛有硝酸钾、氢氧化钙的饱和溶液,试管底部均有未溶解的固体。向烧杯中加入一种物质后,甲试管中固体减少,乙试管中的固体增加,则加入的物质不可能是
A.浓硫酸 B.氢氧化钠 C.氧化钙 D.氯化钠
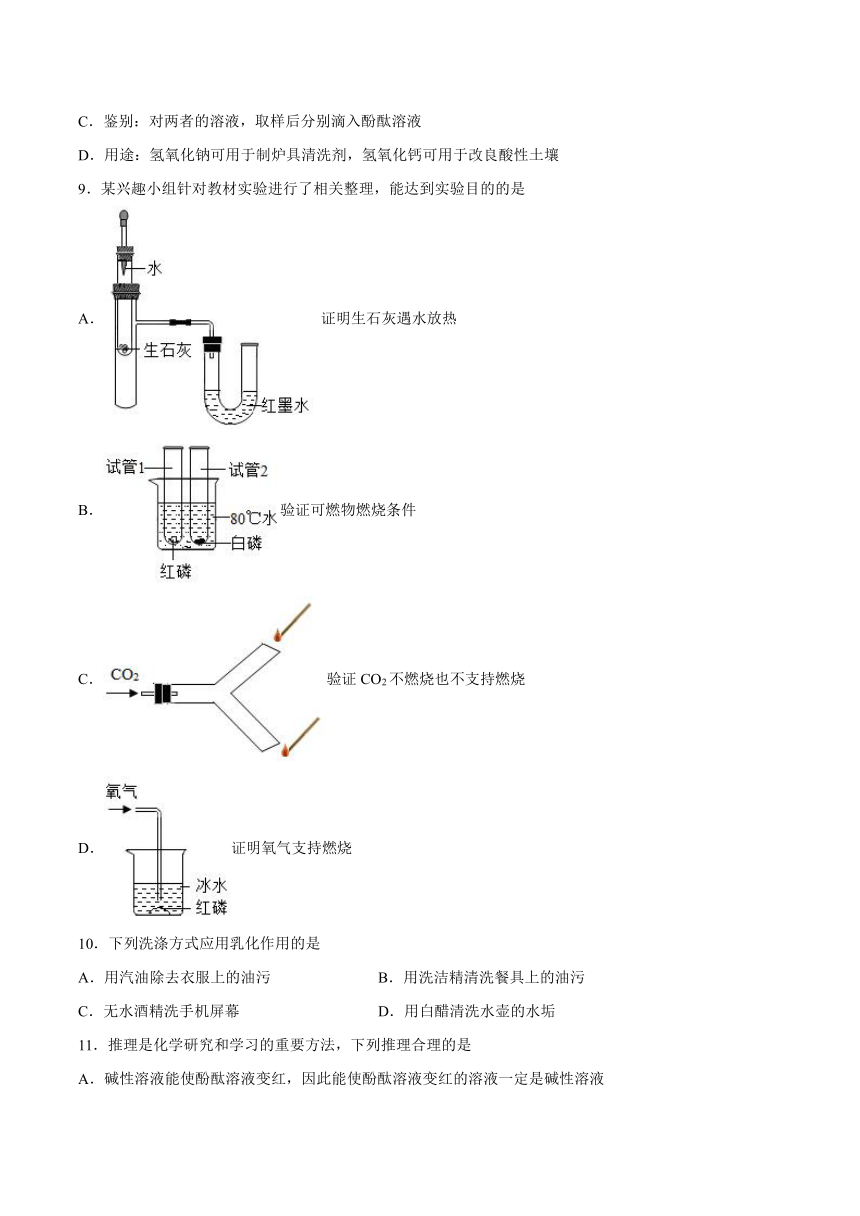
6.化学实验是应用化学知识拓展化学思维,培养化学素养的重要途径。认真分析以下实验,其中不能达到实验目的的是
实验 设计
实验 目的 A.分离溶液中溶质和溶剂 B.验证蜡烛中含有氢元素 C.验证温度对分子运动速率的影响 D.验证生石灰遇水放热
A.A B.B C.C D.D
7.下列有关现象描述中,正确的是( )
A.将二氧化碳通入无色酚酞试液后溶液变成红色
B.生锈的铁钉放在稀硫酸中,片刻后溶液变成浅绿色
C.固体硝酸铵溶于水时,溶液温度降低
D.铁丝在空气中燃烧,火星四射,有黑色固体生成
8.氢氧化钠和氢氧化钙是两种常见的碱,下列说法错误的是
A.溶解性:氢氧化钠易溶于水,氢氧化钙微溶于水
B.保存:在空气中易变质,都需密封保存
C.鉴别:对两者的溶液,取样后分别滴入酚酞溶液
D.用途:氢氧化钠可用于制炉具清洗剂,氢氧化钙可用于改良酸性土壤
9.某兴趣小组针对教材实验进行了相关整理,能达到实验目的的是
A. 证明生石灰遇水放热
B.验证可燃物燃烧条件
C.验证CO2不燃烧也不支持燃烧
D.证明氧气支持燃烧
10.下列洗涤方式应用乳化作用的是
A.用汽油除去衣服上的油污 B.用洗洁精清洗餐具上的油污
C.无水酒精洗手机屏幕 D.用白醋清洗水壶的水垢
11.推理是化学研究和学习的重要方法,下列推理合理的是
A.碱性溶液能使酚酞溶液变红,因此能使酚酞溶液变红的溶液一定是碱性溶液
B.中和反应生成盐和水,因此凡是生成盐和水的反应都是中和反应
C.有机化合物都含有碳元素,因此含碳元素的化合物一定是有机化合物
D.某物质能与稀盐酸反应生成气体,则该物质一定是活泼金属
12.小华到水族馆参观时了解到:一些观赏鱼是从其他地方空运来的,而且必须密封。为了解决鱼的吸氧问题,可在水中加入一种叫做过氧化钙(化学式:CaO2)的制氧剂,它与水反应后的生成物可能是
A.CaO 和 O2 B.CaCO3 和 H2 C.Ca(OH)2 和 O2 D.CaCl2 和 O2
13.逻辑推理是化学常用的思维方法,下列推理正确的是
A.同种元素的原子质子数相同,所以质子数相同的粒子一定是同种元素
B.单质只含有一种元素,则只含一种元素的纯净物一定是单质
C.活泼金属能与稀硫酸反应放出气体,则能与稀硫酸反应放出气体的物质一定是活泼金属
D.化合物都是由不同种元素组成的,所以不同种元素组成的物质一定是化合物
二、简答题
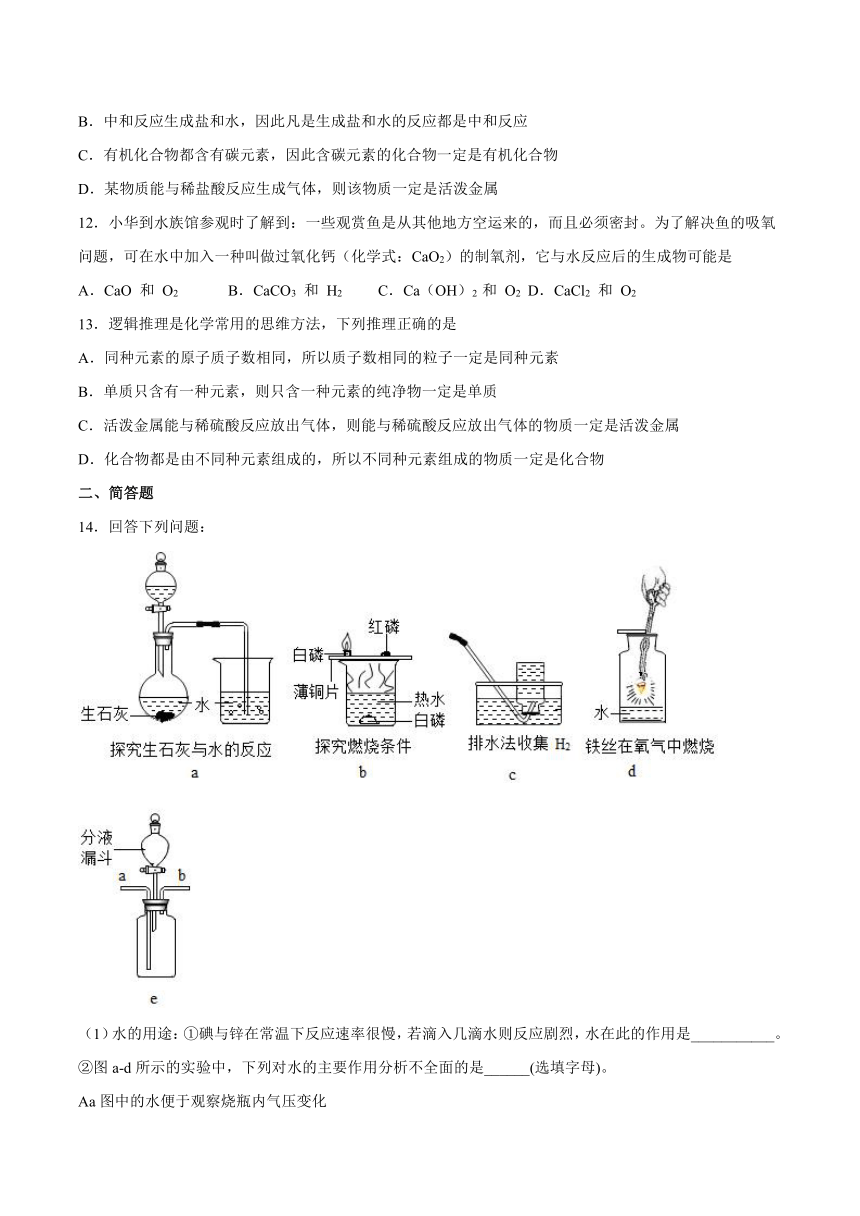
14.回答下列问题:
(1)水的用途:①碘与锌在常温下反应速率很慢,若滴入几滴水则反应剧烈,水在此的作用是___________。
②图a-d所示的实验中,下列对水的主要作用分析不全面的是______(选填字母)。
Aa图中的水便于观察烧瓶内气压变化
Bb图中的水提供热量
Cc图集气瓶中的水排尽空气且便于观察H2何时集满
Dd图中的水防止熔融物炸裂集气瓶
(2)图e装置验证二氧化碳与水的反应,为说明使石蕊变色的物质是碳酸而不是水或二氧化碳,应该采取的实验操作顺序是_______(填序号,可重复选用)。
①从b端通氮气 ②从分液漏斗中滴加适量水 ③从a端通二氧化碳 ④将用石蕊溶液染成紫色的干燥纸花放入广口瓶中
15.化学的学科特征是在原子、分子水平上研究物质和创造物质,请从微观角度解释下列问题:
(1)钠原子和钠离子化学性质不同;
(2)一氧化碳和二氧化碳化学性质不同;
(3)NaOH溶液和Ca(OH)2溶液都能使酚酞溶液变红。
三、推断题
16.图中A、B、C、D、E、F为初中化学常见的六种物质。D是胃液的主要成分, E是红棕色固体,F与D反应后所得溶液为浅绿色,C在工业上常用来生产肥皂。(图中“一”表示两种物质间能发生化学反应,“→”表示两种物质间的转化关系),请回答下列问题:
(1)请写出下列物质(或溶质)的化学式:
B______、D______、E______、F______。
(2)E与足量的D反应的现象为______。
(3)C转化为B的化学方程式为______。
17.A-F是初中化学常见的物质,且均含有同一种元素,它们相互间的关系如图所示,已知A、B、C、D、E是不同类别的物质,其中C可用于玻璃、造纸、纺织、石油精炼、洗涤剂生产等领域,F是相对分子质量最小的氧化物(注:图中反应条件及部分反应物生成物已省略,“-”表示反应关系,“→”表示转化关系),请回答:
(1)写出下列物质C的化学式_______。
(2)写出D与E反应的化学方程式_______。
四、实验题
18.结合下图多角度研究水。
(1)探究生石灰与水反应:如图进行实验观察到的现象是______。
(2)探究燃烧条件:该实验中水的作用是______。
(3)排水法收集H2:原因是______。
(4)电解水:实验说明水是由______组成的;反应的化学方程式为______;
(5)水在高温下也可分解,高温下分解体系中微粒含量与温度的关系如下图所示:
结合图中曲线,水开始分解的温度大约是______℃;A对应的微粒是______(填符号)。
19.学习化学开启了我们认识物质之旅。某实验小组的同学对氢氧化钠的性质及应用进行了如下的探究。
【探究一】溶解过程中的能量变化。如图所示,同学们设计了不同的实验方案进行探究:
(1)实验一中的硝酸铵溶解后,溶液温度_____(填“升高”、“降低”或“不变”)。
(2)实验二所加试剂及用量如图,将分液漏斗中的水全部加入试管后,立即关闭分液漏斗的活塞,此时观察到U形管的液面左低右高,由此得出“氢氧化钠溶于水时放出热量”的结论,你不同意此结论,写出你的理由_____。
【探究二】氢氧化钠的化学性质
如图所示,同学们用氢氧化钠进行了下列实验,请分析并回答下列问题:
(3)①中观察到的现象是_____,②试管中观察到的现象是_____。
(4)③试管中发生反应的化学方程式_____。
(5)③④⑤试管中发生的反应属于复分解反应的是_____。
(6)实验⑤⑥为用软矿泉水瓶所做的对比实验,装_____的软矿泉水瓶变瘪更明显,原因是_____。(用化学方程式表示)
【探究三】氢氧化钠在实验室中的应用
(7)①实验室中能用氢氧化钠溶液吸收的气体是_____(填字母序号)。
a、二氧化碳b、水蒸气c、氯化氢d、氧气
②吸收上述所选气体一般不用氢氧化钙溶液,主要是因为氢氧化钠和氢氧化钙的_____不同。
20.实验是学习化学的一种重要途径,三位同学设计了以下四个实验,请你和她一起完成实验活动。
(1)图中仪器a的名称是_______,贝贝同学在实验室制备二氧化碳,她选择B装置不选择A装置的原因是_______。
(2)米粒同学设计的实验C以证明NaOH溶液和CO2发生反应,该反应的化学反应方程式为_____。
(3)D实验中,树苗同学用湿润的pH试纸测定碳酸钠溶液的酸碱度,测得溶液的pH值和实际值相比_______(填“偏大”、“偏小”或“不变”)。
五、计算题
21.工业上采用离子交换膜电解槽电解饱和食盐水,可得到高浓度的烧碱溶液(含NaOH 35%~48%),某兴趣小组欲验证一化工厂生产的NaOH溶液是否达到了高浓度标准,进行了如下操作,请你参与计算:
(1)用36.5%的浓盐酸配制200g7.3%的盐酸,需要加水(密度为1g mL﹣1)______mL。(计算结果保留一位小数)
(2)采集该化工厂电解槽中的NaOH溶液20g,向其中滴入所配制的盐酸,当溶液的pH=7时,消耗盐酸100g,判断电解槽中NaOH溶液是否达到高浓度标准。(写出计算过程)
22.向100g氯化镁溶液中,不断加入一定溶质质量分数的氢氧化钾溶液,实验数据如下表:
氢氧化钾溶液的质量/g 5.6 11.2 22.4 33.6
生成沉淀的质量/g 0.145 0.29 0.58 0.58
(1)当滴加氢氧化钾溶液的质量为33.6g时,所得溶液的pH_______(填“<”“=”或“>”)7。
(2)选择合理的数据,计算该氯化镁溶液中溶质的质量分数_______。
参考答案:
1.B 2.C 3.D 4.A 5.D 6.A 7.C 8.C 9.A 10.B 11.A 12.C 13.B
14. 加快化学反应速率 AB ④③①②③
15.(1)钠原子和钠离子最外层电子数不同,所以钠原子和钠离子化学性质不同
(2)一个一氧化碳分子由一个碳原子和一个氧原子构成,一个二氧化碳分子由一个碳原子和两个氧原子构成,分子结构不同一氧化碳和二氧化碳化学性质不同。
(3)NaOH溶液和Ca(OH)2溶液都能解离出氢氧根离子,都能使酚酞溶液变红。
16.(1) Na2CO3 HCl Fe2O3 Fe
(2)红棕色固体逐渐消失,溶液由无色变为黄色
(3)2NaOH+CO2=Na2CO3+H2O
17. Na2CO3 Ca(OH)2+H2SO4=CaSO4+2H2O
18.(1)烧杯中的导管口有气泡冒出
(2)使烧杯中的白磷与氧气隔绝,同时提高温度达到铜片上白磷的着火点
(3)H2不溶于水,不与水反应
(4) 氢元素、氧元素
(5) 2000 H
19.(1)降低
(2)加入10mL水后试管中的部分空气被排出,也会使U形管中液面左低右高(其他合理答案均可)
(3) 固体表面变潮湿 溶液由无色变红色
(4)
(5)③④
(6) 氢氧化钠溶液
(7) ac 溶解度
20.(1) 锥形瓶 二氧化碳能溶于水,不能用排水法收集
(2)
(3)偏小
21.(1)160
(2)设:氢氧化钠溶液中溶质的质量分数为x.
x=40%介于35%到48%
答:电解槽中NaOH溶液达到高浓度标准。
22.(1)>
(2)解:设该氯化镁溶液中溶质的质量分数为x
答:该氯化镁溶液中溶质的质量分数为0.95%。
一、单选题
1.下列有关实验现象描述或数据记录正确的是
A.细铁丝在氧气中燃烧,火星四射,生成三氧化二铁
B.打开浓盐酸的瓶盖,瓶口看到白雾
C.用10mL的量筒量得液体体积为7.55mL
D.用pH试纸粗略测定某溶液的pH为8.5
2.推理是研究和学习化学的重要方法,以下推理正确的是
A.酸溶液中都含有氢离子,所以含有氢元素的化合物一定属于酸
B.酸和碱发生中和反应生成盐和水,生成盐和水的反应一定是中和反应
C.碱性溶液可以使无色酚酞变红,能使无色酚酞变红的溶液一定呈碱性
D.碳酸盐和酸反应有气体产生,和酸反应有气体产生的物质一定是碳酸盐
3.以下是同学们设计的几个实验方案,你认为合理的是
A.用25mL蒸馏水和25mL酒精配制50mL酒精溶液
B.将白醋滴在湿润的pH试纸上,测定其pH
C.向某固体中滴加稀盐酸,有气泡产生,该固体一定是碳酸盐
D.用托盘天平、烧杯、玻璃棒、量筒、滴管、药匙等仪器来配制16%KNO3溶液
4.正确的实验操作对人身安全和实验结果都非常重要。下列实验操作正确的是
A.倾倒液体 B.用滴管取液体
C.检查气密性 D.称量氢氧化钠
5.A图表示硝酸钾和氢氧化钙的溶解度随温度变化的情况。B图中甲、乙试管分别盛有硝酸钾、氢氧化钙的饱和溶液,试管底部均有未溶解的固体。向烧杯中加入一种物质后,甲试管中固体减少,乙试管中的固体增加,则加入的物质不可能是
A.浓硫酸 B.氢氧化钠 C.氧化钙 D.氯化钠
6.化学实验是应用化学知识拓展化学思维,培养化学素养的重要途径。认真分析以下实验,其中不能达到实验目的的是
实验 设计
实验 目的 A.分离溶液中溶质和溶剂 B.验证蜡烛中含有氢元素 C.验证温度对分子运动速率的影响 D.验证生石灰遇水放热
A.A B.B C.C D.D
7.下列有关现象描述中,正确的是( )
A.将二氧化碳通入无色酚酞试液后溶液变成红色
B.生锈的铁钉放在稀硫酸中,片刻后溶液变成浅绿色
C.固体硝酸铵溶于水时,溶液温度降低
D.铁丝在空气中燃烧,火星四射,有黑色固体生成
8.氢氧化钠和氢氧化钙是两种常见的碱,下列说法错误的是
A.溶解性:氢氧化钠易溶于水,氢氧化钙微溶于水
B.保存:在空气中易变质,都需密封保存
C.鉴别:对两者的溶液,取样后分别滴入酚酞溶液
D.用途:氢氧化钠可用于制炉具清洗剂,氢氧化钙可用于改良酸性土壤
9.某兴趣小组针对教材实验进行了相关整理,能达到实验目的的是
A. 证明生石灰遇水放热
B.验证可燃物燃烧条件
C.验证CO2不燃烧也不支持燃烧
D.证明氧气支持燃烧
10.下列洗涤方式应用乳化作用的是
A.用汽油除去衣服上的油污 B.用洗洁精清洗餐具上的油污
C.无水酒精洗手机屏幕 D.用白醋清洗水壶的水垢
11.推理是化学研究和学习的重要方法,下列推理合理的是
A.碱性溶液能使酚酞溶液变红,因此能使酚酞溶液变红的溶液一定是碱性溶液
B.中和反应生成盐和水,因此凡是生成盐和水的反应都是中和反应
C.有机化合物都含有碳元素,因此含碳元素的化合物一定是有机化合物
D.某物质能与稀盐酸反应生成气体,则该物质一定是活泼金属
12.小华到水族馆参观时了解到:一些观赏鱼是从其他地方空运来的,而且必须密封。为了解决鱼的吸氧问题,可在水中加入一种叫做过氧化钙(化学式:CaO2)的制氧剂,它与水反应后的生成物可能是
A.CaO 和 O2 B.CaCO3 和 H2 C.Ca(OH)2 和 O2 D.CaCl2 和 O2
13.逻辑推理是化学常用的思维方法,下列推理正确的是
A.同种元素的原子质子数相同,所以质子数相同的粒子一定是同种元素
B.单质只含有一种元素,则只含一种元素的纯净物一定是单质
C.活泼金属能与稀硫酸反应放出气体,则能与稀硫酸反应放出气体的物质一定是活泼金属
D.化合物都是由不同种元素组成的,所以不同种元素组成的物质一定是化合物
二、简答题
14.回答下列问题:
(1)水的用途:①碘与锌在常温下反应速率很慢,若滴入几滴水则反应剧烈,水在此的作用是___________。
②图a-d所示的实验中,下列对水的主要作用分析不全面的是______(选填字母)。
Aa图中的水便于观察烧瓶内气压变化
Bb图中的水提供热量
Cc图集气瓶中的水排尽空气且便于观察H2何时集满
Dd图中的水防止熔融物炸裂集气瓶
(2)图e装置验证二氧化碳与水的反应,为说明使石蕊变色的物质是碳酸而不是水或二氧化碳,应该采取的实验操作顺序是_______(填序号,可重复选用)。
①从b端通氮气 ②从分液漏斗中滴加适量水 ③从a端通二氧化碳 ④将用石蕊溶液染成紫色的干燥纸花放入广口瓶中
15.化学的学科特征是在原子、分子水平上研究物质和创造物质,请从微观角度解释下列问题:
(1)钠原子和钠离子化学性质不同;
(2)一氧化碳和二氧化碳化学性质不同;
(3)NaOH溶液和Ca(OH)2溶液都能使酚酞溶液变红。
三、推断题
16.图中A、B、C、D、E、F为初中化学常见的六种物质。D是胃液的主要成分, E是红棕色固体,F与D反应后所得溶液为浅绿色,C在工业上常用来生产肥皂。(图中“一”表示两种物质间能发生化学反应,“→”表示两种物质间的转化关系),请回答下列问题:
(1)请写出下列物质(或溶质)的化学式:
B______、D______、E______、F______。
(2)E与足量的D反应的现象为______。
(3)C转化为B的化学方程式为______。
17.A-F是初中化学常见的物质,且均含有同一种元素,它们相互间的关系如图所示,已知A、B、C、D、E是不同类别的物质,其中C可用于玻璃、造纸、纺织、石油精炼、洗涤剂生产等领域,F是相对分子质量最小的氧化物(注:图中反应条件及部分反应物生成物已省略,“-”表示反应关系,“→”表示转化关系),请回答:
(1)写出下列物质C的化学式_______。
(2)写出D与E反应的化学方程式_______。
四、实验题
18.结合下图多角度研究水。
(1)探究生石灰与水反应:如图进行实验观察到的现象是______。
(2)探究燃烧条件:该实验中水的作用是______。
(3)排水法收集H2:原因是______。
(4)电解水:实验说明水是由______组成的;反应的化学方程式为______;
(5)水在高温下也可分解,高温下分解体系中微粒含量与温度的关系如下图所示:
结合图中曲线,水开始分解的温度大约是______℃;A对应的微粒是______(填符号)。
19.学习化学开启了我们认识物质之旅。某实验小组的同学对氢氧化钠的性质及应用进行了如下的探究。
【探究一】溶解过程中的能量变化。如图所示,同学们设计了不同的实验方案进行探究:
(1)实验一中的硝酸铵溶解后,溶液温度_____(填“升高”、“降低”或“不变”)。
(2)实验二所加试剂及用量如图,将分液漏斗中的水全部加入试管后,立即关闭分液漏斗的活塞,此时观察到U形管的液面左低右高,由此得出“氢氧化钠溶于水时放出热量”的结论,你不同意此结论,写出你的理由_____。
【探究二】氢氧化钠的化学性质
如图所示,同学们用氢氧化钠进行了下列实验,请分析并回答下列问题:
(3)①中观察到的现象是_____,②试管中观察到的现象是_____。
(4)③试管中发生反应的化学方程式_____。
(5)③④⑤试管中发生的反应属于复分解反应的是_____。
(6)实验⑤⑥为用软矿泉水瓶所做的对比实验,装_____的软矿泉水瓶变瘪更明显,原因是_____。(用化学方程式表示)
【探究三】氢氧化钠在实验室中的应用
(7)①实验室中能用氢氧化钠溶液吸收的气体是_____(填字母序号)。
a、二氧化碳b、水蒸气c、氯化氢d、氧气
②吸收上述所选气体一般不用氢氧化钙溶液,主要是因为氢氧化钠和氢氧化钙的_____不同。
20.实验是学习化学的一种重要途径,三位同学设计了以下四个实验,请你和她一起完成实验活动。
(1)图中仪器a的名称是_______,贝贝同学在实验室制备二氧化碳,她选择B装置不选择A装置的原因是_______。
(2)米粒同学设计的实验C以证明NaOH溶液和CO2发生反应,该反应的化学反应方程式为_____。
(3)D实验中,树苗同学用湿润的pH试纸测定碳酸钠溶液的酸碱度,测得溶液的pH值和实际值相比_______(填“偏大”、“偏小”或“不变”)。
五、计算题
21.工业上采用离子交换膜电解槽电解饱和食盐水,可得到高浓度的烧碱溶液(含NaOH 35%~48%),某兴趣小组欲验证一化工厂生产的NaOH溶液是否达到了高浓度标准,进行了如下操作,请你参与计算:
(1)用36.5%的浓盐酸配制200g7.3%的盐酸,需要加水(密度为1g mL﹣1)______mL。(计算结果保留一位小数)
(2)采集该化工厂电解槽中的NaOH溶液20g,向其中滴入所配制的盐酸,当溶液的pH=7时,消耗盐酸100g,判断电解槽中NaOH溶液是否达到高浓度标准。(写出计算过程)
22.向100g氯化镁溶液中,不断加入一定溶质质量分数的氢氧化钾溶液,实验数据如下表:
氢氧化钾溶液的质量/g 5.6 11.2 22.4 33.6
生成沉淀的质量/g 0.145 0.29 0.58 0.58
(1)当滴加氢氧化钾溶液的质量为33.6g时,所得溶液的pH_______(填“<”“=”或“>”)7。
(2)选择合理的数据,计算该氯化镁溶液中溶质的质量分数_______。
参考答案:
1.B 2.C 3.D 4.A 5.D 6.A 7.C 8.C 9.A 10.B 11.A 12.C 13.B
14. 加快化学反应速率 AB ④③①②③
15.(1)钠原子和钠离子最外层电子数不同,所以钠原子和钠离子化学性质不同
(2)一个一氧化碳分子由一个碳原子和一个氧原子构成,一个二氧化碳分子由一个碳原子和两个氧原子构成,分子结构不同一氧化碳和二氧化碳化学性质不同。
(3)NaOH溶液和Ca(OH)2溶液都能解离出氢氧根离子,都能使酚酞溶液变红。
16.(1) Na2CO3 HCl Fe2O3 Fe
(2)红棕色固体逐渐消失,溶液由无色变为黄色
(3)2NaOH+CO2=Na2CO3+H2O
17. Na2CO3 Ca(OH)2+H2SO4=CaSO4+2H2O
18.(1)烧杯中的导管口有气泡冒出
(2)使烧杯中的白磷与氧气隔绝,同时提高温度达到铜片上白磷的着火点
(3)H2不溶于水,不与水反应
(4) 氢元素、氧元素
(5) 2000 H
19.(1)降低
(2)加入10mL水后试管中的部分空气被排出,也会使U形管中液面左低右高(其他合理答案均可)
(3) 固体表面变潮湿 溶液由无色变红色
(4)
(5)③④
(6) 氢氧化钠溶液
(7) ac 溶解度
20.(1) 锥形瓶 二氧化碳能溶于水,不能用排水法收集
(2)
(3)偏小
21.(1)160
(2)设:氢氧化钠溶液中溶质的质量分数为x.
x=40%介于35%到48%
答:电解槽中NaOH溶液达到高浓度标准。
22.(1)>
(2)解:设该氯化镁溶液中溶质的质量分数为x
答:该氯化镁溶液中溶质的质量分数为0.95%。
