第八单元海水中的化学测试题-2021-2022学年九年级化学鲁教版下册 (word版有答案)
文档属性
| 名称 | 第八单元海水中的化学测试题-2021-2022学年九年级化学鲁教版下册 (word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 337.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-06 21:32:16 | ||
图片预览




文档简介
第八单元《海水中的化学》测试题
一、单选题
1.生活中的下列现象不能说明气体溶解度随温度升高而减小的
A.烧开水时,沸腾前有气泡逸出
B.阳光充足时,盛满水的鱼缸璧上有小气泡
C.启开啤酒瓶盖,有大量泡沫溢出
D.夏季黄昏时,池糖里的鱼浮出水面
2.如图是A、B、C三种固体物质的溶解度曲线,下列说法错误的是( )
A.将t2℃时的A、B、C三种物质的饱和溶液降温至t1℃时,溶质质量分数最小的是C
B.A中混有少量B时,应采用降温结晶的方法提纯A
C.t1℃时,25gA物质能溶解于50g水中形成75g溶液
D.t2℃时的A、B、C三种物质的溶解度大小关系A>B>C
3.60℃时,向100g水中加入一定量硝酸钾形成溶液,降温至20℃,析出固体质量的变化如图(已知:在20℃时,100g水中最多溶解硝酸钾的质量为31.6g),下列说法正确的是
A.20℃时,100g硝酸钾饱和溶液中含硝酸钾的质量为31.6g
B.加入硝酸钾的质量为41.6g
C.降温过程中硝酸钾溶液始终为饱和溶液
D.降温过程中硝酸钾溶液中溶质的质量分数先减小后不变
4.下列除去杂质(括号内为杂质)的方法正确的是
A.N2(O2)——灼热的铜网
B.CO2(H2O)——将气体通入盛有生石灰的干燥管
C.NaCl(KNO3)——将固体溶解,然后降温结晶
D.CuO(Cu)——向固体中加入足量稀盐酸,过滤
5.甲、乙两种不含结晶水的固体物质的溶解度曲线如图所示,下列说法正确的是
A.甲的溶解度比乙小
B.将等质量甲、乙的两种溶液分别由t2℃降温至 t1℃,析出甲的质量一定比析出乙的质量大
C.t2℃时,甲的饱和溶液中溶质与溶液的质量比为1∶2
D.甲中混有少量乙时,可以采用冷却热的饱和溶液的方法提纯甲
6.下列过程中发生化学为变化的是
A.海水晒盐 B.自制汽水
C.将金属制成不同形状 D.氢氧化钠固体潮解
7.下列实验操作不能达到实验目的是( )
选项 实验目的 主要实验操作
A 除去CaO中的CaCO3 高温煅烧
B 检验人体呼出气体中是否含CO2 将气体通入澄清石灰水中,观察现象
C 将硬水软化 沉淀、过滤、吸附
D 鉴别CO2和CO 将气体通入石蕊溶液中、观察现象
A.A B.B C.C D.D
8.下列实验方法正确的是
A.用量筒量取6.85mL蒸馏水 B.用水来区别CaCO3和NaCl两种固体
C.用明矾使硬水转化为软水 D.用铁丝代替红磷测定空气中氧气含量
9.下列各组离子在溶液中能大量共存,并能使紫色石蕊溶液变蓝的是
A.H+、Ca2+、、 B.Ca2+、K+、、Cl-
C.Na+、Ba2+、OH-、 D.Na+、Ba2+、OH-、CI-
10.下列有关溶液的说法中,正确的是( )
A.食盐水倒出一半后浓度降低
B.某溶质的饱和溶液不能再溶解任何物质
C.升温会减小二氧化碳在水中的溶解度
D.蔗糖可以无限溶解在一定量的水中
11.化学是改造物质、应用物质的自然科学。下列对物质应用中,主要通过物理变化实现的是
A.葡萄酿成美酒 B.海水晒得食盐
C.熟石灰改良酸性土壤 D.海水生产纯碱
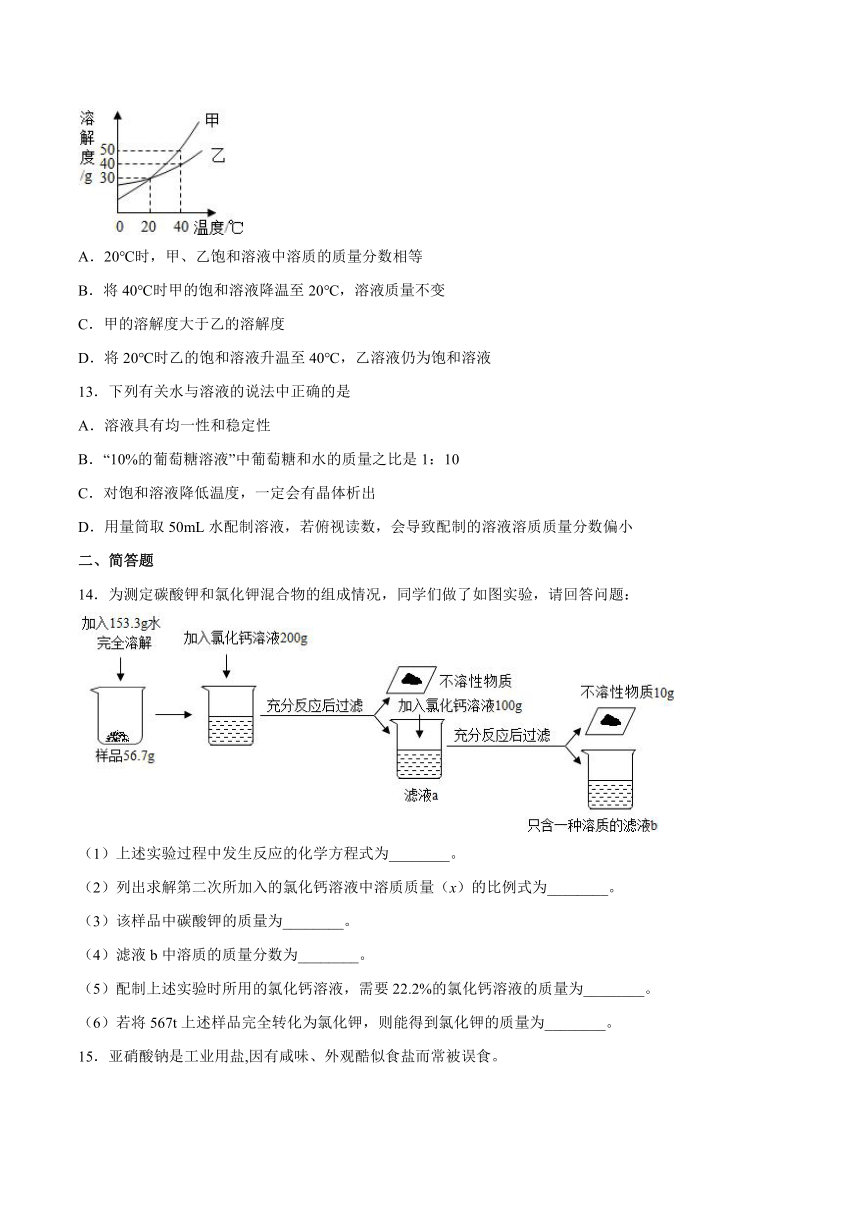
12.甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是
A.20℃时,甲、乙饱和溶液中溶质的质量分数相等
B.将40℃时甲的饱和溶液降温至20℃,溶液质量不变
C.甲的溶解度大于乙的溶解度
D.将20℃时乙的饱和溶液升温至40℃,乙溶液仍为饱和溶液
13.下列有关水与溶液的说法中正确的是
A.溶液具有均一性和稳定性
B.“10%的葡萄糖溶液”中葡萄糖和水的质量之比是1:10
C.对饱和溶液降低温度,一定会有晶体析出
D.用量筒取50mL水配制溶液,若俯视读数,会导致配制的溶液溶质质量分数偏小
二、简答题
14.为测定碳酸钾和氯化钾混合物的组成情况,同学们做了如图实验,请回答问题:
(1)上述实验过程中发生反应的化学方程式为________。
(2)列出求解第二次所加入的氯化钙溶液中溶质质量(x)的比例式为________。
(3)该样品中碳酸钾的质量为________。
(4)滤液b中溶质的质量分数为________。
(5)配制上述实验时所用的氯化钙溶液,需要22.2%的氯化钙溶液的质量为________。
(6)若将567t上述样品完全转化为氯化钾,则能得到氯化钾的质量为________。
15.亚硝酸钠是工业用盐,因有咸味、外观酷似食盐而常被误食。
亚硝酸钠 食盐
溶解性 易溶于水 易溶于水
熔点 271℃ 801℃
沸点 320℃分解放出有臭味的气体 1413℃
与稀盐酸反应 放出红棕色气体 不反应
试设计出两种区别亚硝酸钠和食盐的简单方案(简单叙述即可)
方案一:________________________;
方案二:__________________________。
三、推断题
16.现有一包白色粉末,可能是由氯化钾、氢氧化钠、硝酸钠和硫酸铜中的一种或多种物质组成。为确定其成分,某兴趣小组同学进行了如下实验。
(1)写出生成蓝色沉淀的化学方程式为_____。
(2)通过以上实验,不能确定白色粉末中是否含有_____(填化学式)。
(3)请写出该白色粉末的一种可能的物质组成的成分_____(写化学式)。
17.复习时,小东用水、硝酸钡溶液等物质玩起了化学游戏一“连连看”(如下图所示),其中A、B、C、D、E、F分别是氢氧化钡溶液、硝酸银溶液、硫酸钠溶液、碳酸钠溶液、氧化钙、稀盐酸中的一种。游戏规则要求相连接的两物质之间能发生化学反应,且D与E物质反应时无明显现象。请你和小东一起完成游戏,并回答下列问题:
(1)C、E分别为___________、___________
(2)C与D反应的现象为___________
(3)A与水反应的化学方程式为___________
(4)B与D反应的化学方程式为___________。
18.已知A~G为初中化学常见的七种物质。其中D的固体叫做“干冰”;B中只含两种元素,C与E不含相同元素。各种物质间的反应和转化关系如图所示(“一”表示相连的两种物质之间可以发生反应,“→”表示一种物质可以转化为另一种物质,反应条件、部分反应物和生成物已略去)。
请分析回答:
(1)D的化学式:___________。
(2)B与G反应的化学方程式:___________。
(3)A溶液与F溶液恰好完全反应时,所得溶液中的溶质为___________(填化学式)。
四、实验题
19.某化学兴趣小组为探究氢氧化钠的化学性质,进行了如下实验。
(一)向盛有适量氢氧化钠溶液的三支试管中分别加入下列试剂,实验现象记录如下:
试管编号 1 2 3
加入试剂 先加无色酚酞试液,再加入稀硫酸 通入二氧化碳气体 氯化铜溶液
实验现象 酚酞试液先变红色,后变为___________ 无明显现象 有___________产生
(1)试管1中的现象为酚酞试液先变红色,加入稀硫酸后变为___________色,说明氢氧化钠与硫酸发生了反应。
(2)试管3中发生反应的现象为有___________产生。
(二)兴趣小组的同学们对试管2中是否发生化学反应进一步探究。
小红同学设计了如下实验,其方案如图所示:
实验操作 实验现象 实验结论
软塑料瓶变瘪程度较大的是 二氧化碳能与氢氧化钠发生反应
(3)软塑料瓶变瘪程度较大的是___________(选填“甲”或“乙”)。
(4)小光设计实验验证实验乙瓶中溶质的成分,请帮他填写实验报告:
实验步骤 实验现象 结论
①取少许该溶液于试管中,滴入足量的___________溶液。 ___________ 溶质为碳酸钠和氢氧化钠
②静置上述溶液,取上层清液少许于另一支试管中,滴入几滴___________溶液 溶液变红
写出步骤①发生反应的化学方程式___________。
【反思】氢氧化钠溶液必须密封保存。
20.某化学兴趣小组同学欲除去固体氯化钠中混有的氯化钙。设计实验方案如下,请参与实验并回答问题。
(1)写出A物质的化学式:__________,写出A物质的俗称:_________。
(2)写出反应②的化学方程式___________。
(3)反应①中加入过量A物质的目的是除尽CaCl2,反应②中如果加入盐酸也过量,则对所得到的氯化钠纯度_________(选填“有”或“没有”)影响。
(4)分离后所得氯化钠的质量与分离前原混合物中氯化钠的质量相比较,结果_________(选填“增大”“不变”或“减小”)。
五、计算题
21.实验室有一瓶久置的氢氧化钠固体,某同学想了解其变质情况,称取15g样品于烧杯中,加入90克水,使之完全溶解,再向其中缓慢滴加过量的氢氧化钡溶液,完全反应后生成沉淀质量为5.91g。
(1)求样品中碳酸钠的质量分数?
(2)求反应后所得溶液中氢氧化钠的质量是多少?
22.某兴趣小组测定纯碱样品中碳酸钠的质量分数(假设该样品中杂质不与水反应也不与酸反应),取样品13g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如图所示,
求:
(1)生成二氧化碳的质量为______g;
(2)样品中碳酸钠的质量分数________;
(3)计算恰好完全反应时,所得溶液中溶质的质量分数_________。
23.有一包白色粉末,可能含氯化钠、氢氧化钠、碳酸钠中的一种或几种,为了确定其组成,小明称取了9.3克粉末,向其中加入100克7.3%的稀盐酸充分反应,生成的二氧化碳气体完全逸出(忽略其他物质逸出),所得溶液的质量为107.1克。用pH试纸检测溶液呈中性。
(1)产生二氧化碳气体的化学反应方程式为___________。
(2)这包白色粉末的成分为___________。
(3)求所得溶液中溶质的质量分数___________。(结果保留一位小数)
参考答案:
1.C 2.C 3.B 4.A 5.D 6.B 7.C 8.B 9.D 10.C 11.B 12.A
13.A
14.(1)
(2)
(3)由(2)可以解得x=11. 1g,那么第一加入的氯化钙溶液中氯化钙的质量就应该为22. 2g,共22. 2g+11. 1g=33. 3g,设样品中碳酸钾的质量为y。
解得:y=41. 4g,
答:该样品中碳酸钾的质量为41. 4g;
(4)溶液b中溶质只有氯化钾,设碳酸钾反应生成的氯化钾质量为z。
解得:z=73. 5g,原样品中还含有56. 7g-41. 4g=15. 3g,此时滤液b中溶质质量为735.g+15. 3g=88. 8g,根据质量守恒定律可知此时溶液质量为153. 3g+56. 7g+300g-30g=470g,滤液b中溶质质量分数为:。
答:滤液b中溶质的质量分数为18. 9%;
(5)150g
(6)888t
15. 用酒精灯加热,有臭味气体生成的是亚硝酸纳,无明显变化的是食盐 滴加稀盐酸,有红棕色气体出现的是亚硝酸钠,无现象的是食盐
16.(1)2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
(2)NaNO3
(3)KCl、NaOH、CuSO4
17.(1) 硝酸银##AgNO3
氢氧化钡##Ba(OH)2
(2)有白色沉淀生成
(3)
(4)
18.(1)CO2
(2)
(3)NaOH
19.(1)无
(2)蓝色沉淀
(3)乙
(4) CaCl2(或BaC12) 出现白色沉淀 酚酞 (或 )
20.(1) Na2CO3 纯碱
(2)
(3)没有
(4)增大
21.(1)解:设样品中碳酸钠的质量为x,生成氢氧化钠的质量为y
x=3.18g
y=2.4g
样品中碳酸钠的质量分数为:
答:样品中碳酸钠的质量分数为21.2%。
(2)溶液中氢氧化钠的质量为15g-3.18g+2.4g=14.22g
答:反应后所得溶液中氢氧化钠的质量为14.22g。
22.(1)4.4
(2)设样品中碳酸钠的质量为x,则有
故样品中碳酸钠的质量分数为:
(3)设恰好完全反应时,所得溶液中溶质的质量为y,则有
故恰好完全反应时,所得溶液中溶质的质量分数为:
23.(1)
(2)反应生成二氧化碳的质量为:9.3g+100g-107.1g=2.2g
解:设该白色粉末中碳酸钠的质量为x,与碳酸钠反应的氯化氢的质量为y,碳酸钠与稀盐酸反应生成氯化钠的质量为z
x=5.3g
y=3.65g
z=5.85g
加入稀盐酸的溶质的质量为:100g×7.3%=7.3g大于3.65g,最后溶液pH显中性,故白色粉末中一定含氢氧化钠。
设白色粉末中氢氧化钠的质量为m,氢氧化钠与稀盐酸反应生成氯化钠的质量为n
m=4g
n=5.85g
5.3g+4g=9.3g,故该白色粉末中含氢氧化钠和碳酸钠,不含氯化钠;
(3)所得溶液中溶质的质量分数为:
答:所得溶液中溶质的质量分数为10.9%
一、单选题
1.生活中的下列现象不能说明气体溶解度随温度升高而减小的
A.烧开水时,沸腾前有气泡逸出
B.阳光充足时,盛满水的鱼缸璧上有小气泡
C.启开啤酒瓶盖,有大量泡沫溢出
D.夏季黄昏时,池糖里的鱼浮出水面
2.如图是A、B、C三种固体物质的溶解度曲线,下列说法错误的是( )
A.将t2℃时的A、B、C三种物质的饱和溶液降温至t1℃时,溶质质量分数最小的是C
B.A中混有少量B时,应采用降温结晶的方法提纯A
C.t1℃时,25gA物质能溶解于50g水中形成75g溶液
D.t2℃时的A、B、C三种物质的溶解度大小关系A>B>C
3.60℃时,向100g水中加入一定量硝酸钾形成溶液,降温至20℃,析出固体质量的变化如图(已知:在20℃时,100g水中最多溶解硝酸钾的质量为31.6g),下列说法正确的是
A.20℃时,100g硝酸钾饱和溶液中含硝酸钾的质量为31.6g
B.加入硝酸钾的质量为41.6g
C.降温过程中硝酸钾溶液始终为饱和溶液
D.降温过程中硝酸钾溶液中溶质的质量分数先减小后不变
4.下列除去杂质(括号内为杂质)的方法正确的是
A.N2(O2)——灼热的铜网
B.CO2(H2O)——将气体通入盛有生石灰的干燥管
C.NaCl(KNO3)——将固体溶解,然后降温结晶
D.CuO(Cu)——向固体中加入足量稀盐酸,过滤
5.甲、乙两种不含结晶水的固体物质的溶解度曲线如图所示,下列说法正确的是
A.甲的溶解度比乙小
B.将等质量甲、乙的两种溶液分别由t2℃降温至 t1℃,析出甲的质量一定比析出乙的质量大
C.t2℃时,甲的饱和溶液中溶质与溶液的质量比为1∶2
D.甲中混有少量乙时,可以采用冷却热的饱和溶液的方法提纯甲
6.下列过程中发生化学为变化的是
A.海水晒盐 B.自制汽水
C.将金属制成不同形状 D.氢氧化钠固体潮解
7.下列实验操作不能达到实验目的是( )
选项 实验目的 主要实验操作
A 除去CaO中的CaCO3 高温煅烧
B 检验人体呼出气体中是否含CO2 将气体通入澄清石灰水中,观察现象
C 将硬水软化 沉淀、过滤、吸附
D 鉴别CO2和CO 将气体通入石蕊溶液中、观察现象
A.A B.B C.C D.D
8.下列实验方法正确的是
A.用量筒量取6.85mL蒸馏水 B.用水来区别CaCO3和NaCl两种固体
C.用明矾使硬水转化为软水 D.用铁丝代替红磷测定空气中氧气含量
9.下列各组离子在溶液中能大量共存,并能使紫色石蕊溶液变蓝的是
A.H+、Ca2+、、 B.Ca2+、K+、、Cl-
C.Na+、Ba2+、OH-、 D.Na+、Ba2+、OH-、CI-
10.下列有关溶液的说法中,正确的是( )
A.食盐水倒出一半后浓度降低
B.某溶质的饱和溶液不能再溶解任何物质
C.升温会减小二氧化碳在水中的溶解度
D.蔗糖可以无限溶解在一定量的水中
11.化学是改造物质、应用物质的自然科学。下列对物质应用中,主要通过物理变化实现的是
A.葡萄酿成美酒 B.海水晒得食盐
C.熟石灰改良酸性土壤 D.海水生产纯碱
12.甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是
A.20℃时,甲、乙饱和溶液中溶质的质量分数相等
B.将40℃时甲的饱和溶液降温至20℃,溶液质量不变
C.甲的溶解度大于乙的溶解度
D.将20℃时乙的饱和溶液升温至40℃,乙溶液仍为饱和溶液
13.下列有关水与溶液的说法中正确的是
A.溶液具有均一性和稳定性
B.“10%的葡萄糖溶液”中葡萄糖和水的质量之比是1:10
C.对饱和溶液降低温度,一定会有晶体析出
D.用量筒取50mL水配制溶液,若俯视读数,会导致配制的溶液溶质质量分数偏小
二、简答题
14.为测定碳酸钾和氯化钾混合物的组成情况,同学们做了如图实验,请回答问题:
(1)上述实验过程中发生反应的化学方程式为________。
(2)列出求解第二次所加入的氯化钙溶液中溶质质量(x)的比例式为________。
(3)该样品中碳酸钾的质量为________。
(4)滤液b中溶质的质量分数为________。
(5)配制上述实验时所用的氯化钙溶液,需要22.2%的氯化钙溶液的质量为________。
(6)若将567t上述样品完全转化为氯化钾,则能得到氯化钾的质量为________。
15.亚硝酸钠是工业用盐,因有咸味、外观酷似食盐而常被误食。
亚硝酸钠 食盐
溶解性 易溶于水 易溶于水
熔点 271℃ 801℃
沸点 320℃分解放出有臭味的气体 1413℃
与稀盐酸反应 放出红棕色气体 不反应
试设计出两种区别亚硝酸钠和食盐的简单方案(简单叙述即可)
方案一:________________________;
方案二:__________________________。
三、推断题
16.现有一包白色粉末,可能是由氯化钾、氢氧化钠、硝酸钠和硫酸铜中的一种或多种物质组成。为确定其成分,某兴趣小组同学进行了如下实验。
(1)写出生成蓝色沉淀的化学方程式为_____。
(2)通过以上实验,不能确定白色粉末中是否含有_____(填化学式)。
(3)请写出该白色粉末的一种可能的物质组成的成分_____(写化学式)。
17.复习时,小东用水、硝酸钡溶液等物质玩起了化学游戏一“连连看”(如下图所示),其中A、B、C、D、E、F分别是氢氧化钡溶液、硝酸银溶液、硫酸钠溶液、碳酸钠溶液、氧化钙、稀盐酸中的一种。游戏规则要求相连接的两物质之间能发生化学反应,且D与E物质反应时无明显现象。请你和小东一起完成游戏,并回答下列问题:
(1)C、E分别为___________、___________
(2)C与D反应的现象为___________
(3)A与水反应的化学方程式为___________
(4)B与D反应的化学方程式为___________。
18.已知A~G为初中化学常见的七种物质。其中D的固体叫做“干冰”;B中只含两种元素,C与E不含相同元素。各种物质间的反应和转化关系如图所示(“一”表示相连的两种物质之间可以发生反应,“→”表示一种物质可以转化为另一种物质,反应条件、部分反应物和生成物已略去)。
请分析回答:
(1)D的化学式:___________。
(2)B与G反应的化学方程式:___________。
(3)A溶液与F溶液恰好完全反应时,所得溶液中的溶质为___________(填化学式)。
四、实验题
19.某化学兴趣小组为探究氢氧化钠的化学性质,进行了如下实验。
(一)向盛有适量氢氧化钠溶液的三支试管中分别加入下列试剂,实验现象记录如下:
试管编号 1 2 3
加入试剂 先加无色酚酞试液,再加入稀硫酸 通入二氧化碳气体 氯化铜溶液
实验现象 酚酞试液先变红色,后变为___________ 无明显现象 有___________产生
(1)试管1中的现象为酚酞试液先变红色,加入稀硫酸后变为___________色,说明氢氧化钠与硫酸发生了反应。
(2)试管3中发生反应的现象为有___________产生。
(二)兴趣小组的同学们对试管2中是否发生化学反应进一步探究。
小红同学设计了如下实验,其方案如图所示:
实验操作 实验现象 实验结论
软塑料瓶变瘪程度较大的是 二氧化碳能与氢氧化钠发生反应
(3)软塑料瓶变瘪程度较大的是___________(选填“甲”或“乙”)。
(4)小光设计实验验证实验乙瓶中溶质的成分,请帮他填写实验报告:
实验步骤 实验现象 结论
①取少许该溶液于试管中,滴入足量的___________溶液。 ___________ 溶质为碳酸钠和氢氧化钠
②静置上述溶液,取上层清液少许于另一支试管中,滴入几滴___________溶液 溶液变红
写出步骤①发生反应的化学方程式___________。
【反思】氢氧化钠溶液必须密封保存。
20.某化学兴趣小组同学欲除去固体氯化钠中混有的氯化钙。设计实验方案如下,请参与实验并回答问题。
(1)写出A物质的化学式:__________,写出A物质的俗称:_________。
(2)写出反应②的化学方程式___________。
(3)反应①中加入过量A物质的目的是除尽CaCl2,反应②中如果加入盐酸也过量,则对所得到的氯化钠纯度_________(选填“有”或“没有”)影响。
(4)分离后所得氯化钠的质量与分离前原混合物中氯化钠的质量相比较,结果_________(选填“增大”“不变”或“减小”)。
五、计算题
21.实验室有一瓶久置的氢氧化钠固体,某同学想了解其变质情况,称取15g样品于烧杯中,加入90克水,使之完全溶解,再向其中缓慢滴加过量的氢氧化钡溶液,完全反应后生成沉淀质量为5.91g。
(1)求样品中碳酸钠的质量分数?
(2)求反应后所得溶液中氢氧化钠的质量是多少?
22.某兴趣小组测定纯碱样品中碳酸钠的质量分数(假设该样品中杂质不与水反应也不与酸反应),取样品13g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如图所示,
求:
(1)生成二氧化碳的质量为______g;
(2)样品中碳酸钠的质量分数________;
(3)计算恰好完全反应时,所得溶液中溶质的质量分数_________。
23.有一包白色粉末,可能含氯化钠、氢氧化钠、碳酸钠中的一种或几种,为了确定其组成,小明称取了9.3克粉末,向其中加入100克7.3%的稀盐酸充分反应,生成的二氧化碳气体完全逸出(忽略其他物质逸出),所得溶液的质量为107.1克。用pH试纸检测溶液呈中性。
(1)产生二氧化碳气体的化学反应方程式为___________。
(2)这包白色粉末的成分为___________。
(3)求所得溶液中溶质的质量分数___________。(结果保留一位小数)
参考答案:
1.C 2.C 3.B 4.A 5.D 6.B 7.C 8.B 9.D 10.C 11.B 12.A
13.A
14.(1)
(2)
(3)由(2)可以解得x=11. 1g,那么第一加入的氯化钙溶液中氯化钙的质量就应该为22. 2g,共22. 2g+11. 1g=33. 3g,设样品中碳酸钾的质量为y。
解得:y=41. 4g,
答:该样品中碳酸钾的质量为41. 4g;
(4)溶液b中溶质只有氯化钾,设碳酸钾反应生成的氯化钾质量为z。
解得:z=73. 5g,原样品中还含有56. 7g-41. 4g=15. 3g,此时滤液b中溶质质量为735.g+15. 3g=88. 8g,根据质量守恒定律可知此时溶液质量为153. 3g+56. 7g+300g-30g=470g,滤液b中溶质质量分数为:。
答:滤液b中溶质的质量分数为18. 9%;
(5)150g
(6)888t
15. 用酒精灯加热,有臭味气体生成的是亚硝酸纳,无明显变化的是食盐 滴加稀盐酸,有红棕色气体出现的是亚硝酸钠,无现象的是食盐
16.(1)2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
(2)NaNO3
(3)KCl、NaOH、CuSO4
17.(1) 硝酸银##AgNO3
氢氧化钡##Ba(OH)2
(2)有白色沉淀生成
(3)
(4)
18.(1)CO2
(2)
(3)NaOH
19.(1)无
(2)蓝色沉淀
(3)乙
(4) CaCl2(或BaC12) 出现白色沉淀 酚酞 (或 )
20.(1) Na2CO3 纯碱
(2)
(3)没有
(4)增大
21.(1)解:设样品中碳酸钠的质量为x,生成氢氧化钠的质量为y
x=3.18g
y=2.4g
样品中碳酸钠的质量分数为:
答:样品中碳酸钠的质量分数为21.2%。
(2)溶液中氢氧化钠的质量为15g-3.18g+2.4g=14.22g
答:反应后所得溶液中氢氧化钠的质量为14.22g。
22.(1)4.4
(2)设样品中碳酸钠的质量为x,则有
故样品中碳酸钠的质量分数为:
(3)设恰好完全反应时,所得溶液中溶质的质量为y,则有
故恰好完全反应时,所得溶液中溶质的质量分数为:
23.(1)
(2)反应生成二氧化碳的质量为:9.3g+100g-107.1g=2.2g
解:设该白色粉末中碳酸钠的质量为x,与碳酸钠反应的氯化氢的质量为y,碳酸钠与稀盐酸反应生成氯化钠的质量为z
x=5.3g
y=3.65g
z=5.85g
加入稀盐酸的溶质的质量为:100g×7.3%=7.3g大于3.65g,最后溶液pH显中性,故白色粉末中一定含氢氧化钠。
设白色粉末中氢氧化钠的质量为m,氢氧化钠与稀盐酸反应生成氯化钠的质量为n
m=4g
n=5.85g
5.3g+4g=9.3g,故该白色粉末中含氢氧化钠和碳酸钠,不含氯化钠;
(3)所得溶液中溶质的质量分数为:
答:所得溶液中溶质的质量分数为10.9%
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
