第6章常用的金属和盐复习题---2021-2022学年九年级化学沪教版(上海)下册(word版有答案)
文档属性
| 名称 | 第6章常用的金属和盐复习题---2021-2022学年九年级化学沪教版(上海)下册(word版有答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 150.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-06 21:55:48 | ||
图片预览

文档简介
第6章 常用的金属和盐 复习题
一、单选题
1.下列有关实验现象描述正确的是
A.硫在氧气中燃烧,发出微弱的淡蓝色火焰
B.铁丝在氧气中剧烈燃烧,火星四射,放热,生成黑色固体
C.红磷燃烧产生大量白色烟雾
D.铁钉放入硫酸铜溶液中,铁钉表面有铜生成
2.金属材料在生产、生活中使用很广泛。下列用途是利用了金属的导电性的是
A.铁制铁锅 B.金制项链 C.铜制导线 D.铝制易拉罐
3.据文献报道:一种特殊的铜纳米颗粒具有与金、银极其相似的反应惰性,可替代黄金做精密电子元器件。下列对该铜纳米颗粒的判断,正确的是
A.能与盐酸反应产生氢气 B.具有良好的导电性
C.能与硫酸亚铁发生置换反应 D.在空气中容易发生氧化反应
4.有Mg、Al、Zn的混合物共7.2 g,与足量盐酸反应,生成氢气的质量不可能是
A.0.3 g B.0.5 g C.0.7 g D.0.9 g
5.下列实验操作能达到实验目的的是
选项 实验目的 实验操作
A 鉴别硬水和软水 取样,分别加入肥皂水,振荡
B 鉴别二氧化碳和氮气 将燃着的木条伸入瓶中
C 除去Fe粉中少量Cu粉 加入足量的稀硫酸,过滤,洗涤,烘干
D 除去CO2中少量CO 将混合气体在氧气中点燃
A.A B.B C.C D.D
6.下列关于Ca(OH)2的说法错误的是( )
A.微溶于水,水溶液呈碱性
B.能与酸反应,可用于治疗胃酸过多
C.澄清溶液可用来检验CO2
D.与CuSO4溶液按一定比例混合,可配制波尔多液
7.除去下列物质中混有的少量杂质(括号内为杂质),拟定的实验方案不可行的是
A.N2(O2):通过灼热的铜网 B.CaO(CaCO3):加水充分溶解,再过滤
C.CuO(木炭粉):在空气中灼烧 D.CO(CO2):通过灼热的木炭层
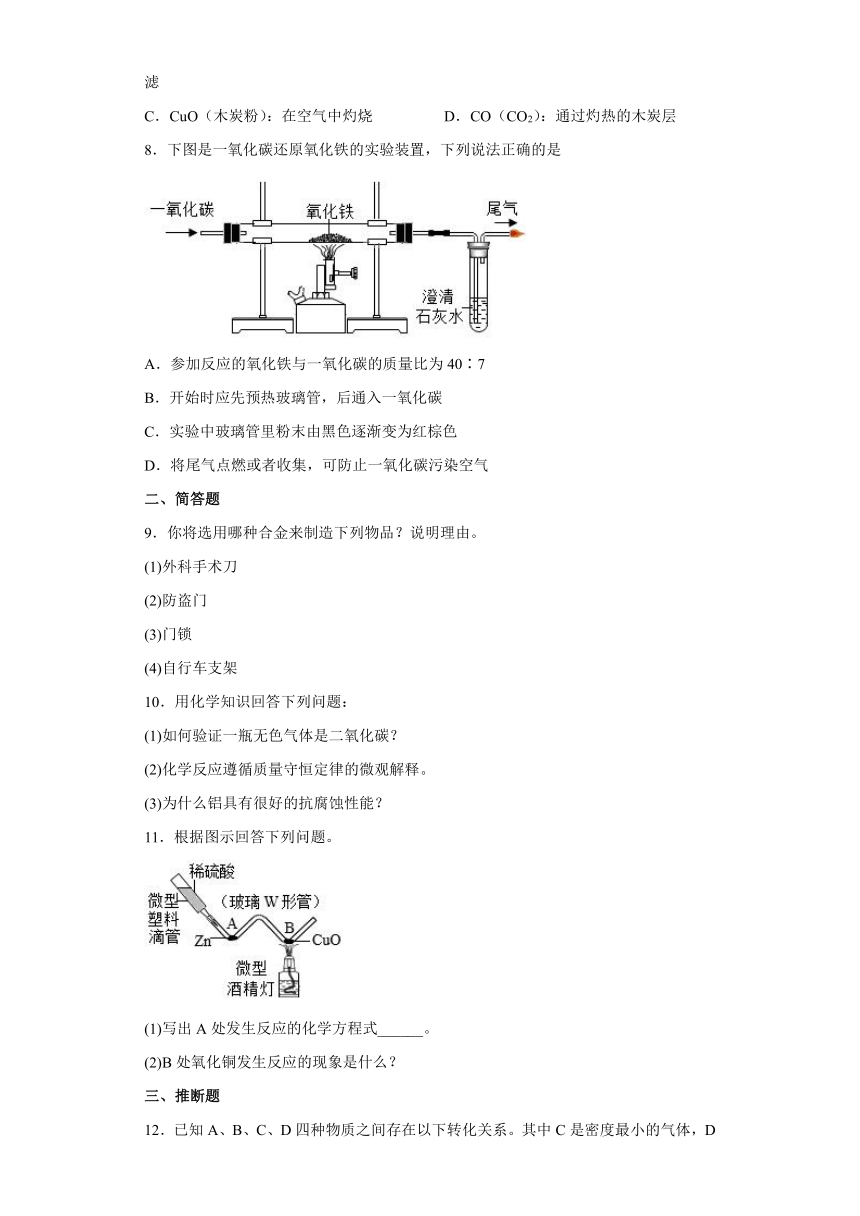
8.下图是一氧化碳还原氧化铁的实验装置,下列说法正确的是
A.参加反应的氧化铁与一氧化碳的质量比为40∶7
B.开始时应先预热玻璃管,后通入一氧化碳
C.实验中玻璃管里粉末由黑色逐渐变为红棕色
D.将尾气点燃或者收集,可防止一氧化碳污染空气
二、简答题
9.你将选用哪种合金来制造下列物品?说明理由。
(1)外科手术刀
(2)防盗门
(3)门锁
(4)自行车支架
10.用化学知识回答下列问题:
(1)如何验证一瓶无色气体是二氧化碳?
(2)化学反应遵循质量守恒定律的微观解释。
(3)为什么铝具有很好的抗腐蚀性能?
11.根据图示回答下列问题。
(1)写出A处发生反应的化学方程式______。
(2)B处氧化铜发生反应的现象是什么?
三、推断题
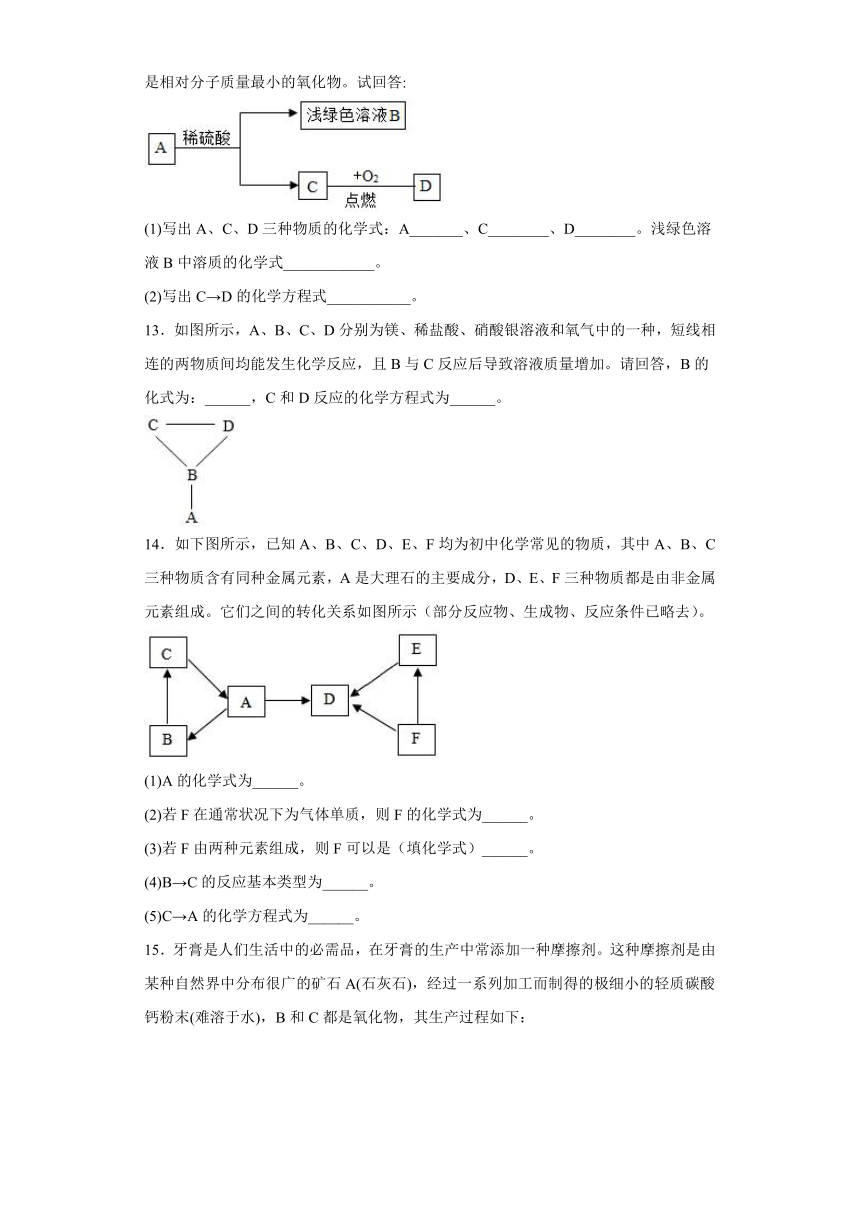
12.已知A、B、C、D四种物质之间存在以下转化关系。其中C是密度最小的气体,D是相对分子质量最小的氧化物。试回答:
(1)写出A、C、D三种物质的化学式:A_______、C________、D________。浅绿色溶液B中溶质的化学式____________。
(2)写出C→D的化学方程式___________。
13.如图所示,A、B、C、D分别为镁、稀盐酸、硝酸银溶液和氧气中的一种,短线相连的两物质间均能发生化学反应,且B与C反应后导致溶液质量增加。请回答,B的化式为:______,C和D反应的化学方程式为______。
14.如下图所示,已知A、B、C、D、E、F均为初中化学常见的物质,其中A、B、C三种物质含有同种金属元素,A是大理石的主要成分,D、E、F三种物质都是由非金属元素组成。它们之间的转化关系如图所示(部分反应物、生成物、反应条件已略去)。
(1)A的化学式为______。
(2)若F在通常状况下为气体单质,则F的化学式为______。
(3)若F由两种元素组成,则F可以是(填化学式)______。
(4)B→C的反应基本类型为______。
(5)C→A的化学方程式为______。
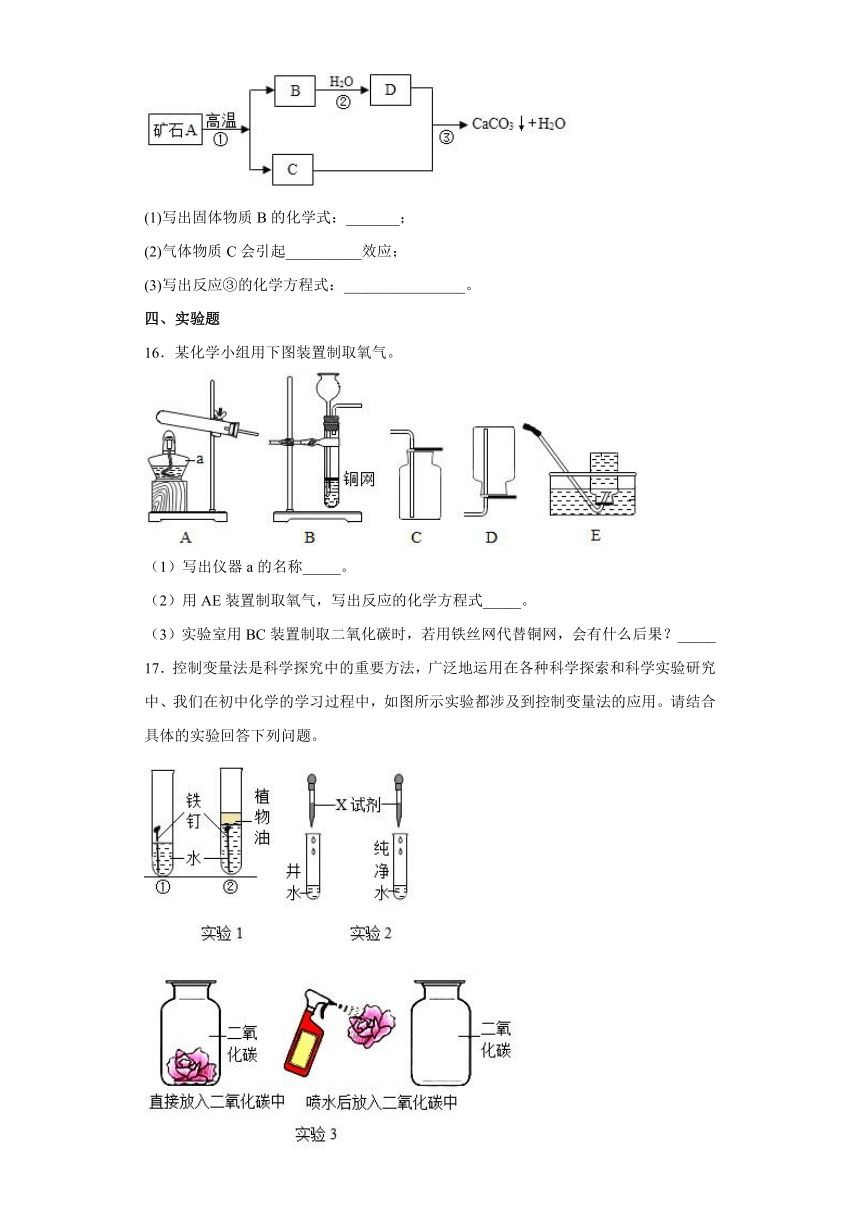
15.牙膏是人们生活中的必需品,在牙膏的生产中常添加一种摩擦剂。这种摩擦剂是由某种自然界中分布很广的矿石A(石灰石),经过一系列加工而制得的极细小的轻质碳酸钙粉末(难溶于水),B和C都是氧化物,其生产过程如下:
(1)写出固体物质B的化学式:_______;
(2)气体物质C会引起__________效应;
(3)写出反应③的化学方程式:________________。
四、实验题
16.某化学小组用下图装置制取氧气。
(1)写出仪器a的名称_____。
(2)用AE装置制取氧气,写出反应的化学方程式_____。
(3)实验室用BC装置制取二氧化碳时,若用铁丝网代替铜网,会有什么后果?_____
17.控制变量法是科学探究中的重要方法,广泛地运用在各种科学探索和科学实验研究中、我们在初中化学的学习过程中,如图所示实验都涉及到控制变量法的应用。请结合具体的实验回答下列问题。
(1)实验1是“探究铁的锈蚀条件”中的一组对比实验,根据①中铁钉生锈的现象,得出铁生锈的条件是______;其中试管②中的水需要事先煮沸,目的是______;
(2)实验2中向等量的井水和纯净水中分别滴入等量的X试剂,观察到井水中产生大量浮渣,则X试剂为______;
(3)实验3中紫色的干石蕊纸花喷水后放入二氧化碳中,观察到的现象是______。
18.如图是初中化学中的几个重要实验。请回答有关问题:
(1)小亮用实验一验证二氧化碳与氢氧化钠溶液反应,看到的现象是______,他根据三氧化硫与二氧化碳所属的类别,推断三氧化硫也能与氢氧化钠溶液反应,反应的化学方程式为______。
(2)通过实验二的三个实验,______(填“能”或“不能”)得出Zn、Fe、Cu三种金属的活动性顺序,得出Fe、Cu 活动性顺序的现象是______,②中反应的化学方程式为______。
(3)实验三利用CO气体模拟炼铁的原理。
①为了避免装置A中玻璃管在加热时可能发生爆炸,加热前应______。
②装置A玻璃管中发生反应的化学方程式为______。
③装置B的作用是______。
19.如图所示,吸滤瓶中放有适量的碎铁屑,分液漏斗中盛有稀硫酸,吸滤瓶的测管口仅系一气球,打开分液漏斗的活塞使稀硫酸滴入吸滤瓶中,使其与碎铁屑充分接触,观察到的实验现象是_______。反应前和反应后相比较,整个装置的质量_______(填写下列序号:①没有变化 ②有变化,前者质量大于后者 ③有变化,后者质量大于前者),用所学的化学知识解释得出上述结论的原因______。
五、计算题
20.家庭厨房就是一个化学小世界,“柴米油盐”中包含着许多化学知识。食醋、食盐和纯碱都是日常生活中常用的物质。食醋中通常含有3%~5%的乙酸,乙酸俗称醋酸(化学式为CH3COOH),是一种无色液体。食盐和纯碱都是白色固体。
(1)醋酸和纯碱中属于无机物的是________(写化学式)。
(2)醋酸中,C、O两元素的质量之比为________(填最简整数比)。
21.工业上,把铁矿石和石灰石等物质一起加入高炉,通入热空气,经过一系列反应最终可得到生铁。
(1)炼铁的原料除了铁矿石和石灰石外,还需要的一种物质是 。
(2)工业上某厂日产含铁1.4×104t的生铁,至少需含氧化铁80%的赤铁矿的质量为多少?(根据化学方程式计算并写出解题过程)
22.实验室有一变质的氢氧化钠样品(样品中只含碳酸钠杂质,且成分均匀),为测量样品中Na2CO3的质量分数,小明进行了如下实验。
①取质量、大小相同的3个烧杯,分别加入一定质量分数的稀盐酸100克;
②向上述3个烧杯中分别加入3份质量不同的样品;
③充分反应后,再称量烧杯及烧杯内物质的总质量(假设产生的气体完全逸出)。
实验数据记录如下:
实验一 实验二 实验三
反应前稀盐酸+烧杯质量(克) 150 150 150
反应前固体样品质量(克) 5 10 15
反应后烧杯内物质+烧杯质量(克) m 157.8 161.7
已知实验中发生的反应有:NaOH+HCl=NaCl+H2O;Na2CO3+2HCl=2NaCl+H2O+CO2↑
(1)根据数据,可判断实验二的样品已完全反应的理由是_________。
(2)表中的m值为__________。
(3)根据实验二的数据计算样品中Na2CO3的质量分数______。(写出计算过程)
试卷第1页,共3页
参考答案:
1.B
2.C
3.B
4.D
5.A
6.B
7.B
8.D
9.(1)外科手术刀用不锈钢,硬度大、耐腐蚀性好
(2)防盗门使用锰钢,硬度大、韧性好
(3)门锁使用黄铜,耐磨、耐腐蚀
(4)自行车支架使用锰钢,韧性好、硬度大
10.(1)向集气瓶倒入澄清石灰水振荡,观察到石灰水变浑浊(等)
(2)化学反应前后原子种类、数目、质量不变(等)
(3)铝能与氧气反应生成一层致密的氧化铝薄膜,阻止铝进一步被氧化(等)
11.(1)Zn+H2SO4= ZnSO4+H2↑
(2)黑色固体变为红色,W形管内壁有水珠生成
12.(1) Fe H2 H2O FeSO4
(2)
13. Mg HCl+AgNO3=AgCl↓+HNO3
14.(1)CaCO3
(2)O2
(3)H2O2
(4)化合反应
(5)(合理即可)
15.(1)CaO
(2)温室
(3)CO2+Ca(OH)2=CaCO3↓+H2O
16. 酒精灯 2KClO32KCl+3O2↑ 制取的二氧化碳中会混有氢气
17.(1) 与氧气接触 除去水中溶有的少量的氧气
(2)肥皂水
(3)紫色石蕊纸花变红
18.(1) 气球胀大
(2) 能 试管③中有红色固体析出,溶液由蓝色变为浅绿色
(3) 通一段时间一氧化碳
吸收二氧化碳,并通过排水法收集一氧化碳
19. 有气泡产生,气球膨胀 ① 因为化学反应遵守质量守恒定律,且反应过程中装置始终处于密闭状态,没有质量损失。
20.(1)Na2CO3;(2)3:4
21.(1)焦炭
(2)解:设至少需含氧化铁80%的赤铁矿的质量为x
x=2.5×104t
答:至少需含氧化铁80%的赤铁矿的质量为2.5×104t。
22.(1)因为实验三产生的气体质量大于实验二产生的气体质量,说明实验二中稀盐酸有剩余,则样品已完全反应
(2)153.9
(3)解:设10 g样品中Na2CO3的质量为x
x=53%
答:样品中Na2CO3的质量分数为53 %
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列有关实验现象描述正确的是
A.硫在氧气中燃烧,发出微弱的淡蓝色火焰
B.铁丝在氧气中剧烈燃烧,火星四射,放热,生成黑色固体
C.红磷燃烧产生大量白色烟雾
D.铁钉放入硫酸铜溶液中,铁钉表面有铜生成
2.金属材料在生产、生活中使用很广泛。下列用途是利用了金属的导电性的是
A.铁制铁锅 B.金制项链 C.铜制导线 D.铝制易拉罐
3.据文献报道:一种特殊的铜纳米颗粒具有与金、银极其相似的反应惰性,可替代黄金做精密电子元器件。下列对该铜纳米颗粒的判断,正确的是
A.能与盐酸反应产生氢气 B.具有良好的导电性
C.能与硫酸亚铁发生置换反应 D.在空气中容易发生氧化反应
4.有Mg、Al、Zn的混合物共7.2 g,与足量盐酸反应,生成氢气的质量不可能是
A.0.3 g B.0.5 g C.0.7 g D.0.9 g
5.下列实验操作能达到实验目的的是
选项 实验目的 实验操作
A 鉴别硬水和软水 取样,分别加入肥皂水,振荡
B 鉴别二氧化碳和氮气 将燃着的木条伸入瓶中
C 除去Fe粉中少量Cu粉 加入足量的稀硫酸,过滤,洗涤,烘干
D 除去CO2中少量CO 将混合气体在氧气中点燃
A.A B.B C.C D.D
6.下列关于Ca(OH)2的说法错误的是( )
A.微溶于水,水溶液呈碱性
B.能与酸反应,可用于治疗胃酸过多
C.澄清溶液可用来检验CO2
D.与CuSO4溶液按一定比例混合,可配制波尔多液
7.除去下列物质中混有的少量杂质(括号内为杂质),拟定的实验方案不可行的是
A.N2(O2):通过灼热的铜网 B.CaO(CaCO3):加水充分溶解,再过滤
C.CuO(木炭粉):在空气中灼烧 D.CO(CO2):通过灼热的木炭层
8.下图是一氧化碳还原氧化铁的实验装置,下列说法正确的是
A.参加反应的氧化铁与一氧化碳的质量比为40∶7
B.开始时应先预热玻璃管,后通入一氧化碳
C.实验中玻璃管里粉末由黑色逐渐变为红棕色
D.将尾气点燃或者收集,可防止一氧化碳污染空气
二、简答题
9.你将选用哪种合金来制造下列物品?说明理由。
(1)外科手术刀
(2)防盗门
(3)门锁
(4)自行车支架
10.用化学知识回答下列问题:
(1)如何验证一瓶无色气体是二氧化碳?
(2)化学反应遵循质量守恒定律的微观解释。
(3)为什么铝具有很好的抗腐蚀性能?
11.根据图示回答下列问题。
(1)写出A处发生反应的化学方程式______。
(2)B处氧化铜发生反应的现象是什么?
三、推断题
12.已知A、B、C、D四种物质之间存在以下转化关系。其中C是密度最小的气体,D是相对分子质量最小的氧化物。试回答:
(1)写出A、C、D三种物质的化学式:A_______、C________、D________。浅绿色溶液B中溶质的化学式____________。
(2)写出C→D的化学方程式___________。
13.如图所示,A、B、C、D分别为镁、稀盐酸、硝酸银溶液和氧气中的一种,短线相连的两物质间均能发生化学反应,且B与C反应后导致溶液质量增加。请回答,B的化式为:______,C和D反应的化学方程式为______。
14.如下图所示,已知A、B、C、D、E、F均为初中化学常见的物质,其中A、B、C三种物质含有同种金属元素,A是大理石的主要成分,D、E、F三种物质都是由非金属元素组成。它们之间的转化关系如图所示(部分反应物、生成物、反应条件已略去)。
(1)A的化学式为______。
(2)若F在通常状况下为气体单质,则F的化学式为______。
(3)若F由两种元素组成,则F可以是(填化学式)______。
(4)B→C的反应基本类型为______。
(5)C→A的化学方程式为______。
15.牙膏是人们生活中的必需品,在牙膏的生产中常添加一种摩擦剂。这种摩擦剂是由某种自然界中分布很广的矿石A(石灰石),经过一系列加工而制得的极细小的轻质碳酸钙粉末(难溶于水),B和C都是氧化物,其生产过程如下:
(1)写出固体物质B的化学式:_______;
(2)气体物质C会引起__________效应;
(3)写出反应③的化学方程式:________________。
四、实验题
16.某化学小组用下图装置制取氧气。
(1)写出仪器a的名称_____。
(2)用AE装置制取氧气,写出反应的化学方程式_____。
(3)实验室用BC装置制取二氧化碳时,若用铁丝网代替铜网,会有什么后果?_____
17.控制变量法是科学探究中的重要方法,广泛地运用在各种科学探索和科学实验研究中、我们在初中化学的学习过程中,如图所示实验都涉及到控制变量法的应用。请结合具体的实验回答下列问题。
(1)实验1是“探究铁的锈蚀条件”中的一组对比实验,根据①中铁钉生锈的现象,得出铁生锈的条件是______;其中试管②中的水需要事先煮沸,目的是______;
(2)实验2中向等量的井水和纯净水中分别滴入等量的X试剂,观察到井水中产生大量浮渣,则X试剂为______;
(3)实验3中紫色的干石蕊纸花喷水后放入二氧化碳中,观察到的现象是______。
18.如图是初中化学中的几个重要实验。请回答有关问题:
(1)小亮用实验一验证二氧化碳与氢氧化钠溶液反应,看到的现象是______,他根据三氧化硫与二氧化碳所属的类别,推断三氧化硫也能与氢氧化钠溶液反应,反应的化学方程式为______。
(2)通过实验二的三个实验,______(填“能”或“不能”)得出Zn、Fe、Cu三种金属的活动性顺序,得出Fe、Cu 活动性顺序的现象是______,②中反应的化学方程式为______。
(3)实验三利用CO气体模拟炼铁的原理。
①为了避免装置A中玻璃管在加热时可能发生爆炸,加热前应______。
②装置A玻璃管中发生反应的化学方程式为______。
③装置B的作用是______。
19.如图所示,吸滤瓶中放有适量的碎铁屑,分液漏斗中盛有稀硫酸,吸滤瓶的测管口仅系一气球,打开分液漏斗的活塞使稀硫酸滴入吸滤瓶中,使其与碎铁屑充分接触,观察到的实验现象是_______。反应前和反应后相比较,整个装置的质量_______(填写下列序号:①没有变化 ②有变化,前者质量大于后者 ③有变化,后者质量大于前者),用所学的化学知识解释得出上述结论的原因______。
五、计算题
20.家庭厨房就是一个化学小世界,“柴米油盐”中包含着许多化学知识。食醋、食盐和纯碱都是日常生活中常用的物质。食醋中通常含有3%~5%的乙酸,乙酸俗称醋酸(化学式为CH3COOH),是一种无色液体。食盐和纯碱都是白色固体。
(1)醋酸和纯碱中属于无机物的是________(写化学式)。
(2)醋酸中,C、O两元素的质量之比为________(填最简整数比)。
21.工业上,把铁矿石和石灰石等物质一起加入高炉,通入热空气,经过一系列反应最终可得到生铁。
(1)炼铁的原料除了铁矿石和石灰石外,还需要的一种物质是 。
(2)工业上某厂日产含铁1.4×104t的生铁,至少需含氧化铁80%的赤铁矿的质量为多少?(根据化学方程式计算并写出解题过程)
22.实验室有一变质的氢氧化钠样品(样品中只含碳酸钠杂质,且成分均匀),为测量样品中Na2CO3的质量分数,小明进行了如下实验。
①取质量、大小相同的3个烧杯,分别加入一定质量分数的稀盐酸100克;
②向上述3个烧杯中分别加入3份质量不同的样品;
③充分反应后,再称量烧杯及烧杯内物质的总质量(假设产生的气体完全逸出)。
实验数据记录如下:
实验一 实验二 实验三
反应前稀盐酸+烧杯质量(克) 150 150 150
反应前固体样品质量(克) 5 10 15
反应后烧杯内物质+烧杯质量(克) m 157.8 161.7
已知实验中发生的反应有:NaOH+HCl=NaCl+H2O;Na2CO3+2HCl=2NaCl+H2O+CO2↑
(1)根据数据,可判断实验二的样品已完全反应的理由是_________。
(2)表中的m值为__________。
(3)根据实验二的数据计算样品中Na2CO3的质量分数______。(写出计算过程)
试卷第1页,共3页
参考答案:
1.B
2.C
3.B
4.D
5.A
6.B
7.B
8.D
9.(1)外科手术刀用不锈钢,硬度大、耐腐蚀性好
(2)防盗门使用锰钢,硬度大、韧性好
(3)门锁使用黄铜,耐磨、耐腐蚀
(4)自行车支架使用锰钢,韧性好、硬度大
10.(1)向集气瓶倒入澄清石灰水振荡,观察到石灰水变浑浊(等)
(2)化学反应前后原子种类、数目、质量不变(等)
(3)铝能与氧气反应生成一层致密的氧化铝薄膜,阻止铝进一步被氧化(等)
11.(1)Zn+H2SO4= ZnSO4+H2↑
(2)黑色固体变为红色,W形管内壁有水珠生成
12.(1) Fe H2 H2O FeSO4
(2)
13. Mg HCl+AgNO3=AgCl↓+HNO3
14.(1)CaCO3
(2)O2
(3)H2O2
(4)化合反应
(5)(合理即可)
15.(1)CaO
(2)温室
(3)CO2+Ca(OH)2=CaCO3↓+H2O
16. 酒精灯 2KClO32KCl+3O2↑ 制取的二氧化碳中会混有氢气
17.(1) 与氧气接触 除去水中溶有的少量的氧气
(2)肥皂水
(3)紫色石蕊纸花变红
18.(1) 气球胀大
(2) 能 试管③中有红色固体析出,溶液由蓝色变为浅绿色
(3) 通一段时间一氧化碳
吸收二氧化碳,并通过排水法收集一氧化碳
19. 有气泡产生,气球膨胀 ① 因为化学反应遵守质量守恒定律,且反应过程中装置始终处于密闭状态,没有质量损失。
20.(1)Na2CO3;(2)3:4
21.(1)焦炭
(2)解:设至少需含氧化铁80%的赤铁矿的质量为x
x=2.5×104t
答:至少需含氧化铁80%的赤铁矿的质量为2.5×104t。
22.(1)因为实验三产生的气体质量大于实验二产生的气体质量,说明实验二中稀盐酸有剩余,则样品已完全反应
(2)153.9
(3)解:设10 g样品中Na2CO3的质量为x
x=53%
答:样品中Na2CO3的质量分数为53 %
答案第1页,共2页
答案第1页,共2页
