第三单元课题2原子的结构课件—2021-2022学年九年级化学人教版上册(共50张PPT)
文档属性
| 名称 | 第三单元课题2原子的结构课件—2021-2022学年九年级化学人教版上册(共50张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 7.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-06 22:39:23 | ||
图片预览








文档简介
(共50张PPT)
课题2 原子的结构
(第一课时)原子的构成 相对原子质量
人教版·九年级·上册
【学习目标】
1、知道原子的构成,以及构成原子的粒子之间的关系;
2、学会原子结构示意图的画法,知道微粒模型化是探索微观世界的
一种方法;
3、认识原子核外排布的基本规律,了解金属、非金属、稀有气体元
素的原子核外电子的排布特点;
4、以氯化钠为例,认识离子的形成过程,知道离子也是构成物质的
一种基本微粒;
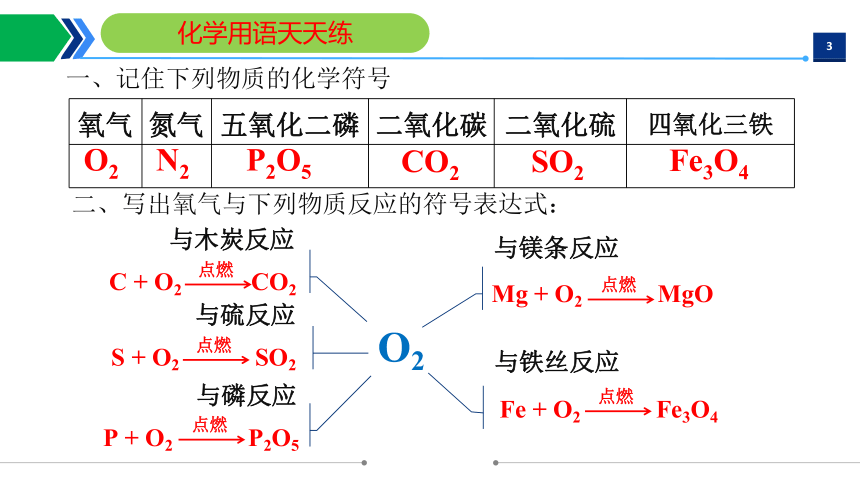
化学用语天天练
氧气 氮气 五氧化二磷 二氧化碳 二氧化硫 四氧化三铁
O2
N2
P2O5
CO2
一、记住下列物质的化学符号
SO2
Fe3O4
O2
与硫反应
与磷反应
与铁丝反应
二、写出氧气与下列物质反应的符号表达式:
与木炭反应
与镁条反应
Mg + O2 MgO
点燃
C + O2 CO2
点燃
Fe + O2 Fe3O4
点燃
S + O2 SO2
点燃
P + O2 P2O5
点燃
一、原子的构成
英国化学家道尔顿
实心球模型
1803年,道尔顿提出:构成物质的最小粒子是原子,原子是不可再分的实心球体。
英国物理学家汤姆生
枣糕模型
1897年,汤姆生发现,原子中还有带负电的电子,他提出:原子并不是构成物质的最小粒子,电子就像枣子一样嵌在糕点中一样。
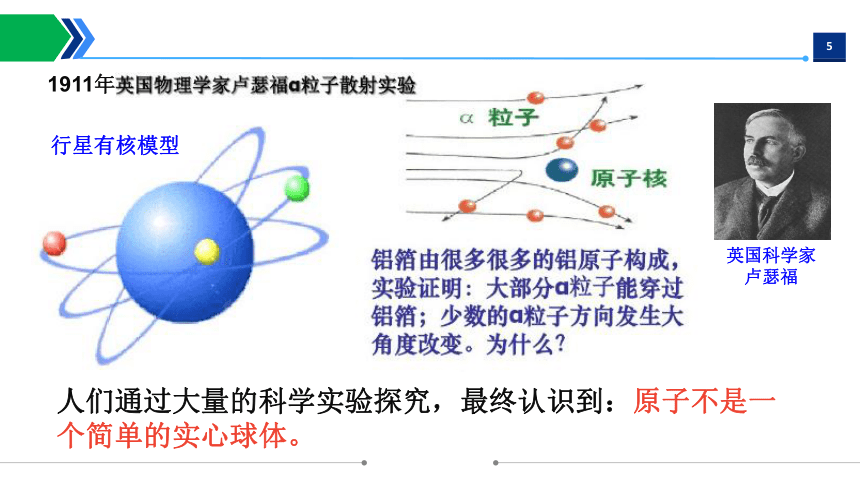
英国科学家
卢瑟福
行星有核模型
1911年
人们通过大量的科学实验探究,最终认识到:原子不是一个简单的实心球体。
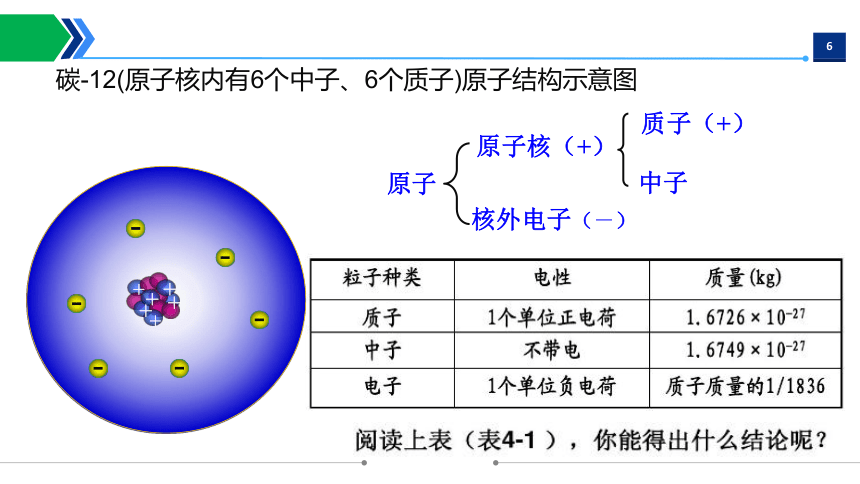
碳-12(原子核内有6个中子、6个质子)原子结构示意图
原子
原子核(+)
核外电子(-)
质子(+)
中子
+
+
+
+
+
+
1、质子带 电,中子 电,电子带 电;
2、中子 电,所以原子核的电性由 决定;
因此原子核带 电,电荷数目(核电荷数)与质子数相等;
3、质子和中子的质量 ,但比 大得多;
4、 的质量很小,可忽略不计。因此,原子的质量约等于
的质量,即 和 质量之和。
正
不带
负
不带
质子
正
几乎相等
电子
电子
原子核
质子
中子
观察上表,你能发现什么规律?
观察下表,思考下列问题:
1、不同种原子核内的质子数 ;
2、同种原子中: ;
3、 核中没有中子。
不同
质子数=核外电子数=核电荷数=原子序数
氢原子
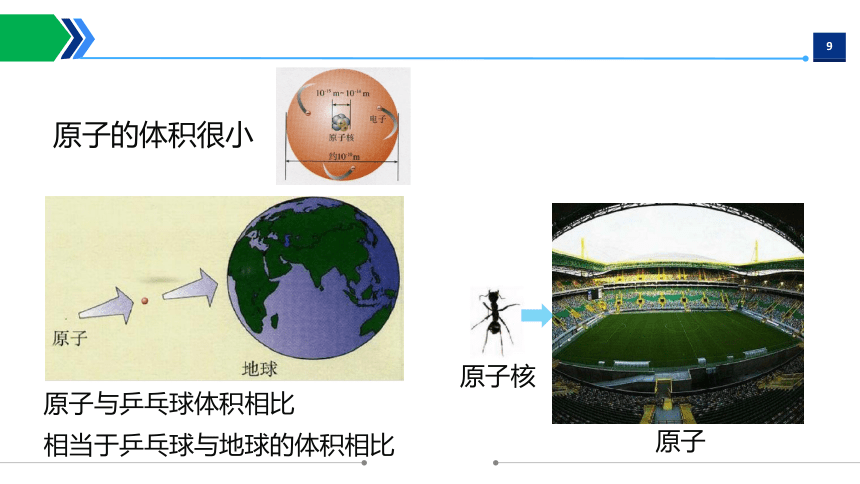
原子的体积很小
原子与乒乓球体积相比
相当于乒乓球与地球的体积相比
原子
原子核
原子的质量也很小
资料:原子的质量测定值
一个碳原子的质量是:0.00000000000000000000000001993千克
即:1.993×10-26千克
一个氧原子的质量是:0.00000000000000000000000002657千克
即:2.657×10-26千克
一个铁原子的质量是:0.00000000000000000000000009288千克
即:9.288×10-26千克
原子的质量很小,书写、使用都很不方便,怎么办?
二、相对原子质量(Ar)
相对原子质量就是以一种碳原子质量的1/12(质子数、中子数均为6)为标准,其它原子的质量跟它相比较所得到的比值。
相对原子质量(Ar)=
某原子的实际质量
(1) 相对原子质量________ 原子的实际质量,是个比值。
(2) 原子实际质量越大,它的相对原子质量数值 越____ 。
(3)相对原子质量的单位是: 。
(4)原子实际质量的单位是: ___________ 。
不等于
大
“1”(省略不写)
千克或克
一个碳原子的实际质量×
1
12
已知一个氧原子的质量是:2.657×10-26Kg
一个碳原子的质量是:1.993×10-26Kg。
则氧原子的相对原子质量为多少?
氧原子的相对原子质量
2.657x10-26kg
≈16
=
1
12
1.993x10-26kg
×
“16”的含义是:1个氧原子的质量是一个标准质量(一个碳原子质量的1/12)的16倍。
张青莲,我国著名的化学家,中国科学院院士。1991年他测定的铟相对原子质量被采用为国际新标准。
观察下表,思考下列问题:
1、同种原子中: ;
质子数=核外电子数=核电荷数=原子序数
质子数
中子数
2、相对原子质量 ≈ + 。
3、原子的另一种表示方法:
C
6
12
质子数
相对原子质量
( )1.下列关于原子的叙述中,正确的是:
A.是带电的微粒 B.是实心球体
C.可分解为分子 D.原子总体不显电性
D
( )2.下列说法错误的是:
A.原子核由质子、中子构成
B.花香四溢主要是由于分子之间有间隔
C.保持水化学性质的微粒是水分子
D.化学反应前后原子的种类不会改变
B
巩固练习
( )3.下列关于原子核的叙述中,正确的是:
①通常由中子和电子构成; ②通常由质子和中子构成;
③带负电荷; ④不显电性;⑤不能再分;
⑥体积大约相当于原子; ⑦质量大约相当于原子。
A.①⑤ B.②⑦ C.③④ D.②⑥⑦
B
( )4.月球土壤中含有大量的He-3原子,它可能成为未来核能的重要原料。He-3原子核内有两个质子和1个中子,则He-3原子的核电荷数为:
A.2 B.1 C.0 .3
A
巩固练习
巩固练习
( )5.铈(Ce)是一种常见的稀土元素,已知铈原子的原子核内有58个质子和82个中子,该原子的核外电子数为:
A.24 B.58 C.82 D.140
B
( )6.下列有关原子的说法错误的是:
A.原子是化学变化中的最小粒子
B.原子中,质子数等于核电荷数
C.原子中,质子数等于核外电子数
D.原子中,中子数等于核外电子数
D
巩固练习
( )7.下列关于原子的叙述中,不正确的是:
A.原子可以构成分子
B.原子是化学反应中的最小微粒
C.原子是由原子核和核外电子构成的
D.原子不带电是因为原子中存在中子
D
( )8.某原子的原子核内有1个质子和2个中子,则该原子的核电荷数为:
A.1 B.2 C.3 D.无法判断
( )9.已知碳14原子中,原子核内含有6个质子和8个中子,则碳14原子的核外电子数为:
A.6 B.8 C.12 D.14
A
A
( )10、2015年10月,中国科研团队首次证实了天然铀单质的存在,用于核电工业的一种铀原子中含有92个质子和143个中子。关于该原子的说法中不正确的是:
A.属于金属元素 B.电子数为92
C.核电荷数为92 D.相对原子质量为143
D
( )11、根据相对原子质量的定义进行判断,氧原子的相对原子质量为:
A.16 g B.2.657×10-26 kg
C.16 D.1.66×10-27 kg
C
( )12、已知一个碳-12原子质量为a kg,一个氧原子质量为bkg,则氧原子的相对原子质量为:
A. bkg B. b C. b/a D. 12b/a
D
巩固练习
15、镁原子核内质子和中子数量相等。
(1)镁的相对原子质量为 ;
(2)若一个碳-12原子质量为a kg,则一个镁原子质量为 kg。
24
2a
C
( )13、某原子R:相对原子质量为m, 核内质子数为n,则其核外电子数为:
A、m-n B、m+n C、n D、无法确定
巩固练习
A
( )14、某原子R:相对原子质量为m, 核内质子数为n,则核内中子数为:
A、m-n B、m+n C、n D、无法确定
课题2 原子的结构
(第二课时)原子核外电子的排布
人教版·九年级·上册
化学用语天天练
二、写出实验室制取氧气的符号表达式:
氧气 氮气 五氧化二磷 二氧化碳 二氧化硫 四氧化三铁
O2
N2
P2O5
CO2
一、记住下列物质的化学符号
SO2
Fe3O4
1、加热高锰酸钾制取氧气:
2、加热氯酸钾和二氧化锰混合物制取氧气:
1、用过氧化氢溶液和二氧化锰制取氧气:
KMnO4 K2MnO4 + MnO2 + O2
KClO3 KCl + O2
MnO2
H2O2 H2O + O2
MnO2
二、原子核外电子的排布
碳原子
电子层数 1 2 3 4 5 6 7
离核远近 能量高低 最多容纳 电子数
1、原子核外电子是分层排布的
2×12
2×22
2×32
2×42
2
8
18
32
近
远
低
高
讨论:若用n表示电子层数,则第n层上最多可以容纳的电子数为 。
2n2
2、核外电子的排布规律 :
(1)电子总是先排第1层,排满后再排第2层;第2层排满后才排第3层。
(2)各电子层最多容纳电子数为2n2个.
(3)最外层上最多容纳8个电子 (第一层为最外层时,最多容纳2个电子)。
3、原子结构示意图:
圈内数字表示核电荷数(质子数)
最外层电子数
2
8
2
12
+
原子核带正电荷
该电子层中的电子数
最外电子层
镁原子结构示意图:
圆圈表示原子核
弧线表示电子层
4、元素的分类
稀有气体元素
非金属元素
金属元素
稀有气体
氦(He)
氖(Ne)
氩(Ar)
特点:最外层上电子数为2或8(化学上把这种结构叫做稳定结构)
性质:在化学反应中不易得失电子,化学性质不活泼。
(锂)Li (铍)Be
金属元素
性质:在化学反应中易失去电子,化 学性质活泼。
(钠)Na (镁)Mg (铝)Al
特点:最外层上电子数<4,不稳定。
(硼)B (碳)C (氮)N (氧) O (氟) F
(硅)Si (磷) P (硫) S (氯)Cl
非金属元素
特点:最外层上电子数≥4,不稳定。
性质:在化学反应中易得到电子,化 学性质活泼。
稳定结构:最外层上有8个电子的结构(第一层为最外层时2个电子为稳定结构)
元素的化学性质是否活泼主要由原子的最外层电子数来决定!
最外层电子数 得失电子能力 化学性质是否活泼
稀有气体
金属元素
非金属元素
= 8
≥ 4
< 4
不易得失电子
易失电子
易得电子
不活泼
活泼
活泼
【归纳小结】
5、离子的形成
钠原子Na
氯原子Cl
钠离子
Na+
Cl-
NaCl
得到1个电子
失去1个电子
Na+
氯离子
Cl-
小技巧:离子带几个正负电荷的快速确定方法:
失几带几正;
得几带几负;
静电引力
(1)离子:原子得失电子后形成的带电荷的微粒叫离子。
阴离子(带负电荷): Cl- O2-
阳离子(带正电荷):Na+ Mg2+
离子
(2)离子符号的写法:
在元素符号的右上角标出离子所带的电荷的数量及电荷的正负。当离子所带电荷数为1时,1省略不写。
钠离子符号为:Na+ 不能写成:Na1+ 、Na+1!
(3)离子符号的意义:
2Mg2+
表示2个镁离子
表示1个镁离子
Mg2+
S2-
表示1个硫离子
2Na+
表示2个钠离子
表示1个镁离子带2个单位正电荷
O2-
表示1个氧离子
6、物质由微粒构成、由元素组成
分子
原子
元素
直接构成
构成
构成
组成
离 子
构成
金属、稀有气体、非金属固体
金属元素与非金属元素组成的物质
物
质
得失
电子
宏观组成
微观构成
巩固练习
( )1.如图为某原子的结构示意图,该原子的原子核中有:
A.8个质子和6个电子
B.8个质子和6个中子
C.6个质子和8个电子
D.6个质子和8个中子
D
( )2.月球的土壤中吸附着数百万吨的氦(He-3),其原子核中质子数为2,中子数为1,下列关于氦(He-3)元素的说法正确的是:
A.原子核外电子数为3 B.相对原子质量为2
C.原子的核电荷数为3 D.原子结构示意图为
D
( )3.漳州市诏安县红星乡是“长寿之乡”,与当地富硒有关。如图是硒(Se)原子的结构示意图,下列描述错误的是:
A.圆圈代表电子
B.核电荷数为34
C.共有4个电子层
D.第二层上有8个电子
A
巩固练习
( )4.如图为某原子的结构示意图,下列说法不正确的是:
A.该原子的质子数为6
B.该原子的核电荷数为16
C.该原子的最外层电子数为6
D.该原子的核外共有3个电子层
巩固练习
A
( )5.根据右图的粒子结构示意图,判断下列说法中不正确的是:
A.它们核电荷数都相同
B.它们的核外电子数相同
C.它们都具有相对稳定的结构
D.它们依次表示原子、离子、离子
A
巩固练习
( )6.下列关于Na、Na+两种粒子的判断中,正确的是( )
①核电荷数相同 ②核外电子数相等 ③电子层结构完全相同
④质量几乎相等 ⑤质子数相等 ⑥Na+比Na稳定
A.①④⑤ B.①③⑤⑥ C.①④⑤⑥ D.②③④
C
( )7.小美从如图的某粒子结构示意图中,获取了下列信息,其中错误的是:
A.表示阴离子
B.核电荷数为12
C.有两个电子层
D.表示相对稳定结构
A
巩固练习
( )8.原子、分子、离子都是构成物质的微粒,下列物质由阴、阳离子构成的是:
A.二氧化碳 B.金刚石 C.氯化钠 D.黄金
C
( )9.下列粒子在化学反应中容易得到电子的是:
巩固练习
D
10.小明从如图的某粒子的结构示意图中获取了下列信息,其中错误的是( )
A.该微粒的符号为:Mg2-
B.该微粒核内有12个质子
C.该微粒属于阳离子
D.该微粒化学性质不活泼
11.与原子的化学性质关系最紧密的是( )
A.质子数 B.中子数
C.电子数 D.最外层电子数
A
D
巩固练习
12.下列关于四种粒子的结构示意图说法正确的是( )
A.①、②的化学性质相似
B.②所示的粒子符号为Na
C.③在化学反应中易失去电子
D.④中X可能为8
D
巩固练习
13.钠原子和氯原子的结构示意图如图所示。
(1)钠原子的原子核内有 个质子,有 个电子层,第一层有 个电子,最外层有 个电子。
(2)氯原子的核电荷数是 。
(3)钠原子与氯原子相同的是 (填序号)。
①质子数 ②电子数 ③电子层数 ④最外层电子数
11
3
2
1
17
③
巩固练习
14.学习化学后,我们学会了从微观角度认识物质。
C
(3)溴的原子结构示意图为 ,则溴原子的质子数X= 。
一氧化碳分子
35
巩固练习
(2)保持一氧化碳化学性质的粒子名称是 。
(1)已知碳原子和氧原子的结构示意图分别为 和 ,则两种原子中相等的是 (填序号)。
A.质子数 B.电子数
C.第一层电子数 D.第二层电子数
15、原子的化学性质主要取决于原子的最外层电子数。
(1)如图甲所示,该原子的核电荷数为 ,名称是 ,由它组成的物质被称为 气体,化学性质 。
(2)如图乙中的原子结构属于稳定结构的有 (填序号,下同);②粒子的得失电子倾向与①、③、④、⑤粒子中的___ _相似,它们在化学反应中都容易 (填“得”或“失”)电子。
10
氖
稀有
不活泼
③⑤
④
失
巩固练习
16、根据下列微粒的结构示意图回答问题。
(1)属于稳定结构的是 (填序号,下同)。
(2)D原子属于 (填“金属”或“非金属”)原子,易______电子,形成_____离子。
(3)属于原子的是____ _,属于阳离子的是_____,属于阴离子的是_____。
金属
失去
阳
ACD
B
E
BCE
巩固练习
(1)Na 和 Na+属于同一种元素,原因是具有相同的 ;
(2)Na 和 Na+的化学性质不同,原因是 。
质子数
最外层电子数
17、观察下列离子的形成过程,回答些列问题:
元素、原子的种类由 来决定;
元素化学性质由原子的 来决定;
【重要结论】
质子数
最外层电子数
巩固练习
18.下图是物质与其构成粒子之间的关系图。回答下列问题:
(1)金属铁是由 (填“原子”、“分子”或“离子”,下同)构成的;二氧化碳是由 构成的;氯化钠是由 构成的。
原子
分子
离子
巩固练习
(2)原子得到或失去电子后形成离子。某离子的结构示意图为:
①当a= 时,该粒子是原子,其符号为 。
10
阴离子
O2-
③当a=13时,该粒子是 (填“原子”“阳离子”或“阴离子”),其符号为 。
②当a=8时,该粒子是 (填“原子”“阳离子”或“阴离子”),其符号为 。
阳离子
Al3+
Ne
巩固练习
本课题已学完,请及时巩固复习!
课题2 原子的结构
(第一课时)原子的构成 相对原子质量
人教版·九年级·上册
【学习目标】
1、知道原子的构成,以及构成原子的粒子之间的关系;
2、学会原子结构示意图的画法,知道微粒模型化是探索微观世界的
一种方法;
3、认识原子核外排布的基本规律,了解金属、非金属、稀有气体元
素的原子核外电子的排布特点;
4、以氯化钠为例,认识离子的形成过程,知道离子也是构成物质的
一种基本微粒;
化学用语天天练
氧气 氮气 五氧化二磷 二氧化碳 二氧化硫 四氧化三铁
O2
N2
P2O5
CO2
一、记住下列物质的化学符号
SO2
Fe3O4
O2
与硫反应
与磷反应
与铁丝反应
二、写出氧气与下列物质反应的符号表达式:
与木炭反应
与镁条反应
Mg + O2 MgO
点燃
C + O2 CO2
点燃
Fe + O2 Fe3O4
点燃
S + O2 SO2
点燃
P + O2 P2O5
点燃
一、原子的构成
英国化学家道尔顿
实心球模型
1803年,道尔顿提出:构成物质的最小粒子是原子,原子是不可再分的实心球体。
英国物理学家汤姆生
枣糕模型
1897年,汤姆生发现,原子中还有带负电的电子,他提出:原子并不是构成物质的最小粒子,电子就像枣子一样嵌在糕点中一样。
英国科学家
卢瑟福
行星有核模型
1911年
人们通过大量的科学实验探究,最终认识到:原子不是一个简单的实心球体。
碳-12(原子核内有6个中子、6个质子)原子结构示意图
原子
原子核(+)
核外电子(-)
质子(+)
中子
+
+
+
+
+
+
1、质子带 电,中子 电,电子带 电;
2、中子 电,所以原子核的电性由 决定;
因此原子核带 电,电荷数目(核电荷数)与质子数相等;
3、质子和中子的质量 ,但比 大得多;
4、 的质量很小,可忽略不计。因此,原子的质量约等于
的质量,即 和 质量之和。
正
不带
负
不带
质子
正
几乎相等
电子
电子
原子核
质子
中子
观察上表,你能发现什么规律?
观察下表,思考下列问题:
1、不同种原子核内的质子数 ;
2、同种原子中: ;
3、 核中没有中子。
不同
质子数=核外电子数=核电荷数=原子序数
氢原子
原子的体积很小
原子与乒乓球体积相比
相当于乒乓球与地球的体积相比
原子
原子核
原子的质量也很小
资料:原子的质量测定值
一个碳原子的质量是:0.00000000000000000000000001993千克
即:1.993×10-26千克
一个氧原子的质量是:0.00000000000000000000000002657千克
即:2.657×10-26千克
一个铁原子的质量是:0.00000000000000000000000009288千克
即:9.288×10-26千克
原子的质量很小,书写、使用都很不方便,怎么办?
二、相对原子质量(Ar)
相对原子质量就是以一种碳原子质量的1/12(质子数、中子数均为6)为标准,其它原子的质量跟它相比较所得到的比值。
相对原子质量(Ar)=
某原子的实际质量
(1) 相对原子质量________ 原子的实际质量,是个比值。
(2) 原子实际质量越大,它的相对原子质量数值 越____ 。
(3)相对原子质量的单位是: 。
(4)原子实际质量的单位是: ___________ 。
不等于
大
“1”(省略不写)
千克或克
一个碳原子的实际质量×
1
12
已知一个氧原子的质量是:2.657×10-26Kg
一个碳原子的质量是:1.993×10-26Kg。
则氧原子的相对原子质量为多少?
氧原子的相对原子质量
2.657x10-26kg
≈16
=
1
12
1.993x10-26kg
×
“16”的含义是:1个氧原子的质量是一个标准质量(一个碳原子质量的1/12)的16倍。
张青莲,我国著名的化学家,中国科学院院士。1991年他测定的铟相对原子质量被采用为国际新标准。
观察下表,思考下列问题:
1、同种原子中: ;
质子数=核外电子数=核电荷数=原子序数
质子数
中子数
2、相对原子质量 ≈ + 。
3、原子的另一种表示方法:
C
6
12
质子数
相对原子质量
( )1.下列关于原子的叙述中,正确的是:
A.是带电的微粒 B.是实心球体
C.可分解为分子 D.原子总体不显电性
D
( )2.下列说法错误的是:
A.原子核由质子、中子构成
B.花香四溢主要是由于分子之间有间隔
C.保持水化学性质的微粒是水分子
D.化学反应前后原子的种类不会改变
B
巩固练习
( )3.下列关于原子核的叙述中,正确的是:
①通常由中子和电子构成; ②通常由质子和中子构成;
③带负电荷; ④不显电性;⑤不能再分;
⑥体积大约相当于原子; ⑦质量大约相当于原子。
A.①⑤ B.②⑦ C.③④ D.②⑥⑦
B
( )4.月球土壤中含有大量的He-3原子,它可能成为未来核能的重要原料。He-3原子核内有两个质子和1个中子,则He-3原子的核电荷数为:
A.2 B.1 C.0 .3
A
巩固练习
巩固练习
( )5.铈(Ce)是一种常见的稀土元素,已知铈原子的原子核内有58个质子和82个中子,该原子的核外电子数为:
A.24 B.58 C.82 D.140
B
( )6.下列有关原子的说法错误的是:
A.原子是化学变化中的最小粒子
B.原子中,质子数等于核电荷数
C.原子中,质子数等于核外电子数
D.原子中,中子数等于核外电子数
D
巩固练习
( )7.下列关于原子的叙述中,不正确的是:
A.原子可以构成分子
B.原子是化学反应中的最小微粒
C.原子是由原子核和核外电子构成的
D.原子不带电是因为原子中存在中子
D
( )8.某原子的原子核内有1个质子和2个中子,则该原子的核电荷数为:
A.1 B.2 C.3 D.无法判断
( )9.已知碳14原子中,原子核内含有6个质子和8个中子,则碳14原子的核外电子数为:
A.6 B.8 C.12 D.14
A
A
( )10、2015年10月,中国科研团队首次证实了天然铀单质的存在,用于核电工业的一种铀原子中含有92个质子和143个中子。关于该原子的说法中不正确的是:
A.属于金属元素 B.电子数为92
C.核电荷数为92 D.相对原子质量为143
D
( )11、根据相对原子质量的定义进行判断,氧原子的相对原子质量为:
A.16 g B.2.657×10-26 kg
C.16 D.1.66×10-27 kg
C
( )12、已知一个碳-12原子质量为a kg,一个氧原子质量为bkg,则氧原子的相对原子质量为:
A. bkg B. b C. b/a D. 12b/a
D
巩固练习
15、镁原子核内质子和中子数量相等。
(1)镁的相对原子质量为 ;
(2)若一个碳-12原子质量为a kg,则一个镁原子质量为 kg。
24
2a
C
( )13、某原子R:相对原子质量为m, 核内质子数为n,则其核外电子数为:
A、m-n B、m+n C、n D、无法确定
巩固练习
A
( )14、某原子R:相对原子质量为m, 核内质子数为n,则核内中子数为:
A、m-n B、m+n C、n D、无法确定
课题2 原子的结构
(第二课时)原子核外电子的排布
人教版·九年级·上册
化学用语天天练
二、写出实验室制取氧气的符号表达式:
氧气 氮气 五氧化二磷 二氧化碳 二氧化硫 四氧化三铁
O2
N2
P2O5
CO2
一、记住下列物质的化学符号
SO2
Fe3O4
1、加热高锰酸钾制取氧气:
2、加热氯酸钾和二氧化锰混合物制取氧气:
1、用过氧化氢溶液和二氧化锰制取氧气:
KMnO4 K2MnO4 + MnO2 + O2
KClO3 KCl + O2
MnO2
H2O2 H2O + O2
MnO2
二、原子核外电子的排布
碳原子
电子层数 1 2 3 4 5 6 7
离核远近 能量高低 最多容纳 电子数
1、原子核外电子是分层排布的
2×12
2×22
2×32
2×42
2
8
18
32
近
远
低
高
讨论:若用n表示电子层数,则第n层上最多可以容纳的电子数为 。
2n2
2、核外电子的排布规律 :
(1)电子总是先排第1层,排满后再排第2层;第2层排满后才排第3层。
(2)各电子层最多容纳电子数为2n2个.
(3)最外层上最多容纳8个电子 (第一层为最外层时,最多容纳2个电子)。
3、原子结构示意图:
圈内数字表示核电荷数(质子数)
最外层电子数
2
8
2
12
+
原子核带正电荷
该电子层中的电子数
最外电子层
镁原子结构示意图:
圆圈表示原子核
弧线表示电子层
4、元素的分类
稀有气体元素
非金属元素
金属元素
稀有气体
氦(He)
氖(Ne)
氩(Ar)
特点:最外层上电子数为2或8(化学上把这种结构叫做稳定结构)
性质:在化学反应中不易得失电子,化学性质不活泼。
(锂)Li (铍)Be
金属元素
性质:在化学反应中易失去电子,化 学性质活泼。
(钠)Na (镁)Mg (铝)Al
特点:最外层上电子数<4,不稳定。
(硼)B (碳)C (氮)N (氧) O (氟) F
(硅)Si (磷) P (硫) S (氯)Cl
非金属元素
特点:最外层上电子数≥4,不稳定。
性质:在化学反应中易得到电子,化 学性质活泼。
稳定结构:最外层上有8个电子的结构(第一层为最外层时2个电子为稳定结构)
元素的化学性质是否活泼主要由原子的最外层电子数来决定!
最外层电子数 得失电子能力 化学性质是否活泼
稀有气体
金属元素
非金属元素
= 8
≥ 4
< 4
不易得失电子
易失电子
易得电子
不活泼
活泼
活泼
【归纳小结】
5、离子的形成
钠原子Na
氯原子Cl
钠离子
Na+
Cl-
NaCl
得到1个电子
失去1个电子
Na+
氯离子
Cl-
小技巧:离子带几个正负电荷的快速确定方法:
失几带几正;
得几带几负;
静电引力
(1)离子:原子得失电子后形成的带电荷的微粒叫离子。
阴离子(带负电荷): Cl- O2-
阳离子(带正电荷):Na+ Mg2+
离子
(2)离子符号的写法:
在元素符号的右上角标出离子所带的电荷的数量及电荷的正负。当离子所带电荷数为1时,1省略不写。
钠离子符号为:Na+ 不能写成:Na1+ 、Na+1!
(3)离子符号的意义:
2Mg2+
表示2个镁离子
表示1个镁离子
Mg2+
S2-
表示1个硫离子
2Na+
表示2个钠离子
表示1个镁离子带2个单位正电荷
O2-
表示1个氧离子
6、物质由微粒构成、由元素组成
分子
原子
元素
直接构成
构成
构成
组成
离 子
构成
金属、稀有气体、非金属固体
金属元素与非金属元素组成的物质
物
质
得失
电子
宏观组成
微观构成
巩固练习
( )1.如图为某原子的结构示意图,该原子的原子核中有:
A.8个质子和6个电子
B.8个质子和6个中子
C.6个质子和8个电子
D.6个质子和8个中子
D
( )2.月球的土壤中吸附着数百万吨的氦(He-3),其原子核中质子数为2,中子数为1,下列关于氦(He-3)元素的说法正确的是:
A.原子核外电子数为3 B.相对原子质量为2
C.原子的核电荷数为3 D.原子结构示意图为
D
( )3.漳州市诏安县红星乡是“长寿之乡”,与当地富硒有关。如图是硒(Se)原子的结构示意图,下列描述错误的是:
A.圆圈代表电子
B.核电荷数为34
C.共有4个电子层
D.第二层上有8个电子
A
巩固练习
( )4.如图为某原子的结构示意图,下列说法不正确的是:
A.该原子的质子数为6
B.该原子的核电荷数为16
C.该原子的最外层电子数为6
D.该原子的核外共有3个电子层
巩固练习
A
( )5.根据右图的粒子结构示意图,判断下列说法中不正确的是:
A.它们核电荷数都相同
B.它们的核外电子数相同
C.它们都具有相对稳定的结构
D.它们依次表示原子、离子、离子
A
巩固练习
( )6.下列关于Na、Na+两种粒子的判断中,正确的是( )
①核电荷数相同 ②核外电子数相等 ③电子层结构完全相同
④质量几乎相等 ⑤质子数相等 ⑥Na+比Na稳定
A.①④⑤ B.①③⑤⑥ C.①④⑤⑥ D.②③④
C
( )7.小美从如图的某粒子结构示意图中,获取了下列信息,其中错误的是:
A.表示阴离子
B.核电荷数为12
C.有两个电子层
D.表示相对稳定结构
A
巩固练习
( )8.原子、分子、离子都是构成物质的微粒,下列物质由阴、阳离子构成的是:
A.二氧化碳 B.金刚石 C.氯化钠 D.黄金
C
( )9.下列粒子在化学反应中容易得到电子的是:
巩固练习
D
10.小明从如图的某粒子的结构示意图中获取了下列信息,其中错误的是( )
A.该微粒的符号为:Mg2-
B.该微粒核内有12个质子
C.该微粒属于阳离子
D.该微粒化学性质不活泼
11.与原子的化学性质关系最紧密的是( )
A.质子数 B.中子数
C.电子数 D.最外层电子数
A
D
巩固练习
12.下列关于四种粒子的结构示意图说法正确的是( )
A.①、②的化学性质相似
B.②所示的粒子符号为Na
C.③在化学反应中易失去电子
D.④中X可能为8
D
巩固练习
13.钠原子和氯原子的结构示意图如图所示。
(1)钠原子的原子核内有 个质子,有 个电子层,第一层有 个电子,最外层有 个电子。
(2)氯原子的核电荷数是 。
(3)钠原子与氯原子相同的是 (填序号)。
①质子数 ②电子数 ③电子层数 ④最外层电子数
11
3
2
1
17
③
巩固练习
14.学习化学后,我们学会了从微观角度认识物质。
C
(3)溴的原子结构示意图为 ,则溴原子的质子数X= 。
一氧化碳分子
35
巩固练习
(2)保持一氧化碳化学性质的粒子名称是 。
(1)已知碳原子和氧原子的结构示意图分别为 和 ,则两种原子中相等的是 (填序号)。
A.质子数 B.电子数
C.第一层电子数 D.第二层电子数
15、原子的化学性质主要取决于原子的最外层电子数。
(1)如图甲所示,该原子的核电荷数为 ,名称是 ,由它组成的物质被称为 气体,化学性质 。
(2)如图乙中的原子结构属于稳定结构的有 (填序号,下同);②粒子的得失电子倾向与①、③、④、⑤粒子中的___ _相似,它们在化学反应中都容易 (填“得”或“失”)电子。
10
氖
稀有
不活泼
③⑤
④
失
巩固练习
16、根据下列微粒的结构示意图回答问题。
(1)属于稳定结构的是 (填序号,下同)。
(2)D原子属于 (填“金属”或“非金属”)原子,易______电子,形成_____离子。
(3)属于原子的是____ _,属于阳离子的是_____,属于阴离子的是_____。
金属
失去
阳
ACD
B
E
BCE
巩固练习
(1)Na 和 Na+属于同一种元素,原因是具有相同的 ;
(2)Na 和 Na+的化学性质不同,原因是 。
质子数
最外层电子数
17、观察下列离子的形成过程,回答些列问题:
元素、原子的种类由 来决定;
元素化学性质由原子的 来决定;
【重要结论】
质子数
最外层电子数
巩固练习
18.下图是物质与其构成粒子之间的关系图。回答下列问题:
(1)金属铁是由 (填“原子”、“分子”或“离子”,下同)构成的;二氧化碳是由 构成的;氯化钠是由 构成的。
原子
分子
离子
巩固练习
(2)原子得到或失去电子后形成离子。某离子的结构示意图为:
①当a= 时,该粒子是原子,其符号为 。
10
阴离子
O2-
③当a=13时,该粒子是 (填“原子”“阳离子”或“阴离子”),其符号为 。
②当a=8时,该粒子是 (填“原子”“阳离子”或“阴离子”),其符号为 。
阳离子
Al3+
Ne
巩固练习
本课题已学完,请及时巩固复习!
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
