第五单元课题2如何正确书写化学方程式课件—2021-2022学年九年级化学人教版上册(共26张PPT)
文档属性
| 名称 | 第五单元课题2如何正确书写化学方程式课件—2021-2022学年九年级化学人教版上册(共26张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-06 22:55:23 | ||
图片预览







文档简介
(共26张PPT)
课题2 如何正确书写化学方程式
人教版·九年级·上册
【学习目标】
1、了解书写化学方程式应遵循的基本原则;
2、理解化学方程式的含义并能正确书写化学方程式;
3、在练习书写化学方程式的过程中学会化学方程式的配平方法;
4、初步学会用化学方程式来表示所获得的信息;
4、结合化学方程式的学习,培养实事求是的科学态度;
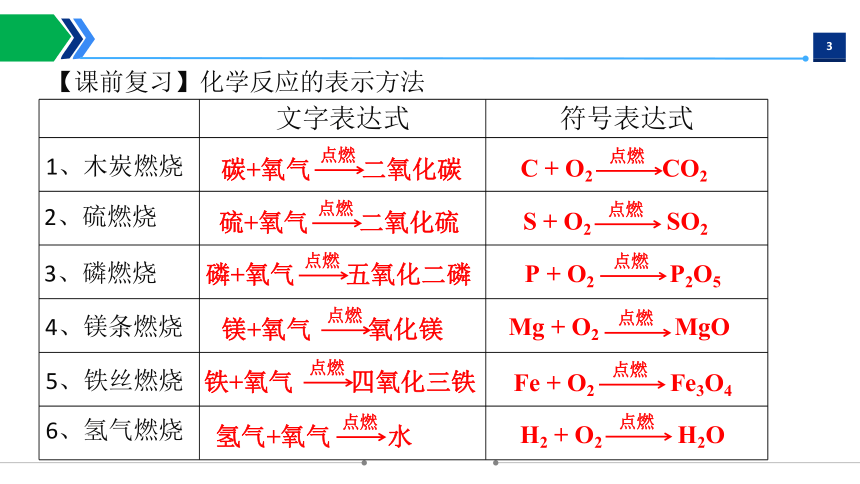
【课前复习】化学反应的表示方法
Mg + O2 MgO
点燃
C + O2 CO2
点燃
Fe + O2 Fe3O4
点燃
S + O2 SO2
点燃
P + O2 P2O5
点燃
文字表达式 符号表达式
1、木炭燃烧
2、硫燃烧
3、磷燃烧
4、镁条燃烧
5、铁丝燃烧
铁+氧气 四氧化三铁
点燃
碳+氧气 二氧化碳
点燃
硫+氧气 二氧化硫
点燃
磷+氧气 五氧化二磷
点燃
镁+氧气 氧化镁
点燃
6、氢气燃烧
氢气+氧气 水
点燃
H2 + O2 H2O
点燃
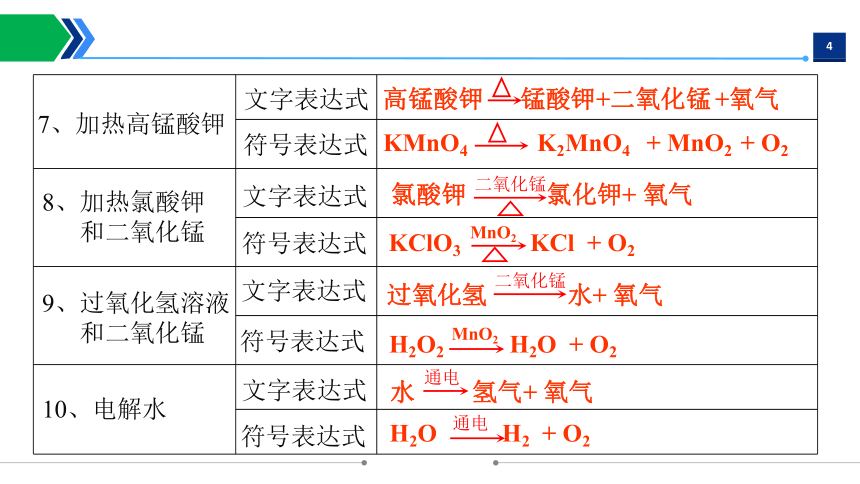
8、加热氯酸钾
和二氧化锰
9、过氧化氢溶液
和二氧化锰
KMnO4 K2MnO4 + MnO2 + O2
KClO3 KCl + O2
MnO2
H2O2 H2O + O2
MnO2
7、加热高锰酸钾
文字表达式
符号表达式
文字表达式
符号表达式
文字表达式
符号表达式
高锰酸钾 锰酸钾+二氧化锰 +氧气
氯酸钾 氯化钾+ 氧气
二氧化锰
过氧化氢 水+ 氧气
二氧化锰
文字表达式
符号表达式
10、电解水
水 氢气+ 氧气
通电
H2O H2 + O2
通电
1、书写化学方程式要遵守两个原则:
一、正确书写化学方程式
(1)遵守客观事实
按照反应事实写出物质的化学式,不能自己凭空想象。
等号两边各原子的种类和个数要相等。但不得改动化学式里的原子个数。
(2)遵守质量守恒定律
二、书写化学方程式的步骤
1、“写”:将物质名称改为化学式;
2、“配”:配平化学方程式,箭号改为短线;
3、“标”:标明反应条件,短线改为等号;
磷+氧气 五氧化二磷
点燃
P + O2 P2O5
4P + 5O2 2P2O5
4P + 5O2 2P2O5
点燃
书写化学方程式时注意:
1、化学式一定要写正确:
2、原子个数一定要相等:
3、反应条件一定不能漏写:
4、 “↑”、“↓”一定要标明:
(遵循客观事实)
(遵循质量守恒定律)
(如点燃、加热、催化剂、通电、高温,加热可以用“△”表示。
(如果反应物中没有气体,而生成物有气体时,要在气体化学式右侧标“↑”)
(若在溶液中反应,且生成了不溶于水的沉淀,要在沉淀化学式右侧标“↓”)
三、配平化学方程式的方法
1、观察法:
S + O2 — SO2
C + O2 — CO2
点燃
点燃
仔细观察,将两边原子个数相平。
2、奇偶数法:
C2H2 + O2 — CO2+ H2O
P + O2 — P2O5
KClO3 — KCl+ O2
点燃
点燃
MnO2
↑
2
4
5
2
2
3
2
2
4
5
(1)确定先要配平的原子:原子个数最多,且只有一处化学式该原子个数为奇数;
(2)在奇数个原子的化学式前加2,再用观察法配平。
3、设1法:
C2H4 + O2 — CO2+ H2O
C2H5OH+ O2 — CO2+ H2O
1
2
2
3
点燃
设最复杂的化学式前系数为1,再用观察法。
1
2
3
3
点燃
Fe + O2 — Fe3O4
3
1
2
点燃
4、设未知数法:
如果用上面的方法将一些易配平的原子配平后,发现还有不易配平的原子,可设未知数x、y,然后根据反应前后原子个数相等建立方程,求出x、y。
4C2H5OH+11O2 — CO2+ H2O + CO
12
x
y
O原子:
4 + 22 = 2x +12 + y
C原子:
8 = x + y
点燃
x = 6
y = 2
4C2H5OH+11O2 — CO2+ H2O + CO
12
6
2
点燃
【讨论分析】 下列化学方程式的书写都错误,其中:
化学式书写错误的是 ;未配平的是 ;
“↑”和“↓”符号使用不当的是 ;
反应条件错写或漏写的是 。
△
① HgO 2Hg+O2↑ ② 2H2O 2H2 ↑+ O2↑
③ C +O2↑ CO2 ④ Mg +O2 MgO2
⑤ 4Fe+3O2 2Fe2O3 ⑥ 2P+5O2 2P2O5
点燃
点燃
点燃
点燃
④⑤
①⑥
③
②
巩固练习
( )1.下列书写化学方程式的原则和步骤中,叙述错误的是:
A.必须遵循质量守恒定律
B.一定要注明反应条件
C.不用注明生成物的颜色
D.在方程式配平的过程中,可以改动物质的化学式,这样
可以使配平容易些
D
巩固练习
( )2.化学方程式是重要的化学用语。下列化学方程式书写正确的是:
A.2KMnO4 K2MnO4+MnO2+O2↑
B.P+O2=P2O5
C.4Fe+3O2 2Fe2O3
D.C+O2 CO2↑
A
( )3.下图为某化学反应的微观示意图:“ ”和“ ”分别代表不同元素的原子,该反应可能是:
A.2CO+O2 2CO2
B.2H2+O2 2H2O
C.CH4+2O2 2H2O+CO2
D.2Mg+O2 2MgO
A
巩固练习
( )4.用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术。已知获得高铁酸钠的反应为:
Fe2O3+mNa2O2=nNa2FeO4+Na2O,其中m、n分别为:
A.2、3 B.3、2
C.1、3 D.1、3
B
巩固练习
( )6.下列四个反应的生成物都是C,如果C的化学式为A2B5,则该反应的化学方程式为:
A.2AB2+B2=2C B.3AB2+B2=2C
C.4AB2+B2=2C D.AB2+4B2=2C
C
( )5.Sb2O5是一种重要的阻燃剂,工业上制取该物质的化学方程式为:Sb2O3+2X=Sb2O5+2H2O,则X的化学式为:
A.H2 B.O2 C.H2O2 D.H2SbO4
C
(1)木炭燃烧:
C + O2 CO2
点燃
(2)硫磺燃烧:
S + O2 SO2
点燃
(3)磷燃烧:
4P + 5O2 2P2O5
点燃
(4)镁条燃烧:
2Mg + O2 2MgO
点燃
(5)铁丝燃烧:
3Fe + 2O2 Fe3O4
点燃
7、写出下列变化的化学方程式:
(6)氢气燃烧:
2H2 + O2 2H2O
点燃
巩固练习
(9)过氧化氢在二氧化锰作催化剂制取氧气
2H2O2 2H2O+ O2↑
MnO2
(8)加热氯酸钾和二氧化锰的混合物制氧气;
(7)高锰酸钾受热分解;
2KClO3 2KCl+3O2↑
MnO2
△
2KMnO4 K2MnO4+MnO2+O2↑
△
(10)电解水
2H2O 2H2↑+ O2↑
通电
【气体“↑”的标法】若反应物没有气体,而生成物有气体时,则在气体化学式右边标上“↑”。
巩固练习
巩固练习
8.工业上用甲和乙反应制备丙和丁,其反应的微观示意图如下:
(1)该化学变化中没有发生改变的粒子是 (填“分子”或“原子”)。
原子
(2)写出该反应的化学方程式: 。
(3)该反应中含氢元素的化合物有 种;反应前后化合价发生了变化的元素是 (填元素符号)。
2
C、H
CH4+H2O CO+3H2
一定条件
10.写出下列反应的化学方程式:
(1)硫化氢(H2S)气体和二氧化硫气体混合生成硫和水:
。
(2)剧烈运动后血液中产生了较多乳酸(C3H6O3),使人肌肉酸痛,经过一段时间放松,由于乳酸与吸入的氧气反应,生成二氧化碳和水,酸痛感消失。此反应的化学方程式为
。
2H2S+SO2=3S↓+2H2O
C3H6O3+3O2=3CO2+3H2O
巩固练习
(3)黑火药是我国古代四大发明之一,它是由木炭、硫磺粉和硝石(硝酸钾)按一定比例混合而成的,黑火药爆炸时生成硫
化钾、氮气和二氧化碳。反应的化学方程式为:
;
3C+S+2KNO3 K2S+N2↑+3CO2↑
点燃
(4)在加热的条件下,氨气(NH3)与氧化铜反应生成铜、氮气和水。该反应的化学方程式为:
;
2NH3+3CuO — 3Cu+N2+3H2O
△
巩固练习
(5)查阅资料可知,米酒味道变酸是因为米酒中产生的醋酸杆菌使乙醇(C2H5OH)和氧气发生反应生成了醋酸(CH3COOH)和另一种常见的无色液体。米酒味道变酸的化学反应方程式为:
;
C2H5OH+O2 CH3COOH+H2O
醋酸杆菌
巩固练习
11、氨气(NH3)在氧气中燃烧过程的微观示意图
(1)在第2、3个方框中把微观粒子补充完整:
(2)第三个方框中的物质属于 ;
A、单质 B、化合物 C、纯净物 D、混合物
(3)写出该反应的化学方程式:
。
4NH3 + 3O2 2N2 + 6H2O
点燃
D
NH3 O2 N2 和H2O
巩固练习
12、现有A、B、C、D四种物质,其中A、B常温下都是一种无色液体,它们具有相同的组成元素,C、D为常见的无色气体.一定条件下四种物质存在下图所示的转化关系:
H2O2
H2O
O2
H2
H2O
2H2 + O2 2H2O
点燃
2H2O2 2H2O+ O2↑
MnO2
2H2O 2H2↑+ O2↑
电解
巩固练习
本课题已学完,请及时巩固复习!
课题2 如何正确书写化学方程式
人教版·九年级·上册
【学习目标】
1、了解书写化学方程式应遵循的基本原则;
2、理解化学方程式的含义并能正确书写化学方程式;
3、在练习书写化学方程式的过程中学会化学方程式的配平方法;
4、初步学会用化学方程式来表示所获得的信息;
4、结合化学方程式的学习,培养实事求是的科学态度;
【课前复习】化学反应的表示方法
Mg + O2 MgO
点燃
C + O2 CO2
点燃
Fe + O2 Fe3O4
点燃
S + O2 SO2
点燃
P + O2 P2O5
点燃
文字表达式 符号表达式
1、木炭燃烧
2、硫燃烧
3、磷燃烧
4、镁条燃烧
5、铁丝燃烧
铁+氧气 四氧化三铁
点燃
碳+氧气 二氧化碳
点燃
硫+氧气 二氧化硫
点燃
磷+氧气 五氧化二磷
点燃
镁+氧气 氧化镁
点燃
6、氢气燃烧
氢气+氧气 水
点燃
H2 + O2 H2O
点燃
8、加热氯酸钾
和二氧化锰
9、过氧化氢溶液
和二氧化锰
KMnO4 K2MnO4 + MnO2 + O2
KClO3 KCl + O2
MnO2
H2O2 H2O + O2
MnO2
7、加热高锰酸钾
文字表达式
符号表达式
文字表达式
符号表达式
文字表达式
符号表达式
高锰酸钾 锰酸钾+二氧化锰 +氧气
氯酸钾 氯化钾+ 氧气
二氧化锰
过氧化氢 水+ 氧气
二氧化锰
文字表达式
符号表达式
10、电解水
水 氢气+ 氧气
通电
H2O H2 + O2
通电
1、书写化学方程式要遵守两个原则:
一、正确书写化学方程式
(1)遵守客观事实
按照反应事实写出物质的化学式,不能自己凭空想象。
等号两边各原子的种类和个数要相等。但不得改动化学式里的原子个数。
(2)遵守质量守恒定律
二、书写化学方程式的步骤
1、“写”:将物质名称改为化学式;
2、“配”:配平化学方程式,箭号改为短线;
3、“标”:标明反应条件,短线改为等号;
磷+氧气 五氧化二磷
点燃
P + O2 P2O5
4P + 5O2 2P2O5
4P + 5O2 2P2O5
点燃
书写化学方程式时注意:
1、化学式一定要写正确:
2、原子个数一定要相等:
3、反应条件一定不能漏写:
4、 “↑”、“↓”一定要标明:
(遵循客观事实)
(遵循质量守恒定律)
(如点燃、加热、催化剂、通电、高温,加热可以用“△”表示。
(如果反应物中没有气体,而生成物有气体时,要在气体化学式右侧标“↑”)
(若在溶液中反应,且生成了不溶于水的沉淀,要在沉淀化学式右侧标“↓”)
三、配平化学方程式的方法
1、观察法:
S + O2 — SO2
C + O2 — CO2
点燃
点燃
仔细观察,将两边原子个数相平。
2、奇偶数法:
C2H2 + O2 — CO2+ H2O
P + O2 — P2O5
KClO3 — KCl+ O2
点燃
点燃
MnO2
↑
2
4
5
2
2
3
2
2
4
5
(1)确定先要配平的原子:原子个数最多,且只有一处化学式该原子个数为奇数;
(2)在奇数个原子的化学式前加2,再用观察法配平。
3、设1法:
C2H4 + O2 — CO2+ H2O
C2H5OH+ O2 — CO2+ H2O
1
2
2
3
点燃
设最复杂的化学式前系数为1,再用观察法。
1
2
3
3
点燃
Fe + O2 — Fe3O4
3
1
2
点燃
4、设未知数法:
如果用上面的方法将一些易配平的原子配平后,发现还有不易配平的原子,可设未知数x、y,然后根据反应前后原子个数相等建立方程,求出x、y。
4C2H5OH+11O2 — CO2+ H2O + CO
12
x
y
O原子:
4 + 22 = 2x +12 + y
C原子:
8 = x + y
点燃
x = 6
y = 2
4C2H5OH+11O2 — CO2+ H2O + CO
12
6
2
点燃
【讨论分析】 下列化学方程式的书写都错误,其中:
化学式书写错误的是 ;未配平的是 ;
“↑”和“↓”符号使用不当的是 ;
反应条件错写或漏写的是 。
△
① HgO 2Hg+O2↑ ② 2H2O 2H2 ↑+ O2↑
③ C +O2↑ CO2 ④ Mg +O2 MgO2
⑤ 4Fe+3O2 2Fe2O3 ⑥ 2P+5O2 2P2O5
点燃
点燃
点燃
点燃
④⑤
①⑥
③
②
巩固练习
( )1.下列书写化学方程式的原则和步骤中,叙述错误的是:
A.必须遵循质量守恒定律
B.一定要注明反应条件
C.不用注明生成物的颜色
D.在方程式配平的过程中,可以改动物质的化学式,这样
可以使配平容易些
D
巩固练习
( )2.化学方程式是重要的化学用语。下列化学方程式书写正确的是:
A.2KMnO4 K2MnO4+MnO2+O2↑
B.P+O2=P2O5
C.4Fe+3O2 2Fe2O3
D.C+O2 CO2↑
A
( )3.下图为某化学反应的微观示意图:“ ”和“ ”分别代表不同元素的原子,该反应可能是:
A.2CO+O2 2CO2
B.2H2+O2 2H2O
C.CH4+2O2 2H2O+CO2
D.2Mg+O2 2MgO
A
巩固练习
( )4.用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术。已知获得高铁酸钠的反应为:
Fe2O3+mNa2O2=nNa2FeO4+Na2O,其中m、n分别为:
A.2、3 B.3、2
C.1、3 D.1、3
B
巩固练习
( )6.下列四个反应的生成物都是C,如果C的化学式为A2B5,则该反应的化学方程式为:
A.2AB2+B2=2C B.3AB2+B2=2C
C.4AB2+B2=2C D.AB2+4B2=2C
C
( )5.Sb2O5是一种重要的阻燃剂,工业上制取该物质的化学方程式为:Sb2O3+2X=Sb2O5+2H2O,则X的化学式为:
A.H2 B.O2 C.H2O2 D.H2SbO4
C
(1)木炭燃烧:
C + O2 CO2
点燃
(2)硫磺燃烧:
S + O2 SO2
点燃
(3)磷燃烧:
4P + 5O2 2P2O5
点燃
(4)镁条燃烧:
2Mg + O2 2MgO
点燃
(5)铁丝燃烧:
3Fe + 2O2 Fe3O4
点燃
7、写出下列变化的化学方程式:
(6)氢气燃烧:
2H2 + O2 2H2O
点燃
巩固练习
(9)过氧化氢在二氧化锰作催化剂制取氧气
2H2O2 2H2O+ O2↑
MnO2
(8)加热氯酸钾和二氧化锰的混合物制氧气;
(7)高锰酸钾受热分解;
2KClO3 2KCl+3O2↑
MnO2
△
2KMnO4 K2MnO4+MnO2+O2↑
△
(10)电解水
2H2O 2H2↑+ O2↑
通电
【气体“↑”的标法】若反应物没有气体,而生成物有气体时,则在气体化学式右边标上“↑”。
巩固练习
巩固练习
8.工业上用甲和乙反应制备丙和丁,其反应的微观示意图如下:
(1)该化学变化中没有发生改变的粒子是 (填“分子”或“原子”)。
原子
(2)写出该反应的化学方程式: 。
(3)该反应中含氢元素的化合物有 种;反应前后化合价发生了变化的元素是 (填元素符号)。
2
C、H
CH4+H2O CO+3H2
一定条件
10.写出下列反应的化学方程式:
(1)硫化氢(H2S)气体和二氧化硫气体混合生成硫和水:
。
(2)剧烈运动后血液中产生了较多乳酸(C3H6O3),使人肌肉酸痛,经过一段时间放松,由于乳酸与吸入的氧气反应,生成二氧化碳和水,酸痛感消失。此反应的化学方程式为
。
2H2S+SO2=3S↓+2H2O
C3H6O3+3O2=3CO2+3H2O
巩固练习
(3)黑火药是我国古代四大发明之一,它是由木炭、硫磺粉和硝石(硝酸钾)按一定比例混合而成的,黑火药爆炸时生成硫
化钾、氮气和二氧化碳。反应的化学方程式为:
;
3C+S+2KNO3 K2S+N2↑+3CO2↑
点燃
(4)在加热的条件下,氨气(NH3)与氧化铜反应生成铜、氮气和水。该反应的化学方程式为:
;
2NH3+3CuO — 3Cu+N2+3H2O
△
巩固练习
(5)查阅资料可知,米酒味道变酸是因为米酒中产生的醋酸杆菌使乙醇(C2H5OH)和氧气发生反应生成了醋酸(CH3COOH)和另一种常见的无色液体。米酒味道变酸的化学反应方程式为:
;
C2H5OH+O2 CH3COOH+H2O
醋酸杆菌
巩固练习
11、氨气(NH3)在氧气中燃烧过程的微观示意图
(1)在第2、3个方框中把微观粒子补充完整:
(2)第三个方框中的物质属于 ;
A、单质 B、化合物 C、纯净物 D、混合物
(3)写出该反应的化学方程式:
。
4NH3 + 3O2 2N2 + 6H2O
点燃
D
NH3 O2 N2 和H2O
巩固练习
12、现有A、B、C、D四种物质,其中A、B常温下都是一种无色液体,它们具有相同的组成元素,C、D为常见的无色气体.一定条件下四种物质存在下图所示的转化关系:
H2O2
H2O
O2
H2
H2O
2H2 + O2 2H2O
点燃
2H2O2 2H2O+ O2↑
MnO2
2H2O 2H2↑+ O2↑
电解
巩固练习
本课题已学完,请及时巩固复习!
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
