第八单元课题2金属的化学性质课件—2021-2022学年九年级化学人教版下册(共52张PPT)
文档属性
| 名称 | 第八单元课题2金属的化学性质课件—2021-2022学年九年级化学人教版下册(共52张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 5.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-06 23:16:58 | ||
图片预览









文档简介
(共52张PPT)
课题2 金属的化学性质
人教版·九年级·下册
(第一课时)金属的化学性质
【学习目标】
1、知道镁、铁、铜等金属与氧气的反应;
2、初步认识常见金属与酸或盐溶液的置换反应,能用置换反应
解释一些有关的化学问题;
3、能用金属活动性顺序对有关的置换反应进行简单的判断,并
能解释一些与日常生活相关的现象。
化学用语天天练
一、用化学方程式表示下列化学反应:
1、镁条燃烧:
2Mg + O2 2MgO
点燃
2、铁丝燃烧:
3、碳与氧化铜在高温下反应:
C+2CuO 2Cu+ CO2↑
高温
CO+CuO Cu+CO2
△
4、一氧化碳与与氧化铜反应:
5、甲烷燃烧:
6、酒精燃烧:
3Fe + 2O2 Fe3O4
点燃
1、有A、B两种金属,金属A单质呈紫红色;B是生产生活中使用最广泛的金属。
(1)则单质A的化学式为 ;金属B的名称是 ;
(2)A、B都具有良好的导电性,但生活中常用A做电线而很少用B做电线。其原因是 。
2、合金都属于 (填“纯净物”或“混合物”);钢和生铁都是铁和 的合金,其中含碳量为2%~4.3%的合金是 。
Cu
铁
Cu的导电性比Fe强
混合物
碳
生铁
【课前思考】
1、常温下铁在空气中能慢慢与氧气反应生锈;
常温下与氧气反应的 难易程度:
常温下铜在空气中很难被氧化。
Fe > Cu
铁只能在纯氧中剧烈燃烧。
镁在空气中点燃能剧烈燃烧。
点燃时与氧气反应的 难易程度:
Mg > Fe
一、金属与氧气反应
比较金属活动性强弱的方法之一:
【结论】由实验可知,部分金属的活动性规律为:
Mg > Al > Fe > Cu > Au
通过比较金属与氧气反应的难易程度来判断金属的活动性强弱。
【发现规律】金属的化学性质(活动性)越活泼,与氧气反
应越容易。
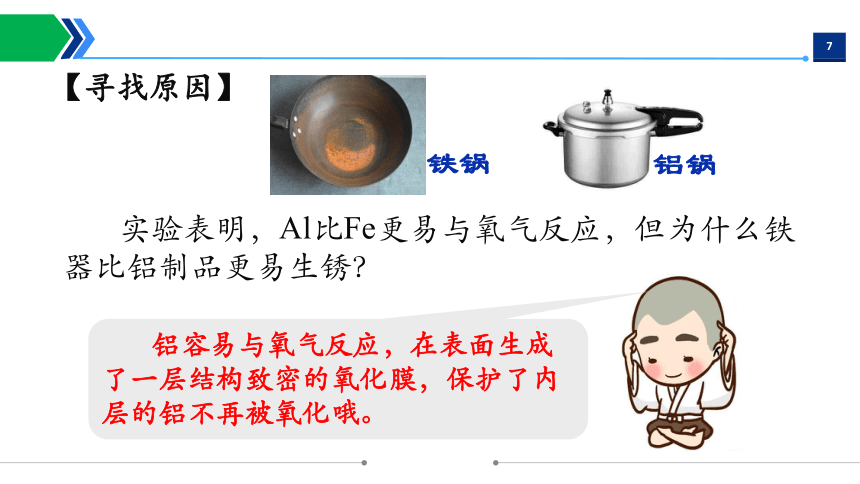
实验表明,Al比Fe更易与氧气反应,但为什么铁器比铝制品更易生锈?
铁锅
铝锅
铝容易与氧气反应,在表面生成了一层结构致密的氧化膜,保护了内层的铝不再被氧化哦。
【寻找原因】
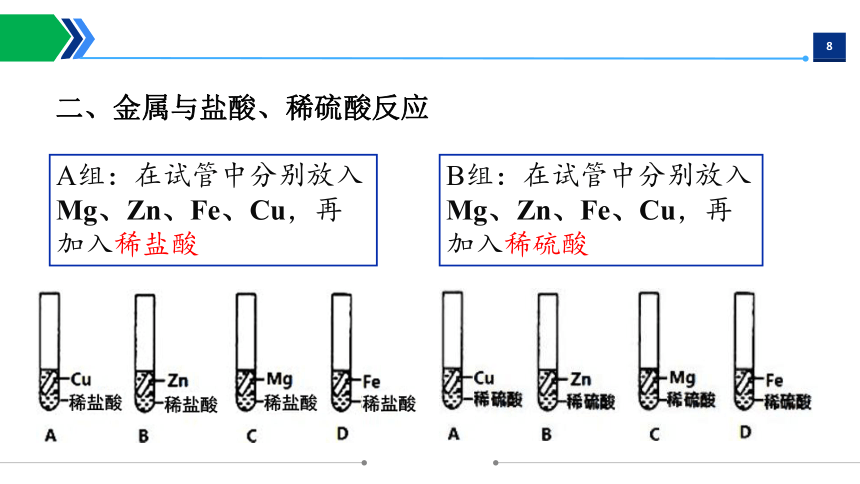
A组:在试管中分别放入Mg、Zn、Fe、Cu,再加入稀盐酸
B组:在试管中分别放入Mg、Zn、Fe、Cu,再加入稀硫酸
二、金属与盐酸、稀硫酸反应
Mg、Zn、Fe、Cu与酸反应的实验现象:
Mg
Zn
Fe
Cu
许多气泡反应最快
较多气泡反应较快
少量气泡反应较慢
没有气泡不反应
【小结】由实验可知,部分金属的活动性规律为:
Mg > Zn > Fe > Cu
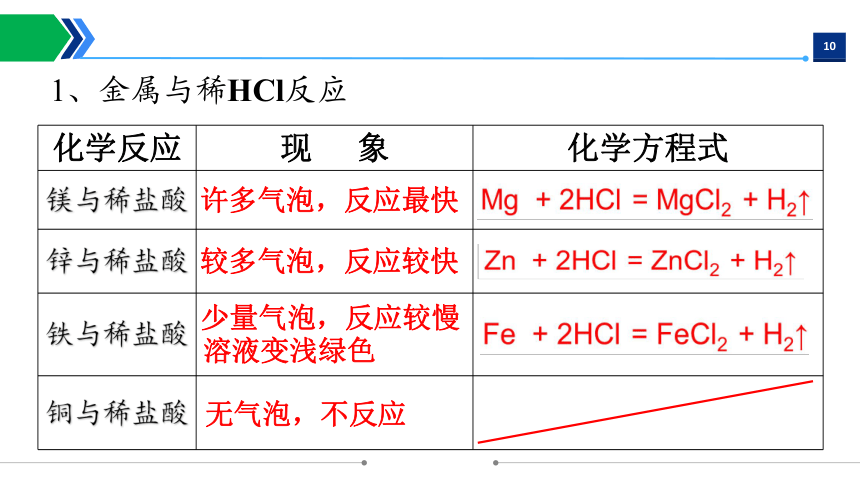
1、金属与稀HCl反应
化学反应 现 象 化学方程式
镁与稀盐酸
锌与稀盐酸
铁与稀盐酸
铜与稀盐酸
许多气泡,反应最快
较多气泡,反应较快
无气泡,不反应
少量气泡,反应较慢
溶液变浅绿色
2、金属与稀H2SO4反应
化学反应 现 象 化学方程式
镁与稀硫酸
锌与稀硫酸
铁与稀硫酸
铜与稀硫酸
许多气泡,反应最快
较多气泡,反应较快
无气泡,不反应
少量气泡,反应较慢
溶液变浅绿色
【金属与酸反应的一般规律】
① 越活泼的金属与稀盐酸、稀硫酸反应 ;
越快
不反应
③ 铁与稀盐酸、稀硫酸反应时,铁元素显 价;
反应后溶液呈 色。
+2
浅绿
活泼金属 + 酸 = 盐 + 氢气
② 不活泼的金属如Cu与稀盐酸、稀硫酸 ;
比较金属活动性强弱的方法之二:
【总结】由刚才的实验可知,金属的活动性规律为:
Mg > Zn> Fe > Cu
通过比较金属与酸反应的剧烈程度来判断金属的活动性强弱。
【发现规律】金属的化学性质(活动性)越活泼,
与酸反应越剧烈。
3、置换反应(第三种基本反应类型)
Zn + H2SO4 = ZnSO4 + H2↑
Fe + H2SO4 = FeSO4 + H2↑
单质
单质
化合物
化合物
+
+
【置换反应】一种单质和一种化合物生成新单质和
新化合物的反应。
Mg + H2SO4 = MgSO4 + H2↑
巩固练习
( )1.小兰家中收藏一件清末的铝制佛像,至今仍保存十分完好。该佛像未锈蚀的主要原因是:
A.铝不易发生化学反应
B.铝的氧化物容易发生化学反应
C.铝不易被氧化
D.铝易被氧化,但氧化铝具有保护内部铝的作用
D
巩固练习
( )2.下列物质在氧气中燃烧,能生成白色固体物质的一组是:①Mg ②S ③Fe ④P ⑤Cu
A.①和④ B.只有③
C.③④⑤ D.③和⑤
A
( )3、下列物质中,不能用金属单质和稀盐酸直接反应制得的是:
A.FeCl3 B.ZnCl2 C.MgCl2 D.FeCl2
A
( )4.根据你的实验经验,下列几种金属投入到稀硫酸中产生氢气速率最快的是:
A.铜 B.锌 C.镁 D.铁
C
( )5.把铁粉放入稀硫酸中,下列叙述正确的是:
① 在铁粉表面产生气泡 ② 溶液由无色逐渐变为浅绿色
③ 铁粉的质量增加
A.②③ B.①②③ C.①③ D.①②
D
巩固练习
( )6、下列反应中属于置换反应的是:
A. C+2CuO 2Cu+ CO2↑
高温
B.2NO+ O2 = 2NO2
高温
C.3CO+ Fe2O3 2Fe+ 3CO2
通电
D.2NaCl 2Na+ Cl2↑
A
巩固练习
B
( )7、下列化学方程式书写正确的是:
A .2Fe+6HCl = 2FeCl3+3H2↑
B.2Mg+O2 2MgO
C.3Fe+2O2 Fe3O4
D.Cu+H2SO4 = CuSO4+H2↑
点燃
△
巩固练习
( )8.平时在洗铝锅时,都要用柔软的抹布而不能用清洁球,其主要原因是:
A.清洁球太贵
B.防止破坏铝锅表面致密的氧化铝保护膜
C.防止铝锅变形
D.抹布洗得更干净
B
巩固练习
( )9.将X、Y、Z三块大小相同的金属片分别投入到质量和浓度相同的稀盐酸中,Z表面无现象,X表面缓慢地产生气泡,Y表面迅速产生大量气泡。则X、Y、Z的金属活动性顺序为:
A.X>Z>Y B.Z>Y>X
C.Y>X>Z D.Z>X>Y
C
巩固练习
( )10、下列鉴别物质,所选试剂或方法不可行的是:
A.水和过氧化氢溶液:加入MnO2,观察有无气泡产生
B.黄金和黄铜(Cu-Zn合金):在空气中加热观察颜色变化
C.CO和CO2:通入紫色石蕊溶液中,观察溶液颜色变化
D.生铁和钢:加入稀硫酸,看是否有气泡产生
D
巩固练习
巩固练习
11.为了测定铜锌合金的组成,小华称取10 g该合金粉末,在粉末中连续三次加入稀盐酸反应.每加一次盐酸,小华记录所得气体的质量,实验数据如下:
第一次 第二次 第三次
连续加入盐酸的体积(mL) 10 10 10
生成氢气的质量(g) 0.08 0.08 0.04
(1)从上表数据分析,小华用10 g合金粉末总共收集到 g 氢气;
0.2
巩固练习
(2)求出该合金中铜的质量分数。(相对原子质量:H-1 Zn-65)
解:设Cu-Zn合金中锌的质量为x。
Zn+2HCl = ZnCl2+H2↑
65 2
x 0.2 g
65 2
x 0.2 g
=
x=6.5g
答:合金中铜的质量分数为35%。
Cu%= ×100% = 35%
10g-6.5g
10g
课题2 金属的化学性质
人教版·九年级·下册
(第二课时)金属活动性顺序
化学用语天天练
一、用化学方程式表示下列化学反应:
1、铜片加热:
2Cu + O2 2CuO
△
2、铝被氧化:
3、镁与稀盐酸反应:
Mg+2HCl MgCl2+ H2↑
4、铁与稀盐酸反应:
5、锌与稀盐酸反应:
6、铝与稀盐酸反应:
3Al + 2O2 2Al2O3
Fe+2HCl FeCl2+ H2↑
Zn+2HCl ZnCl2+ H2↑
2Al+6HCl 2AlCl3+ 3H2↑
7、镁与稀硫酸反应:
8、铁与稀硫酸反应:
9、锌与稀硫酸反应:
10、铝与稀硫酸反应:
Mg+H2SO4 MgSO4+ H2↑
Fe+H2SO4 FeSO4+ H2↑
Zn+H2SO4 ZnSO4+ H2↑
2Al+3H2SO4 Al2(SO4)3+ 3H2↑
三、金属活动性顺序
取洁净的铁丝、铜丝,硫酸铜溶液、硝酸银溶液、硫酸亚铁溶液,按右图进行实验。
实验 实验现象 化学方程式
铁丝 硫酸铜溶液
铜丝 硝酸银溶液
铜丝 硫酸亚铁溶液
铁丝表面有
红色固体出现
无现象,
不反应
铜丝表面有银白色固体出现
3、金属与盐溶液反应
【实验结论】金属的活动性:
Fe > Cu > Ag
比较金属活动性强弱的方法之三:
【总结】由刚才的实验可知,金属的活动性规律为:
Fe > Cu > Ag
【发现规律】通过比较金属与盐溶液是否发生反应来
判断金属的活动性强弱。
对于反应:A + B SO4 =
若能反应:A > B
若不反应:A B
>
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金 属 活 动 性 顺 序 由 强 逐 渐 减 弱
① 越前越强
② 氢前置氢
三、金属活动顺序:
含义
【记忆小技巧】
嫁给那美女,身体细纤轻;
统共一百斤,不能生成氢!
③ 前置后
位置越前,金属活动性越强
H前金属才能与酸反应生成H2
活动性强的金属才能将弱的金属从其盐溶液中置换出来
1、大多数金属与氧气反应:
【归纳总结】金属的化学性质:
活泼金属 + 酸 盐 + 氢气
金属 + 盐溶液 新金属 + 新盐溶液
金属 + 氧气 金属氧化物
点燃或高温
2、活泼金属与酸反应:
3、金属与盐溶液反应:
1、溶液的颜色
初中阶段溶液常见的三种颜色:
(1)蓝色溶液: ;
CuCl2、CuSO4、Cu(NO3)2溶液
(2)浅绿色溶液: ;
(3)黄色溶液: ;
FeCl2、FeSO4、Fe(NO3)2溶液
FeCl3、Fe2(SO4)3 、Fe(NO3)3溶液
【拓宽视界】
2、判断常见金属活泼性的方法
(1)根据金属与酸反应来判断
② 根据 来比较;
反应时间
氢气质量
A
B
将等质量的金属A、B分别放入足量的稀盐酸中,生成氢气和反应时间的关系如图。则金属活动性:A B
<
① 通过 来比较;
相同时间内生成氢气的多少
等质量的金属完全反应所需时间
tB
tA
mB
mA
反应时间
氢气质量
Fe
Zn
【讨论分析】若将足量的金属Fe、Zn分别放入等质量同浓度的稀盐酸中,生成氢气和反应时间的关系图是怎样的?
(2)金属能否与盐溶液反应
① A、B表示金属,对于反应:A+BSO4=
若能发生,则活动性: ;
若不能发生,则活动性: 。
A > B
A < B
② 若同时比较三种金属的活动性,先按由强到弱排序,再按以下方案实验:(以Cu、Ag、Fe为例)
先按由强到弱排序:Fe、Cu、Ag
方案1:两金夹一盐: ;
方案2:两盐夹一金: 。
Fe、Cu(NO3)2、Ag
Fe(NO3)2、Cu、AgNO3
3、金属与酸 反应图像分析
【问题】取m克某活泼金属(金属元素符号用R表示,与酸反应时化合价为+a,相对原子质量为n),与足量稀盐酸反应,生成氢气多少克?
解:设生成氢气的质量为x
2n
2a
mg
x
2n
2a
mg
x
=
2R+2aHCl =2RCla + aH2↑
X =
mg × a
n
m氢气=
金属质量 × 金属化合价
金属相对原子质量
m氢气=
金属质量 × 金属化合价
金属相对原子质量
反应时间
氢气质量
A
B
将等质量的金属A、B(均为+2价)分别放入足量的稀盐酸中,生成氢气和反应时间的关系如图。
(1)金属活动性:A B
(2)相对原子质量:A B
(3)若A、B分别是Al与Mg中的一种,则A表示 。
<
<
Al
4、金属与混合盐溶液反应的规律
【提出问题】将一定量的Fe投入到Cu(NO3)2、AgNO3的混
合溶液中,会发生怎样的反应呢?
【反应规律】这种情况下,金属活动性相差越大的越容易
发生反应。
Fe + 2AgNO3 = 2Ag + Fe(NO3)2
Fe + Cu(NO3)2 = Cu + Fe(NO3)2
Fe先与AgNO3反应;
等AgNO3反应完后,Fe才与Cu(NO3)2反应:
巩固练习
( )1.硫酸铜溶液中加入过量铁粉,充分反应后过滤,留在滤纸上的物质是:
A.铁粉和铜粉的混合物 B.铜粉
C.硫酸亚铁和硫酸铜的混合物 D.铁粉
A
( )2.现将X、Y两种金属片分别插入硫酸铜溶液中,X无明显变化,Y表面有铜析出,则X、Y、Cu三种金属的活动性由强到弱的顺序是:
A.X>Y>Cu B.Cu>X>Y
C.Y>Cu>X D.X>Cu>Y
C
( )3.金属铬(Cr)与氯化亚铁溶液可发生如下反应:
2Cr+3FeCl2=2CrCl3+3Fe,下列说法不正确的是:
A.该反应属于置换反应
B.铬的金属活动性比铁强
C.铬能置换出HCl中的氢元素
D.反应前后元素化合价都不变
D
( )4.下列物质混合能发生反应的是:
A.银与稀盐酸 B.铜与硫酸锌溶液
C.铁与稀硫酸 D.锌与硫酸镁溶液
( )5.下列各组物质发生反应后,所得溶液的颜色是无色的是:
A.铜丝和硝酸银溶液 B.铁和稀硫酸
C.铁和硫酸铜溶液 D.锌和稀硫酸
C
D
( )6.利用盐酸和硝酸银探究铁、铜、银的金属活动顺序,下列实验可以不需要进行的是:
A.铁+稀盐酸 B.铜+稀盐酸
C.银+稀盐酸 D.铜+硝酸银溶液
C
( )7.将过量的铁粉放入含AgNO3和Zn(NO3)2的混合溶液中,搅拌,使其充分反应后,过滤,滤纸上留下的金属是:
A.Ag B.Fe、Ag
C.Zn、Fe D.Zn、Fe、Ag
B
( )8、将一定量的生铁放入足量的稀盐酸中,反应后发现试管底部有黑色的固体剩余,该固体是:
A、Fe B、FeCl2 C 、HCl D、C
D
( )9、向含有CuCl2、ZnCl2、HCl的溶液中加入过量的铁粉,反应后溶液中一定含有:
A.ZnCl2、HCl B.CuCl2、FeCl2
C.CuCl2、HCl D.ZnCl2、FeCl2
D
( )10、金属R与硫酸铜溶液反应的化学方程式是:
R+CuSO4=Cu+RSO4,则下列说法不正确的是:
A.该反应属于置换反应 B.金属活泼:R>Cu
C.该金属可以是金属铝 D.该金属可能是铁
C
( )11、将一定质量的Fe粉投入到含有Cu(NO3)2、AgNO3和Mg (NO3)2的混合溶液中,一段时间后过滤,所得滤渣的可能组成中正确的是:
A、Mg、Fe、Cu、Ag B、Fe、Cu、Ag
C、Fe、Ag D、Fe、Cu
B
( )12、向等质量的锌粉和铁粉中分别加入足量稀硫酸,下列图像描述正确的是:
B
A B C D
C
( )13、相同质量的M、N两种活泼金属,分别与浓度相同的足量的稀盐酸反应(M、N在生成物中均为+2价),生成H2质量和反应时间的关系如右图:
下列叙述正确的是:
A.金属的活泼性N>M
B.两个反应生成H2的体积相等
C.相对原子质量N>M
D.两个反应消耗盐酸的质量一定相等
14.以铁、水、稀盐酸、氧气、稀硫酸、硫酸铜溶液为原
料,根据下列化学反应类型,写出相应的化学方程式:
(1)化合反应:______________________。
(2)分解反应: 。
(3)置换反应: ;
________________________;
_________________________。
3Fe + 2O2 Fe3O4
点燃
2H2O 2H2↑+ O2↑
电解
Fe+2HCl FeCl2+ H2↑
Fe+H2SO4 FeSO4+ H2↑
Fe+CuSO4 FeSO4+ Cu
15.为了达到“收旧利废,节能减排”的目的,从含有金属镁、铁、铜的粉末中,分离和提取出重要化工原料MgSO4和有关金属,实验过程如图,请回答:
(1)操作①中被磁铁吸引的金属A是 ;金属B是 。
(2)操作a的名称是 。
铁
铜
过滤
(4)实验步骤②中除了加入稀硫酸外,还可选用下列试剂
(填字母)。
A.硫酸铜溶液 B.氯化钠溶液 C.硝酸银溶液
(3)写出步骤②所涉及的化学反应方程式:
,其基本反应类型是 。
A
置换反应
Mg+H2SO4 Mg+ H2↑
本课题已学完,请及时巩固复习!
课题2 金属的化学性质
人教版·九年级·下册
(第一课时)金属的化学性质
【学习目标】
1、知道镁、铁、铜等金属与氧气的反应;
2、初步认识常见金属与酸或盐溶液的置换反应,能用置换反应
解释一些有关的化学问题;
3、能用金属活动性顺序对有关的置换反应进行简单的判断,并
能解释一些与日常生活相关的现象。
化学用语天天练
一、用化学方程式表示下列化学反应:
1、镁条燃烧:
2Mg + O2 2MgO
点燃
2、铁丝燃烧:
3、碳与氧化铜在高温下反应:
C+2CuO 2Cu+ CO2↑
高温
CO+CuO Cu+CO2
△
4、一氧化碳与与氧化铜反应:
5、甲烷燃烧:
6、酒精燃烧:
3Fe + 2O2 Fe3O4
点燃
1、有A、B两种金属,金属A单质呈紫红色;B是生产生活中使用最广泛的金属。
(1)则单质A的化学式为 ;金属B的名称是 ;
(2)A、B都具有良好的导电性,但生活中常用A做电线而很少用B做电线。其原因是 。
2、合金都属于 (填“纯净物”或“混合物”);钢和生铁都是铁和 的合金,其中含碳量为2%~4.3%的合金是 。
Cu
铁
Cu的导电性比Fe强
混合物
碳
生铁
【课前思考】
1、常温下铁在空气中能慢慢与氧气反应生锈;
常温下与氧气反应的 难易程度:
常温下铜在空气中很难被氧化。
Fe > Cu
铁只能在纯氧中剧烈燃烧。
镁在空气中点燃能剧烈燃烧。
点燃时与氧气反应的 难易程度:
Mg > Fe
一、金属与氧气反应
比较金属活动性强弱的方法之一:
【结论】由实验可知,部分金属的活动性规律为:
Mg > Al > Fe > Cu > Au
通过比较金属与氧气反应的难易程度来判断金属的活动性强弱。
【发现规律】金属的化学性质(活动性)越活泼,与氧气反
应越容易。
实验表明,Al比Fe更易与氧气反应,但为什么铁器比铝制品更易生锈?
铁锅
铝锅
铝容易与氧气反应,在表面生成了一层结构致密的氧化膜,保护了内层的铝不再被氧化哦。
【寻找原因】
A组:在试管中分别放入Mg、Zn、Fe、Cu,再加入稀盐酸
B组:在试管中分别放入Mg、Zn、Fe、Cu,再加入稀硫酸
二、金属与盐酸、稀硫酸反应
Mg、Zn、Fe、Cu与酸反应的实验现象:
Mg
Zn
Fe
Cu
许多气泡反应最快
较多气泡反应较快
少量气泡反应较慢
没有气泡不反应
【小结】由实验可知,部分金属的活动性规律为:
Mg > Zn > Fe > Cu
1、金属与稀HCl反应
化学反应 现 象 化学方程式
镁与稀盐酸
锌与稀盐酸
铁与稀盐酸
铜与稀盐酸
许多气泡,反应最快
较多气泡,反应较快
无气泡,不反应
少量气泡,反应较慢
溶液变浅绿色
2、金属与稀H2SO4反应
化学反应 现 象 化学方程式
镁与稀硫酸
锌与稀硫酸
铁与稀硫酸
铜与稀硫酸
许多气泡,反应最快
较多气泡,反应较快
无气泡,不反应
少量气泡,反应较慢
溶液变浅绿色
【金属与酸反应的一般规律】
① 越活泼的金属与稀盐酸、稀硫酸反应 ;
越快
不反应
③ 铁与稀盐酸、稀硫酸反应时,铁元素显 价;
反应后溶液呈 色。
+2
浅绿
活泼金属 + 酸 = 盐 + 氢气
② 不活泼的金属如Cu与稀盐酸、稀硫酸 ;
比较金属活动性强弱的方法之二:
【总结】由刚才的实验可知,金属的活动性规律为:
Mg > Zn> Fe > Cu
通过比较金属与酸反应的剧烈程度来判断金属的活动性强弱。
【发现规律】金属的化学性质(活动性)越活泼,
与酸反应越剧烈。
3、置换反应(第三种基本反应类型)
Zn + H2SO4 = ZnSO4 + H2↑
Fe + H2SO4 = FeSO4 + H2↑
单质
单质
化合物
化合物
+
+
【置换反应】一种单质和一种化合物生成新单质和
新化合物的反应。
Mg + H2SO4 = MgSO4 + H2↑
巩固练习
( )1.小兰家中收藏一件清末的铝制佛像,至今仍保存十分完好。该佛像未锈蚀的主要原因是:
A.铝不易发生化学反应
B.铝的氧化物容易发生化学反应
C.铝不易被氧化
D.铝易被氧化,但氧化铝具有保护内部铝的作用
D
巩固练习
( )2.下列物质在氧气中燃烧,能生成白色固体物质的一组是:①Mg ②S ③Fe ④P ⑤Cu
A.①和④ B.只有③
C.③④⑤ D.③和⑤
A
( )3、下列物质中,不能用金属单质和稀盐酸直接反应制得的是:
A.FeCl3 B.ZnCl2 C.MgCl2 D.FeCl2
A
( )4.根据你的实验经验,下列几种金属投入到稀硫酸中产生氢气速率最快的是:
A.铜 B.锌 C.镁 D.铁
C
( )5.把铁粉放入稀硫酸中,下列叙述正确的是:
① 在铁粉表面产生气泡 ② 溶液由无色逐渐变为浅绿色
③ 铁粉的质量增加
A.②③ B.①②③ C.①③ D.①②
D
巩固练习
( )6、下列反应中属于置换反应的是:
A. C+2CuO 2Cu+ CO2↑
高温
B.2NO+ O2 = 2NO2
高温
C.3CO+ Fe2O3 2Fe+ 3CO2
通电
D.2NaCl 2Na+ Cl2↑
A
巩固练习
B
( )7、下列化学方程式书写正确的是:
A .2Fe+6HCl = 2FeCl3+3H2↑
B.2Mg+O2 2MgO
C.3Fe+2O2 Fe3O4
D.Cu+H2SO4 = CuSO4+H2↑
点燃
△
巩固练习
( )8.平时在洗铝锅时,都要用柔软的抹布而不能用清洁球,其主要原因是:
A.清洁球太贵
B.防止破坏铝锅表面致密的氧化铝保护膜
C.防止铝锅变形
D.抹布洗得更干净
B
巩固练习
( )9.将X、Y、Z三块大小相同的金属片分别投入到质量和浓度相同的稀盐酸中,Z表面无现象,X表面缓慢地产生气泡,Y表面迅速产生大量气泡。则X、Y、Z的金属活动性顺序为:
A.X>Z>Y B.Z>Y>X
C.Y>X>Z D.Z>X>Y
C
巩固练习
( )10、下列鉴别物质,所选试剂或方法不可行的是:
A.水和过氧化氢溶液:加入MnO2,观察有无气泡产生
B.黄金和黄铜(Cu-Zn合金):在空气中加热观察颜色变化
C.CO和CO2:通入紫色石蕊溶液中,观察溶液颜色变化
D.生铁和钢:加入稀硫酸,看是否有气泡产生
D
巩固练习
巩固练习
11.为了测定铜锌合金的组成,小华称取10 g该合金粉末,在粉末中连续三次加入稀盐酸反应.每加一次盐酸,小华记录所得气体的质量,实验数据如下:
第一次 第二次 第三次
连续加入盐酸的体积(mL) 10 10 10
生成氢气的质量(g) 0.08 0.08 0.04
(1)从上表数据分析,小华用10 g合金粉末总共收集到 g 氢气;
0.2
巩固练习
(2)求出该合金中铜的质量分数。(相对原子质量:H-1 Zn-65)
解:设Cu-Zn合金中锌的质量为x。
Zn+2HCl = ZnCl2+H2↑
65 2
x 0.2 g
65 2
x 0.2 g
=
x=6.5g
答:合金中铜的质量分数为35%。
Cu%= ×100% = 35%
10g-6.5g
10g
课题2 金属的化学性质
人教版·九年级·下册
(第二课时)金属活动性顺序
化学用语天天练
一、用化学方程式表示下列化学反应:
1、铜片加热:
2Cu + O2 2CuO
△
2、铝被氧化:
3、镁与稀盐酸反应:
Mg+2HCl MgCl2+ H2↑
4、铁与稀盐酸反应:
5、锌与稀盐酸反应:
6、铝与稀盐酸反应:
3Al + 2O2 2Al2O3
Fe+2HCl FeCl2+ H2↑
Zn+2HCl ZnCl2+ H2↑
2Al+6HCl 2AlCl3+ 3H2↑
7、镁与稀硫酸反应:
8、铁与稀硫酸反应:
9、锌与稀硫酸反应:
10、铝与稀硫酸反应:
Mg+H2SO4 MgSO4+ H2↑
Fe+H2SO4 FeSO4+ H2↑
Zn+H2SO4 ZnSO4+ H2↑
2Al+3H2SO4 Al2(SO4)3+ 3H2↑
三、金属活动性顺序
取洁净的铁丝、铜丝,硫酸铜溶液、硝酸银溶液、硫酸亚铁溶液,按右图进行实验。
实验 实验现象 化学方程式
铁丝 硫酸铜溶液
铜丝 硝酸银溶液
铜丝 硫酸亚铁溶液
铁丝表面有
红色固体出现
无现象,
不反应
铜丝表面有银白色固体出现
3、金属与盐溶液反应
【实验结论】金属的活动性:
Fe > Cu > Ag
比较金属活动性强弱的方法之三:
【总结】由刚才的实验可知,金属的活动性规律为:
Fe > Cu > Ag
【发现规律】通过比较金属与盐溶液是否发生反应来
判断金属的活动性强弱。
对于反应:A + B SO4 =
若能反应:A > B
若不反应:A B
>
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金 属 活 动 性 顺 序 由 强 逐 渐 减 弱
① 越前越强
② 氢前置氢
三、金属活动顺序:
含义
【记忆小技巧】
嫁给那美女,身体细纤轻;
统共一百斤,不能生成氢!
③ 前置后
位置越前,金属活动性越强
H前金属才能与酸反应生成H2
活动性强的金属才能将弱的金属从其盐溶液中置换出来
1、大多数金属与氧气反应:
【归纳总结】金属的化学性质:
活泼金属 + 酸 盐 + 氢气
金属 + 盐溶液 新金属 + 新盐溶液
金属 + 氧气 金属氧化物
点燃或高温
2、活泼金属与酸反应:
3、金属与盐溶液反应:
1、溶液的颜色
初中阶段溶液常见的三种颜色:
(1)蓝色溶液: ;
CuCl2、CuSO4、Cu(NO3)2溶液
(2)浅绿色溶液: ;
(3)黄色溶液: ;
FeCl2、FeSO4、Fe(NO3)2溶液
FeCl3、Fe2(SO4)3 、Fe(NO3)3溶液
【拓宽视界】
2、判断常见金属活泼性的方法
(1)根据金属与酸反应来判断
② 根据 来比较;
反应时间
氢气质量
A
B
将等质量的金属A、B分别放入足量的稀盐酸中,生成氢气和反应时间的关系如图。则金属活动性:A B
<
① 通过 来比较;
相同时间内生成氢气的多少
等质量的金属完全反应所需时间
tB
tA
mB
mA
反应时间
氢气质量
Fe
Zn
【讨论分析】若将足量的金属Fe、Zn分别放入等质量同浓度的稀盐酸中,生成氢气和反应时间的关系图是怎样的?
(2)金属能否与盐溶液反应
① A、B表示金属,对于反应:A+BSO4=
若能发生,则活动性: ;
若不能发生,则活动性: 。
A > B
A < B
② 若同时比较三种金属的活动性,先按由强到弱排序,再按以下方案实验:(以Cu、Ag、Fe为例)
先按由强到弱排序:Fe、Cu、Ag
方案1:两金夹一盐: ;
方案2:两盐夹一金: 。
Fe、Cu(NO3)2、Ag
Fe(NO3)2、Cu、AgNO3
3、金属与酸 反应图像分析
【问题】取m克某活泼金属(金属元素符号用R表示,与酸反应时化合价为+a,相对原子质量为n),与足量稀盐酸反应,生成氢气多少克?
解:设生成氢气的质量为x
2n
2a
mg
x
2n
2a
mg
x
=
2R+2aHCl =2RCla + aH2↑
X =
mg × a
n
m氢气=
金属质量 × 金属化合价
金属相对原子质量
m氢气=
金属质量 × 金属化合价
金属相对原子质量
反应时间
氢气质量
A
B
将等质量的金属A、B(均为+2价)分别放入足量的稀盐酸中,生成氢气和反应时间的关系如图。
(1)金属活动性:A B
(2)相对原子质量:A B
(3)若A、B分别是Al与Mg中的一种,则A表示 。
<
<
Al
4、金属与混合盐溶液反应的规律
【提出问题】将一定量的Fe投入到Cu(NO3)2、AgNO3的混
合溶液中,会发生怎样的反应呢?
【反应规律】这种情况下,金属活动性相差越大的越容易
发生反应。
Fe + 2AgNO3 = 2Ag + Fe(NO3)2
Fe + Cu(NO3)2 = Cu + Fe(NO3)2
Fe先与AgNO3反应;
等AgNO3反应完后,Fe才与Cu(NO3)2反应:
巩固练习
( )1.硫酸铜溶液中加入过量铁粉,充分反应后过滤,留在滤纸上的物质是:
A.铁粉和铜粉的混合物 B.铜粉
C.硫酸亚铁和硫酸铜的混合物 D.铁粉
A
( )2.现将X、Y两种金属片分别插入硫酸铜溶液中,X无明显变化,Y表面有铜析出,则X、Y、Cu三种金属的活动性由强到弱的顺序是:
A.X>Y>Cu B.Cu>X>Y
C.Y>Cu>X D.X>Cu>Y
C
( )3.金属铬(Cr)与氯化亚铁溶液可发生如下反应:
2Cr+3FeCl2=2CrCl3+3Fe,下列说法不正确的是:
A.该反应属于置换反应
B.铬的金属活动性比铁强
C.铬能置换出HCl中的氢元素
D.反应前后元素化合价都不变
D
( )4.下列物质混合能发生反应的是:
A.银与稀盐酸 B.铜与硫酸锌溶液
C.铁与稀硫酸 D.锌与硫酸镁溶液
( )5.下列各组物质发生反应后,所得溶液的颜色是无色的是:
A.铜丝和硝酸银溶液 B.铁和稀硫酸
C.铁和硫酸铜溶液 D.锌和稀硫酸
C
D
( )6.利用盐酸和硝酸银探究铁、铜、银的金属活动顺序,下列实验可以不需要进行的是:
A.铁+稀盐酸 B.铜+稀盐酸
C.银+稀盐酸 D.铜+硝酸银溶液
C
( )7.将过量的铁粉放入含AgNO3和Zn(NO3)2的混合溶液中,搅拌,使其充分反应后,过滤,滤纸上留下的金属是:
A.Ag B.Fe、Ag
C.Zn、Fe D.Zn、Fe、Ag
B
( )8、将一定量的生铁放入足量的稀盐酸中,反应后发现试管底部有黑色的固体剩余,该固体是:
A、Fe B、FeCl2 C 、HCl D、C
D
( )9、向含有CuCl2、ZnCl2、HCl的溶液中加入过量的铁粉,反应后溶液中一定含有:
A.ZnCl2、HCl B.CuCl2、FeCl2
C.CuCl2、HCl D.ZnCl2、FeCl2
D
( )10、金属R与硫酸铜溶液反应的化学方程式是:
R+CuSO4=Cu+RSO4,则下列说法不正确的是:
A.该反应属于置换反应 B.金属活泼:R>Cu
C.该金属可以是金属铝 D.该金属可能是铁
C
( )11、将一定质量的Fe粉投入到含有Cu(NO3)2、AgNO3和Mg (NO3)2的混合溶液中,一段时间后过滤,所得滤渣的可能组成中正确的是:
A、Mg、Fe、Cu、Ag B、Fe、Cu、Ag
C、Fe、Ag D、Fe、Cu
B
( )12、向等质量的锌粉和铁粉中分别加入足量稀硫酸,下列图像描述正确的是:
B
A B C D
C
( )13、相同质量的M、N两种活泼金属,分别与浓度相同的足量的稀盐酸反应(M、N在生成物中均为+2价),生成H2质量和反应时间的关系如右图:
下列叙述正确的是:
A.金属的活泼性N>M
B.两个反应生成H2的体积相等
C.相对原子质量N>M
D.两个反应消耗盐酸的质量一定相等
14.以铁、水、稀盐酸、氧气、稀硫酸、硫酸铜溶液为原
料,根据下列化学反应类型,写出相应的化学方程式:
(1)化合反应:______________________。
(2)分解反应: 。
(3)置换反应: ;
________________________;
_________________________。
3Fe + 2O2 Fe3O4
点燃
2H2O 2H2↑+ O2↑
电解
Fe+2HCl FeCl2+ H2↑
Fe+H2SO4 FeSO4+ H2↑
Fe+CuSO4 FeSO4+ Cu
15.为了达到“收旧利废,节能减排”的目的,从含有金属镁、铁、铜的粉末中,分离和提取出重要化工原料MgSO4和有关金属,实验过程如图,请回答:
(1)操作①中被磁铁吸引的金属A是 ;金属B是 。
(2)操作a的名称是 。
铁
铜
过滤
(4)实验步骤②中除了加入稀硫酸外,还可选用下列试剂
(填字母)。
A.硫酸铜溶液 B.氯化钠溶液 C.硝酸银溶液
(3)写出步骤②所涉及的化学反应方程式:
,其基本反应类型是 。
A
置换反应
Mg+H2SO4 Mg+ H2↑
本课题已学完,请及时巩固复习!
同课章节目录
