第九单元课题2溶解度课件—2021-2022学年九年级化学人教版下册(共51张PPT)
文档属性
| 名称 | 第九单元课题2溶解度课件—2021-2022学年九年级化学人教版下册(共51张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 7.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-06 23:20:11 | ||
图片预览








文档简介
(共51张PPT)
课题2 溶解度
人教版·九年级·下册
(第一课时)饱和溶液
【学习目标】
1、了解饱和溶液的含义;认识“饱和”和“不饱和”的相对性;
2、了解溶解度的含义;
3、初步学会绘制和查阅溶解度曲线。
4、知道溶解度的定义 及其与温度、压强的关系;
化学用语天天练
归纳金属的化学性质:
1、镁条燃烧:
2Mg + O2 2MgO
点燃
2、铁丝燃烧:
3Fe + 2O2 Fe3O4
点燃
3、铜片加热:
2Cu + O2 2CuO
△
4、铝被氧化:
3Al + 2O2 2Al2O3
一、金属可以和氧气反应:
化学用语天天练
二、金属可以和稀盐酸或稀硫酸反应:
1、镁与稀盐酸反应:
Mg+2HCl MgCl2+ H2↑
2、铁与稀盐酸反应:
3、锌与稀盐酸反应:
4、铝与稀盐酸反应:
Fe+2HCl FeCl2+ H2↑
Zn+2HCl ZnCl2+ H2↑
2Al+6HCl 2AlCl3+ 3H2↑
5、镁与稀硫酸反应:
6、铁与稀硫酸反应:
7、锌与稀硫酸反应:
8、铝与稀硫酸反应:
Mg+H2SO4 MgSO4+ H2↑
Fe+H2SO4 FeSO4+ H2↑
Zn+H2SO4 ZnSO4+ H2↑
2Al+3H2SO4 Al2(SO4)3+ 3H2↑
1、铁与硫酸铜溶液反应:
3、铜与硝酸银溶液反应:
Fe+CuSO4 FeSO4+ Cu
Cu+2AgNO3 Cu(NO3)2+ 2Ag
三、金属可以和盐溶液反应:
2、铁与氯化铜溶液反应:
Fe+CuCl2 FeCl2+ Cu
4、铝与硝酸银溶液反应:
Al+3AgNO3 Al(NO3)3+ 3Ag
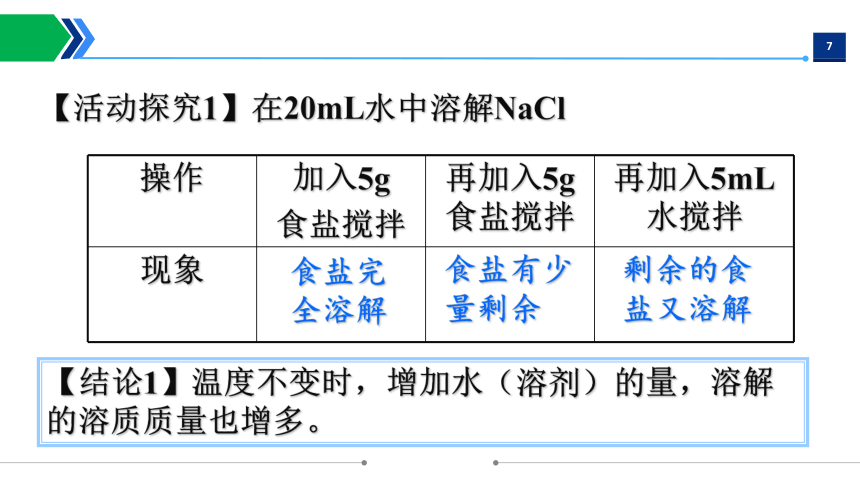
【问题】一定量的水中,NaCl是否可以无限地溶解呢?
操作 加入5g 食盐搅拌 再加入5g食盐搅拌 再加入5mL水搅拌
现象
食盐完全溶解
食盐有少量剩余
剩余的食盐又溶解
【结论1】温度不变时,增加水(溶剂)的量,溶解的溶质质量也增多。
【活动探究1】在20mL水中溶解NaCl
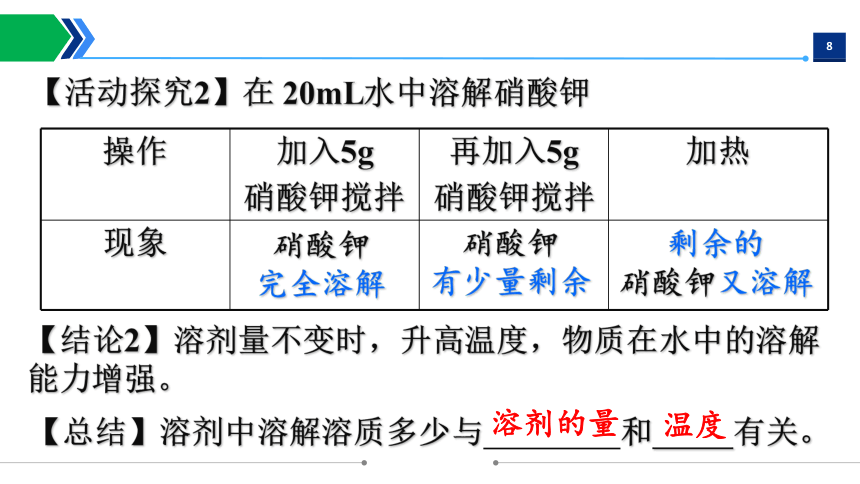
操作 加入5g 硝酸钾搅拌 再加入5g 硝酸钾搅拌 加热
现象
硝酸钾
完全溶解
硝酸钾
有少量剩余
剩余的
硝酸钾又溶解
【活动探究2】在 20mL水中溶解硝酸钾
【结论2】溶剂量不变时,升高温度,物质在水中的溶解 能力增强。
【总结】溶剂中溶解溶质多少与 和 有关。
温度
溶剂的量
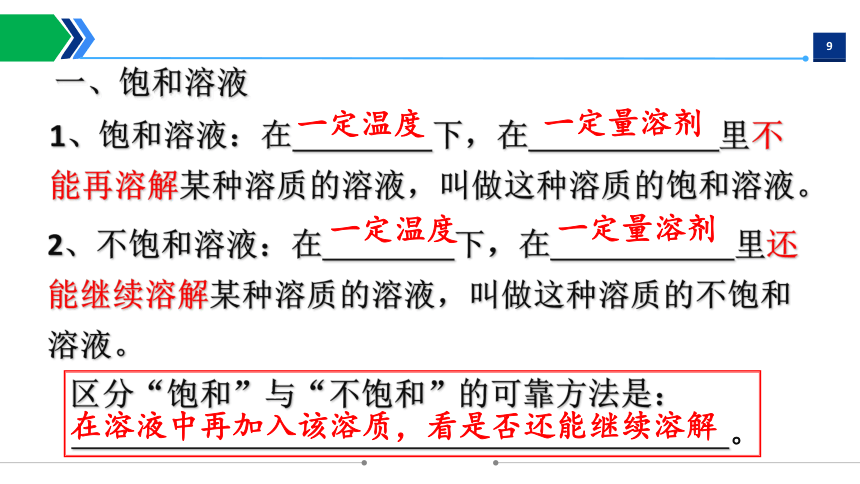
一、饱和溶液
2、不饱和溶液:在 下,在 里还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。
区分“饱和”与“不饱和”的可靠方法是:
。
一定温度
一定量溶剂
一定温度
一定量溶剂
在溶液中再加入该溶质,看是否还能继续溶解
1、饱和溶液:在 下,在 里不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液。
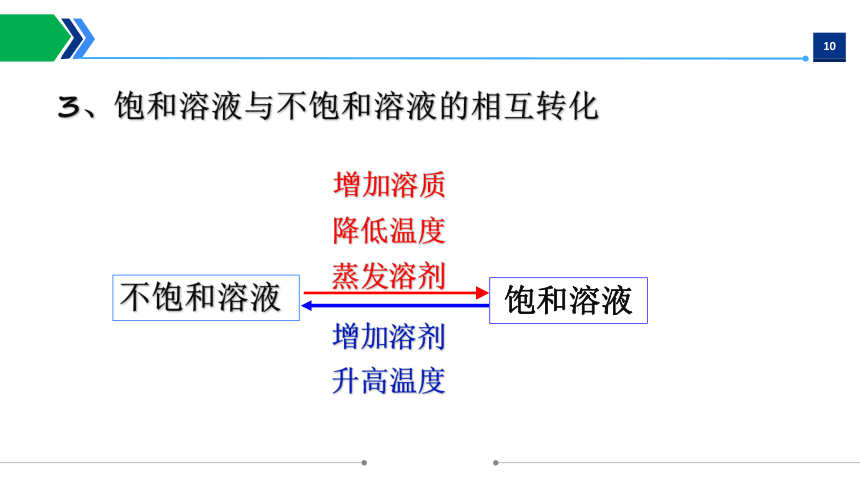
不饱和溶液
饱和溶液
增加溶质
增加溶剂
3、饱和溶液与不饱和溶液的相互转化
降低温度
蒸发溶剂
升高温度
【动脑筋1】
①20℃时,将33克食盐放入100克水中,食盐全部溶解,此时
溶 液质量为 克;
②再向此溶液加入3克食盐又恰好全 部溶解,则溶液中溶质为
克;
③若此时溶液恰好饱和,则饱和溶液的质量为 克;
④再向上述饱和溶液中加入3克食盐,溶液质量是 克。
133
36
136
136
【动脑筋2】实验测知:20℃时,100g水溶解31.6g硝酸钾就饱和了;80℃时,100g水溶解169g硝酸钾就饱和了。
(1)80℃时,向100g水加入160g硝酸钾,完全溶解后得到的是硝酸钾的 (填“饱和”、“不饱和”)溶液;
(2)将上述硝酸钾溶液从80℃冷却到20℃时,此时观察到的现象是 ;析出晶体的质量为 g;
(3)通过上述分析,你发现一条规律:
不饱和
有晶体析出
128.4
析出晶体前的溶液不一定是饱和溶液;
但析出晶体后的溶液一定是饱和溶液。
4、结晶:溶质从溶液中析出来的过程叫做结晶。
硝酸钾热浓溶液
硝酸钾晶体
A
B
(1)结晶的方法之一:降温结晶法;
上述过程中;A中 饱和;B中 饱和。
不一定
一定
海水
贮水池
蒸发池
结晶池
食盐
母液
氯化钠
多种化工原料
你知道海水晒盐的原理吗?
利用风力、阳光的作用蒸发水分,从而析出氯化钠晶体。
(2)结晶的方法之二:蒸发结晶法;
( )1.有关溶液的说法正确的是:
A.溶液都是无色的
B.稀溶液一定是不饱和溶液
C.固体溶解时都放出热量
D.溶液都是均一、稳定的混合物
D
( )2.在一定条件下,将5克食盐放进盛有10克水的烧杯中,充分溶解后,烧杯底部沉积有1.4克食盐,则此时溶液的质量为:
A.15克 B.16.4克
C.11.4克 D.13.6克
D
巩固练习
巩固练习
( )3.把不饱和溶液变成饱和溶液的最可靠的方法是:
A.降低温度 B.蒸发溶剂
C.加入溶质 D.升高温度
C
( )4.现有30 ℃的100 g某物质的饱和溶液,一定能使其变成不饱和溶液的方法是:
A.加入一定量的水 B.降低温度
C.恒温蒸发水分 D.升高温度,水的质量不变
A
( )5.从海水中提取食盐的流程如下,下列说法错误的是:
A.经过第①步操作,海水中的成分基本不变
B.蒸发池中,氯化钠溶液逐渐变浓
C.经过第③步的操作,进入结晶池后,继续蒸发水,
有④发生
D.析出食盐晶体后的母液是氯化钠的不饱和溶液
D
巩固练习
( )6.常温下,向一未知质量的硝酸钾溶液中加入少量硝酸钾晶体,经充分搅拌,发现有部分硝酸钾晶体溶解,则原溶液是:
A.饱和溶液 B.不饱和溶液
C.各部分的性质不同的液体 D.无法确定
B
( )7.室温时,向饱和的氯化钠溶液中加入少量的氯化钠固体,则:
①溶液质量增加 ②溶质质量增加 ③溶剂质量不变
④固体质量不变 ⑤固体质量减少
A.①② B.③④ C.①⑤ D.①②④
B
巩固练习
( )8.在一定温度下,将一瓶接近饱和的硝酸钾溶液转化成饱和溶液的方法是:
①升高温度 ②降低温度 ③增加溶质
④增加溶剂 ⑤蒸发溶剂
A.①②③ B.②③⑤
C.②③④ D.③④⑤
B
巩固练习
( )9.向一定量水中,逐渐加入KNO3固体,下列图像中符合溶液中溶质质量变化规律的是:
A
巩固练习
10.下列说法正确的,在( )中打“√”;错误的,在( )中打“×”。
(1)溶液的体积等于溶质的体积与溶剂的体积之和。( )
(2)饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液。( )
(3)饱和溶液析出晶体后,其溶液变为稀溶液。( )
(4)在温度相同的条件下,同一种物质的饱和溶液比不饱和溶液要浓一些。( )
×
×
×
√
巩固练习
课题2 溶解度
人教版·九年级·下册
(第二课时)溶解度
化学用语天天练
归纳金属的化学性质:
1、镁条燃烧:
2Mg + O2 2MgO
点燃
2、铁丝燃烧:
3Fe + 2O2 Fe3O4
点燃
3、铜片加热:
2Cu + O2 2CuO
△
4、铝被氧化:
3Al + 2O2 2Al2O3
一、金属可以和氧气反应:
化学用语天天练
二、金属可以和稀盐酸或稀硫酸反应:
1、镁与稀盐酸反应:
Mg+2HCl MgCl2+ H2↑
2、铁与稀盐酸反应:
3、锌与稀盐酸反应:
4、铝与稀盐酸反应:
Fe+2HCl FeCl2+ H2↑
Zn+2HCl ZnCl2+ H2↑
2Al+6HCl 2AlCl3+ 3H2↑
5、镁与稀硫酸反应:
6、铁与稀硫酸反应:
7、锌与稀硫酸反应:
8、铝与稀硫酸反应:
Mg+H2SO4 MgSO4+ H2↑
Fe+H2SO4 FeSO4+ H2↑
Zn+H2SO4 ZnSO4+ H2↑
2Al+3H2SO4 Al2(SO4)3+ 3H2↑
1、铁与硫酸铜溶液反应:
3、铜与硝酸银溶液反应:
Fe+CuSO4 FeSO4+ Cu
Cu+2AgNO3 Cu(NO3)2+ 2Ag
三、金属可以和盐溶液反应:
2、铁与氯化铜溶液反应:
Fe+CuCl2 FeCl2+ Cu
4、铝与硝酸银溶液反应:
Al+3AgNO3 Al(NO3)3+ 3Ag
【问题】我们已经知道,不同的物质在水中的溶解能力大小是不相同的。那么,用什么来比较物质溶解能力的大小呢?
二、溶解度
1、溶解度的定义:在一定温度下,某固体物质在100g水里达到饱和状态时所溶解的溶质质量。
①一定温度
溶解度四大要素
②100克水
③饱和状态
④溶质质量
① 20℃时,NaCl、KNO3的溶解度分别为36g、31.6g。
则在20℃时, 比 的溶解能力强。
② 在20℃时,100g水中溶解36g氯化钠达到饱和。
则在20℃时,氯化钠的溶解度为 。
NaCl
KNO3
36g
【讨论分析】
③ 60℃时,硝酸钾的溶解度是110克。则在60℃时,100g水里最多能溶解 硝酸钾。
④ 20℃时硝酸钾的溶解度是31.6g,填写下表:
温度 溶质的质量 溶剂的质量 溶液的质量
110g
20℃
31.6g
100g
131.6g
2、溶解度与溶解性的关系
【理解】20℃时氯化钠的溶解度是36g。则氯化钠属于
( )
A.易溶物质 B.可溶物质
C.微溶物质 D.难溶物质
溶解度(20℃)
A
3、表示溶解度的方法
溶解度是实验的方法测定出来的,表示方法如下:
温度/℃ 0 10 20 30 40 50 60
溶解度/g 35.7 35.8 36 36.3 36.5 37 37.3
(1)表格法
从上表中的数据可以发现:氯化钠的溶解度随温度的变化规律是 。
温度升高,NaCl溶解度逐渐增加
温度/℃ 0 10 20 30 40 50 60
溶解度/g 35.7 35.8 36 36.3 36.5 37 37.3
2、图像法
.
.
.
.
.
.
.
部分物质的溶解度曲线(20℃ )
溶解度曲线形象地体现了溶解度随温度变化而变化的规律。
①曲线中温度与溶解度成一一对应关系;
②两曲线交点表示两种物质在该温度时
溶解度相等;
③由曲线可比较同温度下物质溶解度的
大小;
④大多数物质溶解度随温度升高而增大;
少数物质溶解度随温度变化不大(NaCl);
极个别物质随温度升高而降低[Ca(OH)2]
【动脑筋】甲、乙、丙三物质溶解度曲线如图。
(1)溶解度随温度升高而减小的是 。
(2) ℃时,甲、乙溶解度相等;
丙
40
(3)30℃时,将10g丙物质放入50g水中,得到的溶液是
(填“饱和”或“不饱和”),溶液质量为 g。
饱和
55
(4)30℃时,三物质溶解度由大到小的顺序为 ;
(5)将等质量50℃的甲、乙、丙三物质的饱和溶液降温到10℃时,析出晶体最多的是 ,没有晶体析出的是 。
乙>甲>丙
甲
丙
降温结晶法
蒸发结晶法
结晶方法
【归纳总结】
可溶性的固体混合物可采用降温结晶的方法可以分离:
NaCl、KNO3混合溶液
适合于溶解度随温度变化不大的物质
适合于溶解度随温度变化较大的物质
较纯KNO3
加热浓缩
降温结晶
趁热过滤
3、气体物质的溶解度
【问题1】打开汽水盖时,汽水会自动喷出来,这说明气体在水中的溶解度与什么有关?
原因分析:温度升高,气体在水中的溶解度减小。
原因分析:压强减小,气体在水中的溶解度减小。
【问题2】喝了汽水后,常常会打嗝。这说明气体的溶解度还与什么有关?
(2)影响气体溶解度的因素:
(1)气体的溶解度:是指在压强为101kPa和一定温度时,气体溶解在1体积水里达饱和状态时的气体体积。
温度升高,气体在水中的溶解度减小。
压强增大,气体在水中的溶解度增大。
温度降低,气体在水中的溶解度增大。
压强减小,气体在水中的溶解度减小。
压强
温度
巩固练习
( )2.t ℃时,某物质的溶解度为10 g,则t ℃时该物质的饱和溶液中,溶质、溶剂、饱和溶液间的质量比为:
A.1∶9∶10 B.1∶10∶11
C.9∶1∶10 D.10∶1∶11
B
( )1.下列因素不可能影响固体物质溶解度的是:
A.水的质量 B.温度
C.溶质的性质 D.溶剂的性质
A
( )3.20 ℃时,氯化钠的溶解度为36 g。对这句话理解错误的是:
A.20 ℃时,100 g水中最多能溶解氯化钠36 g
B.20 ℃时,100 g氯化钠饱和溶液中含氯化钠36 g
C.20 ℃时,氯化钠饱和溶液中水与氯化钠的质量比
为100∶36
D.20 ℃时,将36 g氯化钠溶解于100 g水中,所得
溶液为该温度下氯化钠的饱和溶液
B
巩固练习
( )4.KNO3在20 ℃时的溶解度为31.6 g,现在把40 g KNO3放入100 g水中充分溶解,则此时KNO3溶液的质量为:
A.31.6 g B.140 g
C.131.6 g D.71.6 g
C
B
( )5.下列物质的溶解度,随温度升高而减少的是:
A.食盐 B.熟石灰
C.硝酸钠 D.硫酸铜
巩固练习
( )6、气体的溶解度与气体性质、溶剂有关,还与外界条件有关。“打开汽水瓶盖,汽水会自动喷出来”这种现象主要与下列外界条件中的哪一因素有关:
A.压强 B.温度 C.汽水瓶 D.光照
A
( )7.增大气体在水中的溶解度可采用的方法有:①增大压强,②减小压强,③升高温度,④降低温度。其中可行的是:
A.①③ B.②③ C.①④ D.②④
C
巩固练习
( )8.喝了汽水以后常常会打嗝。下列图示能正确解释这一现象的是:
B
巩固练习
( )9.如图为甲、乙两种固体物质在水中的溶解度曲线,下列说法错误的是:
A.甲物质的溶解度随温度的升高而增大
B.在t1 ℃时,甲、乙两种物质的溶解度相等
C.在t2 ℃时,N点表示甲物质的不饱和溶液
D.在t1 ℃时,100 g乙物质的饱和溶液中溶质的质量是25 g
D
巩固练习
10.如图是A、B、C三种物质的溶解度曲线,据图回答:
(1)t1℃时,A、B、C三种物质的溶解度由大到小的顺序是 。
(2)A、B、C三种物质的溶解度受温度影响较小的是 物质。
(3)t1 ℃时,30 g A物质加入到50 g水中,充分搅拌,所得溶液是 (填“饱和”或“不饱和”)溶液。
B>C>A
B
饱和
巩固练习
(4)欲将C物质的饱和溶液变成不饱和,下列方法正确的是 。
A.加一定量的水
B.加入少量C物质
C.降低温度
D.升高温度
巩固练习
AC
11、A、B、C三物质的溶解度曲线如图,回答下列问题:
(2)t2℃时,将等质量的A、B、C的饱和溶液分别降温到t2℃,析出晶体质量最多的是 ;没有晶体析出的是 。
(1)如图,20℃时,将25g物质A放入50g水中,得到溶液的质量为 g;
70
A
C
巩固练习
12、甲、乙两种物质的溶解度曲线如右图。
(2)40℃时,把40g甲物质放入100g水中,所得的溶液是 (选填“饱和”或“不饱和”);
(3)欲将40℃时乙物质的饱和溶液变为
不饱和溶液,可采用的方法是 ;
(4)40℃时,将甲、乙两物质的饱和溶液各100g,分别降温到20℃,所得甲物质溶液的质量 (选填“>”或“=”或“<”)乙物质溶液的质量。
(1)20℃时,甲物质的溶解度为 g;
40
不饱和
降低温度
<
巩固练习
13.下表是NaCl、NH4Cl在不同温度下的溶解度:
温度/℃ 0 20 40 60 80
溶解度/g NaCl 35.7 36.0 36.6 37.3 38.4
NH4Cl 29.4 37.2 45.8 55.2 65.6
(1)以上两种物质溶解度相等的温度范围是 ;
(2)20℃时,将40gNaCl加入到100g水中充分搅拌后,得到溶液的质量为 g;
(3)40℃时,要使接近饱和的NH4Cl溶液变为饱和溶液,下列方法中一定能达到目的的是 (填序号)
①升高温度 ②加溶质NH4Cl ③加水 ④恒温蒸发水
0 ℃ ~20 ℃
136
②④
巩固练习
本课题已学完,请及时巩固复习!
课题2 溶解度
人教版·九年级·下册
(第一课时)饱和溶液
【学习目标】
1、了解饱和溶液的含义;认识“饱和”和“不饱和”的相对性;
2、了解溶解度的含义;
3、初步学会绘制和查阅溶解度曲线。
4、知道溶解度的定义 及其与温度、压强的关系;
化学用语天天练
归纳金属的化学性质:
1、镁条燃烧:
2Mg + O2 2MgO
点燃
2、铁丝燃烧:
3Fe + 2O2 Fe3O4
点燃
3、铜片加热:
2Cu + O2 2CuO
△
4、铝被氧化:
3Al + 2O2 2Al2O3
一、金属可以和氧气反应:
化学用语天天练
二、金属可以和稀盐酸或稀硫酸反应:
1、镁与稀盐酸反应:
Mg+2HCl MgCl2+ H2↑
2、铁与稀盐酸反应:
3、锌与稀盐酸反应:
4、铝与稀盐酸反应:
Fe+2HCl FeCl2+ H2↑
Zn+2HCl ZnCl2+ H2↑
2Al+6HCl 2AlCl3+ 3H2↑
5、镁与稀硫酸反应:
6、铁与稀硫酸反应:
7、锌与稀硫酸反应:
8、铝与稀硫酸反应:
Mg+H2SO4 MgSO4+ H2↑
Fe+H2SO4 FeSO4+ H2↑
Zn+H2SO4 ZnSO4+ H2↑
2Al+3H2SO4 Al2(SO4)3+ 3H2↑
1、铁与硫酸铜溶液反应:
3、铜与硝酸银溶液反应:
Fe+CuSO4 FeSO4+ Cu
Cu+2AgNO3 Cu(NO3)2+ 2Ag
三、金属可以和盐溶液反应:
2、铁与氯化铜溶液反应:
Fe+CuCl2 FeCl2+ Cu
4、铝与硝酸银溶液反应:
Al+3AgNO3 Al(NO3)3+ 3Ag
【问题】一定量的水中,NaCl是否可以无限地溶解呢?
操作 加入5g 食盐搅拌 再加入5g食盐搅拌 再加入5mL水搅拌
现象
食盐完全溶解
食盐有少量剩余
剩余的食盐又溶解
【结论1】温度不变时,增加水(溶剂)的量,溶解的溶质质量也增多。
【活动探究1】在20mL水中溶解NaCl
操作 加入5g 硝酸钾搅拌 再加入5g 硝酸钾搅拌 加热
现象
硝酸钾
完全溶解
硝酸钾
有少量剩余
剩余的
硝酸钾又溶解
【活动探究2】在 20mL水中溶解硝酸钾
【结论2】溶剂量不变时,升高温度,物质在水中的溶解 能力增强。
【总结】溶剂中溶解溶质多少与 和 有关。
温度
溶剂的量
一、饱和溶液
2、不饱和溶液:在 下,在 里还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。
区分“饱和”与“不饱和”的可靠方法是:
。
一定温度
一定量溶剂
一定温度
一定量溶剂
在溶液中再加入该溶质,看是否还能继续溶解
1、饱和溶液:在 下,在 里不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液。
不饱和溶液
饱和溶液
增加溶质
增加溶剂
3、饱和溶液与不饱和溶液的相互转化
降低温度
蒸发溶剂
升高温度
【动脑筋1】
①20℃时,将33克食盐放入100克水中,食盐全部溶解,此时
溶 液质量为 克;
②再向此溶液加入3克食盐又恰好全 部溶解,则溶液中溶质为
克;
③若此时溶液恰好饱和,则饱和溶液的质量为 克;
④再向上述饱和溶液中加入3克食盐,溶液质量是 克。
133
36
136
136
【动脑筋2】实验测知:20℃时,100g水溶解31.6g硝酸钾就饱和了;80℃时,100g水溶解169g硝酸钾就饱和了。
(1)80℃时,向100g水加入160g硝酸钾,完全溶解后得到的是硝酸钾的 (填“饱和”、“不饱和”)溶液;
(2)将上述硝酸钾溶液从80℃冷却到20℃时,此时观察到的现象是 ;析出晶体的质量为 g;
(3)通过上述分析,你发现一条规律:
不饱和
有晶体析出
128.4
析出晶体前的溶液不一定是饱和溶液;
但析出晶体后的溶液一定是饱和溶液。
4、结晶:溶质从溶液中析出来的过程叫做结晶。
硝酸钾热浓溶液
硝酸钾晶体
A
B
(1)结晶的方法之一:降温结晶法;
上述过程中;A中 饱和;B中 饱和。
不一定
一定
海水
贮水池
蒸发池
结晶池
食盐
母液
氯化钠
多种化工原料
你知道海水晒盐的原理吗?
利用风力、阳光的作用蒸发水分,从而析出氯化钠晶体。
(2)结晶的方法之二:蒸发结晶法;
( )1.有关溶液的说法正确的是:
A.溶液都是无色的
B.稀溶液一定是不饱和溶液
C.固体溶解时都放出热量
D.溶液都是均一、稳定的混合物
D
( )2.在一定条件下,将5克食盐放进盛有10克水的烧杯中,充分溶解后,烧杯底部沉积有1.4克食盐,则此时溶液的质量为:
A.15克 B.16.4克
C.11.4克 D.13.6克
D
巩固练习
巩固练习
( )3.把不饱和溶液变成饱和溶液的最可靠的方法是:
A.降低温度 B.蒸发溶剂
C.加入溶质 D.升高温度
C
( )4.现有30 ℃的100 g某物质的饱和溶液,一定能使其变成不饱和溶液的方法是:
A.加入一定量的水 B.降低温度
C.恒温蒸发水分 D.升高温度,水的质量不变
A
( )5.从海水中提取食盐的流程如下,下列说法错误的是:
A.经过第①步操作,海水中的成分基本不变
B.蒸发池中,氯化钠溶液逐渐变浓
C.经过第③步的操作,进入结晶池后,继续蒸发水,
有④发生
D.析出食盐晶体后的母液是氯化钠的不饱和溶液
D
巩固练习
( )6.常温下,向一未知质量的硝酸钾溶液中加入少量硝酸钾晶体,经充分搅拌,发现有部分硝酸钾晶体溶解,则原溶液是:
A.饱和溶液 B.不饱和溶液
C.各部分的性质不同的液体 D.无法确定
B
( )7.室温时,向饱和的氯化钠溶液中加入少量的氯化钠固体,则:
①溶液质量增加 ②溶质质量增加 ③溶剂质量不变
④固体质量不变 ⑤固体质量减少
A.①② B.③④ C.①⑤ D.①②④
B
巩固练习
( )8.在一定温度下,将一瓶接近饱和的硝酸钾溶液转化成饱和溶液的方法是:
①升高温度 ②降低温度 ③增加溶质
④增加溶剂 ⑤蒸发溶剂
A.①②③ B.②③⑤
C.②③④ D.③④⑤
B
巩固练习
( )9.向一定量水中,逐渐加入KNO3固体,下列图像中符合溶液中溶质质量变化规律的是:
A
巩固练习
10.下列说法正确的,在( )中打“√”;错误的,在( )中打“×”。
(1)溶液的体积等于溶质的体积与溶剂的体积之和。( )
(2)饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液。( )
(3)饱和溶液析出晶体后,其溶液变为稀溶液。( )
(4)在温度相同的条件下,同一种物质的饱和溶液比不饱和溶液要浓一些。( )
×
×
×
√
巩固练习
课题2 溶解度
人教版·九年级·下册
(第二课时)溶解度
化学用语天天练
归纳金属的化学性质:
1、镁条燃烧:
2Mg + O2 2MgO
点燃
2、铁丝燃烧:
3Fe + 2O2 Fe3O4
点燃
3、铜片加热:
2Cu + O2 2CuO
△
4、铝被氧化:
3Al + 2O2 2Al2O3
一、金属可以和氧气反应:
化学用语天天练
二、金属可以和稀盐酸或稀硫酸反应:
1、镁与稀盐酸反应:
Mg+2HCl MgCl2+ H2↑
2、铁与稀盐酸反应:
3、锌与稀盐酸反应:
4、铝与稀盐酸反应:
Fe+2HCl FeCl2+ H2↑
Zn+2HCl ZnCl2+ H2↑
2Al+6HCl 2AlCl3+ 3H2↑
5、镁与稀硫酸反应:
6、铁与稀硫酸反应:
7、锌与稀硫酸反应:
8、铝与稀硫酸反应:
Mg+H2SO4 MgSO4+ H2↑
Fe+H2SO4 FeSO4+ H2↑
Zn+H2SO4 ZnSO4+ H2↑
2Al+3H2SO4 Al2(SO4)3+ 3H2↑
1、铁与硫酸铜溶液反应:
3、铜与硝酸银溶液反应:
Fe+CuSO4 FeSO4+ Cu
Cu+2AgNO3 Cu(NO3)2+ 2Ag
三、金属可以和盐溶液反应:
2、铁与氯化铜溶液反应:
Fe+CuCl2 FeCl2+ Cu
4、铝与硝酸银溶液反应:
Al+3AgNO3 Al(NO3)3+ 3Ag
【问题】我们已经知道,不同的物质在水中的溶解能力大小是不相同的。那么,用什么来比较物质溶解能力的大小呢?
二、溶解度
1、溶解度的定义:在一定温度下,某固体物质在100g水里达到饱和状态时所溶解的溶质质量。
①一定温度
溶解度四大要素
②100克水
③饱和状态
④溶质质量
① 20℃时,NaCl、KNO3的溶解度分别为36g、31.6g。
则在20℃时, 比 的溶解能力强。
② 在20℃时,100g水中溶解36g氯化钠达到饱和。
则在20℃时,氯化钠的溶解度为 。
NaCl
KNO3
36g
【讨论分析】
③ 60℃时,硝酸钾的溶解度是110克。则在60℃时,100g水里最多能溶解 硝酸钾。
④ 20℃时硝酸钾的溶解度是31.6g,填写下表:
温度 溶质的质量 溶剂的质量 溶液的质量
110g
20℃
31.6g
100g
131.6g
2、溶解度与溶解性的关系
【理解】20℃时氯化钠的溶解度是36g。则氯化钠属于
( )
A.易溶物质 B.可溶物质
C.微溶物质 D.难溶物质
溶解度(20℃)
A
3、表示溶解度的方法
溶解度是实验的方法测定出来的,表示方法如下:
温度/℃ 0 10 20 30 40 50 60
溶解度/g 35.7 35.8 36 36.3 36.5 37 37.3
(1)表格法
从上表中的数据可以发现:氯化钠的溶解度随温度的变化规律是 。
温度升高,NaCl溶解度逐渐增加
温度/℃ 0 10 20 30 40 50 60
溶解度/g 35.7 35.8 36 36.3 36.5 37 37.3
2、图像法
.
.
.
.
.
.
.
部分物质的溶解度曲线(20℃ )
溶解度曲线形象地体现了溶解度随温度变化而变化的规律。
①曲线中温度与溶解度成一一对应关系;
②两曲线交点表示两种物质在该温度时
溶解度相等;
③由曲线可比较同温度下物质溶解度的
大小;
④大多数物质溶解度随温度升高而增大;
少数物质溶解度随温度变化不大(NaCl);
极个别物质随温度升高而降低[Ca(OH)2]
【动脑筋】甲、乙、丙三物质溶解度曲线如图。
(1)溶解度随温度升高而减小的是 。
(2) ℃时,甲、乙溶解度相等;
丙
40
(3)30℃时,将10g丙物质放入50g水中,得到的溶液是
(填“饱和”或“不饱和”),溶液质量为 g。
饱和
55
(4)30℃时,三物质溶解度由大到小的顺序为 ;
(5)将等质量50℃的甲、乙、丙三物质的饱和溶液降温到10℃时,析出晶体最多的是 ,没有晶体析出的是 。
乙>甲>丙
甲
丙
降温结晶法
蒸发结晶法
结晶方法
【归纳总结】
可溶性的固体混合物可采用降温结晶的方法可以分离:
NaCl、KNO3混合溶液
适合于溶解度随温度变化不大的物质
适合于溶解度随温度变化较大的物质
较纯KNO3
加热浓缩
降温结晶
趁热过滤
3、气体物质的溶解度
【问题1】打开汽水盖时,汽水会自动喷出来,这说明气体在水中的溶解度与什么有关?
原因分析:温度升高,气体在水中的溶解度减小。
原因分析:压强减小,气体在水中的溶解度减小。
【问题2】喝了汽水后,常常会打嗝。这说明气体的溶解度还与什么有关?
(2)影响气体溶解度的因素:
(1)气体的溶解度:是指在压强为101kPa和一定温度时,气体溶解在1体积水里达饱和状态时的气体体积。
温度升高,气体在水中的溶解度减小。
压强增大,气体在水中的溶解度增大。
温度降低,气体在水中的溶解度增大。
压强减小,气体在水中的溶解度减小。
压强
温度
巩固练习
( )2.t ℃时,某物质的溶解度为10 g,则t ℃时该物质的饱和溶液中,溶质、溶剂、饱和溶液间的质量比为:
A.1∶9∶10 B.1∶10∶11
C.9∶1∶10 D.10∶1∶11
B
( )1.下列因素不可能影响固体物质溶解度的是:
A.水的质量 B.温度
C.溶质的性质 D.溶剂的性质
A
( )3.20 ℃时,氯化钠的溶解度为36 g。对这句话理解错误的是:
A.20 ℃时,100 g水中最多能溶解氯化钠36 g
B.20 ℃时,100 g氯化钠饱和溶液中含氯化钠36 g
C.20 ℃时,氯化钠饱和溶液中水与氯化钠的质量比
为100∶36
D.20 ℃时,将36 g氯化钠溶解于100 g水中,所得
溶液为该温度下氯化钠的饱和溶液
B
巩固练习
( )4.KNO3在20 ℃时的溶解度为31.6 g,现在把40 g KNO3放入100 g水中充分溶解,则此时KNO3溶液的质量为:
A.31.6 g B.140 g
C.131.6 g D.71.6 g
C
B
( )5.下列物质的溶解度,随温度升高而减少的是:
A.食盐 B.熟石灰
C.硝酸钠 D.硫酸铜
巩固练习
( )6、气体的溶解度与气体性质、溶剂有关,还与外界条件有关。“打开汽水瓶盖,汽水会自动喷出来”这种现象主要与下列外界条件中的哪一因素有关:
A.压强 B.温度 C.汽水瓶 D.光照
A
( )7.增大气体在水中的溶解度可采用的方法有:①增大压强,②减小压强,③升高温度,④降低温度。其中可行的是:
A.①③ B.②③ C.①④ D.②④
C
巩固练习
( )8.喝了汽水以后常常会打嗝。下列图示能正确解释这一现象的是:
B
巩固练习
( )9.如图为甲、乙两种固体物质在水中的溶解度曲线,下列说法错误的是:
A.甲物质的溶解度随温度的升高而增大
B.在t1 ℃时,甲、乙两种物质的溶解度相等
C.在t2 ℃时,N点表示甲物质的不饱和溶液
D.在t1 ℃时,100 g乙物质的饱和溶液中溶质的质量是25 g
D
巩固练习
10.如图是A、B、C三种物质的溶解度曲线,据图回答:
(1)t1℃时,A、B、C三种物质的溶解度由大到小的顺序是 。
(2)A、B、C三种物质的溶解度受温度影响较小的是 物质。
(3)t1 ℃时,30 g A物质加入到50 g水中,充分搅拌,所得溶液是 (填“饱和”或“不饱和”)溶液。
B>C>A
B
饱和
巩固练习
(4)欲将C物质的饱和溶液变成不饱和,下列方法正确的是 。
A.加一定量的水
B.加入少量C物质
C.降低温度
D.升高温度
巩固练习
AC
11、A、B、C三物质的溶解度曲线如图,回答下列问题:
(2)t2℃时,将等质量的A、B、C的饱和溶液分别降温到t2℃,析出晶体质量最多的是 ;没有晶体析出的是 。
(1)如图,20℃时,将25g物质A放入50g水中,得到溶液的质量为 g;
70
A
C
巩固练习
12、甲、乙两种物质的溶解度曲线如右图。
(2)40℃时,把40g甲物质放入100g水中,所得的溶液是 (选填“饱和”或“不饱和”);
(3)欲将40℃时乙物质的饱和溶液变为
不饱和溶液,可采用的方法是 ;
(4)40℃时,将甲、乙两物质的饱和溶液各100g,分别降温到20℃,所得甲物质溶液的质量 (选填“>”或“=”或“<”)乙物质溶液的质量。
(1)20℃时,甲物质的溶解度为 g;
40
不饱和
降低温度
<
巩固练习
13.下表是NaCl、NH4Cl在不同温度下的溶解度:
温度/℃ 0 20 40 60 80
溶解度/g NaCl 35.7 36.0 36.6 37.3 38.4
NH4Cl 29.4 37.2 45.8 55.2 65.6
(1)以上两种物质溶解度相等的温度范围是 ;
(2)20℃时,将40gNaCl加入到100g水中充分搅拌后,得到溶液的质量为 g;
(3)40℃时,要使接近饱和的NH4Cl溶液变为饱和溶液,下列方法中一定能达到目的的是 (填序号)
①升高温度 ②加溶质NH4Cl ③加水 ④恒温蒸发水
0 ℃ ~20 ℃
136
②④
巩固练习
本课题已学完,请及时巩固复习!
同课章节目录
