第九单元课题3溶液的浓度课件—2021-2022学年九年级化学人教版下册(共28张PPT)
文档属性
| 名称 | 第九单元课题3溶液的浓度课件—2021-2022学年九年级化学人教版下册(共28张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-06 23:28:58 | ||
图片预览








文档简介
(共28张PPT)
课题3 溶液的浓度
人教版·九年级·下册
【学习目标】
1、通过实验、观察现象以及思考问题得出一种表示溶液组成的方
法——溶质的质量分数。
2、能进行溶质质量分数的简单计算。
3、学会一定溶质质量分数的溶液的配制方法,在练习的过程中
了解溶液与生产、生活的广泛联系;
4、掌握溶液稀释的常用方法;
化学用语天天练
归纳金属的化学性质:
1、镁条燃烧:
2Mg + O2 2MgO
点燃
2、铁丝燃烧:
3Fe + 2O2 Fe3O4
点燃
3、铜片加热:
2Cu + O2 2CuO
△
4、铝被氧化:
3Al + 2O2 2Al2O3
一、金属可以和氧气反应:
化学用语天天练
二、金属可以和稀盐酸或稀硫酸反应:
1、镁与稀盐酸反应:
Mg+2HCl MgCl2+ H2↑
2、铁与稀盐酸反应:
3、锌与稀盐酸反应:
4、铝与稀盐酸反应:
Fe+2HCl FeCl2+ H2↑
Zn+2HCl ZnCl2+ H2↑
2Al+6HCl 2AlCl3+ 3H2↑
5、镁与稀硫酸反应:
6、铁与稀硫酸反应:
7、锌与稀硫酸反应:
8、铝与稀硫酸反应:
Mg+H2SO4 MgSO4+ H2↑
Fe+H2SO4 FeSO4+ H2↑
Zn+H2SO4 ZnSO4+ H2↑
2Al+3H2SO4 Al2(SO4)3+ 3H2↑
1、铁与硫酸铜溶液反应:
3、铜与硝酸银溶液反应:
Fe+CuSO4 FeSO4+ Cu
Cu+2AgNO3 Cu(NO3)2+ 2Ag
三、金属可以和盐溶液反应:
2、铁与氯化铜溶液反应:
Fe+CuCl2 FeCl2+ Cu
4、铝与硝酸银溶液反应:
Al+3AgNO3 Al(NO3)3+ 3Ag
我们已经知道溶液可以分为饱和溶液和不饱和溶液两大类,而生活中人们往往很少这样去描述某种溶液。你们知道人们通常是怎样描述溶液的吗?
浓溶液:含溶质多的溶液。
稀溶液:含溶质少的溶液。
溶液
【思考】浓溶液一定是饱和溶液吗?
稀溶液一定是不饱和溶液吗?
浓溶液、稀溶液只能粗略表示溶液的组成,那用什么方法能精确表示溶液的组成?
98%
0.9%
溶液的浓度
1.溶质质量分数:用溶质质量与溶液总质量之比来表示溶液浓度的一种方法。
一、溶质的质量分数
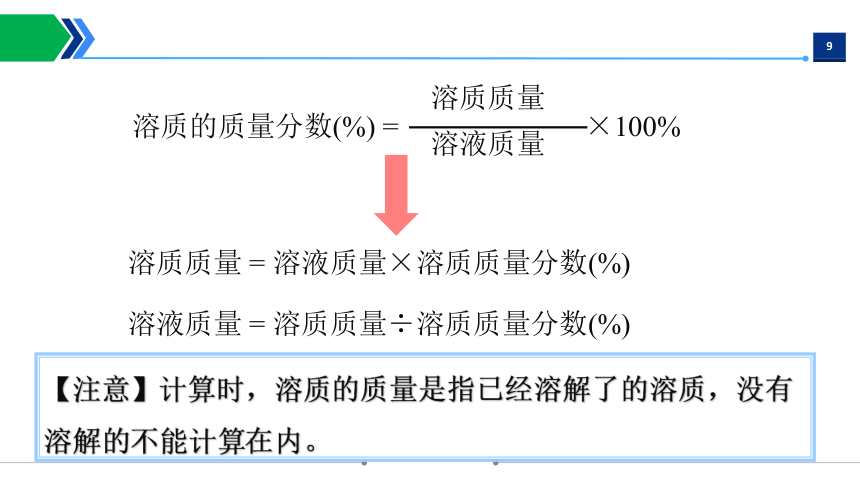
2.计算公式:
溶液质量 = 溶质质量 + 溶剂质量
溶质的质量分数(%) = ×100%
溶质质量
溶液质量
溶质质量 = 溶液质量×溶质质量分数(%)
溶质的质量分数(%) = ×100%
溶质质量
溶液质量
溶液质量 = 溶质质量÷溶质质量分数(%)
【注意】计算时,溶质的质量是指已经溶解了的溶质,没有溶解的不能计算在内。
二、溶液的稀释
1、溶液的稀释方法
加水
加稀溶液
2、稀释规律:
稀释前后溶液中溶质质量保持不变。
三、一定质量分数溶液的配制
【讨论】如何配制50g质量分数为6%的NaCl溶液?
① 计算:需NaCl g,水 mL;
② ; ③ ; ④ 。
称量
溶解
装瓶贴标签
3
47
( )1、20℃时,NaCl溶解于水的实验数据如下表。则下列叙述正确的是:
A.②中所得溶液是饱和溶液
B.20℃时10g水最多能溶解4g NaCl
C.③④溶液中溶质的质量分数相等
D.①所得溶液中溶质的质量分数为20%
C
序号 水的质量/g 加入NaCl质量/g 溶液质量/g
① 10 2 12
② 10 3 13
③ 10 4 13.6
④ 10 5 13.6
巩固练习
( )2、向l00g10%NaOH溶液中加入12.5gNaOH固体,完全溶解后,所得溶液中溶质的质量分数为:
A. 12. 5% B.20% C.22.5% D.25%
( )3、现有一杯20℃的KNO3饱和溶液,欲改变其溶质质量分数,下列方法可行的是:
A.加入一定质量的KNO3 B.升高温度到60℃
C.加入一定质量的水 D.恒温蒸发部分水
B
C
巩固练习
4、如图,计算所得溶液中溶质的质量分数。
NaCl% = ×100%
10g
10g+90g
解:
= 10%
答:溶液中NaCl质量分数为10%。
巩固练习
巩固练习
5、如图,计算所得溶液中溶质的质量分数。
NaCl% = ×100%
20g
20g+80g
解:
= 20%
答:溶液中NaCl质量分数为20%。
巩固练习
溶质NaCl的质量
= 200g×5%
= 10g
6、如图,这杯溶液中含有溶质NaCl的质量是多少呢?。
解:
答:溶液中NaCl质量为10g。
7、实验室要配制150kg16%的氯化钠溶液,需要氯化钠和水的质量是多少?
解:溶质的质量:
答:需要氯化钠是24kg和水的质量是126kg 。
m溶质 = m溶液·a% = 150kg×16% =24kg
溶剂水的质量:
m水 =150kg -24kg =126kg
巩固练习
8、蒸干15g NaCl溶液得到1.2g NaCl,计算原溶液中NaCl的质量分数。
解:
答:原溶液中NaCl的质量分数为8%
1.2g
15g
×100%
NaCl%=
=8%
巩固练习
9、现有12g硝酸钾,要配制成15%的硝酸钾溶液,需要水的质量为多少?
解:设需要水的质量为X
12g
12g+X
×
100%
=15%
解得:X = 68g
答:需要水的质量为68g。
巩固练习
10、要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?
50g98%
浓硫酸
xg水
g、20%
的硫酸溶液?
解:设稀释后溶液的质量为X
50g×98% = x ×20%
x = 245g
m水 = 245g - 50g = 195g
答:需要195克水。
巩固练习
100g10%
NaCl溶液
50g5%
NaCl溶液
g、 %
的NaCl溶液?
11、如图,混合后溶液中溶质质量分数为多少?
解:设混合后溶液中溶质质量分数为为x%
100g×10% + 50g×5% = (100g+50g)×x%
x = 245g
m水 = 245g - 50g = 195g
答:需要195克水。
巩固练习
12、实验室配制100g溶质的质量分数为5%的NaCl溶液,配制过程如下(所用NaCl中不含杂质)。
(1)配制的步骤有:①计算、 ② 、 ③溶解、
④装入细口瓶,贴上标签。
(2)配制过程中的错误是 。
称量
药品与砝码、瓶塞放反了
巩固练习
(3)配制时需要称取NaCl的质量为 g.,量取水的体积为
mL。在量取水时除上述图中仪器外,还应该增加的一种仪器是 。
(4)若配制的氯化钠溶液中溶质的质量分数小于5%,你估计原因可能是 。
5
95
胶头滴管
量取水时仰视读数
巩固练习
13、如图是a、b、c 三物质的溶解度曲线。回答下列问题:
(1)t1 ℃时,将25g a加入到50g水中,得到的溶液中溶质的质量分数为 ;
(2)t2 ℃时,等质量的a、b、c 三
物质的饱和溶液中所含溶剂的质量
由多到少的顺序为 ;
20%
c>b>a
巩固练习
t0
(3)将t2 ℃时等质量的a、b、c 三
物质的饱和溶液降温到t2 ℃,所得
溶液中溶质的质量分数中由大到小
的顺序为 ;
b>a>c
t0
巩固练习
14、现用25g含碳酸钙80%的大理石与100g稀盐酸反应制取二氧化碳,恰好完全反应。试计算:
(1)生成二氧化碳的质量是多少?
解:设生成CO2的质量为x
100
44
x
25g×80%
x= 8.8g
答:生成8.8克二氧化碳。
100
20g
=
44
x
巩固练习
6、现用25g含碳酸钙80%的大理石与100g稀盐酸反应制取二氧化碳,恰好完全反应。试计算:
(2)所用稀盐酸的溶质质量分数是多少?
解:设稀盐酸中HCl的质量为y
100
25g×80%
y=14.6g
答:稀盐酸溶质质量分数为14.6%。
73
y
100
73
20g
y
=
HCl%= ×100% = 14.6%
14.6g
100g
巩固练习
本课题已学完,请及时巩固复习!
课题3 溶液的浓度
人教版·九年级·下册
【学习目标】
1、通过实验、观察现象以及思考问题得出一种表示溶液组成的方
法——溶质的质量分数。
2、能进行溶质质量分数的简单计算。
3、学会一定溶质质量分数的溶液的配制方法,在练习的过程中
了解溶液与生产、生活的广泛联系;
4、掌握溶液稀释的常用方法;
化学用语天天练
归纳金属的化学性质:
1、镁条燃烧:
2Mg + O2 2MgO
点燃
2、铁丝燃烧:
3Fe + 2O2 Fe3O4
点燃
3、铜片加热:
2Cu + O2 2CuO
△
4、铝被氧化:
3Al + 2O2 2Al2O3
一、金属可以和氧气反应:
化学用语天天练
二、金属可以和稀盐酸或稀硫酸反应:
1、镁与稀盐酸反应:
Mg+2HCl MgCl2+ H2↑
2、铁与稀盐酸反应:
3、锌与稀盐酸反应:
4、铝与稀盐酸反应:
Fe+2HCl FeCl2+ H2↑
Zn+2HCl ZnCl2+ H2↑
2Al+6HCl 2AlCl3+ 3H2↑
5、镁与稀硫酸反应:
6、铁与稀硫酸反应:
7、锌与稀硫酸反应:
8、铝与稀硫酸反应:
Mg+H2SO4 MgSO4+ H2↑
Fe+H2SO4 FeSO4+ H2↑
Zn+H2SO4 ZnSO4+ H2↑
2Al+3H2SO4 Al2(SO4)3+ 3H2↑
1、铁与硫酸铜溶液反应:
3、铜与硝酸银溶液反应:
Fe+CuSO4 FeSO4+ Cu
Cu+2AgNO3 Cu(NO3)2+ 2Ag
三、金属可以和盐溶液反应:
2、铁与氯化铜溶液反应:
Fe+CuCl2 FeCl2+ Cu
4、铝与硝酸银溶液反应:
Al+3AgNO3 Al(NO3)3+ 3Ag
我们已经知道溶液可以分为饱和溶液和不饱和溶液两大类,而生活中人们往往很少这样去描述某种溶液。你们知道人们通常是怎样描述溶液的吗?
浓溶液:含溶质多的溶液。
稀溶液:含溶质少的溶液。
溶液
【思考】浓溶液一定是饱和溶液吗?
稀溶液一定是不饱和溶液吗?
浓溶液、稀溶液只能粗略表示溶液的组成,那用什么方法能精确表示溶液的组成?
98%
0.9%
溶液的浓度
1.溶质质量分数:用溶质质量与溶液总质量之比来表示溶液浓度的一种方法。
一、溶质的质量分数
2.计算公式:
溶液质量 = 溶质质量 + 溶剂质量
溶质的质量分数(%) = ×100%
溶质质量
溶液质量
溶质质量 = 溶液质量×溶质质量分数(%)
溶质的质量分数(%) = ×100%
溶质质量
溶液质量
溶液质量 = 溶质质量÷溶质质量分数(%)
【注意】计算时,溶质的质量是指已经溶解了的溶质,没有溶解的不能计算在内。
二、溶液的稀释
1、溶液的稀释方法
加水
加稀溶液
2、稀释规律:
稀释前后溶液中溶质质量保持不变。
三、一定质量分数溶液的配制
【讨论】如何配制50g质量分数为6%的NaCl溶液?
① 计算:需NaCl g,水 mL;
② ; ③ ; ④ 。
称量
溶解
装瓶贴标签
3
47
( )1、20℃时,NaCl溶解于水的实验数据如下表。则下列叙述正确的是:
A.②中所得溶液是饱和溶液
B.20℃时10g水最多能溶解4g NaCl
C.③④溶液中溶质的质量分数相等
D.①所得溶液中溶质的质量分数为20%
C
序号 水的质量/g 加入NaCl质量/g 溶液质量/g
① 10 2 12
② 10 3 13
③ 10 4 13.6
④ 10 5 13.6
巩固练习
( )2、向l00g10%NaOH溶液中加入12.5gNaOH固体,完全溶解后,所得溶液中溶质的质量分数为:
A. 12. 5% B.20% C.22.5% D.25%
( )3、现有一杯20℃的KNO3饱和溶液,欲改变其溶质质量分数,下列方法可行的是:
A.加入一定质量的KNO3 B.升高温度到60℃
C.加入一定质量的水 D.恒温蒸发部分水
B
C
巩固练习
4、如图,计算所得溶液中溶质的质量分数。
NaCl% = ×100%
10g
10g+90g
解:
= 10%
答:溶液中NaCl质量分数为10%。
巩固练习
巩固练习
5、如图,计算所得溶液中溶质的质量分数。
NaCl% = ×100%
20g
20g+80g
解:
= 20%
答:溶液中NaCl质量分数为20%。
巩固练习
溶质NaCl的质量
= 200g×5%
= 10g
6、如图,这杯溶液中含有溶质NaCl的质量是多少呢?。
解:
答:溶液中NaCl质量为10g。
7、实验室要配制150kg16%的氯化钠溶液,需要氯化钠和水的质量是多少?
解:溶质的质量:
答:需要氯化钠是24kg和水的质量是126kg 。
m溶质 = m溶液·a% = 150kg×16% =24kg
溶剂水的质量:
m水 =150kg -24kg =126kg
巩固练习
8、蒸干15g NaCl溶液得到1.2g NaCl,计算原溶液中NaCl的质量分数。
解:
答:原溶液中NaCl的质量分数为8%
1.2g
15g
×100%
NaCl%=
=8%
巩固练习
9、现有12g硝酸钾,要配制成15%的硝酸钾溶液,需要水的质量为多少?
解:设需要水的质量为X
12g
12g+X
×
100%
=15%
解得:X = 68g
答:需要水的质量为68g。
巩固练习
10、要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?
50g98%
浓硫酸
xg水
g、20%
的硫酸溶液?
解:设稀释后溶液的质量为X
50g×98% = x ×20%
x = 245g
m水 = 245g - 50g = 195g
答:需要195克水。
巩固练习
100g10%
NaCl溶液
50g5%
NaCl溶液
g、 %
的NaCl溶液?
11、如图,混合后溶液中溶质质量分数为多少?
解:设混合后溶液中溶质质量分数为为x%
100g×10% + 50g×5% = (100g+50g)×x%
x = 245g
m水 = 245g - 50g = 195g
答:需要195克水。
巩固练习
12、实验室配制100g溶质的质量分数为5%的NaCl溶液,配制过程如下(所用NaCl中不含杂质)。
(1)配制的步骤有:①计算、 ② 、 ③溶解、
④装入细口瓶,贴上标签。
(2)配制过程中的错误是 。
称量
药品与砝码、瓶塞放反了
巩固练习
(3)配制时需要称取NaCl的质量为 g.,量取水的体积为
mL。在量取水时除上述图中仪器外,还应该增加的一种仪器是 。
(4)若配制的氯化钠溶液中溶质的质量分数小于5%,你估计原因可能是 。
5
95
胶头滴管
量取水时仰视读数
巩固练习
13、如图是a、b、c 三物质的溶解度曲线。回答下列问题:
(1)t1 ℃时,将25g a加入到50g水中,得到的溶液中溶质的质量分数为 ;
(2)t2 ℃时,等质量的a、b、c 三
物质的饱和溶液中所含溶剂的质量
由多到少的顺序为 ;
20%
c>b>a
巩固练习
t0
(3)将t2 ℃时等质量的a、b、c 三
物质的饱和溶液降温到t2 ℃,所得
溶液中溶质的质量分数中由大到小
的顺序为 ;
b>a>c
t0
巩固练习
14、现用25g含碳酸钙80%的大理石与100g稀盐酸反应制取二氧化碳,恰好完全反应。试计算:
(1)生成二氧化碳的质量是多少?
解:设生成CO2的质量为x
100
44
x
25g×80%
x= 8.8g
答:生成8.8克二氧化碳。
100
20g
=
44
x
巩固练习
6、现用25g含碳酸钙80%的大理石与100g稀盐酸反应制取二氧化碳,恰好完全反应。试计算:
(2)所用稀盐酸的溶质质量分数是多少?
解:设稀盐酸中HCl的质量为y
100
25g×80%
y=14.6g
答:稀盐酸溶质质量分数为14.6%。
73
y
100
73
20g
y
=
HCl%= ×100% = 14.6%
14.6g
100g
巩固练习
本课题已学完,请及时巩固复习!
同课章节目录
