黑龙江省哈尔滨师范大学青冈实验中学校2021-2022学年高一下学期开学考试化学试题(Word版含答案)
文档属性
| 名称 | 黑龙江省哈尔滨师范大学青冈实验中学校2021-2022学年高一下学期开学考试化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-08 10:07:53 | ||
图片预览


文档简介
哈师大青冈实验中学2022年上学期高一化学开学考试卷
相对原子质量: H-1 C-12 N-14 O-16 F-19 Na-23 Mg-24
Al-27 S-32 Cl-35.5 Cu-64 Zn-65 Ag-108 Ba-137
第Ⅰ卷
一.选择题 (1-16题,每题3分,共48分)
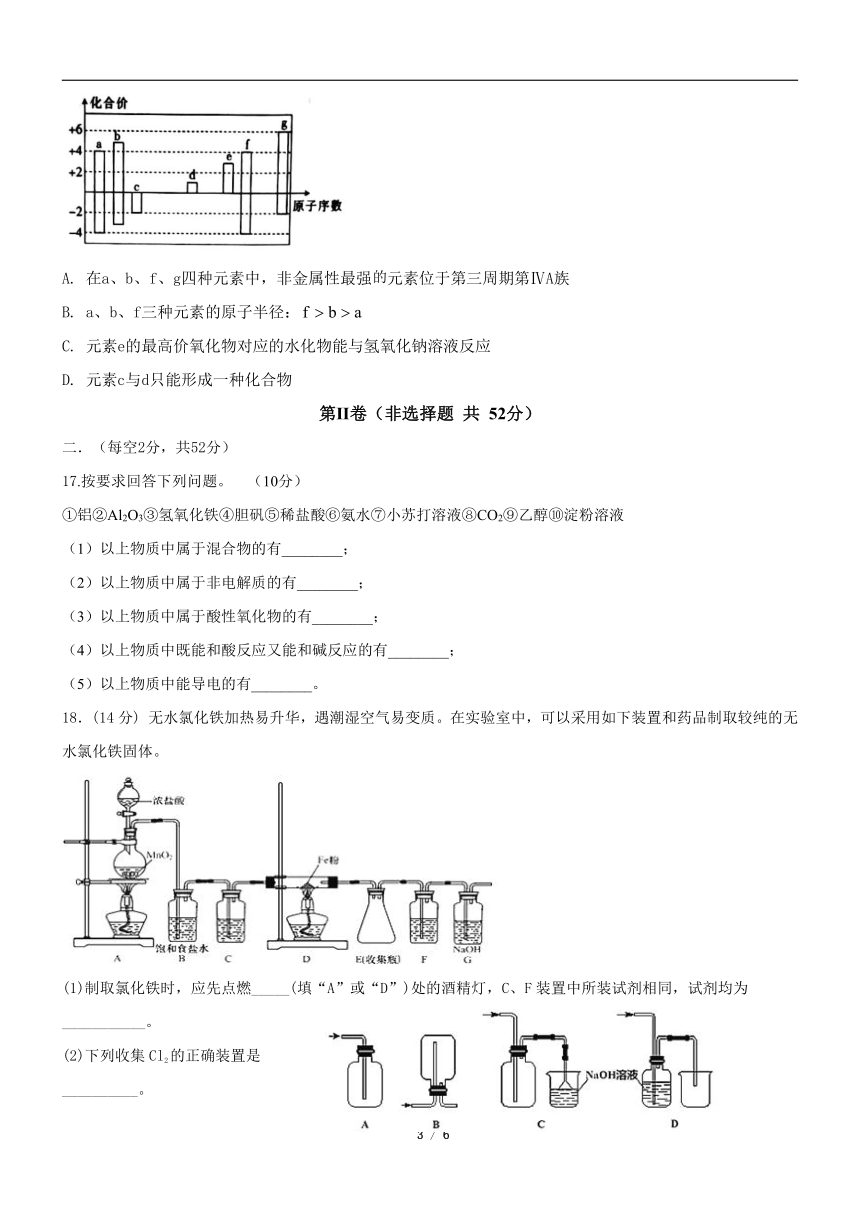
1.我国成功研制的铯(133Cs)原子钟,使我国的时间频率基准的精度从30万年不差1秒提高到600万年不差1秒。已知该铯原子的核外电子数为55,则该原子的中子数和质子数之差为( )
A.23 B.55 C.78 D.133
2.下列属于酸性氧化物的是( )
A.CO2 B.CaO C.K2SO4 D.NaOH
3. 当光束通过下列物质时,不会出现丁达尔效应的是( )
①氢氧化铁胶体 ②水 ③有尘埃的空气 ④蔗糖溶液 ⑤硫酸铜溶液
A.①②④ B.①③⑤ C.①③④ D.②④⑤
4.将一定量的CO2通入下列溶液,一定不会产生沉淀的是 ( )
A.澄清石灰水 B.饱和碳酸钠溶液 C.CaCl2溶液 D.漂白粉溶液
5. 下列离子方程式正确的是( )
A. 向FeCl3溶液中加入过量铁粉:Fe3++Fe═2Fe2+
B.碳酸钙溶于醋酸:
向稀硫酸中加入Ba(OH)2 溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O
次氯酸钙溶液敞口放置在空气中:Ca2++2ClO-+CO2+H2O=2HClO+CaCO3↓
6. RO3n-中共有x个电子,R原子的质量数为M,则R原子核内含有的中子数是( )
A.M-x+n+48 B.M-x+n+24 C.M-x-n-24 D.M+x-n-24
7. 在一密闭容器中盛有0.8molNa2O2与1molNaHCO3,将其加热到300℃,经充分反应后,容器内残留固体是
A. 0.5molNa2CO3和1molNaOH B. 1molNa2CO3和0.6molNaOH
C. 0.8molNa2CO3和1molNaOH D. 只有1molNa2CO3
8. 下列说法不正确的是( )
A.定容时,因不慎使液面高于容量瓶的刻度线,应重新配制
B.焰色反应时,先用稀硫酸洗涤铂丝并在酒精灯火焰上灼烧,然后再进行实验
C.将新制氯水滴入紫色石蕊溶液中,可以看到石蕊溶液先变红后褪色
D.Al(OH)3具有碱性,可用于治疗胃酸过多
9、下列实验方法不能鉴别和的是:
A.分别与相同浓度的盐酸反应看反应剧烈程度
B.分别配成溶液,分别逐滴加入相同浓度的稀盐酸观察现象
C.分别配成溶液,加入澄清石灰水观察现象
D.分别装入试管中加热,并将逸出的气体通入澄清石灰水观察现象
10、下列混合物分离(或除杂)的方法正确的是:
A.除去Mg粉中的Al粉:加入足量NaOH溶液后,过滤、洗涤
B.除去BaCO3固体中混有的BaSO4:加入过量盐酸后,过滤、洗涤
C.除去NaHCO3溶液中的Na2CO3:加入适量稀盐酸
D.除去Al2O3中的少量Fe2O3:加入过量氢氧化钠溶液,过滤、洗涤
11、氟、氯、溴、碘四种元素,下列有关它们的性质递变规律的说法不正确的是:
A.单质的密度依次增大 B.单质的熔点和沸点依次升高
C.Cl2可以从KI溶液中置换出I2 D.F2可以从NaCl溶液中置换出Cl2
12、下列叙述中不正确的是:
A.原子半径:Na>Si>Cl B.酸性:H3PO4<H2SO4<HClO4
C.金属性:Na>Mg>Al D.稳定性:HCl<H2S<SiH4
13、NA代表阿伏加德罗常数的值。下列说法中,错误的是:
A. 28gN2含分子数目为NA
B. 1L 0.1 mol/L KCl溶液中,含K+的数目为0.1 NA
C. 标准状况下,11.2LH2O 含有的原子数目为1.5 NA
D.7.8 g 与足量完全反应,转移电子数为
14.工业上制取的化学反应为,下列说法正确的是( )
A.在反应中被氧化 B.氯原子在反应中失去电子
C.是氧化剂 D.是氧化产物
15.在无色、强碱性溶液中能大量共存的一组离子是( )
A.、、、 B.、、、
C.、、、 D.、、、
16. 随着原子序数的递增,a~g七种短周期元素的最高正价或最低负价与原子序数的关系如图所示。下列说法中正确的是
A. 在a、b、f、g四种元素中,非金属性最强元素位于第三周期第ⅣA族
B. a、b、f三种元素的原子半径:
C. 元素e的最高价氧化物对应的水化物能与氢氧化钠溶液反应
D. 元素c与d只能形成一种化合物
第Ⅱ卷(非选择题 共 52分)
二.(每空2分,共52分)
17.按要求回答下列问题。 (10分)
①铝②Al2O3③氢氧化铁④胆矾⑤稀盐酸⑥氨水⑦小苏打溶液⑧CO2⑨乙醇⑩淀粉溶液
(1)以上物质中属于混合物的有________;
(2)以上物质中属于非电解质的有________;
(3)以上物质中属于酸性氧化物的有________;
(4)以上物质中既能和酸反应又能和碱反应的有________;
(5)以上物质中能导电的有________。
18.(14分) 无水氯化铁加热易升华,遇潮湿空气易变质。在实验室中,可以采用如下装置和药品制取较纯的无水氯化铁固体。
(1)制取氯化铁时,应先点燃_____(填“A”或“D”)处的酒精灯,C、F装置中所装试剂相同,试剂均为___________。
(2)下列收集Cl2的正确装置是__________。
(3)G装置中反应的离子方程式为________________________________。
(4)反应后装置D中残余的固体混合物溶于稀盐酸,滴加几滴KSCN溶液。若溶液变血红色,推断固体物质的成分为___________(选填序号,下同);写出溶液变血红色的离子方程式:_____________,若溶液未变血红色,推断固体物质的成分为_____________。
A. 只有FeCl3 B.只有Fe C.一定有FeCl3 D.一定有Fe
19.(14分分)A、X、W、D、E为短周期主族元素,且原子序数依次增大。A、D同主族,X、W同周期, X形成的气态氢化物化学式为XH3,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为________。W的原子结构示意图为________。
(2)D单质在空气中燃烧的化学方程式是 。
(3)D、E的最高价氧化物的水化物反应的离子方程式是 。
(4)离子半径关系:r(A-) r(Li+)(填“>”、“=”或“<”)
(5)下列事实能说明W元素的非金属性比硫元素的非金属性强的是________(填字母)。
A.W单质与H2S溶液反应,溶液变浑浊
B.在氧化还原反应中,1 mol W单质比1 mol S得电子多
C.W和S两元素的简单氢化物受热分解,前者的分解温度高
(6)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现在改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式____________________________。
20.(14分) 一场突如其来的新冠肺炎疫情,给人们的生活带来了巨大的冲击,在疫情期间外出需戴好口罩,返家后立即杀菌消毒。含氯消毒剂在日常生产生活中有着广泛的用途。
(1)实验室除了可以用和浓盐酸制氯气外,还可以利用如下反应制取氯气:。若要制取标准状况下3.36L氯气,则发生反应HCl的质量为_______g,其中被氧化的HCl的物质的量为_______mol,反应过程中转移的电子数为_______。
(2)“84”消毒液(有效成分为NaClO)在抗击新冠肺炎疫情战役中发挥了重要的作用。常温下,可利用氯气与烧碱溶液反应制得“84”消毒液,在使用前将“84”消毒液的稀释液放置在空气中一段时间,其漂白效果更好,原因为_______(用离子方程式表示,已知通常情况下,弱酸不能制强酸,酸性:)。
(3)二氧化氯()是一种黄绿色的气体。可用作饮用水的消毒杀菌处理剂,是国际上公认的安全、低毒的绿色消毒剂。实验室可用和浓盐酸在一定温度下反应制得:。
①该反应的氧化产物为_______ (填化学式)。
②在该反应中浓盐酸表现出来性质是_______(填标号)。
A.还原性 B.氧化性 C.酸性
③、、(还原产物为)、等物质常被用作消毒剂。等物质的量的上述物质消毒的效率(以1mol物质的得电子数来衡量)最高的是_______(填标号)。
A. B. C. D.
(
6
)
2 / 2
相对原子质量: H-1 C-12 N-14 O-16 F-19 Na-23 Mg-24
Al-27 S-32 Cl-35.5 Cu-64 Zn-65 Ag-108 Ba-137
第Ⅰ卷
一.选择题 (1-16题,每题3分,共48分)
1.我国成功研制的铯(133Cs)原子钟,使我国的时间频率基准的精度从30万年不差1秒提高到600万年不差1秒。已知该铯原子的核外电子数为55,则该原子的中子数和质子数之差为( )
A.23 B.55 C.78 D.133
2.下列属于酸性氧化物的是( )
A.CO2 B.CaO C.K2SO4 D.NaOH
3. 当光束通过下列物质时,不会出现丁达尔效应的是( )
①氢氧化铁胶体 ②水 ③有尘埃的空气 ④蔗糖溶液 ⑤硫酸铜溶液
A.①②④ B.①③⑤ C.①③④ D.②④⑤
4.将一定量的CO2通入下列溶液,一定不会产生沉淀的是 ( )
A.澄清石灰水 B.饱和碳酸钠溶液 C.CaCl2溶液 D.漂白粉溶液
5. 下列离子方程式正确的是( )
A. 向FeCl3溶液中加入过量铁粉:Fe3++Fe═2Fe2+
B.碳酸钙溶于醋酸:
向稀硫酸中加入Ba(OH)2 溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O
次氯酸钙溶液敞口放置在空气中:Ca2++2ClO-+CO2+H2O=2HClO+CaCO3↓
6. RO3n-中共有x个电子,R原子的质量数为M,则R原子核内含有的中子数是( )
A.M-x+n+48 B.M-x+n+24 C.M-x-n-24 D.M+x-n-24
7. 在一密闭容器中盛有0.8molNa2O2与1molNaHCO3,将其加热到300℃,经充分反应后,容器内残留固体是
A. 0.5molNa2CO3和1molNaOH B. 1molNa2CO3和0.6molNaOH
C. 0.8molNa2CO3和1molNaOH D. 只有1molNa2CO3
8. 下列说法不正确的是( )
A.定容时,因不慎使液面高于容量瓶的刻度线,应重新配制
B.焰色反应时,先用稀硫酸洗涤铂丝并在酒精灯火焰上灼烧,然后再进行实验
C.将新制氯水滴入紫色石蕊溶液中,可以看到石蕊溶液先变红后褪色
D.Al(OH)3具有碱性,可用于治疗胃酸过多
9、下列实验方法不能鉴别和的是:
A.分别与相同浓度的盐酸反应看反应剧烈程度
B.分别配成溶液,分别逐滴加入相同浓度的稀盐酸观察现象
C.分别配成溶液,加入澄清石灰水观察现象
D.分别装入试管中加热,并将逸出的气体通入澄清石灰水观察现象
10、下列混合物分离(或除杂)的方法正确的是:
A.除去Mg粉中的Al粉:加入足量NaOH溶液后,过滤、洗涤
B.除去BaCO3固体中混有的BaSO4:加入过量盐酸后,过滤、洗涤
C.除去NaHCO3溶液中的Na2CO3:加入适量稀盐酸
D.除去Al2O3中的少量Fe2O3:加入过量氢氧化钠溶液,过滤、洗涤
11、氟、氯、溴、碘四种元素,下列有关它们的性质递变规律的说法不正确的是:
A.单质的密度依次增大 B.单质的熔点和沸点依次升高
C.Cl2可以从KI溶液中置换出I2 D.F2可以从NaCl溶液中置换出Cl2
12、下列叙述中不正确的是:
A.原子半径:Na>Si>Cl B.酸性:H3PO4<H2SO4<HClO4
C.金属性:Na>Mg>Al D.稳定性:HCl<H2S<SiH4
13、NA代表阿伏加德罗常数的值。下列说法中,错误的是:
A. 28gN2含分子数目为NA
B. 1L 0.1 mol/L KCl溶液中,含K+的数目为0.1 NA
C. 标准状况下,11.2LH2O 含有的原子数目为1.5 NA
D.7.8 g 与足量完全反应,转移电子数为
14.工业上制取的化学反应为,下列说法正确的是( )
A.在反应中被氧化 B.氯原子在反应中失去电子
C.是氧化剂 D.是氧化产物
15.在无色、强碱性溶液中能大量共存的一组离子是( )
A.、、、 B.、、、
C.、、、 D.、、、
16. 随着原子序数的递增,a~g七种短周期元素的最高正价或最低负价与原子序数的关系如图所示。下列说法中正确的是
A. 在a、b、f、g四种元素中,非金属性最强元素位于第三周期第ⅣA族
B. a、b、f三种元素的原子半径:
C. 元素e的最高价氧化物对应的水化物能与氢氧化钠溶液反应
D. 元素c与d只能形成一种化合物
第Ⅱ卷(非选择题 共 52分)
二.(每空2分,共52分)
17.按要求回答下列问题。 (10分)
①铝②Al2O3③氢氧化铁④胆矾⑤稀盐酸⑥氨水⑦小苏打溶液⑧CO2⑨乙醇⑩淀粉溶液
(1)以上物质中属于混合物的有________;
(2)以上物质中属于非电解质的有________;
(3)以上物质中属于酸性氧化物的有________;
(4)以上物质中既能和酸反应又能和碱反应的有________;
(5)以上物质中能导电的有________。
18.(14分) 无水氯化铁加热易升华,遇潮湿空气易变质。在实验室中,可以采用如下装置和药品制取较纯的无水氯化铁固体。
(1)制取氯化铁时,应先点燃_____(填“A”或“D”)处的酒精灯,C、F装置中所装试剂相同,试剂均为___________。
(2)下列收集Cl2的正确装置是__________。
(3)G装置中反应的离子方程式为________________________________。
(4)反应后装置D中残余的固体混合物溶于稀盐酸,滴加几滴KSCN溶液。若溶液变血红色,推断固体物质的成分为___________(选填序号,下同);写出溶液变血红色的离子方程式:_____________,若溶液未变血红色,推断固体物质的成分为_____________。
A. 只有FeCl3 B.只有Fe C.一定有FeCl3 D.一定有Fe
19.(14分分)A、X、W、D、E为短周期主族元素,且原子序数依次增大。A、D同主族,X、W同周期, X形成的气态氢化物化学式为XH3,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为________。W的原子结构示意图为________。
(2)D单质在空气中燃烧的化学方程式是 。
(3)D、E的最高价氧化物的水化物反应的离子方程式是 。
(4)离子半径关系:r(A-) r(Li+)(填“>”、“=”或“<”)
(5)下列事实能说明W元素的非金属性比硫元素的非金属性强的是________(填字母)。
A.W单质与H2S溶液反应,溶液变浑浊
B.在氧化还原反应中,1 mol W单质比1 mol S得电子多
C.W和S两元素的简单氢化物受热分解,前者的分解温度高
(6)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现在改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式____________________________。
20.(14分) 一场突如其来的新冠肺炎疫情,给人们的生活带来了巨大的冲击,在疫情期间外出需戴好口罩,返家后立即杀菌消毒。含氯消毒剂在日常生产生活中有着广泛的用途。
(1)实验室除了可以用和浓盐酸制氯气外,还可以利用如下反应制取氯气:。若要制取标准状况下3.36L氯气,则发生反应HCl的质量为_______g,其中被氧化的HCl的物质的量为_______mol,反应过程中转移的电子数为_______。
(2)“84”消毒液(有效成分为NaClO)在抗击新冠肺炎疫情战役中发挥了重要的作用。常温下,可利用氯气与烧碱溶液反应制得“84”消毒液,在使用前将“84”消毒液的稀释液放置在空气中一段时间,其漂白效果更好,原因为_______(用离子方程式表示,已知通常情况下,弱酸不能制强酸,酸性:)。
(3)二氧化氯()是一种黄绿色的气体。可用作饮用水的消毒杀菌处理剂,是国际上公认的安全、低毒的绿色消毒剂。实验室可用和浓盐酸在一定温度下反应制得:。
①该反应的氧化产物为_______ (填化学式)。
②在该反应中浓盐酸表现出来性质是_______(填标号)。
A.还原性 B.氧化性 C.酸性
③、、(还原产物为)、等物质常被用作消毒剂。等物质的量的上述物质消毒的效率(以1mol物质的得电子数来衡量)最高的是_______(填标号)。
A. B. C. D.
(
6
)
2 / 2
同课章节目录
