第八章常见的酸碱盐练习-2021—2022学年九年级化学科粤版(2012)下册(word版 含答案)
文档属性
| 名称 | 第八章常见的酸碱盐练习-2021—2022学年九年级化学科粤版(2012)下册(word版 含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 148.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-07 00:00:00 | ||
图片预览


文档简介
第八章 常见的酸碱盐 练习
一、单选题
1.下列物质加入水中,所得溶液pH可能为10的是
A.氢氧化钡 B.醋酸 C.硫酸钾 D.食盐
2.掌握分类的方法对于化学学习非常重要,以下物质分类错误的是
A.稀有气体:氖气 B.氧化物:二氧化硫、甲烷
C.单质:金刚石 D.酸:碳酸、硫酸
3.除去下列物质中混有的少量杂质(括号内为杂质),拟定的实验方案不可行的是
A.N2气体(O2)——通过灼热的铜网
B.木炭粉(CuO)——在空气中灼烧
C.KCl固体(MnO2)——加入足量的水溶解,过滤,蒸发结晶
D.CO(CO2)——通过足量的澄清石灰水
4.我们学习了一些物质,并能进行简单地分类。下列各组内物质表示同一种物质的是
A.氢氧化钠、烧碱 B.氢氧化钙、生石灰
C.紫铜、黄铜 D.干冰、水
5.今年秋粮又获丰收,再显中国饭碗自信,其中化肥和农药功不可没。下列说法错误的是
A.Ca3(PO4)2可以促进作物生长,增强作物的抗寒、抗旱能力
B.硝酸钾属于钾肥
C.含氮量为40%的尿素【CO(NH2)2】化肥样品为混合物
D.大量施用化肥和农药会造成环境污染
6.除去下列物质(括号内为杂质)中少量杂质的方法正确的是
A.CaCl2溶液(稀盐酸) 加过量CaCO3粉末,过滤
B.CO2(CO) 通入氧气点燃
C.Cu(C) 在空气中灼烧
D.CuSO4溶液(FeSO4) 加足量锌粉,过滤
7.分类法是化学学习的常用方法,下列分类正确的是
A.碱:烧碱、生石灰、消石灰 B.混合物:空气、粗盐、海水
C.合金:生铁、黄铜、赤铁矿 D.盐:纯碱、酒精、硫酸铜
8.下列关于实验现象的描述,正确的是
A.铁丝在空气中剧烈燃烧,火星四射,放出热量,生成黑色固体
B.硫在氧气中燃烧,发出明亮的蓝紫色火焰,生成有刺激性气味的气体
C.木炭在氧气中燃烧,发出白光,生成二氧化碳气体
D.打开浓盐酸的瓶盖,有大量白烟产生
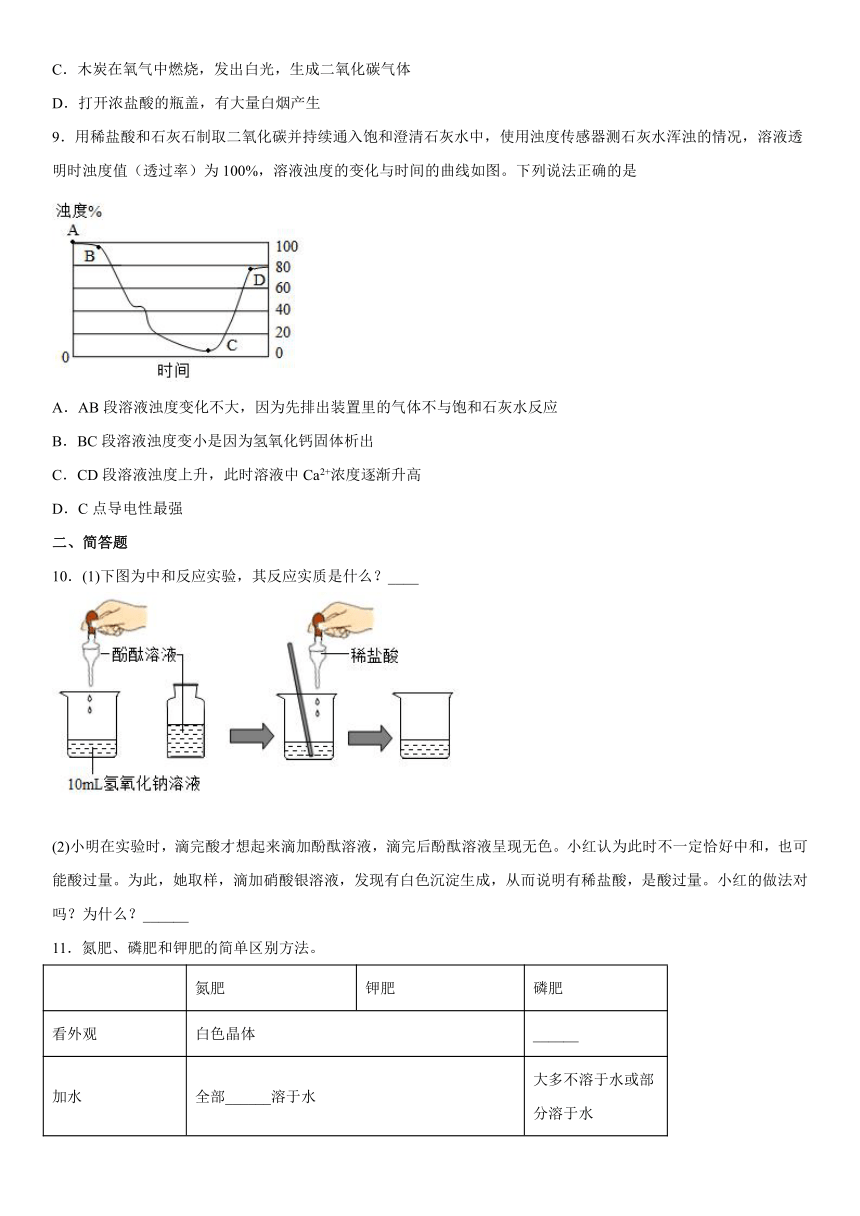
9.用稀盐酸和石灰石制取二氧化碳并持续通入饱和澄清石灰水中,使用浊度传感器测石灰水浑浊的情况,溶液透明时浊度值(透过率)为100%,溶液浊度的变化与时间的曲线如图。下列说法正确的是
A.AB段溶液浊度变化不大,因为先排出装置里的气体不与饱和石灰水反应
B.BC段溶液浊度变小是因为氢氧化钙固体析出
C.CD段溶液浊度上升,此时溶液中Ca2+浓度逐渐升高
D.C点导电性最强
二、简答题
10.(1)下图为中和反应实验,其反应实质是什么?____
(2)小明在实验时,滴完酸才想起来滴加酚酞溶液,滴完后酚酞溶液呈现无色。小红认为此时不一定恰好中和,也可能酸过量。为此,她取样,滴加硝酸银溶液,发现有白色沉淀生成,从而说明有稀盐酸,是酸过量。小红的做法对吗?为什么?______
11.氮肥、磷肥和钾肥的简单区别方法。
氮肥 钾肥 磷肥
看外观 白色晶体 ______
加水 全部______溶于水 大多不溶于水或部分溶于水
加熟石灰研磨 有______气味的______放出 无______气味的______放出
归纳:(1)可以用______区别氮肥和钾肥,______是氮肥(铵态氮肥)。
(2)施肥时铵态氮肥______(填“能”或“不能”)与碱性肥料(如草木灰)混合使用。
(3)区别物质的一般方法是先______方法,再是______方法。
氮肥中氨水是液体,碳酸氢铵有强烈氨味,据此可直接将它们与其他氮肥相区别。
【巧学妙记】化肥的简易鉴别:“一看、二闻、三溶、四加碱。”
三、推断题
12.宇轩同学在厨房里取得一种白色粉末A,到化学实验室进行探究,结果如图:
请回答下列问题:
(1)若A不含氢元素,则A与澄清石灰水反应的化学方程式为_______,其反应的基本类型是_______。
(2)若A含有氢元素,则它与盐酸反应的化学方程式为_______。
(3)B溶液中含有的微粒为_______。(用化学用语填空)
13.A、B、C、D、E分别为1~18号元素中的一种,且原子序数依次增大。A、C元素组成的化合物常温时为液态,且是最常用的溶剂;B元素组成的一种单质可用于净水;D元素原子核内有11个质子;E元素的原子易得到一个电子形成稳定结构。
(1)五种元素之间的最本质区别是_____________。
(2)画出E元素的原子结构示意图___________。
(3)由A、B、C、D四种元素组成的化合物的俗称是_____________。
14.下图是六种物质之间的转化关系。用“—”表示两种物质之间能发生反应,用“→”表示一种物质可以转化为另一种物质。其中A含两种元素并且与氢氧化钠溶液反应无现象,B为纯净物且为白色固体,C与D反应生成一种不溶于硝酸的白色沉淀。试回答下列问题:
(1)足量的A与B反应的现象是______。
(2)C与二氧化碳反应的化学方程式为______。
(3)在图中写出A、B、C、D四种物质(或溶质)的化学式。
15.A、B、C、D、E、F、G是常见物质,B是一种气体单质,E是红色的固体单质,D是浅绿色溶液,G是蓝色溶液,它们可以发生如下转化关系:
(1)推出下列物质的化学式:A______。B______。D______。G______。
(2)写出下列转化的化学方程式:E→F:______;F转化为G的反应______置换反应(填“是”、“不一定是”或“不是”)。
四、实验题
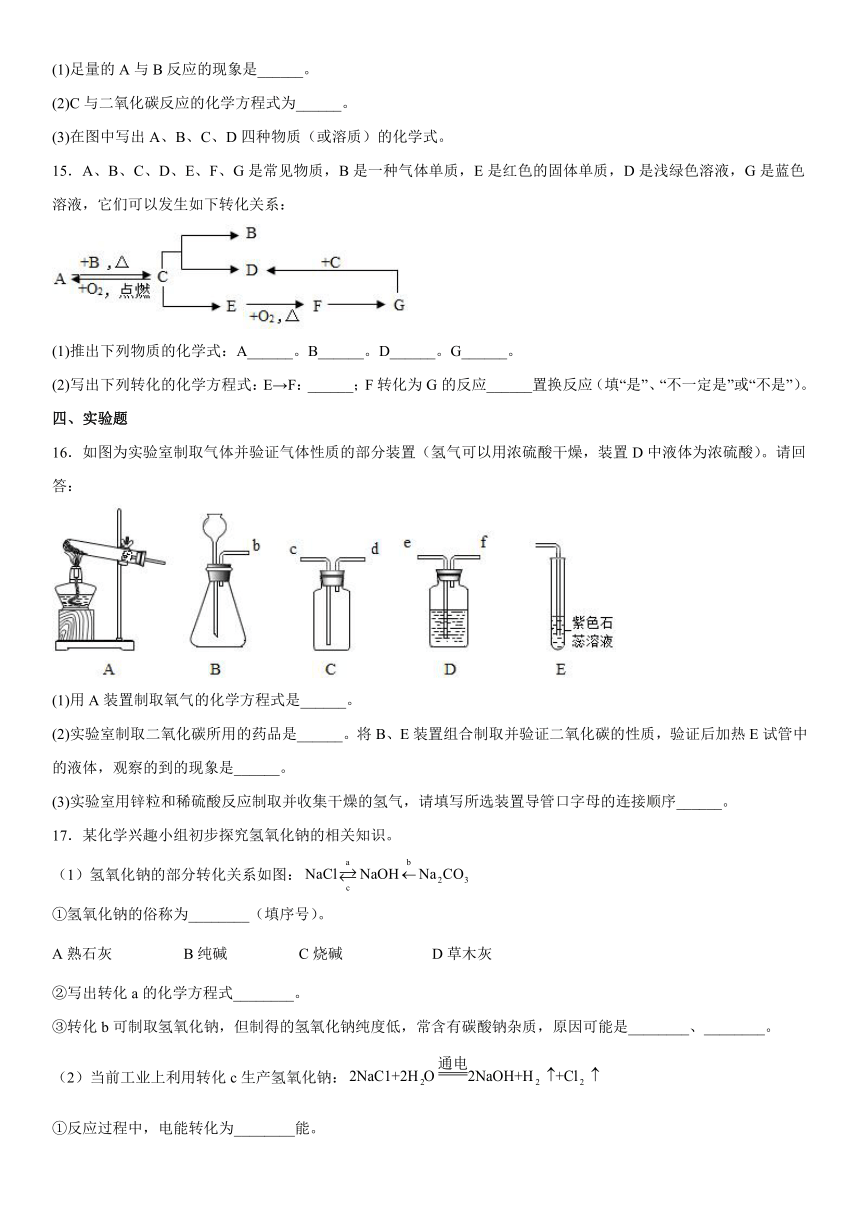
16.如图为实验室制取气体并验证气体性质的部分装置(氢气可以用浓硫酸干燥,装置D中液体为浓硫酸)。请回答:
(1)用A装置制取氧气的化学方程式是______。
(2)实验室制取二氧化碳所用的药品是______。将B、E装置组合制取并验证二氧化碳的性质,验证后加热E试管中的液体,观察的到的现象是______。
(3)实验室用锌粒和稀硫酸反应制取并收集干燥的氢气,请填写所选装置导管口字母的连接顺序______。
17.某化学兴趣小组初步探究氢氧化钠的相关知识。
(1)氢氧化钠的部分转化关系如图:
①氢氧化钠的俗称为________(填序号)。
A熟石灰 B纯碱 C烧碱 D草木灰
②写出转化a的化学方程式________。
③转化b可制取氢氧化钠,但制得的氢氧化钠纯度低,常含有碳酸钠杂质,原因可能是________、________。
(2)当前工业上利用转化c生产氢氧化钠:
①反应过程中,电能转化为________能。
②某化工厂计划生产16t氢氧化钠,理论上需要氯化钠的质量是________ t。
(3)某氢氧化钠样品中含有氯化钠杂质,为测定氢氧化钠的纯度,同学们设计了如下方案。
方案一、称取mg氢氧化钠样品测定消耗稀盐酸的质量,
方案二、称取mg氢氧化钠样品测得生成沉淀的质量
请回答:
①方案一中,为证明氢氧化钠与稀盐酸恰好完全反应,应向样品溶液中________,根据溶液颜色变化判断。
②方案二中,判断CuSO4溶液过量的化学方法是________。
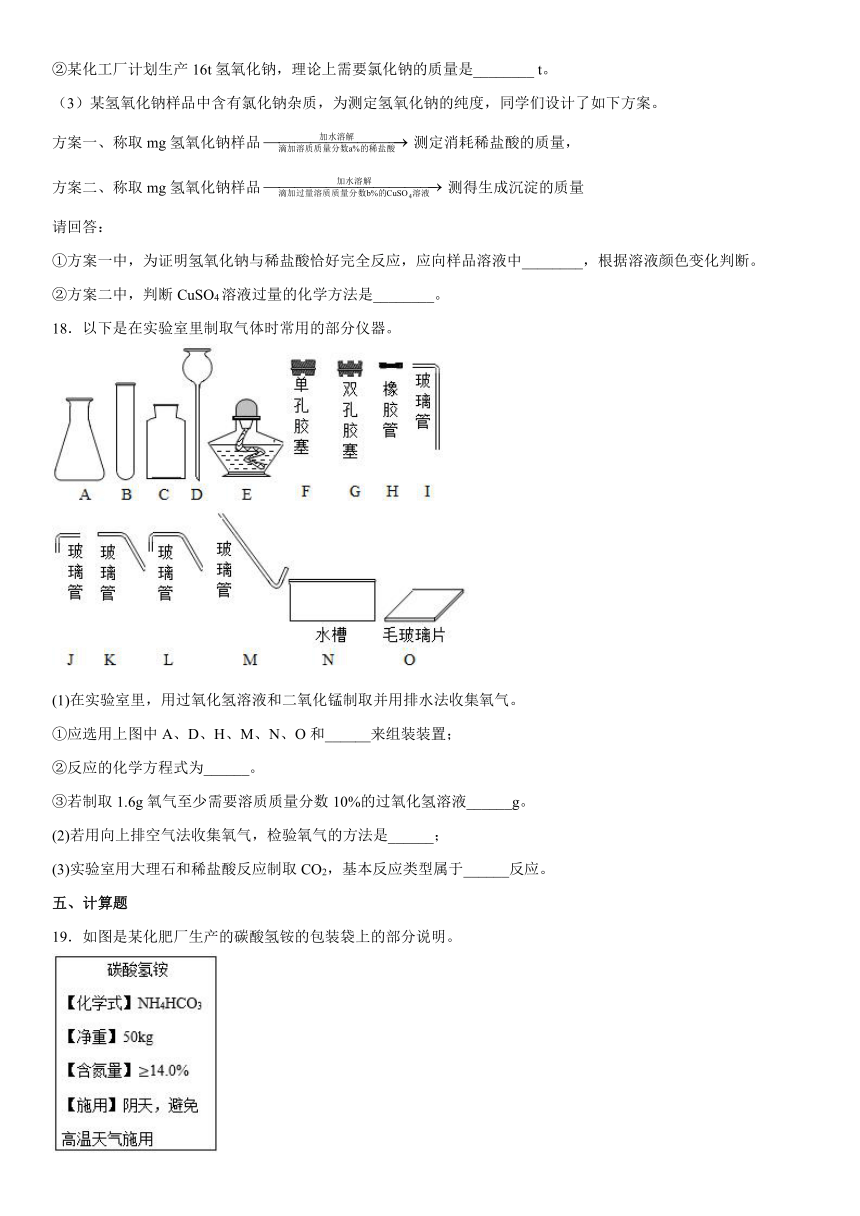
18.以下是在实验室里制取气体时常用的部分仪器。
(1)在实验室里,用过氧化氢溶液和二氧化锰制取并用排水法收集氧气。
①应选用上图中A、D、H、M、N、O和______来组装装置;
②反应的化学方程式为______。
③若制取1.6g氧气至少需要溶质质量分数10%的过氧化氢溶液______g。
(2)若用向上排空气法收集氧气,检验氧气的方法是______;
(3)实验室用大理石和稀盐酸反应制取CO2,基本反应类型属于______反应。
五、计算题
19.如图是某化肥厂生产的碳酸氢铵的包装袋上的部分说明。
(1)避免高温天气施用的原因是___________(用化学方程式表示)。
(2)一袋该化肥中至少含有纯净的NH4HCO3的质量为______Kg(直接写出计算结果)。
20.某纯碱样品中混有少量NaCl,某兴趣小组同学称取6.25g的样品,滴入稀盐酸至恰好完全反应,实验数据记录如下。
反应前 反应后
实验 数据 (烧杯+样品+稀盐酸)的质量g 烧杯的质量g 烧杯+烧杯中溶液的质量g
205.2 103.0 203.0
(1)求反应生成的CO2质量 g。
(2)求反应后所得溶液的溶质质量分数。
21.实验室要测定一瓶标签破损的稀硫酸的溶质质量分数。取20g该稀硫酸样品于烧杯中,将5%的氢氧化钠溶液逐滴滴入到样品中,并不断搅拌,测得溶液的pH随滴入氢氧化钠溶液体积的变化关系如图所示。请分析并完成下列问题:
(1)a点时溶液显______性(填“酸”、“碱”或“中”);
(2)b点时加入氢氧化钠的质量是______g;
(3)计算该稀硫酸的溶质质量分数。
22.某工厂现有废硫酸9.8t(H2SO4的质量分数为10%),试计算:
(1)该9.8t废硫酸中H2SO4的质量为 t;
(2)可以用该厂的废硫酸去中和处理另一工厂的废碱液(主要成分为NaOH),请写出中和过程中发生的化学反应方程式 。
(3)如果用该9.8t废硫酸可以恰好中和废碱液20t,求废碱液中NaOH的质量分数。(写出计算过程)
试卷第1页,共3页
参考答案:
1.A
2.B
3.B
4.A
5.B
6.A
7.B
8.B
9.C
10. 氢离子和氢氧根离子反应生成水分子 不对,氯化钠也能与硝酸银产生白色沉淀,两种情况中都含有氯化钠
11. 灰白色粉末 易 刺激性 氨气 刺激性 氨气 熟石灰 产生刺激性气味 不能 物理 化学
12. 复分解反应 Na+、Cl- 、H2O
13.(1)质子数不同
(2)
(3)小苏打
14.(1)白色固体逐渐减少至消失,固体表面产生气泡
(2)
(3)A为HCl;B为CaCO3或 Na2CO3;C为Ba(OH)2;D为Na2SO4
15.(1)
(2) 不是
16.(1)
(2) 大理石或石灰石和稀盐酸 红色变紫色
(3)befdc
17. C Na2CO3没有完全反应,有剩余,混在得到的NaOH中 NaOH与空气中CO2反应变质生成Na2CO3,混在得到的NaOH中 化学能 23.4 加入酚酞试液 取反应后的上层清液于试管中,加入NaOH溶液,有蓝色沉淀生成(答案合理即可)
18.(1) C F L 34
(2)将带火星小木条伸入瓶丙,若复燃是氧气
(3)复分解
19.(1)
(2)39.5
20.(1)2.2
(2)设反应生成氯化钠的质量为x,碳酸钠的质量为y,
样品中得氯化钠质量为:6.25g-5.3g=0.95g,
所以反应后溶质质量分数为:。
21.(1)酸
(2)1.6
解:跟1.6g氢氧化钠反应所需H2SO4的质量为
xH2SO4+2NaOH= Na2SO4+ 2H2O
x=1.96g
答:该稀硫酸的溶质质量分数是9.8%。
22.(1)0.98
(2)
(3)解:设中和9.8t废硫酸需要氢氧化钠的质量为x
所以废碱液中NaOH的质量分数为
答:废碱液中NaOH的质量分数为4%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列物质加入水中,所得溶液pH可能为10的是
A.氢氧化钡 B.醋酸 C.硫酸钾 D.食盐
2.掌握分类的方法对于化学学习非常重要,以下物质分类错误的是
A.稀有气体:氖气 B.氧化物:二氧化硫、甲烷
C.单质:金刚石 D.酸:碳酸、硫酸
3.除去下列物质中混有的少量杂质(括号内为杂质),拟定的实验方案不可行的是
A.N2气体(O2)——通过灼热的铜网
B.木炭粉(CuO)——在空气中灼烧
C.KCl固体(MnO2)——加入足量的水溶解,过滤,蒸发结晶
D.CO(CO2)——通过足量的澄清石灰水
4.我们学习了一些物质,并能进行简单地分类。下列各组内物质表示同一种物质的是
A.氢氧化钠、烧碱 B.氢氧化钙、生石灰
C.紫铜、黄铜 D.干冰、水
5.今年秋粮又获丰收,再显中国饭碗自信,其中化肥和农药功不可没。下列说法错误的是
A.Ca3(PO4)2可以促进作物生长,增强作物的抗寒、抗旱能力
B.硝酸钾属于钾肥
C.含氮量为40%的尿素【CO(NH2)2】化肥样品为混合物
D.大量施用化肥和农药会造成环境污染
6.除去下列物质(括号内为杂质)中少量杂质的方法正确的是
A.CaCl2溶液(稀盐酸) 加过量CaCO3粉末,过滤
B.CO2(CO) 通入氧气点燃
C.Cu(C) 在空气中灼烧
D.CuSO4溶液(FeSO4) 加足量锌粉,过滤
7.分类法是化学学习的常用方法,下列分类正确的是
A.碱:烧碱、生石灰、消石灰 B.混合物:空气、粗盐、海水
C.合金:生铁、黄铜、赤铁矿 D.盐:纯碱、酒精、硫酸铜
8.下列关于实验现象的描述,正确的是
A.铁丝在空气中剧烈燃烧,火星四射,放出热量,生成黑色固体
B.硫在氧气中燃烧,发出明亮的蓝紫色火焰,生成有刺激性气味的气体
C.木炭在氧气中燃烧,发出白光,生成二氧化碳气体
D.打开浓盐酸的瓶盖,有大量白烟产生
9.用稀盐酸和石灰石制取二氧化碳并持续通入饱和澄清石灰水中,使用浊度传感器测石灰水浑浊的情况,溶液透明时浊度值(透过率)为100%,溶液浊度的变化与时间的曲线如图。下列说法正确的是
A.AB段溶液浊度变化不大,因为先排出装置里的气体不与饱和石灰水反应
B.BC段溶液浊度变小是因为氢氧化钙固体析出
C.CD段溶液浊度上升,此时溶液中Ca2+浓度逐渐升高
D.C点导电性最强
二、简答题
10.(1)下图为中和反应实验,其反应实质是什么?____
(2)小明在实验时,滴完酸才想起来滴加酚酞溶液,滴完后酚酞溶液呈现无色。小红认为此时不一定恰好中和,也可能酸过量。为此,她取样,滴加硝酸银溶液,发现有白色沉淀生成,从而说明有稀盐酸,是酸过量。小红的做法对吗?为什么?______
11.氮肥、磷肥和钾肥的简单区别方法。
氮肥 钾肥 磷肥
看外观 白色晶体 ______
加水 全部______溶于水 大多不溶于水或部分溶于水
加熟石灰研磨 有______气味的______放出 无______气味的______放出
归纳:(1)可以用______区别氮肥和钾肥,______是氮肥(铵态氮肥)。
(2)施肥时铵态氮肥______(填“能”或“不能”)与碱性肥料(如草木灰)混合使用。
(3)区别物质的一般方法是先______方法,再是______方法。
氮肥中氨水是液体,碳酸氢铵有强烈氨味,据此可直接将它们与其他氮肥相区别。
【巧学妙记】化肥的简易鉴别:“一看、二闻、三溶、四加碱。”
三、推断题
12.宇轩同学在厨房里取得一种白色粉末A,到化学实验室进行探究,结果如图:
请回答下列问题:
(1)若A不含氢元素,则A与澄清石灰水反应的化学方程式为_______,其反应的基本类型是_______。
(2)若A含有氢元素,则它与盐酸反应的化学方程式为_______。
(3)B溶液中含有的微粒为_______。(用化学用语填空)
13.A、B、C、D、E分别为1~18号元素中的一种,且原子序数依次增大。A、C元素组成的化合物常温时为液态,且是最常用的溶剂;B元素组成的一种单质可用于净水;D元素原子核内有11个质子;E元素的原子易得到一个电子形成稳定结构。
(1)五种元素之间的最本质区别是_____________。
(2)画出E元素的原子结构示意图___________。
(3)由A、B、C、D四种元素组成的化合物的俗称是_____________。
14.下图是六种物质之间的转化关系。用“—”表示两种物质之间能发生反应,用“→”表示一种物质可以转化为另一种物质。其中A含两种元素并且与氢氧化钠溶液反应无现象,B为纯净物且为白色固体,C与D反应生成一种不溶于硝酸的白色沉淀。试回答下列问题:
(1)足量的A与B反应的现象是______。
(2)C与二氧化碳反应的化学方程式为______。
(3)在图中写出A、B、C、D四种物质(或溶质)的化学式。
15.A、B、C、D、E、F、G是常见物质,B是一种气体单质,E是红色的固体单质,D是浅绿色溶液,G是蓝色溶液,它们可以发生如下转化关系:
(1)推出下列物质的化学式:A______。B______。D______。G______。
(2)写出下列转化的化学方程式:E→F:______;F转化为G的反应______置换反应(填“是”、“不一定是”或“不是”)。
四、实验题
16.如图为实验室制取气体并验证气体性质的部分装置(氢气可以用浓硫酸干燥,装置D中液体为浓硫酸)。请回答:
(1)用A装置制取氧气的化学方程式是______。
(2)实验室制取二氧化碳所用的药品是______。将B、E装置组合制取并验证二氧化碳的性质,验证后加热E试管中的液体,观察的到的现象是______。
(3)实验室用锌粒和稀硫酸反应制取并收集干燥的氢气,请填写所选装置导管口字母的连接顺序______。
17.某化学兴趣小组初步探究氢氧化钠的相关知识。
(1)氢氧化钠的部分转化关系如图:
①氢氧化钠的俗称为________(填序号)。
A熟石灰 B纯碱 C烧碱 D草木灰
②写出转化a的化学方程式________。
③转化b可制取氢氧化钠,但制得的氢氧化钠纯度低,常含有碳酸钠杂质,原因可能是________、________。
(2)当前工业上利用转化c生产氢氧化钠:
①反应过程中,电能转化为________能。
②某化工厂计划生产16t氢氧化钠,理论上需要氯化钠的质量是________ t。
(3)某氢氧化钠样品中含有氯化钠杂质,为测定氢氧化钠的纯度,同学们设计了如下方案。
方案一、称取mg氢氧化钠样品测定消耗稀盐酸的质量,
方案二、称取mg氢氧化钠样品测得生成沉淀的质量
请回答:
①方案一中,为证明氢氧化钠与稀盐酸恰好完全反应,应向样品溶液中________,根据溶液颜色变化判断。
②方案二中,判断CuSO4溶液过量的化学方法是________。
18.以下是在实验室里制取气体时常用的部分仪器。
(1)在实验室里,用过氧化氢溶液和二氧化锰制取并用排水法收集氧气。
①应选用上图中A、D、H、M、N、O和______来组装装置;
②反应的化学方程式为______。
③若制取1.6g氧气至少需要溶质质量分数10%的过氧化氢溶液______g。
(2)若用向上排空气法收集氧气,检验氧气的方法是______;
(3)实验室用大理石和稀盐酸反应制取CO2,基本反应类型属于______反应。
五、计算题
19.如图是某化肥厂生产的碳酸氢铵的包装袋上的部分说明。
(1)避免高温天气施用的原因是___________(用化学方程式表示)。
(2)一袋该化肥中至少含有纯净的NH4HCO3的质量为______Kg(直接写出计算结果)。
20.某纯碱样品中混有少量NaCl,某兴趣小组同学称取6.25g的样品,滴入稀盐酸至恰好完全反应,实验数据记录如下。
反应前 反应后
实验 数据 (烧杯+样品+稀盐酸)的质量g 烧杯的质量g 烧杯+烧杯中溶液的质量g
205.2 103.0 203.0
(1)求反应生成的CO2质量 g。
(2)求反应后所得溶液的溶质质量分数。
21.实验室要测定一瓶标签破损的稀硫酸的溶质质量分数。取20g该稀硫酸样品于烧杯中,将5%的氢氧化钠溶液逐滴滴入到样品中,并不断搅拌,测得溶液的pH随滴入氢氧化钠溶液体积的变化关系如图所示。请分析并完成下列问题:
(1)a点时溶液显______性(填“酸”、“碱”或“中”);
(2)b点时加入氢氧化钠的质量是______g;
(3)计算该稀硫酸的溶质质量分数。
22.某工厂现有废硫酸9.8t(H2SO4的质量分数为10%),试计算:
(1)该9.8t废硫酸中H2SO4的质量为 t;
(2)可以用该厂的废硫酸去中和处理另一工厂的废碱液(主要成分为NaOH),请写出中和过程中发生的化学反应方程式 。
(3)如果用该9.8t废硫酸可以恰好中和废碱液20t,求废碱液中NaOH的质量分数。(写出计算过程)
试卷第1页,共3页
参考答案:
1.A
2.B
3.B
4.A
5.B
6.A
7.B
8.B
9.C
10. 氢离子和氢氧根离子反应生成水分子 不对,氯化钠也能与硝酸银产生白色沉淀,两种情况中都含有氯化钠
11. 灰白色粉末 易 刺激性 氨气 刺激性 氨气 熟石灰 产生刺激性气味 不能 物理 化学
12. 复分解反应 Na+、Cl- 、H2O
13.(1)质子数不同
(2)
(3)小苏打
14.(1)白色固体逐渐减少至消失,固体表面产生气泡
(2)
(3)A为HCl;B为CaCO3或 Na2CO3;C为Ba(OH)2;D为Na2SO4
15.(1)
(2) 不是
16.(1)
(2) 大理石或石灰石和稀盐酸 红色变紫色
(3)befdc
17. C Na2CO3没有完全反应,有剩余,混在得到的NaOH中 NaOH与空气中CO2反应变质生成Na2CO3,混在得到的NaOH中 化学能 23.4 加入酚酞试液 取反应后的上层清液于试管中,加入NaOH溶液,有蓝色沉淀生成(答案合理即可)
18.(1) C F L 34
(2)将带火星小木条伸入瓶丙,若复燃是氧气
(3)复分解
19.(1)
(2)39.5
20.(1)2.2
(2)设反应生成氯化钠的质量为x,碳酸钠的质量为y,
样品中得氯化钠质量为:6.25g-5.3g=0.95g,
所以反应后溶质质量分数为:。
21.(1)酸
(2)1.6
解:跟1.6g氢氧化钠反应所需H2SO4的质量为
xH2SO4+2NaOH= Na2SO4+ 2H2O
x=1.96g
答:该稀硫酸的溶质质量分数是9.8%。
22.(1)0.98
(2)
(3)解:设中和9.8t废硫酸需要氢氧化钠的质量为x
所以废碱液中NaOH的质量分数为
答:废碱液中NaOH的质量分数为4%。
答案第1页,共2页
答案第1页,共2页
