第八章常见的酸碱盐提高练习—2021—2022学年九年级化学科粤版(2012)下册(word版有答案)
文档属性
| 名称 | 第八章常见的酸碱盐提高练习—2021—2022学年九年级化学科粤版(2012)下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 168.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-07 18:49:56 | ||
图片预览

文档简介
第八章 常见的酸碱盐 提高练习
一、单选题
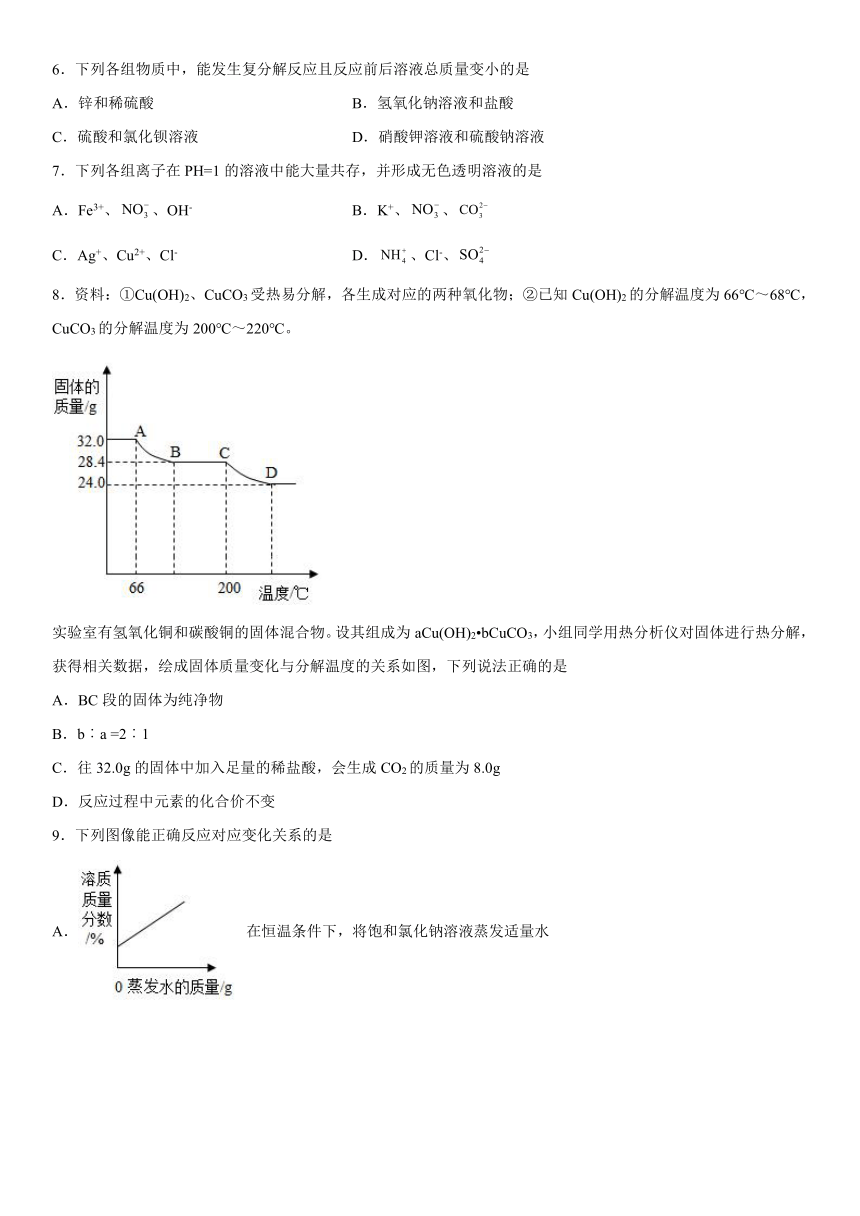
1.下列对化学肥料的认识错误的是
A.NH4H2PO4 复合肥
B.CO(NH2)2 氮肥
C.Ca3(PO4)2 磷肥
D.KNO3 钾肥
2.实验室可用 制取H2,下列实验操作或实验装置正确的是
A.配制稀硫酸 B.制备H2
C.干燥H2 D.收集H2
3.除去热水瓶胆内的水垢(主要成分是碳酸钙),最好采用的方法是
A.猛击后用大量水冲洗 B.加入石灰水浸泡
C.加入食醋浸泡 D.通入石蕊试液中
4.规范操作,对顺利完成科学探究很重要。下列实验基本操作错误的是
A. B. C. D.
5.下列关于实验现象的描述正确的是
A.氢气在空气中燃烧,产生白色火焰
B.木炭在氧气中燃烧,产生黄色火焰
C.加热碳酸氢铵,生成有刺激性气味的气体
D.铁丝在氧气中生成四氧化三铁
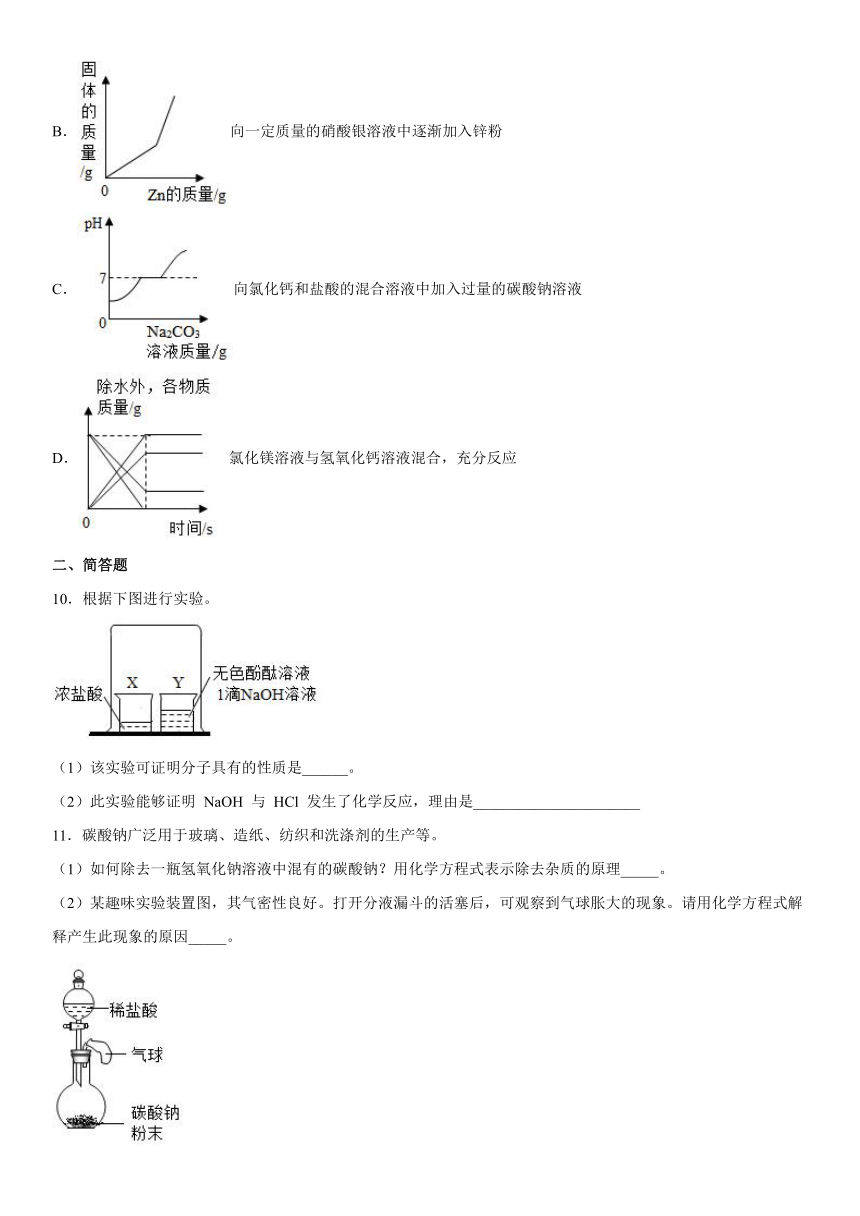
6.下列各组物质中,能发生复分解反应且反应前后溶液总质量变小的是
A.锌和稀硫酸 B.氢氧化钠溶液和盐酸
C.硫酸和氯化钡溶液 D.硝酸钾溶液和硫酸钠溶液
7.下列各组离子在PH=1的溶液中能大量共存,并形成无色透明溶液的是
A.Fe3+、、OH- B.K+、、
C.Ag+、Cu2+、Cl- D.、Cl-、
8.资料:①Cu(OH)2、CuCO3受热易分解,各生成对应的两种氧化物;②已知Cu(OH)2的分解温度为66℃~68℃,CuCO3的分解温度为200℃~220℃。
实验室有氢氧化铜和碳酸铜的固体混合物。设其组成为aCu(OH)2 bCuCO3,小组同学用热分析仪对固体进行热分解,获得相关数据,绘成固体质量变化与分解温度的关系如图,下列说法正确的是
A.BC段的固体为纯净物
B.b︰a =2︰1
C.往32.0g的固体中加入足量的稀盐酸,会生成CO2的质量为8.0g
D.反应过程中元素的化合价不变
9.下列图像能正确反应对应变化关系的是
A.在恒温条件下,将饱和氯化钠溶液蒸发适量水
B.向一定质量的硝酸银溶液中逐渐加入锌粉
C.向氯化钙和盐酸的混合溶液中加入过量的碳酸钠溶液
D.氯化镁溶液与氢氧化钙溶液混合,充分反应
二、简答题
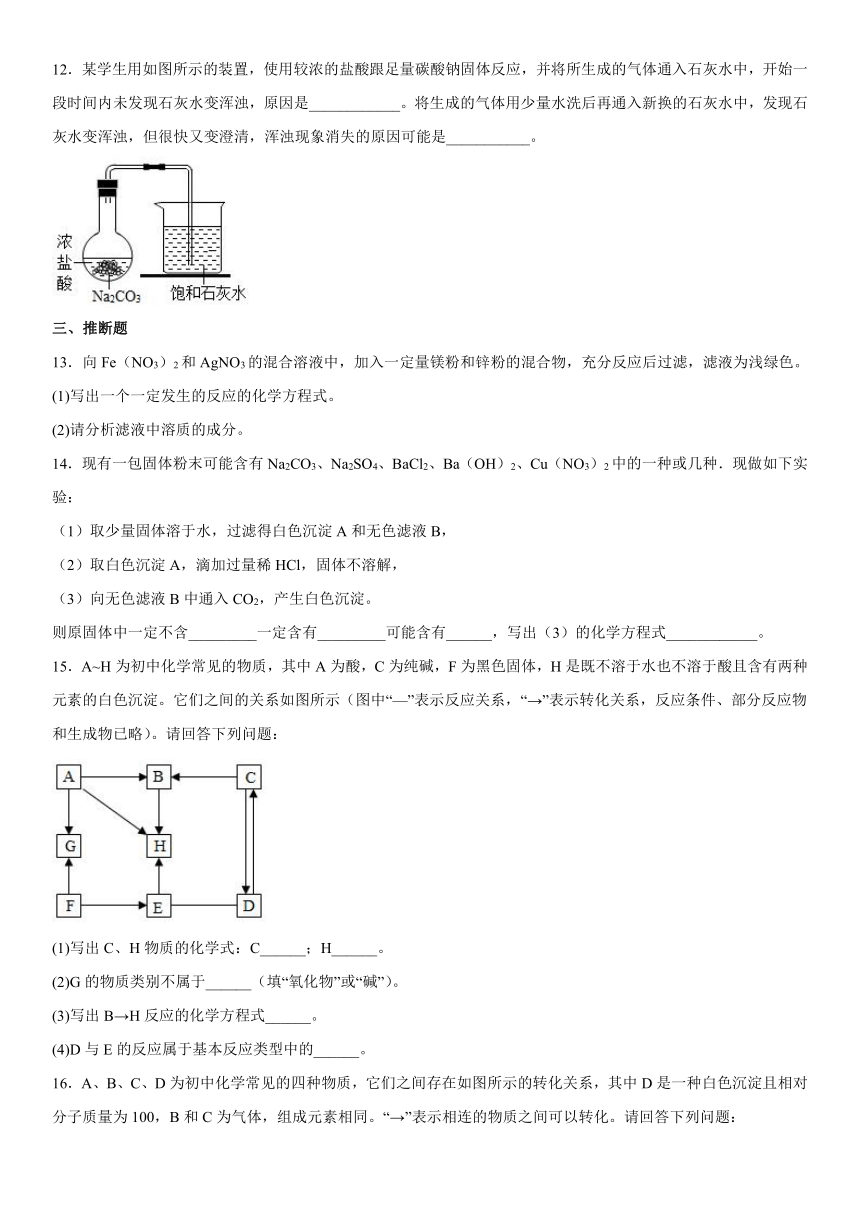
10.根据下图进行实验。
(1)该实验可证明分子具有的性质是______。
(2)此实验能够证明 NaOH 与 HCl 发生了化学反应,理由是______________________
11.碳酸钠广泛用于玻璃、造纸、纺织和洗涤剂的生产等。
(1)如何除去一瓶氢氧化钠溶液中混有的碳酸钠?用化学方程式表示除去杂质的原理_____。
(2)某趣味实验装置图,其气密性良好。打开分液漏斗的活塞后,可观察到气球胀大的现象。请用化学方程式解释产生此现象的原因_____。
12.某学生用如图所示的装置,使用较浓的盐酸跟足量碳酸钠固体反应,并将所生成的气体通入石灰水中,开始一段时间内未发现石灰水变浑浊,原因是____________。将生成的气体用少量水洗后再通入新换的石灰水中,发现石灰水变浑浊,但很快又变澄清,浑浊现象消失的原因可能是___________。
三、推断题
13.向Fe(NO3)2和AgNO3的混合溶液中,加入一定量镁粉和锌粉的混合物,充分反应后过滤,滤液为浅绿色。
(1)写出一个一定发生的反应的化学方程式。
(2)请分析滤液中溶质的成分。
14.现有一包固体粉末可能含有Na2CO3、Na2SO4、BaCl2、Ba(OH)2、Cu(NO3)2中的一种或几种.现做如下实验:
(1)取少量固体溶于水,过滤得白色沉淀A和无色滤液B,
(2)取白色沉淀A,滴加过量稀HCl,固体不溶解,
(3)向无色滤液B中通入CO2,产生白色沉淀。
则原固体中一定不含_________一定含有_________可能含有______,写出(3)的化学方程式____________。
15.A~H为初中化学常见的物质,其中A为酸,C为纯碱,F为黑色固体,H是既不溶于水也不溶于酸且含有两种元素的白色沉淀。它们之间的关系如图所示(图中“—”表示反应关系,“→”表示转化关系,反应条件、部分反应物和生成物已略)。请回答下列问题:
(1)写出C、H物质的化学式:C______;H______。
(2)G的物质类别不属于______(填“氧化物”或“碱”)。
(3)写出B→H反应的化学方程式______。
(4)D与E的反应属于基本反应类型中的______。
16.A、B、C、D为初中化学常见的四种物质,它们之间存在如图所示的转化关系,其中D是一种白色沉淀且相对分子质量为100,B和C为气体,组成元素相同。“→”表示相连的物质之间可以转化。请回答下列问题:
(1)写出C→D的化学反应方程式______。
(2)B和C化学性质不同的原因______。
四、实验题
17.根据图回答问题:
(1)由实验1得到的结论是 ______________________________ 。为确保实验成功,操作时需注意的问题是 ________________________________________________ 。
(2)实验2的目的是 _________________________________ 。
(3)实验3中发生反应的化学方程式为 ____________________________ ,当观察到溶液由红色变为无色后,小明想知道反应后溶液中除NaCl外,是否还含有其它溶质(不考虑酚酞),于是他向反应后的溶液中加入一种试剂,从而得出了结论。小明加入的试剂可能是 _____________________ 。
18.下图是粗盐提纯实验的部分操作,请回答相关问题。
A 溶解B.蒸发C.过滤D.取一定量的粗盐
(1)粗盐提纯的正确操作顺序为___________(填字母)。
(2)上图所示操作中,有错误的是___________(填字母)。
(3)操作A中,玻璃棒的作用是___________。
(4)操作B中___________时停止加热。
(5)过滤时用到的玻璃仪器有烧杯、___________、___________。过滤时的“两低”是指滤纸边缘低于漏斗边缘,___________。
19.在天平两端各放等质量的两个锥形瓶瓶口用单孔塞和导管连接起来,气球中装有等质量的碳酸钠,如图所示。左盘锥形瓶中盛有克水,右盘锥形瓶中盛有克稀盐酸,天平平衡。
(1)实验开始时,将气球中的碳酸钠倒入锥形瓶中,观察到的现象是______,天平的指针______(气球产生的浮力不计。填“偏左”、“偏右”或“在标尺中央”,下同)。
(2)待上述实验的反应完成后,将锥形瓶瓶口上的单孔塞、导管和气球去掉,天平的指针______;原因是______。
五、计算题
20.某化学兴趣活动小组用采集的石灰岩样品进行相关实验。将采集到的样品用水冲洗后晾干,称取20.00g样品平均分成两份,分别与足量相同的稀盐酸反应,测定释放出二氧化碳的质量与反应时间的关系如图所示。
(1)由图中曲线可以看出,固体物质与液体物质反应,当其他条件相同时,接触面积越 ,其反应速率越 。
(2)求样品中碳酸钙的质量分数(假设样品中其他杂质不参加反应,不考虑水、氯化氢逸出)。
21.将5g固体氢氧化钠完全溶解在50g溶质质量分数为12%的氢氧化钠溶液中,求:
(1)所得溶液的溶质质量分数。
(2)为测其某盐酸的溶质质量分数,现取10g上述所得氢氧化钠溶液与18.25g此盐酸混合,恰好完全反应,求此盐酸的溶质质量分数。
(3)求反应后溶液的溶质质量分数(计算结果保留到0.1%)
22.氢氧化钠是一种重要的化工原料,广泛用于造纸、纺织、石油化工等方面。
(1)氢氧化钠具有强烈的腐蚀性,使用时必须十分小心。如果不慎沾在皮肤上,要立即用大量水冲洗,然后涂上___________(填“氢氧化钙”“硼酸”之一)溶液。
(2)氢氧化钠固体放在空气中易吸收水分,并能与二氧化碳反应而变质,所以应该密封保存。氢氧化钠在空气中变质的原因是(用化学方程式表示)___________。
(3)室温下,某实验小组的同学取一定量的Na2CO3粉末于烧杯中,加入足量水溶解后,再逐滴加入溶质质量分数为11.1%的CaCl2溶液,反应生成沉淀的质量与加入CaCl2溶液的质量关系如下图所示。试回答:
①Na2CO3的水溶液显___________(填“酸性”“中性”“碱性”之一)。
②当滴入CaCl2溶液60g时(即图中A点),烧杯中溶液里含有的溶质为___________(写化学式)。
③当滴入11.1%的CaCl2溶液100g时(即图中B点),恰好完全反应,试通过计算,求所取碳酸钠的质量(计算结果精确至0.1g)__________。
试卷第1页,共3页
参考答案:
1.D
2.B
3.C
4.A
5.C
6.C
7.D
8.D
9.C
10. 分子是不断运动的 溶液由红色变为无色
11.
12. 浓盐酸具有挥发性,挥发出的HCl进入石灰水,与氢氧化钙反应生成氯化钙和水,氯化钙和二氧化碳不反应,故开始一段时间内未发现石灰水变浑浊
反应生成的碳酸钙和二氧化碳、水反应生成溶于水的碳酸氢钙,故浑浊现象消失
13.(1)Mg + 2AgNO3=Mg(NO3)2+2Ag
(2)一定有硝酸镁、硝酸锌、硝酸亚铁,可能有硝酸银
14. Cu(NO3)2、 Na2CO3 Na2SO4 、Ba(OH)2 BaCl2
15.(1) Na2CO3 AgCl
(2)碱
(3)
(4)复分解反应
16.(1)
(2)分子构成不同
17. 二氧化碳不燃烧也不支持燃烧,密度比空气大 沿蜡烛对面一侧烧杯内壁缓缓倾倒二氧化碳 探究反应物的状态对反应速率的影响 紫色石蕊溶液(或锌等活泼金属或碳酸钠溶液等)
18.(1)DACB
(2)C
(3)加速溶解
(4)大量固体
(5) 漏斗(或玻璃棒) 玻璃棒(或漏斗) 液面低于滤纸边缘
19.(1) 左盘锥形瓶中无明显现象,右盘锥形瓶中产生气泡,气球胀大 在标尺中央
(2) 偏左 右盘锥形瓶中产生二氧化碳逸出,质量减小
20.(1) 大 快 (或 小 慢) (2)75%
21.(1)20%
解:所得溶液的溶质质量分数为×100%=20%;
(2)10%
解:设盐酸的溶质质量为x,生成氯化钠的质量为y,则有
盐酸的溶质质量分数为×100%=10%;
(3)10.4%
反应后溶液的溶质质量分数为×100%≈10.4%;
答:所得溶液的溶质质量分数为20%;盐酸的溶质质量分数为10%;反应后溶液的溶质质量分数为10.4%。
22.(1)硼酸
(2)
(3) 碱性 Na2CO3、NaCl 解:根据题意,恰好完全反应时参加反应的CaCl2质量:100g×11.1%=11.1g。
设所取碳酸钠的质量为x。
x=10.6g
答:所取碳酸钠的质量为10.6g。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列对化学肥料的认识错误的是
A.NH4H2PO4 复合肥
B.CO(NH2)2 氮肥
C.Ca3(PO4)2 磷肥
D.KNO3 钾肥
2.实验室可用 制取H2,下列实验操作或实验装置正确的是
A.配制稀硫酸 B.制备H2
C.干燥H2 D.收集H2
3.除去热水瓶胆内的水垢(主要成分是碳酸钙),最好采用的方法是
A.猛击后用大量水冲洗 B.加入石灰水浸泡
C.加入食醋浸泡 D.通入石蕊试液中
4.规范操作,对顺利完成科学探究很重要。下列实验基本操作错误的是
A. B. C. D.
5.下列关于实验现象的描述正确的是
A.氢气在空气中燃烧,产生白色火焰
B.木炭在氧气中燃烧,产生黄色火焰
C.加热碳酸氢铵,生成有刺激性气味的气体
D.铁丝在氧气中生成四氧化三铁
6.下列各组物质中,能发生复分解反应且反应前后溶液总质量变小的是
A.锌和稀硫酸 B.氢氧化钠溶液和盐酸
C.硫酸和氯化钡溶液 D.硝酸钾溶液和硫酸钠溶液
7.下列各组离子在PH=1的溶液中能大量共存,并形成无色透明溶液的是
A.Fe3+、、OH- B.K+、、
C.Ag+、Cu2+、Cl- D.、Cl-、
8.资料:①Cu(OH)2、CuCO3受热易分解,各生成对应的两种氧化物;②已知Cu(OH)2的分解温度为66℃~68℃,CuCO3的分解温度为200℃~220℃。
实验室有氢氧化铜和碳酸铜的固体混合物。设其组成为aCu(OH)2 bCuCO3,小组同学用热分析仪对固体进行热分解,获得相关数据,绘成固体质量变化与分解温度的关系如图,下列说法正确的是
A.BC段的固体为纯净物
B.b︰a =2︰1
C.往32.0g的固体中加入足量的稀盐酸,会生成CO2的质量为8.0g
D.反应过程中元素的化合价不变
9.下列图像能正确反应对应变化关系的是
A.在恒温条件下,将饱和氯化钠溶液蒸发适量水
B.向一定质量的硝酸银溶液中逐渐加入锌粉
C.向氯化钙和盐酸的混合溶液中加入过量的碳酸钠溶液
D.氯化镁溶液与氢氧化钙溶液混合,充分反应
二、简答题
10.根据下图进行实验。
(1)该实验可证明分子具有的性质是______。
(2)此实验能够证明 NaOH 与 HCl 发生了化学反应,理由是______________________
11.碳酸钠广泛用于玻璃、造纸、纺织和洗涤剂的生产等。
(1)如何除去一瓶氢氧化钠溶液中混有的碳酸钠?用化学方程式表示除去杂质的原理_____。
(2)某趣味实验装置图,其气密性良好。打开分液漏斗的活塞后,可观察到气球胀大的现象。请用化学方程式解释产生此现象的原因_____。
12.某学生用如图所示的装置,使用较浓的盐酸跟足量碳酸钠固体反应,并将所生成的气体通入石灰水中,开始一段时间内未发现石灰水变浑浊,原因是____________。将生成的气体用少量水洗后再通入新换的石灰水中,发现石灰水变浑浊,但很快又变澄清,浑浊现象消失的原因可能是___________。
三、推断题
13.向Fe(NO3)2和AgNO3的混合溶液中,加入一定量镁粉和锌粉的混合物,充分反应后过滤,滤液为浅绿色。
(1)写出一个一定发生的反应的化学方程式。
(2)请分析滤液中溶质的成分。
14.现有一包固体粉末可能含有Na2CO3、Na2SO4、BaCl2、Ba(OH)2、Cu(NO3)2中的一种或几种.现做如下实验:
(1)取少量固体溶于水,过滤得白色沉淀A和无色滤液B,
(2)取白色沉淀A,滴加过量稀HCl,固体不溶解,
(3)向无色滤液B中通入CO2,产生白色沉淀。
则原固体中一定不含_________一定含有_________可能含有______,写出(3)的化学方程式____________。
15.A~H为初中化学常见的物质,其中A为酸,C为纯碱,F为黑色固体,H是既不溶于水也不溶于酸且含有两种元素的白色沉淀。它们之间的关系如图所示(图中“—”表示反应关系,“→”表示转化关系,反应条件、部分反应物和生成物已略)。请回答下列问题:
(1)写出C、H物质的化学式:C______;H______。
(2)G的物质类别不属于______(填“氧化物”或“碱”)。
(3)写出B→H反应的化学方程式______。
(4)D与E的反应属于基本反应类型中的______。
16.A、B、C、D为初中化学常见的四种物质,它们之间存在如图所示的转化关系,其中D是一种白色沉淀且相对分子质量为100,B和C为气体,组成元素相同。“→”表示相连的物质之间可以转化。请回答下列问题:
(1)写出C→D的化学反应方程式______。
(2)B和C化学性质不同的原因______。
四、实验题
17.根据图回答问题:
(1)由实验1得到的结论是 ______________________________ 。为确保实验成功,操作时需注意的问题是 ________________________________________________ 。
(2)实验2的目的是 _________________________________ 。
(3)实验3中发生反应的化学方程式为 ____________________________ ,当观察到溶液由红色变为无色后,小明想知道反应后溶液中除NaCl外,是否还含有其它溶质(不考虑酚酞),于是他向反应后的溶液中加入一种试剂,从而得出了结论。小明加入的试剂可能是 _____________________ 。
18.下图是粗盐提纯实验的部分操作,请回答相关问题。
A 溶解B.蒸发C.过滤D.取一定量的粗盐
(1)粗盐提纯的正确操作顺序为___________(填字母)。
(2)上图所示操作中,有错误的是___________(填字母)。
(3)操作A中,玻璃棒的作用是___________。
(4)操作B中___________时停止加热。
(5)过滤时用到的玻璃仪器有烧杯、___________、___________。过滤时的“两低”是指滤纸边缘低于漏斗边缘,___________。
19.在天平两端各放等质量的两个锥形瓶瓶口用单孔塞和导管连接起来,气球中装有等质量的碳酸钠,如图所示。左盘锥形瓶中盛有克水,右盘锥形瓶中盛有克稀盐酸,天平平衡。
(1)实验开始时,将气球中的碳酸钠倒入锥形瓶中,观察到的现象是______,天平的指针______(气球产生的浮力不计。填“偏左”、“偏右”或“在标尺中央”,下同)。
(2)待上述实验的反应完成后,将锥形瓶瓶口上的单孔塞、导管和气球去掉,天平的指针______;原因是______。
五、计算题
20.某化学兴趣活动小组用采集的石灰岩样品进行相关实验。将采集到的样品用水冲洗后晾干,称取20.00g样品平均分成两份,分别与足量相同的稀盐酸反应,测定释放出二氧化碳的质量与反应时间的关系如图所示。
(1)由图中曲线可以看出,固体物质与液体物质反应,当其他条件相同时,接触面积越 ,其反应速率越 。
(2)求样品中碳酸钙的质量分数(假设样品中其他杂质不参加反应,不考虑水、氯化氢逸出)。
21.将5g固体氢氧化钠完全溶解在50g溶质质量分数为12%的氢氧化钠溶液中,求:
(1)所得溶液的溶质质量分数。
(2)为测其某盐酸的溶质质量分数,现取10g上述所得氢氧化钠溶液与18.25g此盐酸混合,恰好完全反应,求此盐酸的溶质质量分数。
(3)求反应后溶液的溶质质量分数(计算结果保留到0.1%)
22.氢氧化钠是一种重要的化工原料,广泛用于造纸、纺织、石油化工等方面。
(1)氢氧化钠具有强烈的腐蚀性,使用时必须十分小心。如果不慎沾在皮肤上,要立即用大量水冲洗,然后涂上___________(填“氢氧化钙”“硼酸”之一)溶液。
(2)氢氧化钠固体放在空气中易吸收水分,并能与二氧化碳反应而变质,所以应该密封保存。氢氧化钠在空气中变质的原因是(用化学方程式表示)___________。
(3)室温下,某实验小组的同学取一定量的Na2CO3粉末于烧杯中,加入足量水溶解后,再逐滴加入溶质质量分数为11.1%的CaCl2溶液,反应生成沉淀的质量与加入CaCl2溶液的质量关系如下图所示。试回答:
①Na2CO3的水溶液显___________(填“酸性”“中性”“碱性”之一)。
②当滴入CaCl2溶液60g时(即图中A点),烧杯中溶液里含有的溶质为___________(写化学式)。
③当滴入11.1%的CaCl2溶液100g时(即图中B点),恰好完全反应,试通过计算,求所取碳酸钠的质量(计算结果精确至0.1g)__________。
试卷第1页,共3页
参考答案:
1.D
2.B
3.C
4.A
5.C
6.C
7.D
8.D
9.C
10. 分子是不断运动的 溶液由红色变为无色
11.
12. 浓盐酸具有挥发性,挥发出的HCl进入石灰水,与氢氧化钙反应生成氯化钙和水,氯化钙和二氧化碳不反应,故开始一段时间内未发现石灰水变浑浊
反应生成的碳酸钙和二氧化碳、水反应生成溶于水的碳酸氢钙,故浑浊现象消失
13.(1)Mg + 2AgNO3=Mg(NO3)2+2Ag
(2)一定有硝酸镁、硝酸锌、硝酸亚铁,可能有硝酸银
14. Cu(NO3)2、 Na2CO3 Na2SO4 、Ba(OH)2 BaCl2
15.(1) Na2CO3 AgCl
(2)碱
(3)
(4)复分解反应
16.(1)
(2)分子构成不同
17. 二氧化碳不燃烧也不支持燃烧,密度比空气大 沿蜡烛对面一侧烧杯内壁缓缓倾倒二氧化碳 探究反应物的状态对反应速率的影响 紫色石蕊溶液(或锌等活泼金属或碳酸钠溶液等)
18.(1)DACB
(2)C
(3)加速溶解
(4)大量固体
(5) 漏斗(或玻璃棒) 玻璃棒(或漏斗) 液面低于滤纸边缘
19.(1) 左盘锥形瓶中无明显现象,右盘锥形瓶中产生气泡,气球胀大 在标尺中央
(2) 偏左 右盘锥形瓶中产生二氧化碳逸出,质量减小
20.(1) 大 快 (或 小 慢) (2)75%
21.(1)20%
解:所得溶液的溶质质量分数为×100%=20%;
(2)10%
解:设盐酸的溶质质量为x,生成氯化钠的质量为y,则有
盐酸的溶质质量分数为×100%=10%;
(3)10.4%
反应后溶液的溶质质量分数为×100%≈10.4%;
答:所得溶液的溶质质量分数为20%;盐酸的溶质质量分数为10%;反应后溶液的溶质质量分数为10.4%。
22.(1)硼酸
(2)
(3) 碱性 Na2CO3、NaCl 解:根据题意,恰好完全反应时参加反应的CaCl2质量:100g×11.1%=11.1g。
设所取碳酸钠的质量为x。
x=10.6g
答:所取碳酸钠的质量为10.6g。
答案第1页,共2页
答案第1页,共2页
