第八章常见的酸碱盐章末复习-2021-2022学年九年级化学科粤版(2012)下册(word版有答案)
文档属性
| 名称 | 第八章常见的酸碱盐章末复习-2021-2022学年九年级化学科粤版(2012)下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 132.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-07 18:58:38 | ||
图片预览


文档简介
第八章 常见的酸碱盐 章末复习
一、单选题
1.下列是一些食物的近似pH,其中酸性最强的是
食物 苹果 菠菜 牛奶 鸡蛋清
pH 2.9-3.3 5.1-5.7 6.3-6.6 7.6-8.0
A.苹果 B.菠菜 C.牛奶 D.鸡蛋清
2.M是一种金属元素,M2+与其它几种离子构成的化合物的溶解性见表,根据以上信息,判断下列反应肯定不能发生的是
O2- OH- Cl-
M2+ 难溶 难溶 难溶 易溶 易溶 易溶
A.MCl2+NaOH B.MSO4+Ba(NO3)2 C.M(NO3)2+ NaCl D.MO+H2SO4
3.某无色混合气体可能由CH4、H2、CO、CO2和HCl中的若干种气体组成,将此混合气体通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小,把剩余气体导出后,在O2中能够点燃,燃烧产物不能使白色CuSO4粉末变蓝色。则原混合气体中一定含有
A.HCl和CO B.HC1、H2和CO2 C.CH4和H2 D.CO和CO2
4.除去难溶性杂质后的食盐中往往含有少量的Na2SO4、MgCl2、CaCl2等杂质,为了将这些杂质除去,可向食盐溶液中加入过量的NaOH、Na2CO3、BaCl2溶液,然后过滤除去沉淀,再加入盐酸调至溶液pH=7,最后经蒸发得到精盐。下列操作及加入溶液顺序不正确的是
A.BaCl2、Na2CO3、NaOH、过滤、HCl B.BaCl2、NaOH、Na2CO3、过滤、HCl
C.Na2CO3、BaCl2、NaOH、过滤、HCl D.NaOH、BaCl2、Na2CO3、过滤、HCl
5.下列关于实验现象的描述正确的是
A.氢气在空气中燃烧,产生白色火焰
B.木炭在氧气中燃烧,产生黄色火焰
C.加热碳酸氢铵,生成有刺激性气味的气体
D.铁丝在氧气中生成四氧化三铁
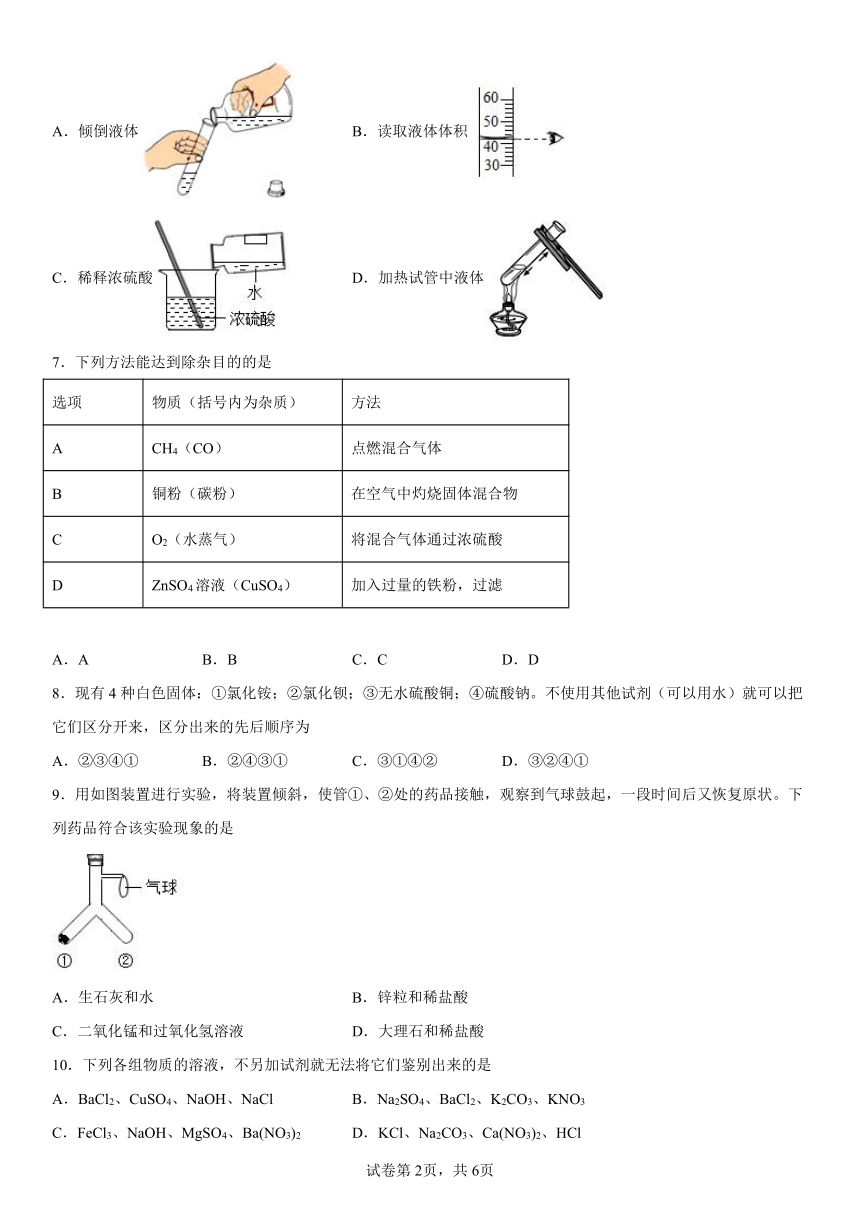
6.下列实验操作错误的是
A.倾倒液体 B.读取液体体积
C.稀释浓硫酸 D.加热试管中液体
7.下列方法能达到除杂目的的是
选项 物质(括号内为杂质) 方法
A CH4(CO) 点燃混合气体
B 铜粉(碳粉) 在空气中灼烧固体混合物
C O2(水蒸气) 将混合气体通过浓硫酸
D ZnSO4溶液(CuSO4) 加入过量的铁粉,过滤
A.A B.B C.C D.D
8.现有4种白色固体:①氯化铵;②氯化钡;③无水硫酸铜;④硫酸钠。不使用其他试剂(可以用水)就可以把它们区分开来,区分出来的先后顺序为
A.②③④① B.②④③① C.③①④② D.③②④①
9.用如图装置进行实验,将装置倾斜,使管①、②处的药品接触,观察到气球鼓起,一段时间后又恢复原状。下列药品符合该实验现象的是
A.生石灰和水 B.锌粒和稀盐酸
C.二氧化锰和过氧化氢溶液 D.大理石和稀盐酸
10.下列各组物质的溶液,不另加试剂就无法将它们鉴别出来的是
A.BaCl2、CuSO4、NaOH、NaCl B.Na2SO4、BaCl2、K2CO3、KNO3
C.FeCl3、NaOH、MgSO4、Ba(NO3)2 D.KCl、Na2CO3、Ca(NO3)2、HCl
二、简答题
11.生活用品中蕴含着丰富的化学知识。
用品 管道通 石灰乳
有效成分 NaOH Ca(OH)2
(1)管道通在使用时禁止与皮肤接触,其原因是_____。
(2)使用石灰乳抹墙,一段时间后变硬的原因_____(用化学方程式回答)。
12.宏观现象,微观本质。请用粒子观点,简单解释下列现象:
(1)用体温计测量体温时水银柱上升,这是因为水银受热时汞原子之间的_____________;
(2)一氧化碳和二氧化碳的化学性质不同,这是因为它们的_____________不同;
(3)苏打水能导电是因为苏打水中含有能自由移动的_____________。
13.为除去某NaCl溶液中的MgSO4、CaCl2杂质,实验室设计如下方案进行操作:
a.加过量Ba(OH)2溶液;b.过滤;c.加过量Na2CO3溶液;d.加适量稀盐酸。
(1). 写出以上操作合理的先后顺序(用字母表示,每个操作限用一次)。
(2). 以上操作中产生的沉淀共有多少种?
(3). 写出加入稀盐酸时发生中和反应的化学方程式。
三、推断题
14.宇轩同学在厨房里取得一种白色粉末A,到化学实验室进行探究,结果如图:
请回答下列问题:
(1)若A不含氢元素,则A与澄清石灰水反应的化学方程式为_______,其反应的基本类型是_______。
(2)若A含有氢元素,则它与盐酸反应的化学方程式为_______。
(3)B溶液中含有的微粒为_______。(用化学用语填空)
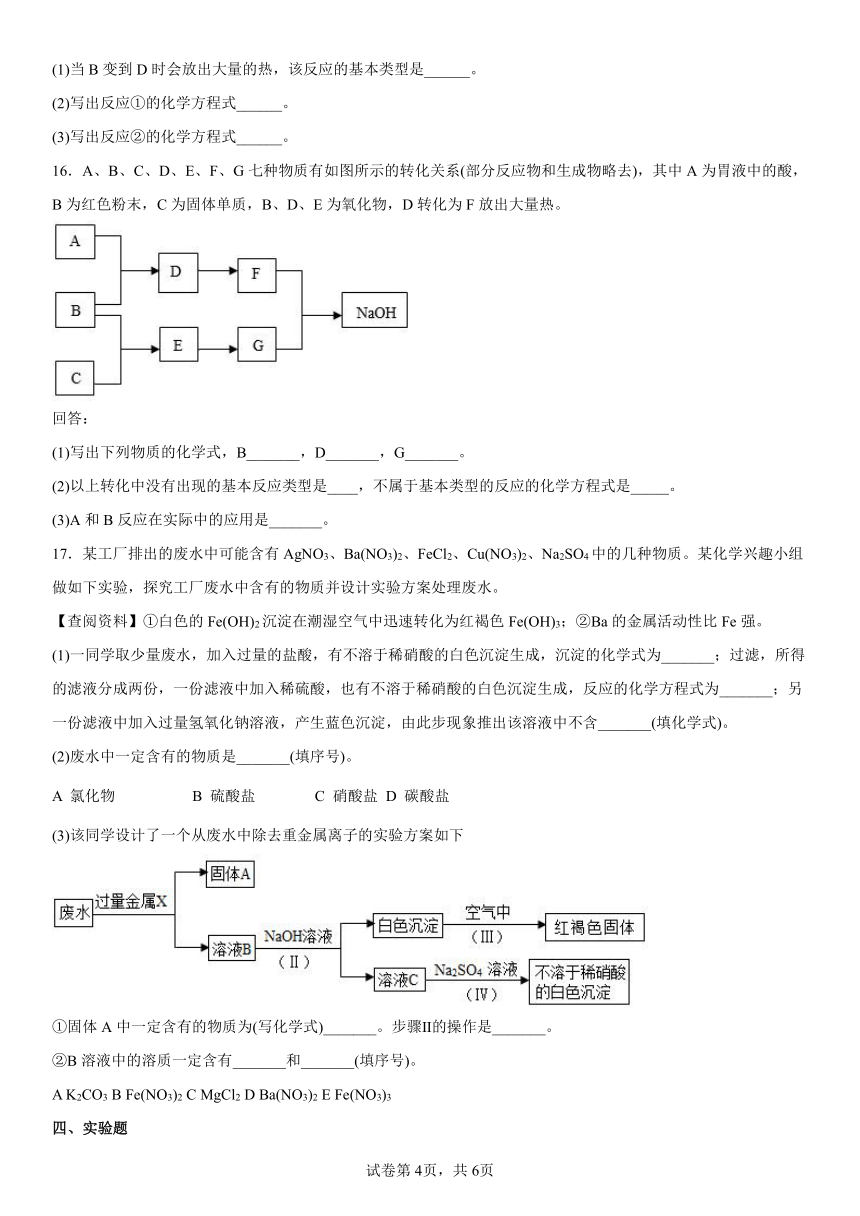
15.A、B、C、D是初中化学常见的几种物质,它们之间有如图所示的转化关系,其中A是石灰石的主要成分。请回答:
(1)当B变到D时会放出大量的热,该反应的基本类型是______。
(2)写出反应①的化学方程式______。
(3)写出反应②的化学方程式______。
16.A、B、C、D、E、F、G七种物质有如图所示的转化关系(部分反应物和生成物略去),其中A为胃液中的酸,B为红色粉末,C为固体单质,B、D、E为氧化物,D转化为F放出大量热。
回答:
(1)写出下列物质的化学式,B_______,D_______,G_______。
(2)以上转化中没有出现的基本反应类型是____,不属于基本类型的反应的化学方程式是_____。
(3)A和B反应在实际中的应用是_______。
17.某工厂排出的废水中可能含有AgNO3、Ba(NO3)2、FeCl2、Cu(NO3)2、Na2SO4中的几种物质。某化学兴趣小组做如下实验,探究工厂废水中含有的物质并设计实验方案处理废水。
【查阅资料】①白色的Fe(OH)2沉淀在潮湿空气中迅速转化为红褐色Fe(OH)3;②Ba的金属活动性比Fe强。
(1)一同学取少量废水,加入过量的盐酸,有不溶于稀硝酸的白色沉淀生成,沉淀的化学式为_______;过滤,所得的滤液分成两份,一份滤液中加入稀硫酸,也有不溶于稀硝酸的白色沉淀生成,反应的化学方程式为_______;另一份滤液中加入过量氢氧化钠溶液,产生蓝色沉淀,由此步现象推出该溶液中不含_______(填化学式)。
(2)废水中一定含有的物质是_______(填序号)。
A 氯化物 B 硫酸盐 C 硝酸盐 D 碳酸盐
(3)该同学设计了一个从废水中除去重金属离子的实验方案如下
①固体A中一定含有的物质为(写化学式)_______。步骤Ⅱ的操作是_______。
②B溶液中的溶质一定含有_______和_______(填序号)。
A K2CO3 B Fe(NO3)2 C MgCl2 D Ba(NO3)2 E Fe(NO3)3
四、实验题
18.某兴趣小组的同学探究分子的运动,实验如图所示。图中试管A和装置D的试管中装有体积和浓度相同的浓氨水,试管B和C中装有体积和浓度相同的酚酞溶液。
(1)实验前,另取少量酚酞溶液,向其中滴加浓氨水,观察到酚酞溶液变红。这一操作的目的是 ________________________ 。
(2)实验①和实验②都会出现的现象是 _________ ,但出现此现象的快慢不同。
(3)从微观的角度解释产生上述现象快慢不同的原因是 __________________ 。
19.如图是同学们所熟悉的实验装置,请根据题目要求回答有关问题:
(1)写出仪器的名称:①_______。
(2)实验室若用A装置制备氧气,反应的化学方程式为_______。
(3)在实验室里若要制取二氧化碳气体,发生装置选择_______(填字母代号),若要得到干燥二氧化碳,还要用到G装置,则G装置所盛试剂名称是_______。
五、计算题
20.尿素〔CO(NH2)2〕是化肥中最主要的一种,其含氮量高,在土壤中不残留任何有害物质,长期施用没有不良影响。
(1)尿素属于化肥中的______肥(填“氮”“钾”或“复合”)。
(2)CO(NH2)2中共含有______(写数字)种元素;
(3)CO(NH2)2的相对分子质量是______
(4)CO(NH2)2中C、H、N、O元素的质量比为______。
21.取一定质量的碳酸钙,高温加热一段时间后,得到氧化钙和碳酸钙的固体混合物。其中碳、氧元素质量比为3:14,那么该固体混合物中氧化钙和碳酸钙的质量比为______;取该固体混合物25.6g,加入溶质质量分数10%的稀盐酸219g,恰好完全反应,将得到的溶液蒸发、结晶,最后得到固体的质量为_____g。
22.同学们从山上采集到一种石灰石,他们取80g该样品进行煅烧实验(所含杂质在煅烧过程中不发生变化),反应结束后剩余固体的质量为75.6g。
(1)当石灰石完全反应后,生成CO2的质量为_____g。
(2)根据反应的化学方程式求该石灰石中CaCO3的质量为多少?写出计算过程。
23.将含有杂质的某氯化钠样品3g溶于足量水中,再向所得溶液中滴入200g一定溶质的质量分数的硝酸银溶液(杂质不与AgNO3溶液反应)。生成沉淀的质量与滴入硝酸银溶液的质量关系如图所示。(提示:NaCl + AgNO3 = AgCl↓+ NaNO3)试计算:
(1)恰好完全反应时生成沉淀质量为 g;
(2)该硝酸银溶液中溶质的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.C
3.A
4.C
5.C
6.C
7.C
8.D
9.A
10.B
11. 氢氧化钠具有强烈的腐蚀性 Ca(OH)2+CO2═CaCO3↓+H2O
12. 间隔变大 分子构成或分子结构 离子
13.(1)acbd
(2)4
(3)
14. 复分解反应 Na+、Cl- 、H2O
15.(1)化合反应
(2)CaCO3CaO+CO2↑
(3)Ca(OH)2+CO2=CaCO3↓+H2O
16.(1) Fe2O3 H2O Na2CO3
(2) 分解反应 CO2+2NaOH=Na2CO3+H2O
(3)除铁锈
17. AgCl Ba(NO3)2+H2SO4═BaSO4↓+2HNO3 FeCl2、Na2SO4 C Fe、Ag和Cu 过滤 B D
18. 探究浓氨水和酚酞溶液接触是否有变化(变红) 酚酞溶液变红 D中氨水温度比B高,D中氨气分子运动速率比B快,所以C中酚酞溶液先变红。
19. 长颈漏斗 2KClO32KCl+3O2↑ B或C 浓硫酸
20.(1)尿素中含有氮元素,属于化肥中的氮肥。
(2)CO(NH2)2中共含有C、O、N、H,4种元素;
(3)CO(NH2)2的相对分子质量是12+16+(14+1×2)×2=60;
(4)CO(NH2)2中C、H、N、O元素的质量比为12:(1×4):(14×2):16=3:1:7:4。
21. 7:25 33.3
22.(1)4.4g
(2)解:设样品中含CaCO3的质量为x
解得x=10g,
答:样品中碳酸钙的质量为10g。
23.(1)5.74
(2解:设硝酸银溶液中溶质的质量为x
x=6.8g
答:硝酸银溶液中溶质的质量分数6.8%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列是一些食物的近似pH,其中酸性最强的是
食物 苹果 菠菜 牛奶 鸡蛋清
pH 2.9-3.3 5.1-5.7 6.3-6.6 7.6-8.0
A.苹果 B.菠菜 C.牛奶 D.鸡蛋清
2.M是一种金属元素,M2+与其它几种离子构成的化合物的溶解性见表,根据以上信息,判断下列反应肯定不能发生的是
O2- OH- Cl-
M2+ 难溶 难溶 难溶 易溶 易溶 易溶
A.MCl2+NaOH B.MSO4+Ba(NO3)2 C.M(NO3)2+ NaCl D.MO+H2SO4
3.某无色混合气体可能由CH4、H2、CO、CO2和HCl中的若干种气体组成,将此混合气体通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小,把剩余气体导出后,在O2中能够点燃,燃烧产物不能使白色CuSO4粉末变蓝色。则原混合气体中一定含有
A.HCl和CO B.HC1、H2和CO2 C.CH4和H2 D.CO和CO2
4.除去难溶性杂质后的食盐中往往含有少量的Na2SO4、MgCl2、CaCl2等杂质,为了将这些杂质除去,可向食盐溶液中加入过量的NaOH、Na2CO3、BaCl2溶液,然后过滤除去沉淀,再加入盐酸调至溶液pH=7,最后经蒸发得到精盐。下列操作及加入溶液顺序不正确的是
A.BaCl2、Na2CO3、NaOH、过滤、HCl B.BaCl2、NaOH、Na2CO3、过滤、HCl
C.Na2CO3、BaCl2、NaOH、过滤、HCl D.NaOH、BaCl2、Na2CO3、过滤、HCl
5.下列关于实验现象的描述正确的是
A.氢气在空气中燃烧,产生白色火焰
B.木炭在氧气中燃烧,产生黄色火焰
C.加热碳酸氢铵,生成有刺激性气味的气体
D.铁丝在氧气中生成四氧化三铁
6.下列实验操作错误的是
A.倾倒液体 B.读取液体体积
C.稀释浓硫酸 D.加热试管中液体
7.下列方法能达到除杂目的的是
选项 物质(括号内为杂质) 方法
A CH4(CO) 点燃混合气体
B 铜粉(碳粉) 在空气中灼烧固体混合物
C O2(水蒸气) 将混合气体通过浓硫酸
D ZnSO4溶液(CuSO4) 加入过量的铁粉,过滤
A.A B.B C.C D.D
8.现有4种白色固体:①氯化铵;②氯化钡;③无水硫酸铜;④硫酸钠。不使用其他试剂(可以用水)就可以把它们区分开来,区分出来的先后顺序为
A.②③④① B.②④③① C.③①④② D.③②④①
9.用如图装置进行实验,将装置倾斜,使管①、②处的药品接触,观察到气球鼓起,一段时间后又恢复原状。下列药品符合该实验现象的是
A.生石灰和水 B.锌粒和稀盐酸
C.二氧化锰和过氧化氢溶液 D.大理石和稀盐酸
10.下列各组物质的溶液,不另加试剂就无法将它们鉴别出来的是
A.BaCl2、CuSO4、NaOH、NaCl B.Na2SO4、BaCl2、K2CO3、KNO3
C.FeCl3、NaOH、MgSO4、Ba(NO3)2 D.KCl、Na2CO3、Ca(NO3)2、HCl
二、简答题
11.生活用品中蕴含着丰富的化学知识。
用品 管道通 石灰乳
有效成分 NaOH Ca(OH)2
(1)管道通在使用时禁止与皮肤接触,其原因是_____。
(2)使用石灰乳抹墙,一段时间后变硬的原因_____(用化学方程式回答)。
12.宏观现象,微观本质。请用粒子观点,简单解释下列现象:
(1)用体温计测量体温时水银柱上升,这是因为水银受热时汞原子之间的_____________;
(2)一氧化碳和二氧化碳的化学性质不同,这是因为它们的_____________不同;
(3)苏打水能导电是因为苏打水中含有能自由移动的_____________。
13.为除去某NaCl溶液中的MgSO4、CaCl2杂质,实验室设计如下方案进行操作:
a.加过量Ba(OH)2溶液;b.过滤;c.加过量Na2CO3溶液;d.加适量稀盐酸。
(1). 写出以上操作合理的先后顺序(用字母表示,每个操作限用一次)。
(2). 以上操作中产生的沉淀共有多少种?
(3). 写出加入稀盐酸时发生中和反应的化学方程式。
三、推断题
14.宇轩同学在厨房里取得一种白色粉末A,到化学实验室进行探究,结果如图:
请回答下列问题:
(1)若A不含氢元素,则A与澄清石灰水反应的化学方程式为_______,其反应的基本类型是_______。
(2)若A含有氢元素,则它与盐酸反应的化学方程式为_______。
(3)B溶液中含有的微粒为_______。(用化学用语填空)
15.A、B、C、D是初中化学常见的几种物质,它们之间有如图所示的转化关系,其中A是石灰石的主要成分。请回答:
(1)当B变到D时会放出大量的热,该反应的基本类型是______。
(2)写出反应①的化学方程式______。
(3)写出反应②的化学方程式______。
16.A、B、C、D、E、F、G七种物质有如图所示的转化关系(部分反应物和生成物略去),其中A为胃液中的酸,B为红色粉末,C为固体单质,B、D、E为氧化物,D转化为F放出大量热。
回答:
(1)写出下列物质的化学式,B_______,D_______,G_______。
(2)以上转化中没有出现的基本反应类型是____,不属于基本类型的反应的化学方程式是_____。
(3)A和B反应在实际中的应用是_______。
17.某工厂排出的废水中可能含有AgNO3、Ba(NO3)2、FeCl2、Cu(NO3)2、Na2SO4中的几种物质。某化学兴趣小组做如下实验,探究工厂废水中含有的物质并设计实验方案处理废水。
【查阅资料】①白色的Fe(OH)2沉淀在潮湿空气中迅速转化为红褐色Fe(OH)3;②Ba的金属活动性比Fe强。
(1)一同学取少量废水,加入过量的盐酸,有不溶于稀硝酸的白色沉淀生成,沉淀的化学式为_______;过滤,所得的滤液分成两份,一份滤液中加入稀硫酸,也有不溶于稀硝酸的白色沉淀生成,反应的化学方程式为_______;另一份滤液中加入过量氢氧化钠溶液,产生蓝色沉淀,由此步现象推出该溶液中不含_______(填化学式)。
(2)废水中一定含有的物质是_______(填序号)。
A 氯化物 B 硫酸盐 C 硝酸盐 D 碳酸盐
(3)该同学设计了一个从废水中除去重金属离子的实验方案如下
①固体A中一定含有的物质为(写化学式)_______。步骤Ⅱ的操作是_______。
②B溶液中的溶质一定含有_______和_______(填序号)。
A K2CO3 B Fe(NO3)2 C MgCl2 D Ba(NO3)2 E Fe(NO3)3
四、实验题
18.某兴趣小组的同学探究分子的运动,实验如图所示。图中试管A和装置D的试管中装有体积和浓度相同的浓氨水,试管B和C中装有体积和浓度相同的酚酞溶液。
(1)实验前,另取少量酚酞溶液,向其中滴加浓氨水,观察到酚酞溶液变红。这一操作的目的是 ________________________ 。
(2)实验①和实验②都会出现的现象是 _________ ,但出现此现象的快慢不同。
(3)从微观的角度解释产生上述现象快慢不同的原因是 __________________ 。
19.如图是同学们所熟悉的实验装置,请根据题目要求回答有关问题:
(1)写出仪器的名称:①_______。
(2)实验室若用A装置制备氧气,反应的化学方程式为_______。
(3)在实验室里若要制取二氧化碳气体,发生装置选择_______(填字母代号),若要得到干燥二氧化碳,还要用到G装置,则G装置所盛试剂名称是_______。
五、计算题
20.尿素〔CO(NH2)2〕是化肥中最主要的一种,其含氮量高,在土壤中不残留任何有害物质,长期施用没有不良影响。
(1)尿素属于化肥中的______肥(填“氮”“钾”或“复合”)。
(2)CO(NH2)2中共含有______(写数字)种元素;
(3)CO(NH2)2的相对分子质量是______
(4)CO(NH2)2中C、H、N、O元素的质量比为______。
21.取一定质量的碳酸钙,高温加热一段时间后,得到氧化钙和碳酸钙的固体混合物。其中碳、氧元素质量比为3:14,那么该固体混合物中氧化钙和碳酸钙的质量比为______;取该固体混合物25.6g,加入溶质质量分数10%的稀盐酸219g,恰好完全反应,将得到的溶液蒸发、结晶,最后得到固体的质量为_____g。
22.同学们从山上采集到一种石灰石,他们取80g该样品进行煅烧实验(所含杂质在煅烧过程中不发生变化),反应结束后剩余固体的质量为75.6g。
(1)当石灰石完全反应后,生成CO2的质量为_____g。
(2)根据反应的化学方程式求该石灰石中CaCO3的质量为多少?写出计算过程。
23.将含有杂质的某氯化钠样品3g溶于足量水中,再向所得溶液中滴入200g一定溶质的质量分数的硝酸银溶液(杂质不与AgNO3溶液反应)。生成沉淀的质量与滴入硝酸银溶液的质量关系如图所示。(提示:NaCl + AgNO3 = AgCl↓+ NaNO3)试计算:
(1)恰好完全反应时生成沉淀质量为 g;
(2)该硝酸银溶液中溶质的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.C
3.A
4.C
5.C
6.C
7.C
8.D
9.A
10.B
11. 氢氧化钠具有强烈的腐蚀性 Ca(OH)2+CO2═CaCO3↓+H2O
12. 间隔变大 分子构成或分子结构 离子
13.(1)acbd
(2)4
(3)
14. 复分解反应 Na+、Cl- 、H2O
15.(1)化合反应
(2)CaCO3CaO+CO2↑
(3)Ca(OH)2+CO2=CaCO3↓+H2O
16.(1) Fe2O3 H2O Na2CO3
(2) 分解反应 CO2+2NaOH=Na2CO3+H2O
(3)除铁锈
17. AgCl Ba(NO3)2+H2SO4═BaSO4↓+2HNO3 FeCl2、Na2SO4 C Fe、Ag和Cu 过滤 B D
18. 探究浓氨水和酚酞溶液接触是否有变化(变红) 酚酞溶液变红 D中氨水温度比B高,D中氨气分子运动速率比B快,所以C中酚酞溶液先变红。
19. 长颈漏斗 2KClO32KCl+3O2↑ B或C 浓硫酸
20.(1)尿素中含有氮元素,属于化肥中的氮肥。
(2)CO(NH2)2中共含有C、O、N、H,4种元素;
(3)CO(NH2)2的相对分子质量是12+16+(14+1×2)×2=60;
(4)CO(NH2)2中C、H、N、O元素的质量比为12:(1×4):(14×2):16=3:1:7:4。
21. 7:25 33.3
22.(1)4.4g
(2)解:设样品中含CaCO3的质量为x
解得x=10g,
答:样品中碳酸钙的质量为10g。
23.(1)5.74
(2解:设硝酸银溶液中溶质的质量为x
x=6.8g
答:硝酸银溶液中溶质的质量分数6.8%
答案第1页,共2页
答案第1页,共2页
