第八章常见的酸碱盐章末练习-2021-2022学年九年级化学科粤版(2012)下册(word版有答案)
文档属性
| 名称 | 第八章常见的酸碱盐章末练习-2021-2022学年九年级化学科粤版(2012)下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 357.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-07 19:00:58 | ||
图片预览



文档简介
第八章 常见的酸碱盐 章末练习
一、单选题
1.下列有关物质的性质与用途对应关系正确的是
A.石墨质软,可用作电池电极
B.氮气难溶于水,可用作保护气
C.活性炭具有吸附性,可使硬水软化
D.生石灰与水反应,可做干燥剂
2.物质酸碱性对生命活动具有重要意义。一些食物的pH范围如下表所示,其中碱性最强的是
食物 西红柿 鸡蛋清 胡萝卜 西瓜
pH 4.0~4.4 7.6~8.0 4.9~5.2 5.2~5.8
A.西红柿 B.鸡蛋清 C.胡萝卜 D.西瓜
3.物质的性质决定其用途。下列有关物质用途的说法正确的是
A.液态氮气可用于冷藏血液
B.氧气可作为推进火箭上天的高能燃料
C.烧碱用于治疗胃酸过多
D.石灰石用于改良酸性土壤
4.下列指定反应的化学方程式正确的是
A.实验室用双氧水制氧气:
B.碳酸氢铵受热分解:
C.铁丝和稀盐酸反应:
D.电解饱和食盐水:
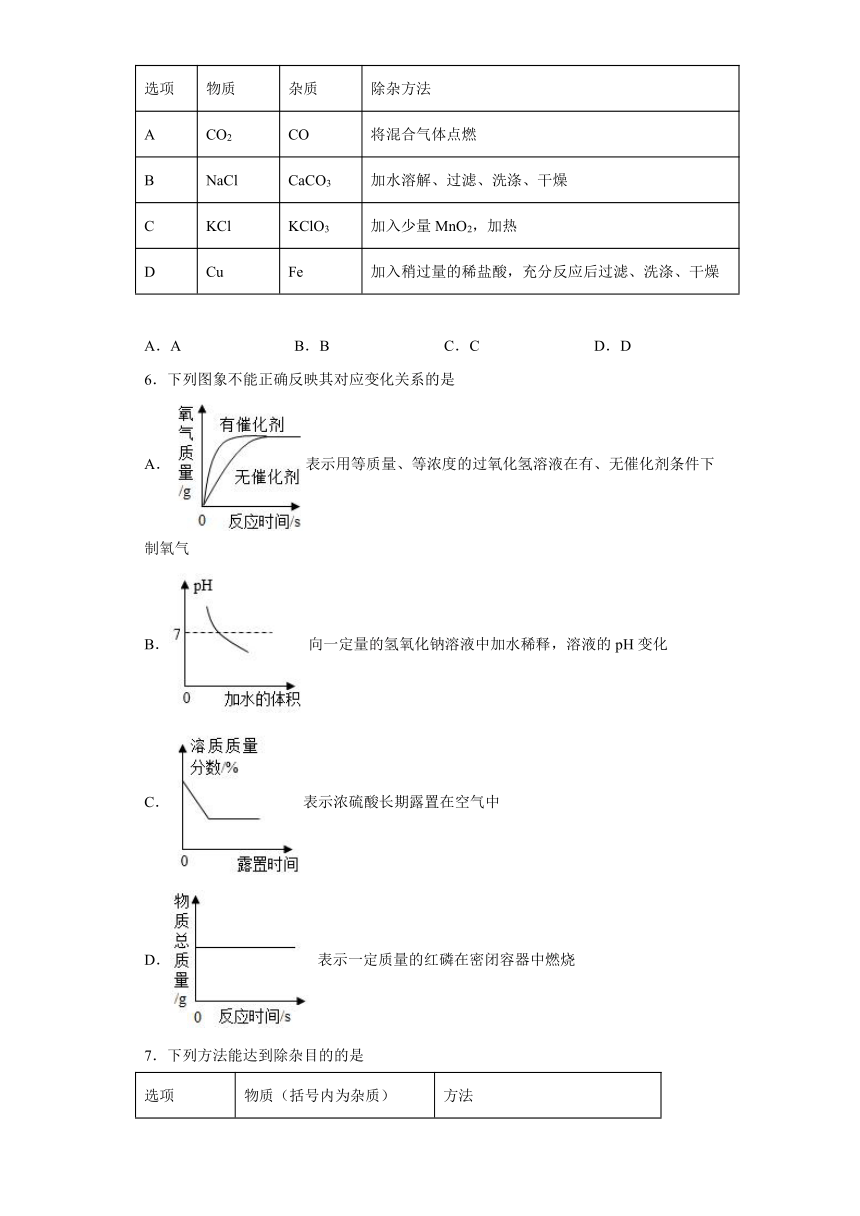
5.下列除去物质中少量杂质的方法正确的是
选项 物质 杂质 除杂方法
A CO2 CO 将混合气体点燃
B NaCl CaCO3 加水溶解、过滤、洗涤、干燥
C KCl KClO3 加入少量MnO2,加热
D Cu Fe 加入稍过量的稀盐酸,充分反应后过滤、洗涤、干燥
A.A B.B C.C D.D
6.下列图象不能正确反映其对应变化关系的是
A.表示用等质量、等浓度的过氧化氢溶液在有、无催化剂条件下制氧气
B.向一定量的氢氧化钠溶液中加水稀释,溶液的pH变化
C.表示浓硫酸长期露置在空气中
D.表示一定质量的红磷在密闭容器中燃烧
7.下列方法能达到除杂目的的是
选项 物质(括号内为杂质) 方法
A CH4(CO) 点燃混合气体
B 铜粉(碳粉) 在空气中灼烧固体混合物
C O2(水蒸气) 将混合气体通过浓硫酸
D ZnSO4溶液(CuSO4) 加入过量的铁粉,过滤
A.A B.B C.C D.D
8.下列有关生产、环保、资源问题叙述错误的是
A.长期使用硫酸铵会使土壤酸化、板结,应将硫酸铵与熟石灰混合使用
B.“温室效应”主要是由二氧化碳等气体引起的
C.pH<5.6的降水称为酸雨,它的形成与大气中SO2等气体有关
D.煤和石油是不可再生资源,综合利用可以提高其利用率
9.下列有关硫元素的价类二维图判断正确的是
A.A点表示的物质类别是碱
B.B点可以表示SO2
C.C点对应的物质能和氢氧化钠溶液反应生成D点对应的物质
D.D点一定为K2SO4
二、简答题
10.(1)焊接铁制品时常用稀硫酸除去铁锈(主要成分为氧化铁)。写出该反应的化学方程式_____;
(2)为了防止铁制品锈蚀,除了保持其干燥洁净外,还可刷防锈漆,原理是_____;
(3)厨房里为了洗去碗筷上的油污常常向水中加入少量的洗洁精,利用的原理是_____。
11.实验室有四瓶标签脱落的化肥试剂,只知道他们分别是硝酸铵、碳酸氢铵、磷矿粉、尿素中的一种。
(1)取少量上述四种化肥观察,从外观上即可与其他化肥区分出来的是哪一种__________?
(2)请设计实验鉴别剩余三种化肥(简要写出实验步骤、现象和结论)__________。
12.在5mL氢氧化钠溶液中滴加2滴酚酞试液,溶液呈______色,再加入5mL稀盐酸,得到无色溶液,则无色溶液一定是_________。
Ⅰ pH≤7
Ⅱ pH=7
Ⅲ pH <7
ⅣpH>7
将无色溶液蒸发至干,看到的现象是____________。
若将40克10%氢氧化钠溶液和足量稀盐酸反应,计算生成氯化钠的物质的量。(根据化学方程式计算)_______
三、推断题
13.下图是常见物质之间的转化关系,其中A为常见的干燥剂,E为最常见的液体。请回答:
(1)A的化学式为______。
(2)B所属的物质类别为______。
(3)写出B和D反应生成C和F的化学方程式______。
(4)说出物质C在生活中的用途______(填一条即可)。
14.实验老师请化学兴趣小组的同学帮助他将失去标签的盐酸、氢氧化钠和硝酸钾三瓶溶液鉴别出来,重新贴好标签。为了鉴别这三种溶液,他们用试管各取三种溶液少许,编号为A、B、C,分别滴加酚酞试液,观察到A溶液变红色,B、C两溶液无变化;另用两支试管再各取B、C少许,分别滴加碳酸钠溶液,观察到C溶液有气泡产生,B溶液无变化。根据上述实验现象,请你推测:
(1)A溶液中溶质的化学式为___________,B溶液中溶质的化学式为_______________;
(2)C溶液滴加碳酸钠溶液后发生反应的化学方程式为_________。
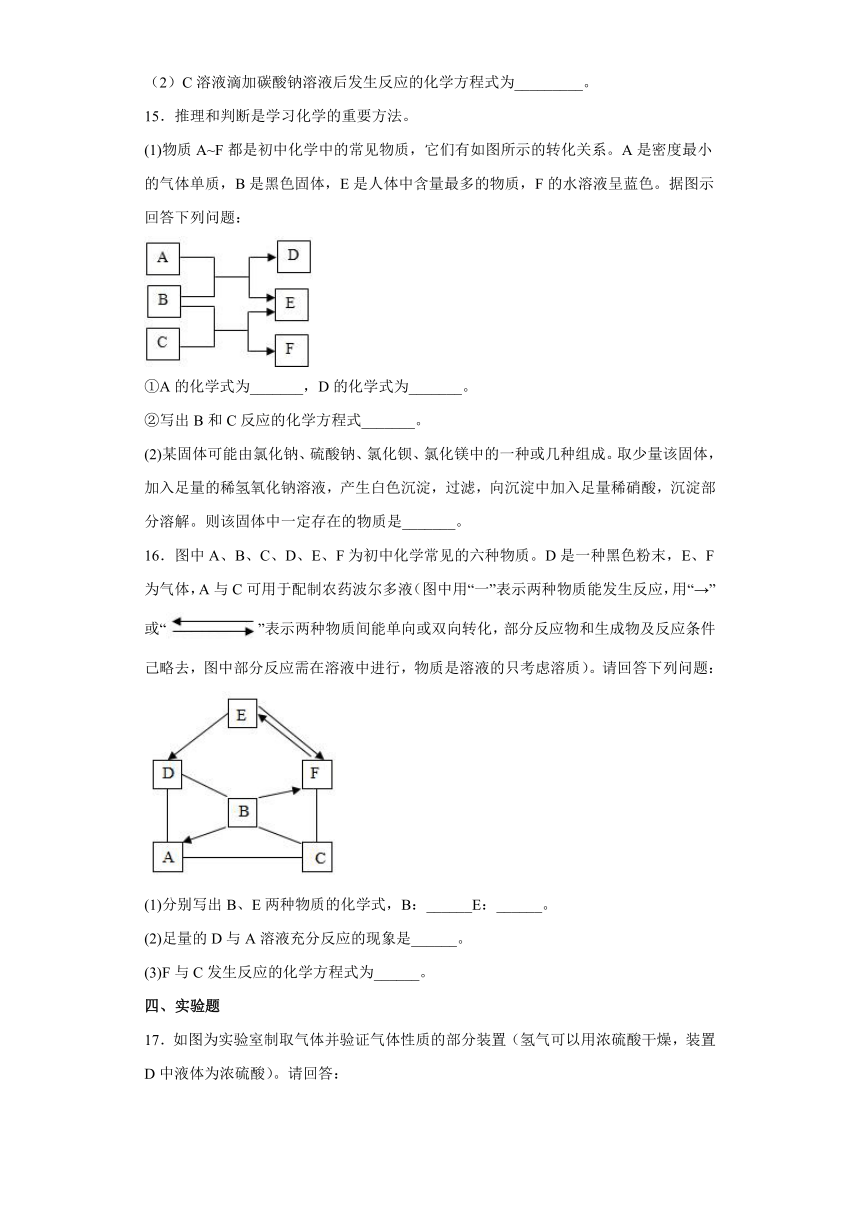
15.推理和判断是学习化学的重要方法。
(1)物质A~F都是初中化学中的常见物质,它们有如图所示的转化关系。A是密度最小的气体单质,B是黑色固体,E是人体中含量最多的物质,F的水溶液呈蓝色。据图示回答下列问题:
①A的化学式为_______,D的化学式为_______。
②写出B和C反应的化学方程式_______。
(2)某固体可能由氯化钠、硫酸钠、氯化钡、氯化镁中的一种或几种组成。取少量该固体,加入足量的稀氢氧化钠溶液,产生白色沉淀,过滤,向沉淀中加入足量稀硝酸,沉淀部分溶解。则该固体中一定存在的物质是_______。
16.图中A、B、C、D、E、F为初中化学常见的六种物质。D是一种黑色粉末,E、F为气体,A与C可用于配制农药波尔多液(图中用“一”表示两种物质能发生反应,用“→”或“”表示两种物质间能单向或双向转化,部分反应物和生成物及反应条件己略去,图中部分反应需在溶液中进行,物质是溶液的只考虑溶质)。请回答下列问题:
(1)分别写出B、E两种物质的化学式,B:______E:______。
(2)足量的D与A溶液充分反应的现象是______。
(3)F与C发生反应的化学方程式为______。
四、实验题
17.如图为实验室制取气体并验证气体性质的部分装置(氢气可以用浓硫酸干燥,装置D中液体为浓硫酸)。请回答:
(1)用A装置制取氧气的化学方程式是______。
(2)实验室制取二氧化碳所用的药品是______。将B、E装置组合制取并验证二氧化碳的性质,验证后加热E试管中的液体,观察的到的现象是______。
(3)实验室用锌粒和稀硫酸反应制取并收集干燥的氢气,请填写所选装置导管口字母的连接顺序______。
18.通过一年的学习,你已经掌握了实验室制取气体的有关知识,请结合图回答相关问题:
(1)写出图中标有序号的仪器名称①_____。
(2)实验室欲使用高锰酸钾制取氧气,可选择 _____的组合来制取并收集氧气。
(3)实验室要收集一瓶干燥的二氧化碳。干燥二氧化碳需将气体通过盛有 _____洗气瓶(填物质名称)。
(4)要鉴别氧气和二氧化碳,可选择 。
A.无色酚酞溶液
B.燃着的木条
C.澄清石灰水
D.紫色石蕊溶液
19.某化学兴趣小组为验证硫酸的部分化学性质,进行了如下实验。
(1)实验一:向装有CuO的试管中加入一定量的稀硫酸,观察到氧化铜完全溶解并得到蓝色溶液,该反应的化学方程式为________;
实验二:向装有NaOH溶液的试管中加入一定量的稀硫酸,没有观察到明显现象;
(2)实验三:为了证明NaOH溶液和稀硫酸发生了反应,该组同学设计了如图一所示实验,传感器测定的pH和温度随溶液质量变化情况见图二、图三。
则B溶液是________,图三中的M与图二中X、Y、Z中的________数值相等;
(3)实验四:将实验一和实验二所得溶液混合得到蓝色沉淀,则实验二所得溶液的溶质为___。
五、计算题
20.尿素〔CO(NH2)2〕是化肥中最主要的一种,其含氮量高,在土壤中不残留任何有害物质,长期施用没有不良影响。
(1)尿素属于化肥中的______肥(填“氮”“钾”或“复合”)。
(2)CO(NH2)2中共含有______(写数字)种元素;
(3)CO(NH2)2的相对分子质量是______
(4)CO(NH2)2中C、H、N、O元素的质量比为______。
21.NaOH是重要的化工原料,研究其制备、检验、贮存及应用具有重要意义。某工厂化验室用20% NaOH溶液洗涤一定量石油产品中残余H2SO4,共消耗NaOH溶液20g,洗涤后的溶液呈中性。计算这一定量石油产品中所含H2SO4的质量_____(写出计算过程)。
22.将40g由氯化钠和碳酸钠组成的固体混合物溶于100g足量水中,再向所得溶液中滴加氯化钙溶液,生成沉淀的质量与加入氯化钙溶液质量的关系如图所示。(Ca的相对原子质量:40),试回答:
(1)沉淀质量m= 。
(2)A点溶质是 (填化学式)
(3)恰好完全反应时所得溶液中溶质的质量分数。
试卷第1页,共3页
参考答案:
1.D
2.B
3.A
4.D
5.D
6.B
7.C
8.A
9.C
10. Fe2O3+3H2SO4=Fe2(SO4)3 +3H2O 隔绝空气(氧气)和水 乳化作用
11. 磷矿粉 取三种化肥少许,分别加熟石灰研磨,有刺激性气味产生的是碳酸氢铵和硝酸铵,无刺激性气味产生的是尿素,再取适量能产生刺激性气味的化肥于试管中,分别加入稀盐酸,产生气泡的是碳酸氢铵,无明显现象的是硝酸铵。
12. 红 Ⅰ 白色固体 0.1mol
13. CaO 碱 补钙(合理即可)
14. NaOH KNO3
15.(1) H2 Cu
(2)硫酸钠、氯化钡、氯化镁
16.(1) H2SO CO
(2)黑色固体表面覆盖一层紫红色固体,溶液由蓝色变为浅绿色
(3)CO2+Ca(OH)2=CaCO3↓+H2O
17.(1)
(2) 大理石或石灰石和稀盐酸 红色变紫色
(3)befdc
18.(1)试管
(2)BC或BD
(3)浓硫酸
(4)BCD
19.(1)
(2) 稀硫酸 Y
(3)硫酸钠和氢氧化钠
20.(1)尿素中含有氮元素,属于化肥中的氮肥。
(2)CO(NH2)2中共含有C、O、N、H,4种元素;
(3)CO(NH2)2的相对分子质量是12+16+(14+1×2)×2=60;
(4)CO(NH2)2中C、H、N、O元素的质量比为12:(1×4):(14×2):16=3:1:7:4。
21.4.9g
22.(1)15g
(2)NaCl、CaCl2
(3)解:设混合物中碳酸钠的质量为y,生成的氯化钠的质量为z
y=21.2g
z=23.4g
原混合物中NaC1的质量:40-21.2=18.8
溶液中溶质的质量分数=
答:恰好完全反应时所得溶液中溶质的质量分数为21.1%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列有关物质的性质与用途对应关系正确的是
A.石墨质软,可用作电池电极
B.氮气难溶于水,可用作保护气
C.活性炭具有吸附性,可使硬水软化
D.生石灰与水反应,可做干燥剂
2.物质酸碱性对生命活动具有重要意义。一些食物的pH范围如下表所示,其中碱性最强的是
食物 西红柿 鸡蛋清 胡萝卜 西瓜
pH 4.0~4.4 7.6~8.0 4.9~5.2 5.2~5.8
A.西红柿 B.鸡蛋清 C.胡萝卜 D.西瓜
3.物质的性质决定其用途。下列有关物质用途的说法正确的是
A.液态氮气可用于冷藏血液
B.氧气可作为推进火箭上天的高能燃料
C.烧碱用于治疗胃酸过多
D.石灰石用于改良酸性土壤
4.下列指定反应的化学方程式正确的是
A.实验室用双氧水制氧气:
B.碳酸氢铵受热分解:
C.铁丝和稀盐酸反应:
D.电解饱和食盐水:
5.下列除去物质中少量杂质的方法正确的是
选项 物质 杂质 除杂方法
A CO2 CO 将混合气体点燃
B NaCl CaCO3 加水溶解、过滤、洗涤、干燥
C KCl KClO3 加入少量MnO2,加热
D Cu Fe 加入稍过量的稀盐酸,充分反应后过滤、洗涤、干燥
A.A B.B C.C D.D
6.下列图象不能正确反映其对应变化关系的是
A.表示用等质量、等浓度的过氧化氢溶液在有、无催化剂条件下制氧气
B.向一定量的氢氧化钠溶液中加水稀释,溶液的pH变化
C.表示浓硫酸长期露置在空气中
D.表示一定质量的红磷在密闭容器中燃烧
7.下列方法能达到除杂目的的是
选项 物质(括号内为杂质) 方法
A CH4(CO) 点燃混合气体
B 铜粉(碳粉) 在空气中灼烧固体混合物
C O2(水蒸气) 将混合气体通过浓硫酸
D ZnSO4溶液(CuSO4) 加入过量的铁粉,过滤
A.A B.B C.C D.D
8.下列有关生产、环保、资源问题叙述错误的是
A.长期使用硫酸铵会使土壤酸化、板结,应将硫酸铵与熟石灰混合使用
B.“温室效应”主要是由二氧化碳等气体引起的
C.pH<5.6的降水称为酸雨,它的形成与大气中SO2等气体有关
D.煤和石油是不可再生资源,综合利用可以提高其利用率
9.下列有关硫元素的价类二维图判断正确的是
A.A点表示的物质类别是碱
B.B点可以表示SO2
C.C点对应的物质能和氢氧化钠溶液反应生成D点对应的物质
D.D点一定为K2SO4
二、简答题
10.(1)焊接铁制品时常用稀硫酸除去铁锈(主要成分为氧化铁)。写出该反应的化学方程式_____;
(2)为了防止铁制品锈蚀,除了保持其干燥洁净外,还可刷防锈漆,原理是_____;
(3)厨房里为了洗去碗筷上的油污常常向水中加入少量的洗洁精,利用的原理是_____。
11.实验室有四瓶标签脱落的化肥试剂,只知道他们分别是硝酸铵、碳酸氢铵、磷矿粉、尿素中的一种。
(1)取少量上述四种化肥观察,从外观上即可与其他化肥区分出来的是哪一种__________?
(2)请设计实验鉴别剩余三种化肥(简要写出实验步骤、现象和结论)__________。
12.在5mL氢氧化钠溶液中滴加2滴酚酞试液,溶液呈______色,再加入5mL稀盐酸,得到无色溶液,则无色溶液一定是_________。
Ⅰ pH≤7
Ⅱ pH=7
Ⅲ pH <7
ⅣpH>7
将无色溶液蒸发至干,看到的现象是____________。
若将40克10%氢氧化钠溶液和足量稀盐酸反应,计算生成氯化钠的物质的量。(根据化学方程式计算)_______
三、推断题
13.下图是常见物质之间的转化关系,其中A为常见的干燥剂,E为最常见的液体。请回答:
(1)A的化学式为______。
(2)B所属的物质类别为______。
(3)写出B和D反应生成C和F的化学方程式______。
(4)说出物质C在生活中的用途______(填一条即可)。
14.实验老师请化学兴趣小组的同学帮助他将失去标签的盐酸、氢氧化钠和硝酸钾三瓶溶液鉴别出来,重新贴好标签。为了鉴别这三种溶液,他们用试管各取三种溶液少许,编号为A、B、C,分别滴加酚酞试液,观察到A溶液变红色,B、C两溶液无变化;另用两支试管再各取B、C少许,分别滴加碳酸钠溶液,观察到C溶液有气泡产生,B溶液无变化。根据上述实验现象,请你推测:
(1)A溶液中溶质的化学式为___________,B溶液中溶质的化学式为_______________;
(2)C溶液滴加碳酸钠溶液后发生反应的化学方程式为_________。
15.推理和判断是学习化学的重要方法。
(1)物质A~F都是初中化学中的常见物质,它们有如图所示的转化关系。A是密度最小的气体单质,B是黑色固体,E是人体中含量最多的物质,F的水溶液呈蓝色。据图示回答下列问题:
①A的化学式为_______,D的化学式为_______。
②写出B和C反应的化学方程式_______。
(2)某固体可能由氯化钠、硫酸钠、氯化钡、氯化镁中的一种或几种组成。取少量该固体,加入足量的稀氢氧化钠溶液,产生白色沉淀,过滤,向沉淀中加入足量稀硝酸,沉淀部分溶解。则该固体中一定存在的物质是_______。
16.图中A、B、C、D、E、F为初中化学常见的六种物质。D是一种黑色粉末,E、F为气体,A与C可用于配制农药波尔多液(图中用“一”表示两种物质能发生反应,用“→”或“”表示两种物质间能单向或双向转化,部分反应物和生成物及反应条件己略去,图中部分反应需在溶液中进行,物质是溶液的只考虑溶质)。请回答下列问题:
(1)分别写出B、E两种物质的化学式,B:______E:______。
(2)足量的D与A溶液充分反应的现象是______。
(3)F与C发生反应的化学方程式为______。
四、实验题
17.如图为实验室制取气体并验证气体性质的部分装置(氢气可以用浓硫酸干燥,装置D中液体为浓硫酸)。请回答:
(1)用A装置制取氧气的化学方程式是______。
(2)实验室制取二氧化碳所用的药品是______。将B、E装置组合制取并验证二氧化碳的性质,验证后加热E试管中的液体,观察的到的现象是______。
(3)实验室用锌粒和稀硫酸反应制取并收集干燥的氢气,请填写所选装置导管口字母的连接顺序______。
18.通过一年的学习,你已经掌握了实验室制取气体的有关知识,请结合图回答相关问题:
(1)写出图中标有序号的仪器名称①_____。
(2)实验室欲使用高锰酸钾制取氧气,可选择 _____的组合来制取并收集氧气。
(3)实验室要收集一瓶干燥的二氧化碳。干燥二氧化碳需将气体通过盛有 _____洗气瓶(填物质名称)。
(4)要鉴别氧气和二氧化碳,可选择 。
A.无色酚酞溶液
B.燃着的木条
C.澄清石灰水
D.紫色石蕊溶液
19.某化学兴趣小组为验证硫酸的部分化学性质,进行了如下实验。
(1)实验一:向装有CuO的试管中加入一定量的稀硫酸,观察到氧化铜完全溶解并得到蓝色溶液,该反应的化学方程式为________;
实验二:向装有NaOH溶液的试管中加入一定量的稀硫酸,没有观察到明显现象;
(2)实验三:为了证明NaOH溶液和稀硫酸发生了反应,该组同学设计了如图一所示实验,传感器测定的pH和温度随溶液质量变化情况见图二、图三。
则B溶液是________,图三中的M与图二中X、Y、Z中的________数值相等;
(3)实验四:将实验一和实验二所得溶液混合得到蓝色沉淀,则实验二所得溶液的溶质为___。
五、计算题
20.尿素〔CO(NH2)2〕是化肥中最主要的一种,其含氮量高,在土壤中不残留任何有害物质,长期施用没有不良影响。
(1)尿素属于化肥中的______肥(填“氮”“钾”或“复合”)。
(2)CO(NH2)2中共含有______(写数字)种元素;
(3)CO(NH2)2的相对分子质量是______
(4)CO(NH2)2中C、H、N、O元素的质量比为______。
21.NaOH是重要的化工原料,研究其制备、检验、贮存及应用具有重要意义。某工厂化验室用20% NaOH溶液洗涤一定量石油产品中残余H2SO4,共消耗NaOH溶液20g,洗涤后的溶液呈中性。计算这一定量石油产品中所含H2SO4的质量_____(写出计算过程)。
22.将40g由氯化钠和碳酸钠组成的固体混合物溶于100g足量水中,再向所得溶液中滴加氯化钙溶液,生成沉淀的质量与加入氯化钙溶液质量的关系如图所示。(Ca的相对原子质量:40),试回答:
(1)沉淀质量m= 。
(2)A点溶质是 (填化学式)
(3)恰好完全反应时所得溶液中溶质的质量分数。
试卷第1页,共3页
参考答案:
1.D
2.B
3.A
4.D
5.D
6.B
7.C
8.A
9.C
10. Fe2O3+3H2SO4=Fe2(SO4)3 +3H2O 隔绝空气(氧气)和水 乳化作用
11. 磷矿粉 取三种化肥少许,分别加熟石灰研磨,有刺激性气味产生的是碳酸氢铵和硝酸铵,无刺激性气味产生的是尿素,再取适量能产生刺激性气味的化肥于试管中,分别加入稀盐酸,产生气泡的是碳酸氢铵,无明显现象的是硝酸铵。
12. 红 Ⅰ 白色固体 0.1mol
13. CaO 碱 补钙(合理即可)
14. NaOH KNO3
15.(1) H2 Cu
(2)硫酸钠、氯化钡、氯化镁
16.(1) H2SO CO
(2)黑色固体表面覆盖一层紫红色固体,溶液由蓝色变为浅绿色
(3)CO2+Ca(OH)2=CaCO3↓+H2O
17.(1)
(2) 大理石或石灰石和稀盐酸 红色变紫色
(3)befdc
18.(1)试管
(2)BC或BD
(3)浓硫酸
(4)BCD
19.(1)
(2) 稀硫酸 Y
(3)硫酸钠和氢氧化钠
20.(1)尿素中含有氮元素,属于化肥中的氮肥。
(2)CO(NH2)2中共含有C、O、N、H,4种元素;
(3)CO(NH2)2的相对分子质量是12+16+(14+1×2)×2=60;
(4)CO(NH2)2中C、H、N、O元素的质量比为12:(1×4):(14×2):16=3:1:7:4。
21.4.9g
22.(1)15g
(2)NaCl、CaCl2
(3)解:设混合物中碳酸钠的质量为y,生成的氯化钠的质量为z
y=21.2g
z=23.4g
原混合物中NaC1的质量:40-21.2=18.8
溶液中溶质的质量分数=
答:恰好完全反应时所得溶液中溶质的质量分数为21.1%
答案第1页,共2页
答案第1页,共2页
