专题8金属和金属材料单元练习---2021-2022学年九年级化学仁爱版下册(word版有答案)
文档属性
| 名称 | 专题8金属和金属材料单元练习---2021-2022学年九年级化学仁爱版下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 114.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 仁爱科普版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-07 19:11:04 | ||
图片预览


文档简介
专题8 金属和金属材料 单元练习
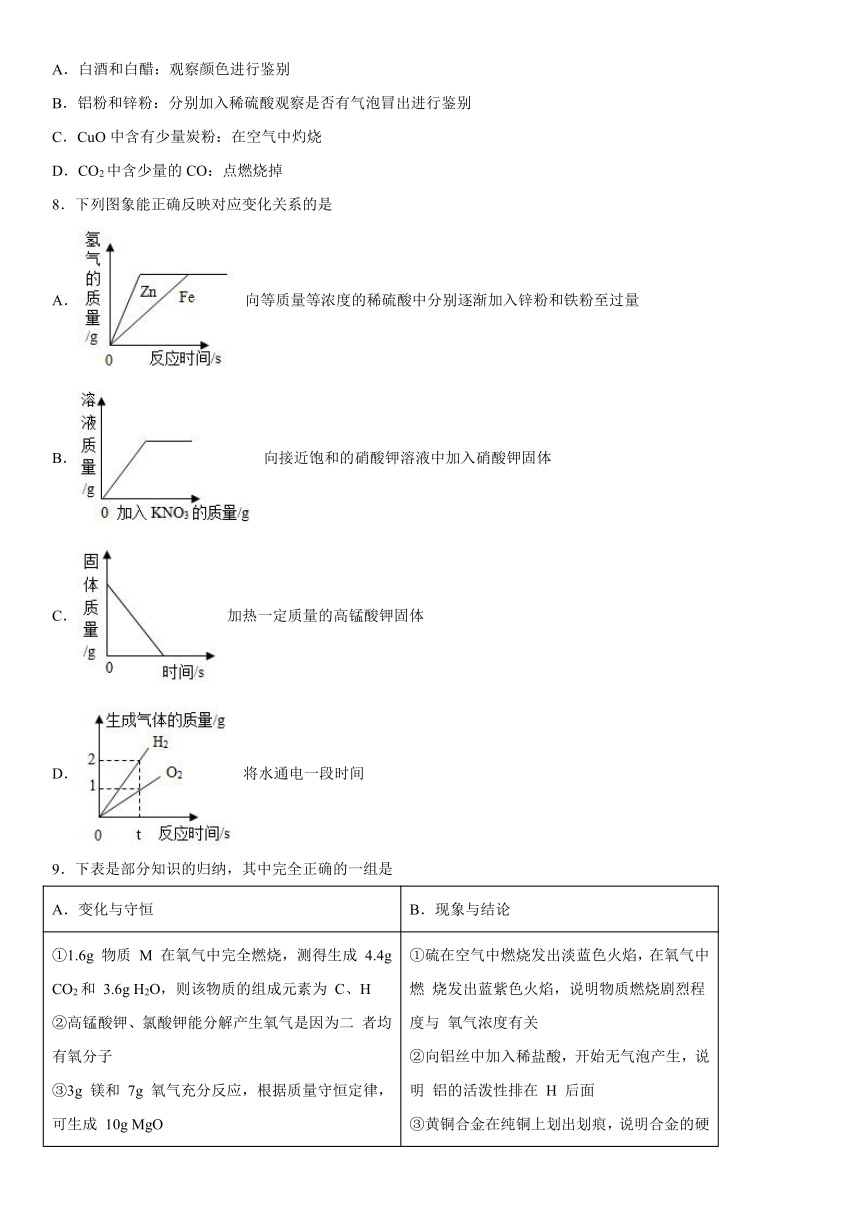
一、单选题
1.物质的性质决定物质的用途。下列物质的用途主要利用物质的化学性质的是
A.由石墨制成的铅笔芯 B.木材用作燃料
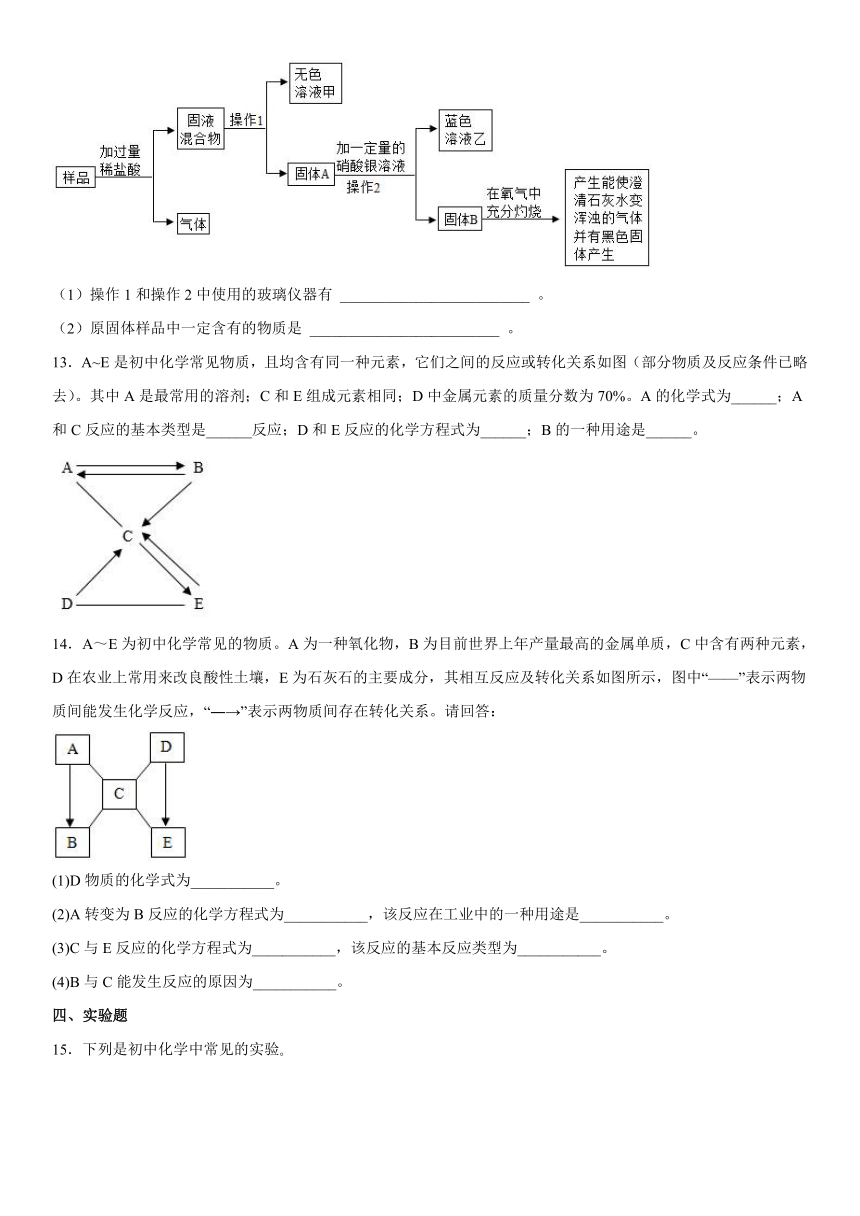
C.干冰用于人工降雨 D.铜丝制成的电线
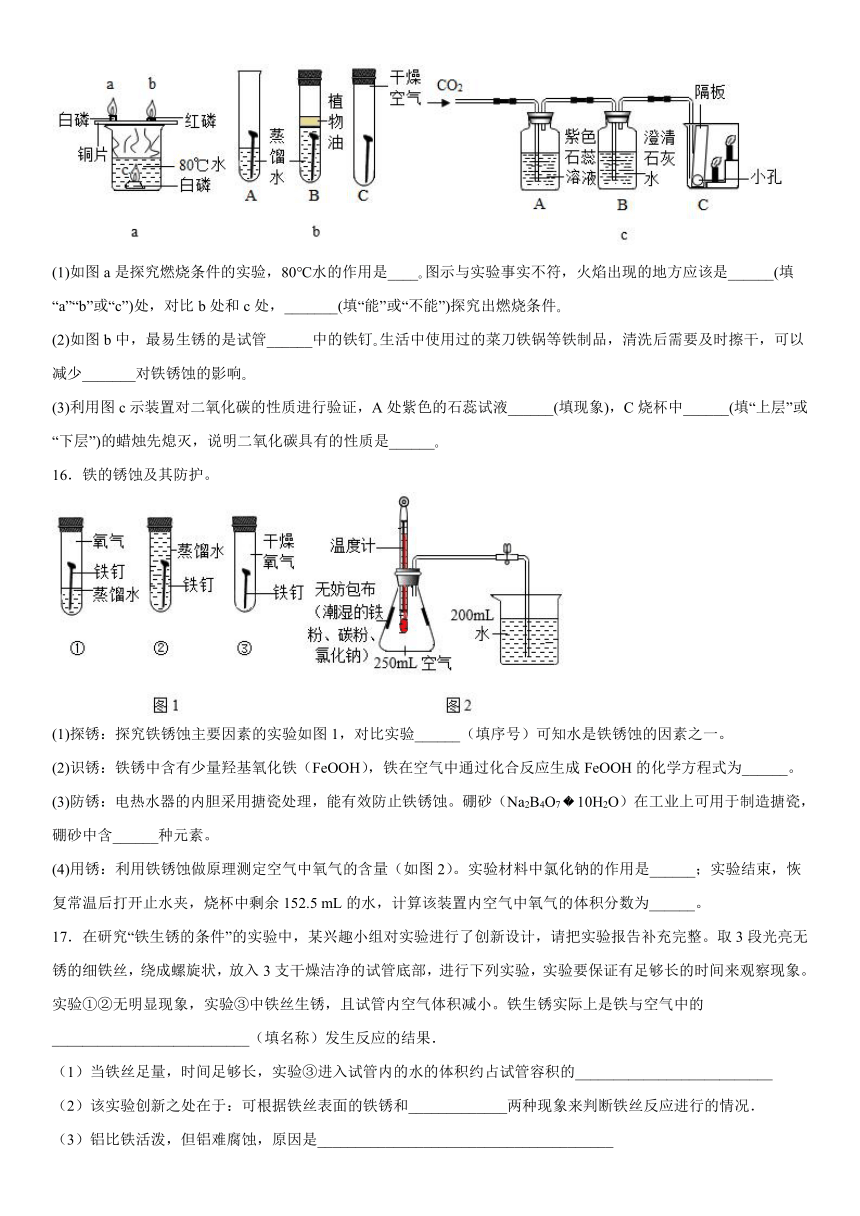
2.下列我国古代发明或技术中,主要原理不是化学变化的是
A.炭黑制墨 B.粮食酿酒 C.湿法冶金 D.燃放烟火
3.下列有关实验现象的描述正确的是
A.打开盛有浓盐酸的试剂瓶瓶塞,瓶口上方出现大量白烟
B.硫在氧气中燃烧产生微弱的淡蓝色火焰
C.铝丝插入硫酸铜溶液中,铝丝表面覆盖一层光亮红色的物质
D.电解水时正极产生的气体体积比负极产生的气体体积大
4.下列实验方案设计不合理的是
选项 实验内容 操作方法
A 鉴别二氧化硫和二氧化碳 闻气味
B 鉴别硬水和软水 加肥皂水
C 除去氮气中混有的一氧化碳 通入灼热的氧化铜
D 除去氧化铜中的铜粉 在氧气流中加热
A.A B.B C.C D.D
5.除去下列物质中混有的少量杂质(括号内为杂质),所用方法正确的是
A.二氧化碳(一氧化碳)——将气体点燃
B.铜(氧化铜)——在空气中加热
C.氯化钾(氯酸钾)——加热
D.二氧化碳(氧气)——通过足量的石灰水
6.下列有关物质用途的说法,不正确的是
A.氯化钠可用作食品调味剂
B.碳酸钙可用作补钙剂
C.生石灰可用作食品干燥剂
D.铁制容器可用来盛装波尔多液
7.下列有关物质的鉴别或除杂操作正确的是
A.白酒和白醋:观察颜色进行鉴别
B.铝粉和锌粉:分别加入稀硫酸观察是否有气泡冒出进行鉴别
C.CuO中含有少量炭粉:在空气中灼烧
D.CO2中含少量的CO:点燃烧掉
8.下列图象能正确反映对应变化关系的是
A. 向等质量等浓度的稀硫酸中分别逐渐加入锌粉和铁粉至过量
B. 向接近饱和的硝酸钾溶液中加入硝酸钾固体
C. 加热一定质量的高锰酸钾固体
D. 将水通电一段时间
9.下表是部分知识的归纳,其中完全正确的一组是
A.变化与守恒 B.现象与结论
①1.6g 物质 M 在氧气中完全燃烧,测得生成 4.4g CO2和 3.6g H2O,则该物质的组成元素为 C、H ②高锰酸钾、氯酸钾能分解产生氧气是因为二 者均有氧分子 ③3g 镁和 7g 氧气充分反应,根据质量守恒定律,可生成 10g MgO ①硫在空气中燃烧发出淡蓝色火焰,在氧气中燃 烧发出蓝紫色火焰,说明物质燃烧剧烈程度与 氧气浓度有关 ②向铝丝中加入稀盐酸,开始无气泡产生,说明 铝的活泼性排在 H 后面 ③黄铜合金在纯铜上划出划痕,说明合金的硬度 比纯金属大
C.化学与生活 D.性质与用途
①在钢铁表面涂油能防止钢铁生锈 ②在山林中遇火灾时,尽量向逆风方向奔跑 ③废旧玻璃、金属、塑料等属于可回收物,有 效回收再利用可节约能源 ①稀有气体可用作电光源利用了其化学性质 ②液氮可用作低温麻醉利用了其化学性质 ③CO2 可用于灭火,仅利用了其不燃烧也不支持 燃烧的性质
A.A B.B C.C D.D
二、简答题
10.钠及其化合物是中学化学学习和研究的重要内容。
(1)钠的核电荷数是11,钠原子的核外有三个电子层,则钠原子的原子结构示意图为______钠离子的符号为______。
(2)钠与水反应生成氢氧化钠和氢气,化学方程式为______,小苏打(NaHCO3)受热可分解成碳酸钠、二氧化碳和水,化学方程式为______;
(3)金属钠的化学性质非常活泼,常温下即可以和氧气、二氧化碳、水等物质反应,因此实验室中少量的钠是保存在煤油中的。由此可知,金属钠的密度______煤油(填“大于“或“小于”)。
(4)已知2Na2O2+2H2O=4NaOH+O2↑;2Na2O2+2CO2=2Na2CO3+O2。实验室散口放置的过氧化钠(Na2O2)已部分变质,取少量该固体样品于试管中,加足量水,可观察到的现象为______。
11.回答下列问题。
(1)铝、铁、铜是三种常见的金属,人类开始使用这三种金属的先后顺序为_____;
(2)金属铝虽然比铁发现的晚,比铁活泼,但是现在应用却比较广泛,因为金属铝比铁耐腐蚀。金属铝耐腐蚀的原因是什么_____
(3)某化学小组用一定量AgNO3和Mg(NO3)2混合溶液进行了右图实验,若加入的锌粉过量,充分反应后过滤,所得固体B中含有的金属物质是_____;滤液A中所含有的溶质化学式是_____。
三、推断题
12.有一包固体粉末,可能含碳、铝、铜、氧化铝、氧化铜中的一种或几种。为探究该固体粉末的组成,某化学兴趣小组进行了如图所示实验:(已知:金属银在空气中加热无明显变化)
(1)操作1和操作2中使用的玻璃仪器有 _________________________ 。
(2)原固体样品中一定含有的物质是 _________________________ 。
13.A~E是初中化学常见物质,且均含有同一种元素,它们之间的反应或转化关系如图(部分物质及反应条件已略去)。其中A是最常用的溶剂;C和E组成元素相同;D中金属元素的质量分数为70%。A的化学式为______;A和C反应的基本类型是______反应;D和E反应的化学方程式为______;B的一种用途是______。
14.A~E为初中化学常见的物质。A为一种氧化物,B为目前世界上年产量最高的金属单质,C中含有两种元素,D在农业上常用来改良酸性土壤,E为石灰石的主要成分,其相互反应及转化关系如图所示,图中“——”表示两物质间能发生化学反应,“―→”表示两物质间存在转化关系。请回答:
(1)D物质的化学式为___________。
(2)A转变为B反应的化学方程式为___________,该反应在工业中的一种用途是___________。
(3)C与E反应的化学方程式为___________,该反应的基本反应类型为___________。
(4)B与C能发生反应的原因为___________。
四、实验题
15.下列是初中化学中常见的实验
(1)如图a是探究燃烧条件的实验,80℃水的作用是____ 图示与实验事实不符,火焰出现的地方应该是______(填“a”“b”或“c”)处,对比b处和c处,_______(填“能”或“不能”)探究出燃烧条件
(2)如图b中,最易生锈的是试管______中的铁钉 生活中使用过的菜刀铁锅等铁制品,清洗后需要及时擦干,可以减少_______对铁锈蚀的影响
(3)利用图c示装置对二氧化碳的性质进行验证,A处紫色的石蕊试液______(填现象),C烧杯中______(填“上层”或“下层”)的蜡烛先熄灭,说明二氧化碳具有的性质是______
16.铁的锈蚀及其防护。
(1)探锈:探究铁锈蚀主要因素的实验如图1,对比实验______(填序号)可知水是铁锈蚀的因素之一。
(2)识锈:铁锈中含有少量羟基氧化铁(FeOOH),铁在空气中通过化合反应生成FeOOH的化学方程式为______。
(3)防锈:电热水器的内胆采用搪瓷处理,能有效防止铁锈蚀。硼砂(Na2B4O710H2O)在工业上可用于制造搪瓷,硼砂中含______种元素。
(4)用锈:利用铁锈蚀做原理测定空气中氧气的含量(如图2)。实验材料中氯化钠的作用是______;实验结束,恢复常温后打开止水夹,烧杯中剩余152.5 mL的水,计算该装置内空气中氧气的体积分数为______。
17.在研究“铁生锈的条件”的实验中,某兴趣小组对实验进行了创新设计,请把实验报告补充完整。取3段光亮无锈的细铁丝,绕成螺旋状,放入3支干燥洁净的试管底部,进行下列实验,实验要保证有足够长的时间来观察现象。实验①②无明显现象,实验③中铁丝生锈,且试管内空气体积减小。铁生锈实际上是铁与空气中的__________________________(填名称)发生反应的结果.
(1)当铁丝足量,时间足够长,实验③进入试管内的水的体积约占试管容积的__________________________
(2)该实验创新之处在于:可根据铁丝表面的铁锈和_____________两种现象来判断铁丝反应进行的情况.
(3)铝比铁活泼,但铝难腐蚀,原因是_______________________________________
(4)金属资源储量有限且不能再生,为了保护金属资源,除防止金属的腐蚀外,你还有什么合理的建议_________________________________________________________________(答一点即可)
五、计算题
18.某工厂利用废硫酸溶液与铁反应制取硫酸亚铁。49t废硫酸溶液中的硫酸 与5.6t铁恰好完全反应。求:
(1)废硫酸溶液中溶质的质量分数。
(2)理论上生产的硫酸亚铁的质量。
19.实验室里用8.0g粗锌与足量稀硫酸反应(粗锌所含的杂质不跟稀硫酸反应)制得氢气0.2g。
(1)硫酸(H2SO4)中氢、硫、氧元素质量比为__________。
(2)计算粗锌中锌的质量分数(写出计算过程)。
20.古玩市场惊现“三星堆”遗址出土的同款假黄金面具。
【查阅资料】(1)铜锌合金(又称:假黄金)外观和黄金相似,常被不法商贩以假乱真。
(2)标准状况下,氢气密度
为进一步定量分析黄金面具中金属锌的质量分数,小明同学利用下图设计了如下实验::
(1)按图所示组装实验装置,并检查装置的气密性。
(2)向锥形瓶中加入5.0g黄金面具样品,注射器中吸入25mL稀硫酸。
(3)将注射器中的稀硫酸平均分5次推入锥形瓶中:每次推入稀硫酸、待不再产生气泡后,记录收集气体的总体积(忽略其他因素对测量结果造成的影响),如下表。
次数 第1次 第2次 第3次 第4次 第5次
收集气体的总体积/mL 200 400 515 x 525
(1)上表中的数据x=___________
(2)分析数据,完全反应后生成氢气的体积V=___________mL
【数据处理】
(3)此黄金面具中锌的质量分数___________(写出计算过程)
试卷第1页,共3页
参考答案:
1.B
2.A
3.C
4.C
5.C
6.D
7.C
8.A
9.C
10.(1) Na+
(2) 2Na+2H2O=2NaOH+H2 ↑ 2NaHCO3Na2CO3+H2O+CO2 ↑
(3)大于
(4)固体溶解,有气泡产生
11.(1)铜、铁、铝
(2)铝易与空气中的氧气反应在其表面生成一层致密的氧化铝薄膜,阻止了铝的进一步氧化
(3) Ag、Zn(或银、锌) Zn(NO3)2、Mg(NO3)2
12. 烧杯、漏斗、玻璃棒 碳、铝
13. H2O 化合 供给呼吸(写出一条,合理即可)
14.(1)Ca(OH)2
(2) 工业炼铁
(3) 复分解反应
(4)铁为氢前金属,活动性比氢强
15. 提高温度 隔绝氧气 a 不能 A 水(或水蒸气) 变红色 下层 密度比空气大,不燃烧也不支持燃烧
16.(1)①③ ③①
(2)
(3)四 4
(4) 加快锈蚀速率 19%
17. 氧气和水蒸气
试管内空气体积减小(或试管内液面上升) 易生成一层致密的氧化物保护膜,阻止铝不再被氧化 回收利用(有计划合理地开采矿物;废旧金属的回收利用;寻找金属的替代品等合理答案均可)
18.解:设废硫酸溶液中溶质的质量分数为x;理论上生产的硫酸亚铁的质量为y
答:(1)废硫酸溶液中溶质的质量分数为20%。
(2)理论上生产的硫酸亚铁的质量15.2t。
19.(1)1:16:32
(2)81.25%
解:设粗锌中锌的质量为x,
粗锌中锌的质量分数为×100%=81.25%;
答:粗锌中锌的质量分数为81.25%。
20.(1)520
(2)500
(3)解:生成氢气的质量=500mL×0.09g/L=0.045g
设黄金面具中锌的质量为x
=
x=1.4625g
此黄金面具中锌的质量分数=×100%=29.25%
答:此黄金面具中锌的质量分数为29.25%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.物质的性质决定物质的用途。下列物质的用途主要利用物质的化学性质的是
A.由石墨制成的铅笔芯 B.木材用作燃料
C.干冰用于人工降雨 D.铜丝制成的电线
2.下列我国古代发明或技术中,主要原理不是化学变化的是
A.炭黑制墨 B.粮食酿酒 C.湿法冶金 D.燃放烟火
3.下列有关实验现象的描述正确的是
A.打开盛有浓盐酸的试剂瓶瓶塞,瓶口上方出现大量白烟
B.硫在氧气中燃烧产生微弱的淡蓝色火焰
C.铝丝插入硫酸铜溶液中,铝丝表面覆盖一层光亮红色的物质
D.电解水时正极产生的气体体积比负极产生的气体体积大
4.下列实验方案设计不合理的是
选项 实验内容 操作方法
A 鉴别二氧化硫和二氧化碳 闻气味
B 鉴别硬水和软水 加肥皂水
C 除去氮气中混有的一氧化碳 通入灼热的氧化铜
D 除去氧化铜中的铜粉 在氧气流中加热
A.A B.B C.C D.D
5.除去下列物质中混有的少量杂质(括号内为杂质),所用方法正确的是
A.二氧化碳(一氧化碳)——将气体点燃
B.铜(氧化铜)——在空气中加热
C.氯化钾(氯酸钾)——加热
D.二氧化碳(氧气)——通过足量的石灰水
6.下列有关物质用途的说法,不正确的是
A.氯化钠可用作食品调味剂
B.碳酸钙可用作补钙剂
C.生石灰可用作食品干燥剂
D.铁制容器可用来盛装波尔多液
7.下列有关物质的鉴别或除杂操作正确的是
A.白酒和白醋:观察颜色进行鉴别
B.铝粉和锌粉:分别加入稀硫酸观察是否有气泡冒出进行鉴别
C.CuO中含有少量炭粉:在空气中灼烧
D.CO2中含少量的CO:点燃烧掉
8.下列图象能正确反映对应变化关系的是
A. 向等质量等浓度的稀硫酸中分别逐渐加入锌粉和铁粉至过量
B. 向接近饱和的硝酸钾溶液中加入硝酸钾固体
C. 加热一定质量的高锰酸钾固体
D. 将水通电一段时间
9.下表是部分知识的归纳,其中完全正确的一组是
A.变化与守恒 B.现象与结论
①1.6g 物质 M 在氧气中完全燃烧,测得生成 4.4g CO2和 3.6g H2O,则该物质的组成元素为 C、H ②高锰酸钾、氯酸钾能分解产生氧气是因为二 者均有氧分子 ③3g 镁和 7g 氧气充分反应,根据质量守恒定律,可生成 10g MgO ①硫在空气中燃烧发出淡蓝色火焰,在氧气中燃 烧发出蓝紫色火焰,说明物质燃烧剧烈程度与 氧气浓度有关 ②向铝丝中加入稀盐酸,开始无气泡产生,说明 铝的活泼性排在 H 后面 ③黄铜合金在纯铜上划出划痕,说明合金的硬度 比纯金属大
C.化学与生活 D.性质与用途
①在钢铁表面涂油能防止钢铁生锈 ②在山林中遇火灾时,尽量向逆风方向奔跑 ③废旧玻璃、金属、塑料等属于可回收物,有 效回收再利用可节约能源 ①稀有气体可用作电光源利用了其化学性质 ②液氮可用作低温麻醉利用了其化学性质 ③CO2 可用于灭火,仅利用了其不燃烧也不支持 燃烧的性质
A.A B.B C.C D.D
二、简答题
10.钠及其化合物是中学化学学习和研究的重要内容。
(1)钠的核电荷数是11,钠原子的核外有三个电子层,则钠原子的原子结构示意图为______钠离子的符号为______。
(2)钠与水反应生成氢氧化钠和氢气,化学方程式为______,小苏打(NaHCO3)受热可分解成碳酸钠、二氧化碳和水,化学方程式为______;
(3)金属钠的化学性质非常活泼,常温下即可以和氧气、二氧化碳、水等物质反应,因此实验室中少量的钠是保存在煤油中的。由此可知,金属钠的密度______煤油(填“大于“或“小于”)。
(4)已知2Na2O2+2H2O=4NaOH+O2↑;2Na2O2+2CO2=2Na2CO3+O2。实验室散口放置的过氧化钠(Na2O2)已部分变质,取少量该固体样品于试管中,加足量水,可观察到的现象为______。
11.回答下列问题。
(1)铝、铁、铜是三种常见的金属,人类开始使用这三种金属的先后顺序为_____;
(2)金属铝虽然比铁发现的晚,比铁活泼,但是现在应用却比较广泛,因为金属铝比铁耐腐蚀。金属铝耐腐蚀的原因是什么_____
(3)某化学小组用一定量AgNO3和Mg(NO3)2混合溶液进行了右图实验,若加入的锌粉过量,充分反应后过滤,所得固体B中含有的金属物质是_____;滤液A中所含有的溶质化学式是_____。
三、推断题
12.有一包固体粉末,可能含碳、铝、铜、氧化铝、氧化铜中的一种或几种。为探究该固体粉末的组成,某化学兴趣小组进行了如图所示实验:(已知:金属银在空气中加热无明显变化)
(1)操作1和操作2中使用的玻璃仪器有 _________________________ 。
(2)原固体样品中一定含有的物质是 _________________________ 。
13.A~E是初中化学常见物质,且均含有同一种元素,它们之间的反应或转化关系如图(部分物质及反应条件已略去)。其中A是最常用的溶剂;C和E组成元素相同;D中金属元素的质量分数为70%。A的化学式为______;A和C反应的基本类型是______反应;D和E反应的化学方程式为______;B的一种用途是______。
14.A~E为初中化学常见的物质。A为一种氧化物,B为目前世界上年产量最高的金属单质,C中含有两种元素,D在农业上常用来改良酸性土壤,E为石灰石的主要成分,其相互反应及转化关系如图所示,图中“——”表示两物质间能发生化学反应,“―→”表示两物质间存在转化关系。请回答:
(1)D物质的化学式为___________。
(2)A转变为B反应的化学方程式为___________,该反应在工业中的一种用途是___________。
(3)C与E反应的化学方程式为___________,该反应的基本反应类型为___________。
(4)B与C能发生反应的原因为___________。
四、实验题
15.下列是初中化学中常见的实验
(1)如图a是探究燃烧条件的实验,80℃水的作用是____ 图示与实验事实不符,火焰出现的地方应该是______(填“a”“b”或“c”)处,对比b处和c处,_______(填“能”或“不能”)探究出燃烧条件
(2)如图b中,最易生锈的是试管______中的铁钉 生活中使用过的菜刀铁锅等铁制品,清洗后需要及时擦干,可以减少_______对铁锈蚀的影响
(3)利用图c示装置对二氧化碳的性质进行验证,A处紫色的石蕊试液______(填现象),C烧杯中______(填“上层”或“下层”)的蜡烛先熄灭,说明二氧化碳具有的性质是______
16.铁的锈蚀及其防护。
(1)探锈:探究铁锈蚀主要因素的实验如图1,对比实验______(填序号)可知水是铁锈蚀的因素之一。
(2)识锈:铁锈中含有少量羟基氧化铁(FeOOH),铁在空气中通过化合反应生成FeOOH的化学方程式为______。
(3)防锈:电热水器的内胆采用搪瓷处理,能有效防止铁锈蚀。硼砂(Na2B4O710H2O)在工业上可用于制造搪瓷,硼砂中含______种元素。
(4)用锈:利用铁锈蚀做原理测定空气中氧气的含量(如图2)。实验材料中氯化钠的作用是______;实验结束,恢复常温后打开止水夹,烧杯中剩余152.5 mL的水,计算该装置内空气中氧气的体积分数为______。
17.在研究“铁生锈的条件”的实验中,某兴趣小组对实验进行了创新设计,请把实验报告补充完整。取3段光亮无锈的细铁丝,绕成螺旋状,放入3支干燥洁净的试管底部,进行下列实验,实验要保证有足够长的时间来观察现象。实验①②无明显现象,实验③中铁丝生锈,且试管内空气体积减小。铁生锈实际上是铁与空气中的__________________________(填名称)发生反应的结果.
(1)当铁丝足量,时间足够长,实验③进入试管内的水的体积约占试管容积的__________________________
(2)该实验创新之处在于:可根据铁丝表面的铁锈和_____________两种现象来判断铁丝反应进行的情况.
(3)铝比铁活泼,但铝难腐蚀,原因是_______________________________________
(4)金属资源储量有限且不能再生,为了保护金属资源,除防止金属的腐蚀外,你还有什么合理的建议_________________________________________________________________(答一点即可)
五、计算题
18.某工厂利用废硫酸溶液与铁反应制取硫酸亚铁。49t废硫酸溶液中的硫酸 与5.6t铁恰好完全反应。求:
(1)废硫酸溶液中溶质的质量分数。
(2)理论上生产的硫酸亚铁的质量。
19.实验室里用8.0g粗锌与足量稀硫酸反应(粗锌所含的杂质不跟稀硫酸反应)制得氢气0.2g。
(1)硫酸(H2SO4)中氢、硫、氧元素质量比为__________。
(2)计算粗锌中锌的质量分数(写出计算过程)。
20.古玩市场惊现“三星堆”遗址出土的同款假黄金面具。
【查阅资料】(1)铜锌合金(又称:假黄金)外观和黄金相似,常被不法商贩以假乱真。
(2)标准状况下,氢气密度
为进一步定量分析黄金面具中金属锌的质量分数,小明同学利用下图设计了如下实验::
(1)按图所示组装实验装置,并检查装置的气密性。
(2)向锥形瓶中加入5.0g黄金面具样品,注射器中吸入25mL稀硫酸。
(3)将注射器中的稀硫酸平均分5次推入锥形瓶中:每次推入稀硫酸、待不再产生气泡后,记录收集气体的总体积(忽略其他因素对测量结果造成的影响),如下表。
次数 第1次 第2次 第3次 第4次 第5次
收集气体的总体积/mL 200 400 515 x 525
(1)上表中的数据x=___________
(2)分析数据,完全反应后生成氢气的体积V=___________mL
【数据处理】
(3)此黄金面具中锌的质量分数___________(写出计算过程)
试卷第1页,共3页
参考答案:
1.B
2.A
3.C
4.C
5.C
6.D
7.C
8.A
9.C
10.(1) Na+
(2) 2Na+2H2O=2NaOH+H2 ↑ 2NaHCO3Na2CO3+H2O+CO2 ↑
(3)大于
(4)固体溶解,有气泡产生
11.(1)铜、铁、铝
(2)铝易与空气中的氧气反应在其表面生成一层致密的氧化铝薄膜,阻止了铝的进一步氧化
(3) Ag、Zn(或银、锌) Zn(NO3)2、Mg(NO3)2
12. 烧杯、漏斗、玻璃棒 碳、铝
13. H2O 化合 供给呼吸(写出一条,合理即可)
14.(1)Ca(OH)2
(2) 工业炼铁
(3) 复分解反应
(4)铁为氢前金属,活动性比氢强
15. 提高温度 隔绝氧气 a 不能 A 水(或水蒸气) 变红色 下层 密度比空气大,不燃烧也不支持燃烧
16.(1)①③ ③①
(2)
(3)四 4
(4) 加快锈蚀速率 19%
17. 氧气和水蒸气
试管内空气体积减小(或试管内液面上升) 易生成一层致密的氧化物保护膜,阻止铝不再被氧化 回收利用(有计划合理地开采矿物;废旧金属的回收利用;寻找金属的替代品等合理答案均可)
18.解:设废硫酸溶液中溶质的质量分数为x;理论上生产的硫酸亚铁的质量为y
答:(1)废硫酸溶液中溶质的质量分数为20%。
(2)理论上生产的硫酸亚铁的质量15.2t。
19.(1)1:16:32
(2)81.25%
解:设粗锌中锌的质量为x,
粗锌中锌的质量分数为×100%=81.25%;
答:粗锌中锌的质量分数为81.25%。
20.(1)520
(2)500
(3)解:生成氢气的质量=500mL×0.09g/L=0.045g
设黄金面具中锌的质量为x
=
x=1.4625g
此黄金面具中锌的质量分数=×100%=29.25%
答:此黄金面具中锌的质量分数为29.25%。
答案第1页,共2页
答案第1页,共2页
