黑龙江省哈尔滨师范大学青冈实验中学2021-2022学年高二下学期开学考试化学试题(Word版含答案)
文档属性
| 名称 | 黑龙江省哈尔滨师范大学青冈实验中学2021-2022学年高二下学期开学考试化学试题(Word版含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 324.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-08 16:22:44 | ||
图片预览


文档简介
哈师大青冈实验中学2021—2022学年度开学初考试
高二学年化学试题
可能用到的相对原子质量:H:1 O:16 C:12 Cu:64 S:32
选择题(每小题2分,共50分,每小题只有一个正确答案)
1.空气污染已成为人类社会面临的重大威胁。下列气体不属于大气污染物的是( )
A.NO B.CO2 C.CO D.NO2
2.下列过程属于物理变化的是
A.煤的气化 B.石油的裂化 C.煤的干馏 D.石油的分馏
3.医院里检验糖尿病的方法是:将病人尿液加入到CuSO4和NaOH的混合液中,加热后若产生红色沉淀,则说明病人的尿液中含有( )
A.葡萄糖 B.乙酸 C.蛋白质 D.脂肪
4.聚四氟乙烯()是不粘锅涂覆物质的主要成分。下列关于聚四氟乙烯的说法,不正确的是
A.属于高分子化合物 B.单体是CF2=CF2
C.可由加聚反应得到 D.能使高锰酸钾酸性溶液褪色
5.下列各种混合物中,能用分液漏斗进行分离的是
A.酒精和水 B.水和四氯化碳 C.碘和四氯化碳 D.汽油和植物油
6..下列措施不能加快Zn与1mol/LH2SO4反应产生H2的速率的是
A.用Zn粉代替Zn粒 B.滴加少量的CuSO4溶液
C.升高温度 D.再加入1mol/LCH3COOH溶液
7.下列各组物质中,化学键类型完全相同的是
A.和NaOH B.和 C.和HCl D.和NaCl
8.工业上不宜用电解法制备的金属是
A.Na B.Mg C.Al D.Fe
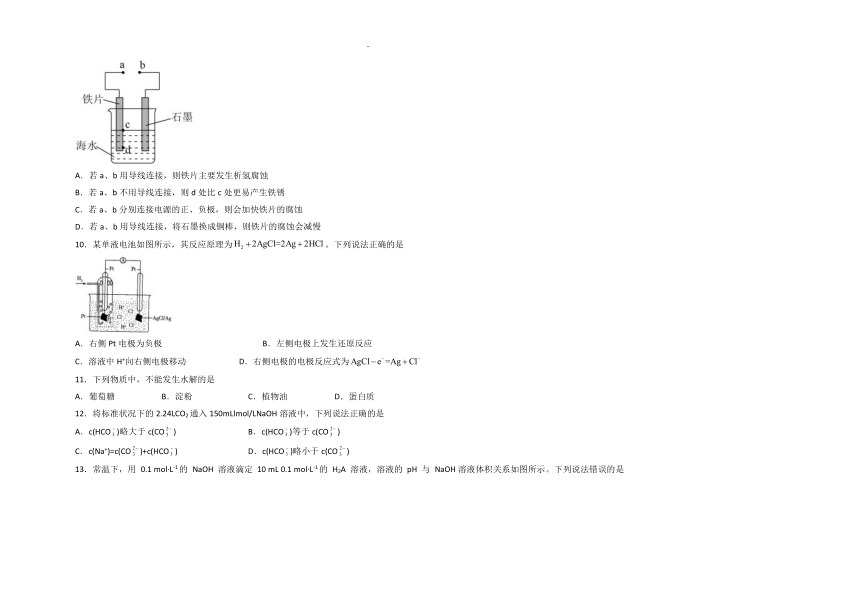
9.模拟电化学腐蚀及防护的装置如图所示,下列有关说法正确的是
A.若a、b用导线连接,则铁片主要发生析氢腐蚀
B.若a、b不用导线连接,则d处比c处更易产生铁锈
C.若a、b分别连接电源的正、负极,则会加快铁片的腐蚀
D.若a、b用导线连接,将石墨换成铜棒,则铁片的腐蚀会减慢
10.某单液电池如图所示,其反应原理为。下列说法正确的是
A.右侧Pt电极为负极 B.左侧电极上发生还原反应
C.溶液中H+向右侧电极移动 D.右侧电极的电极反应式为
11.下列物质中,不能发生水解的是
A.葡萄糖 B.淀粉 C.植物油 D.蛋白质
12.将标准状况下的2.24LCO2通入150mLlmol/LNaOH溶液中,下列说法正确的是
A.c(HCO)略大于c(CO) B.c(HCO)等于c(CO)
C.c(Na+)=c(CO)+c(HCO) D.c(HCO)略小于c(CO)
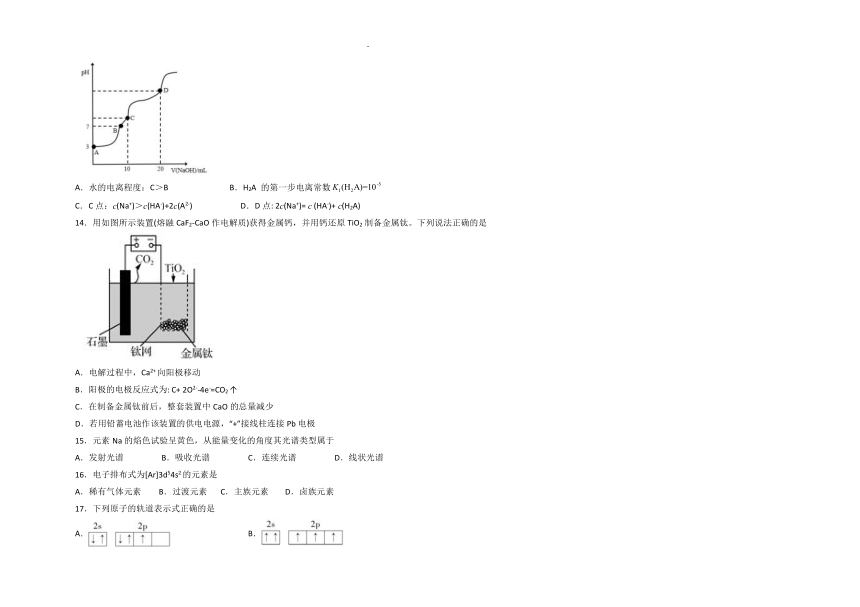
13.常温下,用 0.1 mol·L-1的 NaOH 溶液滴定 10 mL 0.1 mol·L-1的 H2A 溶液,溶液的 pH 与 NaOH溶液体积关系如图所示。下列说法错误的是
A.水的电离程度:C>B B.H2A 的第一步电离常数
C.C点:c(Na+)>c(HA-)+2c(A2-) D.D点: 2c(Na+)= c (HA-)+ c(H2A)
14.用如图所示装置(熔融CaF2-CaO作电解质)获得金属钙,并用钙还原TiO2 制备金属钛。下列说法正确的是
A.电解过程中,Ca2+ 向阳极移动
B.阳极的电极反应式为: C+ 2O2--4e-=CO2 ↑
C.在制备金属钛前后,整套装置中CaO的总量减少
D.若用铅蓄电池作该装置的供电电源,“+”接线柱连接Pb 电极
15.元素Na的焰色试验呈黄色,从能量变化的角度其光谱类型属于
A.发射光谱 B.吸收光谱 C.连续光谱 D.线状光谱
16.电子排布式为[Ar]3d54s2的元素是
A.稀有气体元素 B.过渡元素 C.主族元素 D.卤族元素
17.下列原子的轨道表示式正确的是
A. B.
C. D.
18.短周期主族元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数之和为18,X最外层电子数是次外层电子数的3倍,Z的单质晶体是应用广泛的半导体材料,W与X位于同一主族。下列说法不正确的是
A.X、W都能与Y形成离子化合物 B.W的简单阴离子能促进水电离
C.原子半径:r(W)>r(Z)>r(Y)>r(X) D.最高价氧化物对应水化物的酸性:W>Z
19.下列说法不正确的是
A.乙烯中C=C键的键能小于乙烷中C-C键的键能的2倍
B.σ键可以绕键轴旋转,π键不能绕键轴旋转
C.在气体单质中,一定有σ键,可能有π键
D.s-p σ键和p-p σ键电子云对称性相同
20.下列有机化合物中σ键与π键个数比为3∶2的是
A.CH3CH3 B.CH2=CH2 C.CH4 D. CH≡CH
21.根据下列五种元素的电离能数据(单位:kJ·mol-1),判断下列说法不正确的是
元素代号 I1 I2 I3 I4
Q 2 080 4 000 6 100 9 400
R 500 4 600 6 900 9 500
S 740 1 500 7 700 10 500
T 580 1 800 2 700 11 600
U 420 3 100 4 400 5 900
A.元素的电负性最大的可能是Q元素 B.R和S均可能与U在同一主族
C.U元素可能在元素周期表的s区 D.原子的价电子排布为ns2np1的可能是T元素
22.下列微粒表述正确,且对水的电离能产生影响的是
A.氢氧化钠的电子式: B.乙酸的结构式:
C.甲烷分子的空间填充模型: D.硫离子的结构示意图:
23.下列各组元素性质的叙述中,正确的是
A.N、O、F的电负性依次增大 B.N、O、F的第一电离能依次增大
C.N、O、F的最高正化合价依次升高 D.O、F、Ne的原子半径依次减小
24.向15 mL 0.1 mol/L H2A二元弱酸溶液中逐滴滴加0.1 mol/L NaOH溶液,混合溶液中H2A、HA-和A2-的物质的量分数(δ)随pH变化的关系如图所示。下列叙述正确的是
A.曲线Ⅱ代表的微粒是A2-
B.pH=3至pH=4的过程中n(H2A)、n(A2-)、n(HA-)之和不变
C.0.01mol/LNaHA溶液中存在:c(Na+)>c(HA-)>c(H2A)>c(A2-)
D.向pH=4.2的溶液中持续滴加NaOH溶液,水的电离程度持续变大
25.17.五种前四周期的元素X、Y、Z、Q、T。已知X元素基态原子的M层有6种运动状态不同的电子;Y元素的价阳离子的3d能级半充满,基态Z原子的L层p能级有一个空轨道;Q原子的L电子层的p能级只有一对成对电子;基态T原子的M电子层上p轨道半充满。下列说法不正确的是
A.X、Y、T三种元素第一电离能的大小次序是:
B.若X、T、Z的最高价的氧化物对应的水化物分别为u、v、w,则酸性为:
C.若M是在X下一周期且与X同主族的元素,则M原子的简化电子排布式是
D.元素Q与另四种元素形成的二元化合物均不止一种
第II卷(非选择题)
二、填空题((共50分)
26.Ⅰ.海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验(苯,一种不溶于水,密度比水小的液体):
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是___________(从下列仪器中选出所需的仪器,用标号字母填写在空自处)。
A.烧杯B.坩埚C.表面皿D.泥三角E.酒精灯F.干燥器
(2)步骤③的实验操作名称是___________。
(3)步骤④中还可以用,请写出氧化I- 的离子方程式:___________。
(4)检验水溶液中是否含有单质碘可以用___________溶液。
Ⅱ.分别用一个化学方程式解释下列问题。
(5)甲烷与氯气的混合物在漫射光下一段时间,出现白雾:____________________。
(6)溴水中通入乙烯,溴水颜色褪去:____________________。
(7)工业上通过乙烯水化获得乙醇:____________________。
27.硅是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态硅(Si)原子的核外电子排布式为[Ne]_______,有_______个未成对电子。
(2)碳(C)、硅(Si)、锗(Ge)是同族元素。
①基态Ge原子的核外电子占据_______个能层、_______个能级。
②上述三种元素的电负性由大到小的顺序为_______(填元素符号)。
③固态CO2可用于人工降雨,SiO2常用于_______(填一种即可)。
④请写出高温条件下碳和二氧化硅反应的化学方程式:_______。
(3)在元素周期表中,某些元素与其右下方的主族元素(如图所示)的一些性质是相似的。如Si与NaOH反应生成Na2SiO3和H2,则B与NaOH反应生成_______(填化学式)和H2。
Ⅰ.用如图所示装置做电解实验,a、b、c、d均为铂电极,A槽与B槽选择的溶液足量但不同,可供选择的电解质溶液有:①500 mL 2 mol·L-1 CuSO4溶液 ②500 mL 2 mol·L-1NaCl溶液 ③500 mL 2 mol·L-1Na2SO4溶液 ④500 mL2 mol·L-1AgNO3溶液 ⑤500 mL2 mol·L-1CuCl2溶液。
(1)若A槽选择500 mL2 mol·L-1CuCl2溶液,B槽选择500 mL 2 mol·L-1 CuSO4溶液,闭合开关K2,则b极为___________ (填 阴极”或“阳极”),与a极现象相同的电极为___________(填“c极”或“d极”),d极上的电极反应式为___________。
(2)若电解池工作时,a、b、c、d电极均有气体产生,且只有a极产生的是黄绿色气体,则A槽选择的溶液为___________ (填标号,下同),B 槽选择的溶液为___________,闭合的开关是 ___________,相同时间内,a、c电极上产生气体的体积(相同状况)之比为___________。
(3)若A槽选择500 mL2 mol·L-1AgNO3溶液,B槽选择500 mL 2 mol·L-1 CuSO4溶液,闭合开关K1,则析出固体的电极是___________
Ⅱ.新冠疫情期间,某同学为解决环境卫生消毒问题,设计了一个电解装置,用于制备“84”消毒液的有效成分,
(4)如图所示,则c为电源的___________极;该发生器中发生反应的离子方程式为___________。
29..弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问题:
(1)生活中明矾常作净水剂,其净水的原理是___________(用离子方程式表示)。
(2)某温度下,和的电离常数数值相等,物质的量浓度相同的溶液和氨水混合后,溶液中,则所加入溶液的体积___________(填“大于”“小于”或“等于”)氨水的体积。
(3)常温下,取溶液与溶液等体积混合,测得混合后溶液的。写出的电离方程式___________,并写出所得溶液中离子浓度大小关系__________
(4)含的废水毒性较大,某工厂废水中含的。为了使废水的排放达标,进行如下处理:
①绿矾为,反应(Ⅰ)中与的物质的量之比为___________。
②常温下若处理后的废水中,则处理后的废水的___________。
选择题每小题2分,共50分
1--5 B DADB 6---10 DBDCC 11--15 AADBA 16--20 BCCCD
--25BBABC
.13分 未标注的2分
(1)BDE(3分)(2)过滤(1分)(3)2I-+Cl2=I2+Cl-
淀粉 (1分)
(答案合理即可) (6) (7)
27.12分
(1) (2分) 2
(2) 4 8 C>Si>Ge (2分) 光导纤维
2C+SiO2Si+2CO↑;生成CO2也给分(2分)
(3)NaBO2(2分))
28 .14分 未标注的1分
Ⅰ.(1) 阳极 c极
4OH- -4e-=2H2O+O2 ↑或2H2O- 4e- =O2↑+4H+(2分)
(2) ② ③ K1 2:1(2分)
(3)b极、d极(2分)
Ⅱ. 负 (或;)(2分)
29.11分 未标注的每空2分
(1)
(2)等于(1分)
(3) C(Cl-) >C(M+ )>C(H+) >C(OH- ) (4) 6
高二学年化学试题
可能用到的相对原子质量:H:1 O:16 C:12 Cu:64 S:32
选择题(每小题2分,共50分,每小题只有一个正确答案)
1.空气污染已成为人类社会面临的重大威胁。下列气体不属于大气污染物的是( )
A.NO B.CO2 C.CO D.NO2
2.下列过程属于物理变化的是
A.煤的气化 B.石油的裂化 C.煤的干馏 D.石油的分馏
3.医院里检验糖尿病的方法是:将病人尿液加入到CuSO4和NaOH的混合液中,加热后若产生红色沉淀,则说明病人的尿液中含有( )
A.葡萄糖 B.乙酸 C.蛋白质 D.脂肪
4.聚四氟乙烯()是不粘锅涂覆物质的主要成分。下列关于聚四氟乙烯的说法,不正确的是
A.属于高分子化合物 B.单体是CF2=CF2
C.可由加聚反应得到 D.能使高锰酸钾酸性溶液褪色
5.下列各种混合物中,能用分液漏斗进行分离的是
A.酒精和水 B.水和四氯化碳 C.碘和四氯化碳 D.汽油和植物油
6..下列措施不能加快Zn与1mol/LH2SO4反应产生H2的速率的是
A.用Zn粉代替Zn粒 B.滴加少量的CuSO4溶液
C.升高温度 D.再加入1mol/LCH3COOH溶液
7.下列各组物质中,化学键类型完全相同的是
A.和NaOH B.和 C.和HCl D.和NaCl
8.工业上不宜用电解法制备的金属是
A.Na B.Mg C.Al D.Fe
9.模拟电化学腐蚀及防护的装置如图所示,下列有关说法正确的是
A.若a、b用导线连接,则铁片主要发生析氢腐蚀
B.若a、b不用导线连接,则d处比c处更易产生铁锈
C.若a、b分别连接电源的正、负极,则会加快铁片的腐蚀
D.若a、b用导线连接,将石墨换成铜棒,则铁片的腐蚀会减慢
10.某单液电池如图所示,其反应原理为。下列说法正确的是
A.右侧Pt电极为负极 B.左侧电极上发生还原反应
C.溶液中H+向右侧电极移动 D.右侧电极的电极反应式为
11.下列物质中,不能发生水解的是
A.葡萄糖 B.淀粉 C.植物油 D.蛋白质
12.将标准状况下的2.24LCO2通入150mLlmol/LNaOH溶液中,下列说法正确的是
A.c(HCO)略大于c(CO) B.c(HCO)等于c(CO)
C.c(Na+)=c(CO)+c(HCO) D.c(HCO)略小于c(CO)
13.常温下,用 0.1 mol·L-1的 NaOH 溶液滴定 10 mL 0.1 mol·L-1的 H2A 溶液,溶液的 pH 与 NaOH溶液体积关系如图所示。下列说法错误的是
A.水的电离程度:C>B B.H2A 的第一步电离常数
C.C点:c(Na+)>c(HA-)+2c(A2-) D.D点: 2c(Na+)= c (HA-)+ c(H2A)
14.用如图所示装置(熔融CaF2-CaO作电解质)获得金属钙,并用钙还原TiO2 制备金属钛。下列说法正确的是
A.电解过程中,Ca2+ 向阳极移动
B.阳极的电极反应式为: C+ 2O2--4e-=CO2 ↑
C.在制备金属钛前后,整套装置中CaO的总量减少
D.若用铅蓄电池作该装置的供电电源,“+”接线柱连接Pb 电极
15.元素Na的焰色试验呈黄色,从能量变化的角度其光谱类型属于
A.发射光谱 B.吸收光谱 C.连续光谱 D.线状光谱
16.电子排布式为[Ar]3d54s2的元素是
A.稀有气体元素 B.过渡元素 C.主族元素 D.卤族元素
17.下列原子的轨道表示式正确的是
A. B.
C. D.
18.短周期主族元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数之和为18,X最外层电子数是次外层电子数的3倍,Z的单质晶体是应用广泛的半导体材料,W与X位于同一主族。下列说法不正确的是
A.X、W都能与Y形成离子化合物 B.W的简单阴离子能促进水电离
C.原子半径:r(W)>r(Z)>r(Y)>r(X) D.最高价氧化物对应水化物的酸性:W>Z
19.下列说法不正确的是
A.乙烯中C=C键的键能小于乙烷中C-C键的键能的2倍
B.σ键可以绕键轴旋转,π键不能绕键轴旋转
C.在气体单质中,一定有σ键,可能有π键
D.s-p σ键和p-p σ键电子云对称性相同
20.下列有机化合物中σ键与π键个数比为3∶2的是
A.CH3CH3 B.CH2=CH2 C.CH4 D. CH≡CH
21.根据下列五种元素的电离能数据(单位:kJ·mol-1),判断下列说法不正确的是
元素代号 I1 I2 I3 I4
Q 2 080 4 000 6 100 9 400
R 500 4 600 6 900 9 500
S 740 1 500 7 700 10 500
T 580 1 800 2 700 11 600
U 420 3 100 4 400 5 900
A.元素的电负性最大的可能是Q元素 B.R和S均可能与U在同一主族
C.U元素可能在元素周期表的s区 D.原子的价电子排布为ns2np1的可能是T元素
22.下列微粒表述正确,且对水的电离能产生影响的是
A.氢氧化钠的电子式: B.乙酸的结构式:
C.甲烷分子的空间填充模型: D.硫离子的结构示意图:
23.下列各组元素性质的叙述中,正确的是
A.N、O、F的电负性依次增大 B.N、O、F的第一电离能依次增大
C.N、O、F的最高正化合价依次升高 D.O、F、Ne的原子半径依次减小
24.向15 mL 0.1 mol/L H2A二元弱酸溶液中逐滴滴加0.1 mol/L NaOH溶液,混合溶液中H2A、HA-和A2-的物质的量分数(δ)随pH变化的关系如图所示。下列叙述正确的是
A.曲线Ⅱ代表的微粒是A2-
B.pH=3至pH=4的过程中n(H2A)、n(A2-)、n(HA-)之和不变
C.0.01mol/LNaHA溶液中存在:c(Na+)>c(HA-)>c(H2A)>c(A2-)
D.向pH=4.2的溶液中持续滴加NaOH溶液,水的电离程度持续变大
25.17.五种前四周期的元素X、Y、Z、Q、T。已知X元素基态原子的M层有6种运动状态不同的电子;Y元素的价阳离子的3d能级半充满,基态Z原子的L层p能级有一个空轨道;Q原子的L电子层的p能级只有一对成对电子;基态T原子的M电子层上p轨道半充满。下列说法不正确的是
A.X、Y、T三种元素第一电离能的大小次序是:
B.若X、T、Z的最高价的氧化物对应的水化物分别为u、v、w,则酸性为:
C.若M是在X下一周期且与X同主族的元素,则M原子的简化电子排布式是
D.元素Q与另四种元素形成的二元化合物均不止一种
第II卷(非选择题)
二、填空题((共50分)
26.Ⅰ.海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验(苯,一种不溶于水,密度比水小的液体):
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是___________(从下列仪器中选出所需的仪器,用标号字母填写在空自处)。
A.烧杯B.坩埚C.表面皿D.泥三角E.酒精灯F.干燥器
(2)步骤③的实验操作名称是___________。
(3)步骤④中还可以用,请写出氧化I- 的离子方程式:___________。
(4)检验水溶液中是否含有单质碘可以用___________溶液。
Ⅱ.分别用一个化学方程式解释下列问题。
(5)甲烷与氯气的混合物在漫射光下一段时间,出现白雾:____________________。
(6)溴水中通入乙烯,溴水颜色褪去:____________________。
(7)工业上通过乙烯水化获得乙醇:____________________。
27.硅是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态硅(Si)原子的核外电子排布式为[Ne]_______,有_______个未成对电子。
(2)碳(C)、硅(Si)、锗(Ge)是同族元素。
①基态Ge原子的核外电子占据_______个能层、_______个能级。
②上述三种元素的电负性由大到小的顺序为_______(填元素符号)。
③固态CO2可用于人工降雨,SiO2常用于_______(填一种即可)。
④请写出高温条件下碳和二氧化硅反应的化学方程式:_______。
(3)在元素周期表中,某些元素与其右下方的主族元素(如图所示)的一些性质是相似的。如Si与NaOH反应生成Na2SiO3和H2,则B与NaOH反应生成_______(填化学式)和H2。
Ⅰ.用如图所示装置做电解实验,a、b、c、d均为铂电极,A槽与B槽选择的溶液足量但不同,可供选择的电解质溶液有:①500 mL 2 mol·L-1 CuSO4溶液 ②500 mL 2 mol·L-1NaCl溶液 ③500 mL 2 mol·L-1Na2SO4溶液 ④500 mL2 mol·L-1AgNO3溶液 ⑤500 mL2 mol·L-1CuCl2溶液。
(1)若A槽选择500 mL2 mol·L-1CuCl2溶液,B槽选择500 mL 2 mol·L-1 CuSO4溶液,闭合开关K2,则b极为___________ (填 阴极”或“阳极”),与a极现象相同的电极为___________(填“c极”或“d极”),d极上的电极反应式为___________。
(2)若电解池工作时,a、b、c、d电极均有气体产生,且只有a极产生的是黄绿色气体,则A槽选择的溶液为___________ (填标号,下同),B 槽选择的溶液为___________,闭合的开关是 ___________,相同时间内,a、c电极上产生气体的体积(相同状况)之比为___________。
(3)若A槽选择500 mL2 mol·L-1AgNO3溶液,B槽选择500 mL 2 mol·L-1 CuSO4溶液,闭合开关K1,则析出固体的电极是___________
Ⅱ.新冠疫情期间,某同学为解决环境卫生消毒问题,设计了一个电解装置,用于制备“84”消毒液的有效成分,
(4)如图所示,则c为电源的___________极;该发生器中发生反应的离子方程式为___________。
29..弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问题:
(1)生活中明矾常作净水剂,其净水的原理是___________(用离子方程式表示)。
(2)某温度下,和的电离常数数值相等,物质的量浓度相同的溶液和氨水混合后,溶液中,则所加入溶液的体积___________(填“大于”“小于”或“等于”)氨水的体积。
(3)常温下,取溶液与溶液等体积混合,测得混合后溶液的。写出的电离方程式___________,并写出所得溶液中离子浓度大小关系__________
(4)含的废水毒性较大,某工厂废水中含的。为了使废水的排放达标,进行如下处理:
①绿矾为,反应(Ⅰ)中与的物质的量之比为___________。
②常温下若处理后的废水中,则处理后的废水的___________。
选择题每小题2分,共50分
1--5 B DADB 6---10 DBDCC 11--15 AADBA 16--20 BCCCD
--25BBABC
.13分 未标注的2分
(1)BDE(3分)(2)过滤(1分)(3)2I-+Cl2=I2+Cl-
淀粉 (1分)
(答案合理即可) (6) (7)
27.12分
(1) (2分) 2
(2) 4 8 C>Si>Ge (2分) 光导纤维
2C+SiO2Si+2CO↑;生成CO2也给分(2分)
(3)NaBO2(2分))
28 .14分 未标注的1分
Ⅰ.(1) 阳极 c极
4OH- -4e-=2H2O+O2 ↑或2H2O- 4e- =O2↑+4H+(2分)
(2) ② ③ K1 2:1(2分)
(3)b极、d极(2分)
Ⅱ. 负 (或;)(2分)
29.11分 未标注的每空2分
(1)
(2)等于(1分)
(3) C(Cl-) >C(M+ )>C(H+) >C(OH- ) (4) 6
同课章节目录
