海南省2021-2022学年高三下学期3月学业水平诊断(三)化学试题(Word版含答案)
文档属性
| 名称 | 海南省2021-2022学年高三下学期3月学业水平诊断(三)化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 522.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-09 09:20:20 | ||
图片预览




文档简介
海南省2021—2022学年高三学业水平诊断(三)
化 学
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Ag 108
一、选择题:本题共8小题,每小题2分,共16分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.2021年10月我国发布首次以CO、为原料合成蛋白质。下列有关说法错误的是( )
A.蛋白质是高分子化合物 B.可以被氧化成CO
C.工业上合成氨反应是化合反应 D.蛋白质水解的最终产物是氨基酸
2.据古代文献记载:“慈石治肾家诸病,而通耳明目。”“慈石,色轻紫,石上皲涩,可吸连针铁。”“慈石”的主要成分是( )
A. B.
C. D.
3.用如图所示装置能制备下列干燥的气体,且能控制反应的发生和停止的是( )(甲、乙、丙表示加入的试剂,部分夹持装置省略)
选项 气体 甲 乙 丙
A 浓盐酸 二氧化锰 氯化钙
B 稀硫酸 石灰石 五氧化二磷
C 饱和食盐水 电石 碱石灰
D 稀硫酸 锌粒 碱石灰
4.化学与生活息息相关。下列说法错误的是( )
A.浓度为95%的乙醇溶液常用于消毒杀菌
B.氯仿和四氯化碳都是常用的有机溶剂
C.甲醛的水溶液可用作防腐剂
D.聚四氟乙烯是不粘锅内侧涂层的主要成分
5.、是有机合成的重要试剂,、的熔点依次为167℃、-93.6℃。的空间结构如图所示。下列说法正确的是( )
A.分子含14mol共价键 B.的空间结构为平面三角形
C.键能不同导致、的熔点不同 D.P分子中共用电子对偏向氯
6.下列各组物质不能用水一次性鉴别的是( )
A.甲苯、溴乙烷、乙醛 B.无水硫酸铜、碳酸钠、硫酸钡
C.氯化钡、磷酸钾、硫酸铵 D.二氧化氮气体、溴蒸气
7.工业上用氨催化氧化法制硝酸的反应之一是,该反应在任何温度下都能自发进行。下列说法正确的是( )
A.该反应的、
B.其他条件不变,加入催化剂,正反应速率增大,逆反应速率减小
C.其他条件不变,改变温度,平衡常数和的平衡转化率一定都会变化
D.恒温恒容条件下,混合气体的密度不变时,反应达到平衡状态
8.设为阿伏加德罗常数的值。下列说法正确的是( )
A.溶液中含数为
B.1mol乙二醇中含杂化的原子数为
C.、的混合物中含有个硫原子
D.1mol乙炔中含有的键数为
二、选择题:本题共6小题,每小题4分,共24分。每小题有一个或两个选项是符合题目要求的。若正确答案只包括一个选项,多选得0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要选错一个就得0分。
9.工业上常采用电渗析法从含萄糖酸钠(用GCOONa表示)的废水中提取化工产品葡萄糖酸(GCOOH)和烧碱,模拟装置如图所示(电极均为石墨)。
下列说法错误的是( )
A.交换膜1、2分别为阳离子、阴离子交换膜
B.a电极为阴极,b电极上发生氧化反应
C.一段时间后,a、b电极产生气体的质量之比为8∶1
D.电路中通过1mol电子时,理论上回收40gNaOH
10.短周期主族元素R、X、Y、Z、W的原子序数依次增大,、和都是18电子微粒。常用于检验的存在。下列判断正确的是( )
A.分子的空间构型为直线形
B.在水中能抑制水的电离
C.元素的氧化物对应的水化物酸性:W>Z>X
D.分子中键和键数之比为5∶4
11.下列有关和性质的解释合理的是( )
选项 性质 解释
A 常温下,呈液态,呈气态 分子间存在氢键,而分子间不存在氢键
B 双氧水中存在 中氧有孤电子对,有空轨道,能形成配位键
C 能氧化 中氧的化合价只能降低
D 溶液中存在 是离子化合物
12.2021年诺贝尔生理学或医学奖获得者发现椒素能识别TRPVI受体。辣椒素的结构简式如图所示。
下列说法正确的是( )
A.辣椒素能与溶液反应生成
B.辣椒素分子中含1个手性碳原子
C.辣椒素能发生水解反应
D.辣椒索有顺反异构体
13.已知亚磷酸是二元弱酸,298K时的电离常数分别为:,.298K时,向溶液中通入HCl气体,溶液的pH与通入HCl物质的量的关系如图所示。下列说法正确的是( )
A.a点溶液中:
B.室温下,b点溶液的pH>7
C.c点溶液中:
D.溶液中存在的含P的离了有、、
14.根据下列实验操作和现象,所推出的结论正确的是( )
选项 实验操作 现象 结论
A 将溶液和溶液等体积混合,内滴加3滴品红溶液 溶液褪色 一定大于
B 向某溶液中滴加苯酚溶液 溶液变紫色 该溶液中含
C 向KI淀粉溶液中滴加少量溶液 溶液变蓝色 氧化性:
D 25℃时向溶液W中滴加甲基橙溶液 溶液变黄色 W溶液的pH一定大于7
三、非选择题:本题共5小题,共60分。
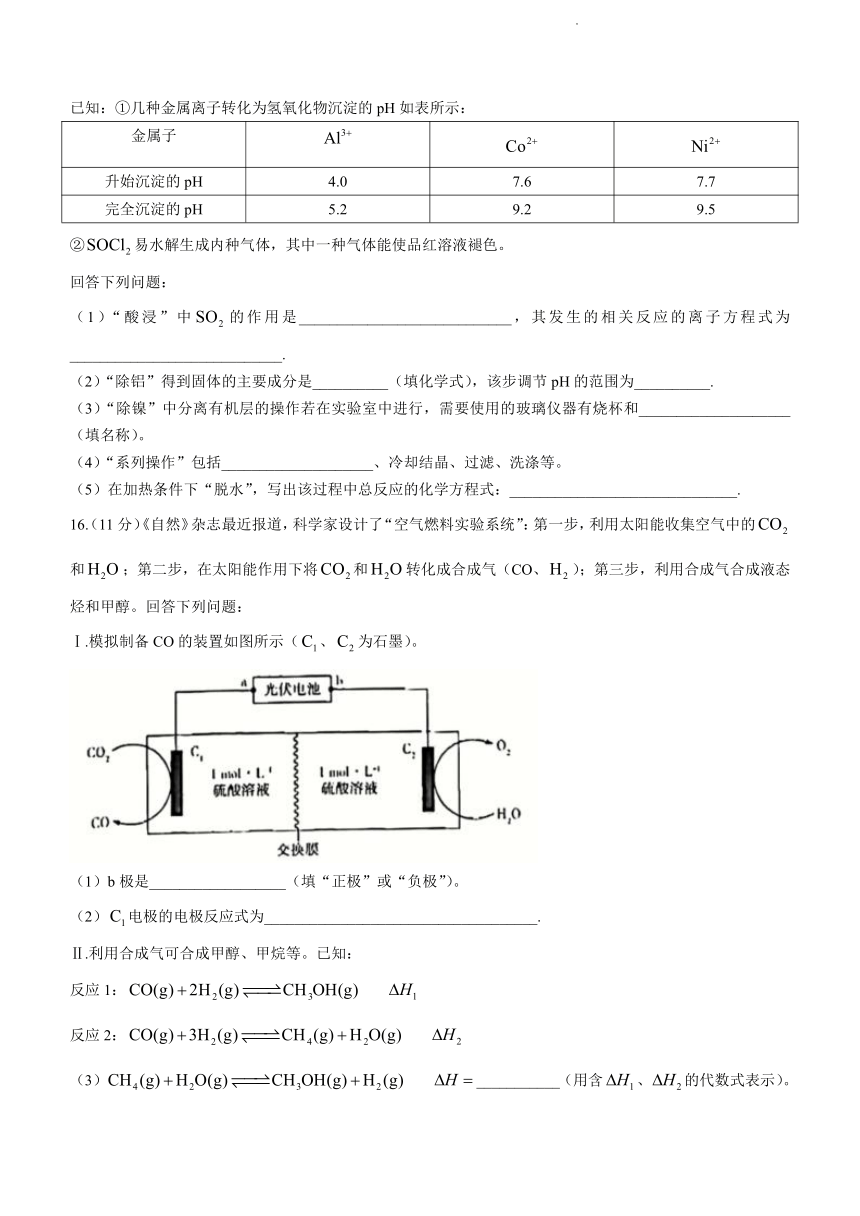
15.(10分)常作湿度指示剂、分析试剂等。以钻液(主要成分是CoO、,含少量Ni、等杂质)为原料制备无水氯化钴的流程如下(部分产物和条件省略):
已知:①几种金属离子转化为氢氧化物沉淀的pH如表所示:
金属子
升始沉淀的pH 4.0 7.6 7.7
完全沉淀的pH 5.2 9.2 9.5
②易水解生成内种气体,其中一种气体能使品红溶液褪色。
回答下列问题:
(1)“酸浸”中的作用是____________________________,其发生的相关反应的离子方程式为____________________________.
(2)“除铝”得到固体的主要成分是__________(填化学式),该步调节pH的范围为__________.
(3)“除镍”中分离有机层的操作若在实验室中进行,需要使用的玻璃仪器有烧杯和____________________(填名称)。
(4)“系列操作”包括____________________、冷却结晶、过滤、洗涤等。
(5)在加热条件下“脱水”,写出该过程中总反应的化学方程式:______________________________.
16.(11分)《自然》杂志最近报道,科学家设计了“空气燃料实验系统”:第一步,利用太阳能收集空气中的和;第二步,在太阳能作用下将和转化成合成气(CO、);第三步,利用合成气合成液态烃和甲醇。回答下列问题:
Ⅰ.模拟制备CO的装置如图所示(、为石墨)。
(1)b极是__________________(填“正极”或“负极”)。
(2)电极的电极反应式为____________________________________.
Ⅱ.利用合成气可合成甲醇、甲烷等。已知:
反应1:
反应2:
(3) ___________(用含、的代数式表示)。
(4)的速率方程为(k为速率常数,与温度、催化剂有关)。假设在某温度、催化剂作用下,仅发生反应2,测得反应速率与CO、浓度的关系如表所示:
实验 反应速率
① 0.10 0.10 v
② 0.20 0.10 2v
③ 0.20 0.20 8v
④ 0.40 x 36v
则__________,____________________表格中____________.
(5)在一定温度下,向某恒容密闭容器中充入CO和,仅发生反应1,测得平衡体系中的体积分数与投料比的关系如图所示。
在a、b、c三点中,CO的转化率最大的是__________(填字母)。
(6)在1L恒容密闭容器中充入1molCO和,在T℃、催化剂作用下只发生反应1,达到平衡时,则该温度下反应1的平衡常数__________。
17.(11分)碳化锂是一种重要的化工试剂,实验室制备的反应原理是;实验室制备CO的反应原理是,在浓硫酸、加热条件下生成CO、和,通过净化得到CO。在空气中易潮解。某实验小组拟设计实验制备碳化锂并探究其性质:
回答下列问题:
(1)按气流从左至右,装置的连接顺序为A、_________________(各装置只使用一次)。
(2)实验中,应先点燃_________(填“A”或“C”)处酒精灯,其目的是________________________________.
(3)该制备装中存在明显的缺陷,改进措施是________________________________________________.
(4)如果草酸用甲酸(HCOOH)代替(其他不变),也可以制备CO,用甲酸制备CO的化学方程式为_____________________.
(5)取少量碳化锂投入水中产生气体,该气体能使溴的四氯化碳溶液褪色,向反应后溶液中滴几滴酚酞溶液,振荡,溶液变粉红色,写出碳化锂和水反应的化学方程式:_____________________.
18.(14分)某药物活性成分中间体的一种合成路线如下:
已知:(、、表示烃基或氢原子)
回答下列问题:
(1)J中含氧官能团的名称是__________;A的名称是__________.
(2)A→B的反应试剂和条件是____________________;D→E的反应类型是____________________.
(3)I的结构简式为____________________.
(4)E→F的化学方程式为________________________________________.
(5)F的同分异构体中,同时满足下列条件的结构有_________种(不考虑立体异构)。
①能发生水解反应且水解产物能与溶液发生显色反应;
②苯环上只有2个取代基;
③0.1mol该有机物与足量银氨溶液充分反应最多生成43.2gAg。
(6)以2-氯内烷为原料合成,设计合成路线:________________________________________(无机试剂任选)。
19.(14分)据《科学》报道,中国科学家首次实现超导体中分段费米面。回答下列问题:
(1)Bi与P位于同主族,基态P原子的价层电子排布式为____________。基念Se原子核外电子云轮廓图呈哑铃形的能级上共有____________个电子。
(2)二氯二茂铌的组成为。环戊二烯阴离子的平面结构简式如图所示:
①C、H、Cl的电负性由大到小的顺序为________________________。
②中C原子的杂化类型是________________________。
③已知分子中的大键可以用表示,其中m代表参与形成大键的原子数,n代表参与形成大键的电子数,则中大键可以表示为_________.
(3)的空间构型为__________________.
(4)四氟化铌的熔点为72℃,它的晶体类型为__________________.
(5)硒化锌的品胞如图所示,a点锌原子坐标为(0,0,0),b点锌原子坐标为,则c点硒原子坐标为__________________.
海南省2021—2022学年高三学业水平诊断(三)
化学·答案
1~8小题,每小题2分,共16分。
1.B 2.C 3.D 4.A 5.D 6.C 7.C 8.B
9~14小题,每小题4分,共24分。每小题有一个或两个选项是符合题目要求的。若正确答案只包括一个选项,多选得0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要选错一个就得0分。
9.C 10.AD 11.AB 12.CD 13.AC 14.C
15.(1)将还原为(1分) (2分)
(2)(1分) (2分)
(3)分液漏斗(1分)
(4)蒸发浓缩(1分)
(5)(合理即可,2分)
16.(1)正极(1分)
(2)(2分)
(3)(2分)
(4)1(1分) 2(1分) 0.30(1分)
(5)c(1分)
(6)1(2分)
17.(1)D、C、B(2分)
(2)A(1分) 排尽装置内空气,避免空气干扰实验(2分)
(3)将从装置B中出来的气体点燃(合理即可,2分)
(4)(2分)
(5)(2分)
18.(1)酮羰基(1分) 1,3-二溴丁烷(1分)
(2)NaOH水溶液、加热(2分) 取代反应(1分)
(3)(2分)
(4)(2分)
(5)6(2分)
(6)(合理即可,3分)
19.(1)3(1分) 16(2分)
(2)①Cl>C>H(2分)
②(2分)
③(2分)
(3)正四面体形(2分)
(4)分子晶体(1分)
(5)(2分)
化 学
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Ag 108
一、选择题:本题共8小题,每小题2分,共16分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.2021年10月我国发布首次以CO、为原料合成蛋白质。下列有关说法错误的是( )
A.蛋白质是高分子化合物 B.可以被氧化成CO
C.工业上合成氨反应是化合反应 D.蛋白质水解的最终产物是氨基酸
2.据古代文献记载:“慈石治肾家诸病,而通耳明目。”“慈石,色轻紫,石上皲涩,可吸连针铁。”“慈石”的主要成分是( )
A. B.
C. D.
3.用如图所示装置能制备下列干燥的气体,且能控制反应的发生和停止的是( )(甲、乙、丙表示加入的试剂,部分夹持装置省略)
选项 气体 甲 乙 丙
A 浓盐酸 二氧化锰 氯化钙
B 稀硫酸 石灰石 五氧化二磷
C 饱和食盐水 电石 碱石灰
D 稀硫酸 锌粒 碱石灰
4.化学与生活息息相关。下列说法错误的是( )
A.浓度为95%的乙醇溶液常用于消毒杀菌
B.氯仿和四氯化碳都是常用的有机溶剂
C.甲醛的水溶液可用作防腐剂
D.聚四氟乙烯是不粘锅内侧涂层的主要成分
5.、是有机合成的重要试剂,、的熔点依次为167℃、-93.6℃。的空间结构如图所示。下列说法正确的是( )
A.分子含14mol共价键 B.的空间结构为平面三角形
C.键能不同导致、的熔点不同 D.P分子中共用电子对偏向氯
6.下列各组物质不能用水一次性鉴别的是( )
A.甲苯、溴乙烷、乙醛 B.无水硫酸铜、碳酸钠、硫酸钡
C.氯化钡、磷酸钾、硫酸铵 D.二氧化氮气体、溴蒸气
7.工业上用氨催化氧化法制硝酸的反应之一是,该反应在任何温度下都能自发进行。下列说法正确的是( )
A.该反应的、
B.其他条件不变,加入催化剂,正反应速率增大,逆反应速率减小
C.其他条件不变,改变温度,平衡常数和的平衡转化率一定都会变化
D.恒温恒容条件下,混合气体的密度不变时,反应达到平衡状态
8.设为阿伏加德罗常数的值。下列说法正确的是( )
A.溶液中含数为
B.1mol乙二醇中含杂化的原子数为
C.、的混合物中含有个硫原子
D.1mol乙炔中含有的键数为
二、选择题:本题共6小题,每小题4分,共24分。每小题有一个或两个选项是符合题目要求的。若正确答案只包括一个选项,多选得0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要选错一个就得0分。
9.工业上常采用电渗析法从含萄糖酸钠(用GCOONa表示)的废水中提取化工产品葡萄糖酸(GCOOH)和烧碱,模拟装置如图所示(电极均为石墨)。
下列说法错误的是( )
A.交换膜1、2分别为阳离子、阴离子交换膜
B.a电极为阴极,b电极上发生氧化反应
C.一段时间后,a、b电极产生气体的质量之比为8∶1
D.电路中通过1mol电子时,理论上回收40gNaOH
10.短周期主族元素R、X、Y、Z、W的原子序数依次增大,、和都是18电子微粒。常用于检验的存在。下列判断正确的是( )
A.分子的空间构型为直线形
B.在水中能抑制水的电离
C.元素的氧化物对应的水化物酸性:W>Z>X
D.分子中键和键数之比为5∶4
11.下列有关和性质的解释合理的是( )
选项 性质 解释
A 常温下,呈液态,呈气态 分子间存在氢键,而分子间不存在氢键
B 双氧水中存在 中氧有孤电子对,有空轨道,能形成配位键
C 能氧化 中氧的化合价只能降低
D 溶液中存在 是离子化合物
12.2021年诺贝尔生理学或医学奖获得者发现椒素能识别TRPVI受体。辣椒素的结构简式如图所示。
下列说法正确的是( )
A.辣椒素能与溶液反应生成
B.辣椒素分子中含1个手性碳原子
C.辣椒素能发生水解反应
D.辣椒索有顺反异构体
13.已知亚磷酸是二元弱酸,298K时的电离常数分别为:,.298K时,向溶液中通入HCl气体,溶液的pH与通入HCl物质的量的关系如图所示。下列说法正确的是( )
A.a点溶液中:
B.室温下,b点溶液的pH>7
C.c点溶液中:
D.溶液中存在的含P的离了有、、
14.根据下列实验操作和现象,所推出的结论正确的是( )
选项 实验操作 现象 结论
A 将溶液和溶液等体积混合,内滴加3滴品红溶液 溶液褪色 一定大于
B 向某溶液中滴加苯酚溶液 溶液变紫色 该溶液中含
C 向KI淀粉溶液中滴加少量溶液 溶液变蓝色 氧化性:
D 25℃时向溶液W中滴加甲基橙溶液 溶液变黄色 W溶液的pH一定大于7
三、非选择题:本题共5小题,共60分。
15.(10分)常作湿度指示剂、分析试剂等。以钻液(主要成分是CoO、,含少量Ni、等杂质)为原料制备无水氯化钴的流程如下(部分产物和条件省略):
已知:①几种金属离子转化为氢氧化物沉淀的pH如表所示:
金属子
升始沉淀的pH 4.0 7.6 7.7
完全沉淀的pH 5.2 9.2 9.5
②易水解生成内种气体,其中一种气体能使品红溶液褪色。
回答下列问题:
(1)“酸浸”中的作用是____________________________,其发生的相关反应的离子方程式为____________________________.
(2)“除铝”得到固体的主要成分是__________(填化学式),该步调节pH的范围为__________.
(3)“除镍”中分离有机层的操作若在实验室中进行,需要使用的玻璃仪器有烧杯和____________________(填名称)。
(4)“系列操作”包括____________________、冷却结晶、过滤、洗涤等。
(5)在加热条件下“脱水”,写出该过程中总反应的化学方程式:______________________________.
16.(11分)《自然》杂志最近报道,科学家设计了“空气燃料实验系统”:第一步,利用太阳能收集空气中的和;第二步,在太阳能作用下将和转化成合成气(CO、);第三步,利用合成气合成液态烃和甲醇。回答下列问题:
Ⅰ.模拟制备CO的装置如图所示(、为石墨)。
(1)b极是__________________(填“正极”或“负极”)。
(2)电极的电极反应式为____________________________________.
Ⅱ.利用合成气可合成甲醇、甲烷等。已知:
反应1:
反应2:
(3) ___________(用含、的代数式表示)。
(4)的速率方程为(k为速率常数,与温度、催化剂有关)。假设在某温度、催化剂作用下,仅发生反应2,测得反应速率与CO、浓度的关系如表所示:
实验 反应速率
① 0.10 0.10 v
② 0.20 0.10 2v
③ 0.20 0.20 8v
④ 0.40 x 36v
则__________,____________________表格中____________.
(5)在一定温度下,向某恒容密闭容器中充入CO和,仅发生反应1,测得平衡体系中的体积分数与投料比的关系如图所示。
在a、b、c三点中,CO的转化率最大的是__________(填字母)。
(6)在1L恒容密闭容器中充入1molCO和,在T℃、催化剂作用下只发生反应1,达到平衡时,则该温度下反应1的平衡常数__________。
17.(11分)碳化锂是一种重要的化工试剂,实验室制备的反应原理是;实验室制备CO的反应原理是,在浓硫酸、加热条件下生成CO、和,通过净化得到CO。在空气中易潮解。某实验小组拟设计实验制备碳化锂并探究其性质:
回答下列问题:
(1)按气流从左至右,装置的连接顺序为A、_________________(各装置只使用一次)。
(2)实验中,应先点燃_________(填“A”或“C”)处酒精灯,其目的是________________________________.
(3)该制备装中存在明显的缺陷,改进措施是________________________________________________.
(4)如果草酸用甲酸(HCOOH)代替(其他不变),也可以制备CO,用甲酸制备CO的化学方程式为_____________________.
(5)取少量碳化锂投入水中产生气体,该气体能使溴的四氯化碳溶液褪色,向反应后溶液中滴几滴酚酞溶液,振荡,溶液变粉红色,写出碳化锂和水反应的化学方程式:_____________________.
18.(14分)某药物活性成分中间体的一种合成路线如下:
已知:(、、表示烃基或氢原子)
回答下列问题:
(1)J中含氧官能团的名称是__________;A的名称是__________.
(2)A→B的反应试剂和条件是____________________;D→E的反应类型是____________________.
(3)I的结构简式为____________________.
(4)E→F的化学方程式为________________________________________.
(5)F的同分异构体中,同时满足下列条件的结构有_________种(不考虑立体异构)。
①能发生水解反应且水解产物能与溶液发生显色反应;
②苯环上只有2个取代基;
③0.1mol该有机物与足量银氨溶液充分反应最多生成43.2gAg。
(6)以2-氯内烷为原料合成,设计合成路线:________________________________________(无机试剂任选)。
19.(14分)据《科学》报道,中国科学家首次实现超导体中分段费米面。回答下列问题:
(1)Bi与P位于同主族,基态P原子的价层电子排布式为____________。基念Se原子核外电子云轮廓图呈哑铃形的能级上共有____________个电子。
(2)二氯二茂铌的组成为。环戊二烯阴离子的平面结构简式如图所示:
①C、H、Cl的电负性由大到小的顺序为________________________。
②中C原子的杂化类型是________________________。
③已知分子中的大键可以用表示,其中m代表参与形成大键的原子数,n代表参与形成大键的电子数,则中大键可以表示为_________.
(3)的空间构型为__________________.
(4)四氟化铌的熔点为72℃,它的晶体类型为__________________.
(5)硒化锌的品胞如图所示,a点锌原子坐标为(0,0,0),b点锌原子坐标为,则c点硒原子坐标为__________________.
海南省2021—2022学年高三学业水平诊断(三)
化学·答案
1~8小题,每小题2分,共16分。
1.B 2.C 3.D 4.A 5.D 6.C 7.C 8.B
9~14小题,每小题4分,共24分。每小题有一个或两个选项是符合题目要求的。若正确答案只包括一个选项,多选得0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要选错一个就得0分。
9.C 10.AD 11.AB 12.CD 13.AC 14.C
15.(1)将还原为(1分) (2分)
(2)(1分) (2分)
(3)分液漏斗(1分)
(4)蒸发浓缩(1分)
(5)(合理即可,2分)
16.(1)正极(1分)
(2)(2分)
(3)(2分)
(4)1(1分) 2(1分) 0.30(1分)
(5)c(1分)
(6)1(2分)
17.(1)D、C、B(2分)
(2)A(1分) 排尽装置内空气,避免空气干扰实验(2分)
(3)将从装置B中出来的气体点燃(合理即可,2分)
(4)(2分)
(5)(2分)
18.(1)酮羰基(1分) 1,3-二溴丁烷(1分)
(2)NaOH水溶液、加热(2分) 取代反应(1分)
(3)(2分)
(4)(2分)
(5)6(2分)
(6)(合理即可,3分)
19.(1)3(1分) 16(2分)
(2)①Cl>C>H(2分)
②(2分)
③(2分)
(3)正四面体形(2分)
(4)分子晶体(1分)
(5)(2分)
同课章节目录
