广东省名校2021-2022学年高三下学期3月开学测试化学试题(Word版含答案)
文档属性
| 名称 | 广东省名校2021-2022学年高三下学期3月开学测试化学试题(Word版含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-09 09:29:51 | ||
图片预览

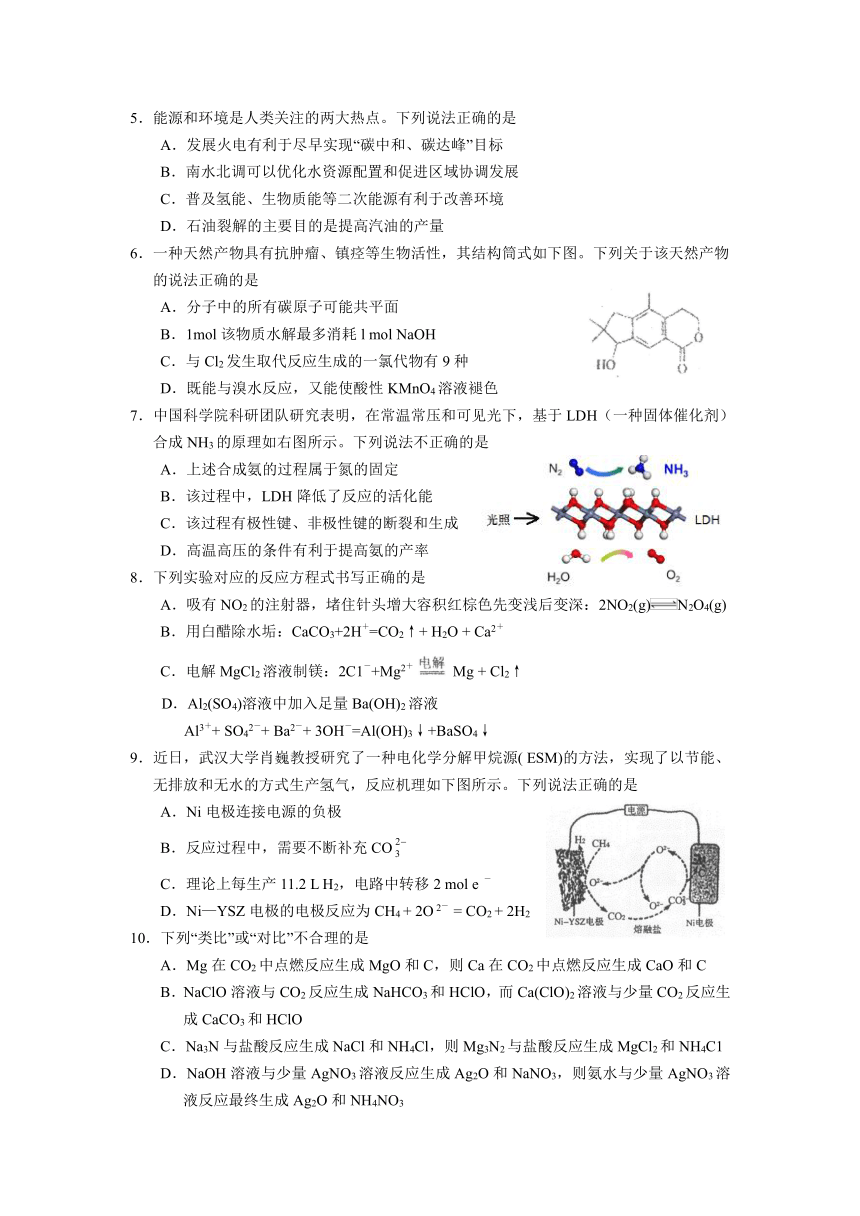


文档简介
广东名校2022届高三下学期开学测试
化 学
时间:75分钟,全卷满分:100分
可能用到的相对原子质量:H-1 Li-7 B-11 C-12 N-14 O-16 Na-23 Mg-24
Al-27 S-32 Cl-35.5 K-39 Ca-40 Cr-52 Mn-55 Fe-56 Ni-59 Cu-64 Ga-70 Mo-96
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11-16小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.中国年中国昧。下列新春文化的主要材料不属于天然有机高分子的是
2.化学与生产、生活、科技、环境等关系密切。下列说法错误的是
A.汽车尾气催化转化器可有效减少CO2的排放,实现“碳中和”
B.春雨如雾,雾是一种气溶胶,光束透过大雾可观察到丁达尔效应
C.稀土永磁材料是电子技术通讯中的重要材料,稀土元素均为金属元素
D.“深海勇士”号潜水艇使用的锂离子电池是一种二次电池
3.实验室通过制氯气来获得漂白液,下列装置(夹持装置略)中不必使用的是
4.NA为阿伏加德罗常数的值。下列叙述正确的是
A.pH=1的HCl溶液中,含HCl分子的数目为NA
B.0.3mol的NO2与足量的H2O完全反应时产生2.24LNO气体
C.6.4g环状S8()分子中含有的S—S键数为0.2 NA
D.1LpH=4的0.1mol·L-1K2Cr2O7溶液中所含Cr2O72-数为0.1 NA
5.能源和环境是人类关注的两大热点。下列说法正确的是
A.发展火电有利于尽早实现“碳中和、碳达峰”目标
B.南水北调可以优化水资源配置和促进区域协调发展
C.普及氢能、生物质能等二次能源有利于改善环境
D.石油裂解的主要目的是提高汽油的产量
6.一种天然产物具有抗肿瘤、镇痉等生物活性,其结构筒式如下图。下列关于该天然产物
的说法正确的是
A.分子中的所有碳原子可能共平面
B.1mol该物质水解最多消耗l mol NaOH
C.与Cl2发生取代反应生成的一氯代物有9种
D.既能与溴水反应,又能使酸性KMnO4溶液褪色
7.中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理如右图所示。下列说法不正确的是
A.上述合成氨的过程属于氮的固定
B.该过程中,LDH降低了反应的活化能
C.该过程有极性键、非极性键的断裂和生成
D.高温高压的条件有利于提高氨的产率
8.下列实验对应的反应方程式书写正确的是
A.吸有NO2的注射器,堵住针头增大容积红棕色先变浅后变深:2NO2(g)N2O4(g)
B.用白醋除水垢:CaCO3+2H+=CO2↑+ H2O + Ca2+
C.电解MgCl2溶液制镁:2C1-+Mg2+ Mg + Cl2↑
D.Al2(SO4)溶液中加入足量Ba(OH)2溶液
Al3++ SO42-+ Ba2-+ 3OH-=Al(OH)3↓+BaSO4↓
9.近日,武汉大学肖巍教授研究了一种电化学分解甲烷源( ESM)的方法,实现了以节能、无排放和无水的方式生产氢气,反应机理如下图所示。下列说法正确的是
A.Ni电极连接电源的负极
B.反应过程中,需要不断补充CO
C.理论上每生产11.2 L H2,电路中转移2 mol e -
D.Ni—YSZ电极的电极反应为CH4 + 2O 2- = CO2 + 2H2
10.下列“类比”或“对比”不合理的是
A.Mg在CO2中点燃反应生成MgO和C,则Ca在CO2中点燃反应生成CaO和C
B.NaClO溶液与CO2反应生成NaHCO3和HClO,而Ca(ClO)2溶液与少量CO2反应生成CaCO3和HClO
C.Na3N与盐酸反应生成NaCl和NH4Cl,则Mg3N2与盐酸反应生成MgCl2和NH4C1
D.NaOH溶液与少量AgNO3溶液反应生成Ag2O和NaNO3,则氨水与少量AgNO3溶液反应最终生成Ag2O和NH4NO3
11.某多孔储氢材料前驱体结构如图,M、W、X、Y、Z五种元素原子序数依次增大Z原子最外层电子数是电子层数的3倍。下列说法正确的是
A.Z的氢化物只含极性键
B.原子半径:M>W>X>Y>Z
C.Z的氢化物沸点一定比X的氢化物的沸点高
D.已知H3WO3的电离反应:H3WO3+H2OH++W(OH)4-,Ka=5.81× 10-10,可判断H3WO3是一元弱酸
12.下列化学用语使用正确的是
A.SiO2的结构式:O-Si=O
B.H2O2的电子式:
C.BaSO4的电离方程式:BaSO4SO42-+ Ba2+
D.12C与14C互为同素异形体
13.对下列粒子组在溶液中能否大量共存的判断和分析均正确的是
粒子组 判断和分析
A Na+、Al3+、Cl-、NH3·H2O 不能大量共存,因发生反应:Al3++4NH3·H2O = AlO+4NH+2H2O
B H+、K+、S2O、SO 不能大量共存,因发生反应:2H++ S2O=S↓+SO2↑+H2O
C Na+、Fe3+、SO、H2O2 能大量共存,粒子间不反应
D H++ Na+、Cl-、MnO 能大量共存,粒子间不反应
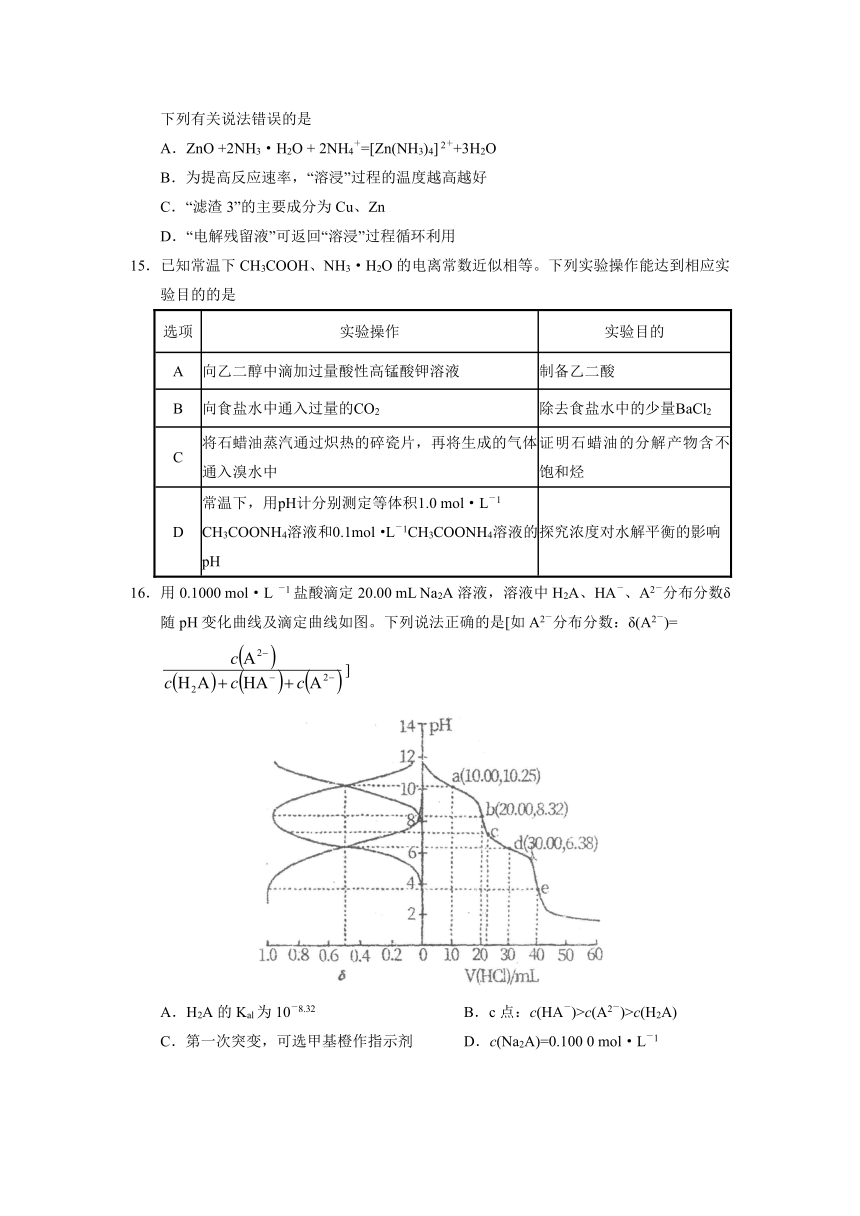
14.现代工业开发了用“NH3—NH4Cl水溶液”浸出氧化锌烟灰(主要成分为ZnO、Pb、CuO和As2O3)制取高纯锌的工艺流程如下图所示:
已知:①浸出液中含[Zn(NH3)4]2+、[Cu(NH3)4]2+、AsCl52-,且存在[M(NH3)4]2+ M 2++ 4NH3(M为Cu或Zn);②“氧化除杂”的目的是将AsCl52-转化为As2O5胶体,再经吸附聚沉除去。
下列有关说法错误的是
A.ZnO +2NH3·H2O + 2NH4+=[Zn(NH3)4] 2++3H2O
B.为提高反应速率,“溶浸”过程的温度越高越好
C.“滤渣3”的主要成分为Cu、Zn
D.“电解残留液”可返回“溶浸”过程循环利用
15.已知常温下CH3COOH、NH3·H2O的电离常数近似相等。下列实验操作能达到相应实
验目的的是
选项 实验操作 实验目的
A 向乙二醇中滴加过量酸性高锰酸钾溶液 制备乙二酸
B 向食盐水中通入过量的CO2 除去食盐水中的少量BaCl2
C 将石蜡油蒸汽通过炽热的碎瓷片,再将生成的气体通入溴水中 证明石蜡油的分解产物含不饱和烃
D 常温下,用pH计分别测定等体积1.0 mol·L-1CH3COONH4溶液和0.1mol·L-1CH3COONH4溶液的pH 探究浓度对水解平衡的影响
16.用0.1000 mol·L -1盐酸滴定20.00 mL Na2A溶液,溶液中H2A、HA-、A2-分布分数δ随pH变化曲线及滴定曲线如图。下列说法正确的是[如A2-分布分数:δ(A2-)=
]
A.H2A的Kal为10-8.32 B.c点:c(HA-)>c(A2-)>c(H2A)
C.第一次突变,可选甲基橙作指示剂 D.c(Na2A)=0.100 0 mol·L-1
二、非选择题:共56分。第17~l9题为必考题,考生都必须作答,第20~21题为选考题,考生根据要求作答。
(一)必考题:共42分。
17.(14分)某化学兴趣小组探究FeCl3溶液和Na2SO3溶液的反应情况。请回答相关问题。
(1)简述用FeCl3晶体配制FeCl3溶液的方法:________________________________;Na2SO3溶液用________(填瓶塞材质)细口瓶保存。
[实验1]分别将100 mL 1.0 mol·L-1的FeCl3溶液和Na2SO3溶液装入两个烧杯中,按下图进行实验,观察到电流汁指针发生偏转。
(2)请写出左侧烧杯中的电极反应式____________________________________________。
盐桥中的阳离子向____________(填“左侧”或“右侧”)烧杯中迁移。
[实验2]在试管1中加入2 mL 1.0 mo1·L-1Na2SO3溶液,然后滴加两滴1.0 mol·L-1 FeCl3溶液,溶液中立刻变成红褐色。对试管l进行加热至沸腾,产生红褐色沉淀。取出几漓混合液,加K3[Fe(CN)6]溶液,无蓝色沉淀出现。整个过程中来观察到明显的气泡产生。
[实验3]在试管2中加入5 mol 1.0 mol·L-1 FeCl3溶液,然后再滴加l mL 1.0 mol·L-1 Na2SO3溶液,溶液立刻变成红褐色。取出几滴混合液,加K3[Fe(CN)6】溶液,产生蓝色沉淀。
(3)实验3中生成蓝色沉淀的离子方程式为________________________________________。
请设计实验证明SO被氧化____________________________________________________。
(反思与研讨]
资料显示:H2SO3的Kal=1.7×10-2 Ka2=6.0 × 10-8;Fe(OH)3的Ksp=4 × 10-38;
反应2Fe3++ SO+ H2O2Fe2++SO+ 2H+的平衡常数K= 1020.6。
(4)反应2Fe3++ 3SO+6H2O2Fe(OH)3↓+ 3H2SO3的平衡常数K的数量级为________。由此可判断FeCl3溶液和Na2SO3溶液发生________________________(填“互促水解”或“氧化还原”)反应的趋势更大。
18.(14分)铼(Re)是熔点和沸点较高的金属单质之一,用于制造高效能喷射引擎和火箭引擎。钼酸锂(Li2MoO4)的外观为白色结晶粉末,用于电极材料、金属陶瓷的制作。从辉钼矿氧化焙烧后的烟道灰(主要成分有SiO2、Re2O7、MoO3、CuO、Fe3O4)中提取铼粉和制钼酸锂的流程如下图所示。
已知:
Ⅰ.Re2O7是酸性氧化物,过铼酸(HReO4)是易溶于水的一元强酸,但不具有强氧化性。
Ⅱ.过铼酸铵(NH4ReO4)是白色片状晶体,微溶于冷水,溶于热水。
回答下列问题:
(1)“碱浸”时,Re2O7和MoO3分别与NaOH发生以下反应________________(填写化学方程式)、MoO3+2NaOH NaMoO4+H2O,则“滤渣I”的主要成分为________(填化学式)。
(2)“还原”时,Zn被氧化成ZnO2 2-,铼的化合物被还原生成难溶的2ReO2·2H2O,该反应的离子方程式为________________________________。
(3)“沉铼”时,加入热NH4C1溶液至产生白色沉淀,为使沉淀充分析出并分离得到纯净NH4ReO4晶体,“操作I”包括________、________、洗涤、干燥。
(4)“热解”时,发生反应的化学方程式为____________________。
(5)“酸化沉钼”过程溶液pH和反应时间对钼酸的析出有很大影响,根据图2中数据判断最佳的“酸化沉钼”条件:反应时间为____________min、pH为____________。
(6)电氧化法是一种极具发展前景的钼精矿冶金工艺,其工作原理如图3所示。电解时,若维持电流强度为0.5A(相当于每秒通过5×10-6mol电子),电解90min,理论上消耗MoS2的质量为________g。
19.(14分)甲醇是重要的化工原料,研究甲醇的制备及用途在工业上有重要的意义。
(1)一种重要的工业制备甲醇的反应为CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H。
已知:①CO(g)+H2O(g)CO2(g)+H2(g) △H1=-40.9kJ·mol-1
②CO(g)+2H2O(g)CH3OH(g) △H2=-90.4kJ·mol-1
试计算制备反应的△H=__________。
(2)对于反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),v正=k正p(CO2)·p3(H2),v逆=k逆·p(CH3OH)
·p(H2O)。其中k正、k逆分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。
在540K下,按初始投料比n(CO2):n(H2)=3:l、n(CO2):n(H2)=1:1、n(CO2):n(H2)=1:3,得到不同压强条件下H2的平衡转化率关系图:
①比较a、b、c各曲线所表示的投料比大小顺序为________________(用字母表示)。
②点N在线b上,计算540K的压强平衡常数Kp=____________(用平衡分压代替平衡浓度计算)。
③540K条件下,某容器测得某时刻p(CO2)=0.2MPa,p(CH3OH)=p(H2O)=0.1MPa,
p(H2)=0.4MPa,此时v正:v逆=____________。
(3)甲醇催化可制取丙烯,反应为:
3CH3OH(g)C3H6(g)+3H2O(g),反应的Arrhenius经验公式的实验数据如下图中曲线a所示,己知Arrhenius经验公式为R lnk=(Ea为活化能,k为速率常数,R和C为常数)
①该反应的活化能Ea=____________kJ·mol-1。
②当使用更高效催化剂时,在图中画出R lnk与关系的示意图。
(4)在饱和KHCO3电解液中,电解活化的CO2也可以制备CH3OH,其原理如下图所示,则
阴极的电极反应式为_______。
(二)选考题:共14分。请考生从2道题中任选一题作答。如果多做,则按所做的第一题计分。
20.[选修3:物质结构与性质】(14分)
(1)据世界权威刊物《自然》最近报道,我国科学家选择碲化锆(ZrTe2)和砷化镉(Cd3As2)
为材料验证了三维量子霍尔效应,并发现了金属-绝缘体的转换。回答下列问题:
①基态锌原子的电子排布式为________,原子中运动的电子有两种相反的自旋状态,若一种自旋状态用表示,与之相反的用表示,称为电子的自旋磁量子数。对于基态的锌原子,其价电子自旋磁量子数的代数和为________。
②Cd与Zn同族,价电子数相同,若配离子[Cd(CN)x](x-2)-的中心离子价电子数与配体提供的电子数之和为18,则x=________。
③碲和硫同主族,TeO32-的空间构型为________,写出一个与TeO32-互为等电子体的分子________。
(2)石墨烯是一种二维碳纳米材料,具有优异的光学、力学、电学特性,在材料学、微纳加工、能源、生物医学和药物传递方面具有重要应用前景。1 mol石墨烯含六元环的数目为________;石墨烯中部分碳原子被氧化后,其平面结构将发生改变,转化为氧化石墨烯(如
下图4),氧化石墨烯中键角α________(填“>”、“<”或“=”)键角β,原因是____________。
(3)立方氮化硼晶体的结构和硬度都与金刚石相似,晶胞结构如图5所示,B原子填在由N原子构成的________(填“四面体”、“八两体”或“立方体”)空隙中。若晶胞边长为a pm,B原子半径为b pm,N原子半径为c pm,则该晶胞的空间利用率为________(列出计算式),氮硼原子间的最短距离为________ pm。
21.[选修5:有机化学基础](14分)某药物中间体I的合成路线如图所示:
已知:
回答下列问题:
(1)A的结构简式为________;H的官能团名称为________。
(2)反应②中的化学方程式为________________________。
(3)反应⑤的化学反应类型为____________。
(4)同时满足下列条件的F的同分异构体的数目为________。
①分子结构中含六元碳环、甲基和酮羰基;②既能发生水解反应,又能发生银镜反应写出其中核磁共振氢谱有4组峰,峰面积比为4:4:3:1的结构简式____________。
(5)参照上述合成路线和信息,以和为原料(无机试剂任选),设计三步制备
的合成路线。
化学参考答案
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11-16小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
题号 1 2 3 4 5 6 7 8 9 10
答案 B A B C B B D A A D
题号 11 12 13 14 15 16
答案 D C B B C D
二、非选择题:共56分。第17~19题为必考题,考生都必须作答。第20~21题为选考题,考生根据要求作答。
17.(14分)
(1)先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度(2分) 橡胶(1分)
(2) Fe3++e-=Fe2+(2分) 左侧(1分)
(3)3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓(2分) 取少许试管中的混合液,加入盐酸酸化,再加入BaCl2溶液,有白色沉淀生成(2分)
(4) 1017(2分) 氧化还原(2分)
18.(14分)
(1)Re2O7+2NaOH2NaReO4+H2O(2分);CuO、Fe3O4(每个1分,共2分)
(2)3Zn+2ReO4-+4OH-=3ZnO22-+2ReO2·2H2O(2分)
(3)冷却结晶、过滤(2分)
(4)4NH4ReO4+3O22N2+8H2O+2Re2O7(2分)
(5)60 1.0(每个1分,共2分)
(6)0.24(2分)
19.(14分)
(1)-49.5kJ·mol-1(2分)
(2)①a>b>c(2分) ②0.5 (MPa)-2(2分)③0.64 (2分)
(3)①31(2分) ②(2分)
(4) 7CO2 +6e-+5H2O=CH3OH+6HCO3-(2分)
【选修3:物质结构与性质】(14分)
(1)①1s22s22p63s23p63d104s2或[Ar]3d104s2(1分);0(1分)
②4(2分)
③三角锥形(1分);PCl3、NF3、SOCl2等(1分)
(2) 0.5NA(1分);<(1分);
键角α对应的碳为sp3杂化,键角β对应的碳为sp2杂化(2分)
(3)四面体(1分);(2分);(1分)
21.[选修5:有机化学基础](14分)
(1)(2分);碳碳双键、酶基(2分)
(2)(2分)
(3)加成反应或还原反应(1分)
(4) 13 (2分);(2分)
(5)(每步1分,共3分,每步反应物、生成物、试剂和条件都正确才得分)
化 学
时间:75分钟,全卷满分:100分
可能用到的相对原子质量:H-1 Li-7 B-11 C-12 N-14 O-16 Na-23 Mg-24
Al-27 S-32 Cl-35.5 K-39 Ca-40 Cr-52 Mn-55 Fe-56 Ni-59 Cu-64 Ga-70 Mo-96
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11-16小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.中国年中国昧。下列新春文化的主要材料不属于天然有机高分子的是
2.化学与生产、生活、科技、环境等关系密切。下列说法错误的是
A.汽车尾气催化转化器可有效减少CO2的排放,实现“碳中和”
B.春雨如雾,雾是一种气溶胶,光束透过大雾可观察到丁达尔效应
C.稀土永磁材料是电子技术通讯中的重要材料,稀土元素均为金属元素
D.“深海勇士”号潜水艇使用的锂离子电池是一种二次电池
3.实验室通过制氯气来获得漂白液,下列装置(夹持装置略)中不必使用的是
4.NA为阿伏加德罗常数的值。下列叙述正确的是
A.pH=1的HCl溶液中,含HCl分子的数目为NA
B.0.3mol的NO2与足量的H2O完全反应时产生2.24LNO气体
C.6.4g环状S8()分子中含有的S—S键数为0.2 NA
D.1LpH=4的0.1mol·L-1K2Cr2O7溶液中所含Cr2O72-数为0.1 NA
5.能源和环境是人类关注的两大热点。下列说法正确的是
A.发展火电有利于尽早实现“碳中和、碳达峰”目标
B.南水北调可以优化水资源配置和促进区域协调发展
C.普及氢能、生物质能等二次能源有利于改善环境
D.石油裂解的主要目的是提高汽油的产量
6.一种天然产物具有抗肿瘤、镇痉等生物活性,其结构筒式如下图。下列关于该天然产物
的说法正确的是
A.分子中的所有碳原子可能共平面
B.1mol该物质水解最多消耗l mol NaOH
C.与Cl2发生取代反应生成的一氯代物有9种
D.既能与溴水反应,又能使酸性KMnO4溶液褪色
7.中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理如右图所示。下列说法不正确的是
A.上述合成氨的过程属于氮的固定
B.该过程中,LDH降低了反应的活化能
C.该过程有极性键、非极性键的断裂和生成
D.高温高压的条件有利于提高氨的产率
8.下列实验对应的反应方程式书写正确的是
A.吸有NO2的注射器,堵住针头增大容积红棕色先变浅后变深:2NO2(g)N2O4(g)
B.用白醋除水垢:CaCO3+2H+=CO2↑+ H2O + Ca2+
C.电解MgCl2溶液制镁:2C1-+Mg2+ Mg + Cl2↑
D.Al2(SO4)溶液中加入足量Ba(OH)2溶液
Al3++ SO42-+ Ba2-+ 3OH-=Al(OH)3↓+BaSO4↓
9.近日,武汉大学肖巍教授研究了一种电化学分解甲烷源( ESM)的方法,实现了以节能、无排放和无水的方式生产氢气,反应机理如下图所示。下列说法正确的是
A.Ni电极连接电源的负极
B.反应过程中,需要不断补充CO
C.理论上每生产11.2 L H2,电路中转移2 mol e -
D.Ni—YSZ电极的电极反应为CH4 + 2O 2- = CO2 + 2H2
10.下列“类比”或“对比”不合理的是
A.Mg在CO2中点燃反应生成MgO和C,则Ca在CO2中点燃反应生成CaO和C
B.NaClO溶液与CO2反应生成NaHCO3和HClO,而Ca(ClO)2溶液与少量CO2反应生成CaCO3和HClO
C.Na3N与盐酸反应生成NaCl和NH4Cl,则Mg3N2与盐酸反应生成MgCl2和NH4C1
D.NaOH溶液与少量AgNO3溶液反应生成Ag2O和NaNO3,则氨水与少量AgNO3溶液反应最终生成Ag2O和NH4NO3
11.某多孔储氢材料前驱体结构如图,M、W、X、Y、Z五种元素原子序数依次增大Z原子最外层电子数是电子层数的3倍。下列说法正确的是
A.Z的氢化物只含极性键
B.原子半径:M>W>X>Y>Z
C.Z的氢化物沸点一定比X的氢化物的沸点高
D.已知H3WO3的电离反应:H3WO3+H2OH++W(OH)4-,Ka=5.81× 10-10,可判断H3WO3是一元弱酸
12.下列化学用语使用正确的是
A.SiO2的结构式:O-Si=O
B.H2O2的电子式:
C.BaSO4的电离方程式:BaSO4SO42-+ Ba2+
D.12C与14C互为同素异形体
13.对下列粒子组在溶液中能否大量共存的判断和分析均正确的是
粒子组 判断和分析
A Na+、Al3+、Cl-、NH3·H2O 不能大量共存,因发生反应:Al3++4NH3·H2O = AlO+4NH+2H2O
B H+、K+、S2O、SO 不能大量共存,因发生反应:2H++ S2O=S↓+SO2↑+H2O
C Na+、Fe3+、SO、H2O2 能大量共存,粒子间不反应
D H++ Na+、Cl-、MnO 能大量共存,粒子间不反应
14.现代工业开发了用“NH3—NH4Cl水溶液”浸出氧化锌烟灰(主要成分为ZnO、Pb、CuO和As2O3)制取高纯锌的工艺流程如下图所示:
已知:①浸出液中含[Zn(NH3)4]2+、[Cu(NH3)4]2+、AsCl52-,且存在[M(NH3)4]2+ M 2++ 4NH3(M为Cu或Zn);②“氧化除杂”的目的是将AsCl52-转化为As2O5胶体,再经吸附聚沉除去。
下列有关说法错误的是
A.ZnO +2NH3·H2O + 2NH4+=[Zn(NH3)4] 2++3H2O
B.为提高反应速率,“溶浸”过程的温度越高越好
C.“滤渣3”的主要成分为Cu、Zn
D.“电解残留液”可返回“溶浸”过程循环利用
15.已知常温下CH3COOH、NH3·H2O的电离常数近似相等。下列实验操作能达到相应实
验目的的是
选项 实验操作 实验目的
A 向乙二醇中滴加过量酸性高锰酸钾溶液 制备乙二酸
B 向食盐水中通入过量的CO2 除去食盐水中的少量BaCl2
C 将石蜡油蒸汽通过炽热的碎瓷片,再将生成的气体通入溴水中 证明石蜡油的分解产物含不饱和烃
D 常温下,用pH计分别测定等体积1.0 mol·L-1CH3COONH4溶液和0.1mol·L-1CH3COONH4溶液的pH 探究浓度对水解平衡的影响
16.用0.1000 mol·L -1盐酸滴定20.00 mL Na2A溶液,溶液中H2A、HA-、A2-分布分数δ随pH变化曲线及滴定曲线如图。下列说法正确的是[如A2-分布分数:δ(A2-)=
]
A.H2A的Kal为10-8.32 B.c点:c(HA-)>c(A2-)>c(H2A)
C.第一次突变,可选甲基橙作指示剂 D.c(Na2A)=0.100 0 mol·L-1
二、非选择题:共56分。第17~l9题为必考题,考生都必须作答,第20~21题为选考题,考生根据要求作答。
(一)必考题:共42分。
17.(14分)某化学兴趣小组探究FeCl3溶液和Na2SO3溶液的反应情况。请回答相关问题。
(1)简述用FeCl3晶体配制FeCl3溶液的方法:________________________________;Na2SO3溶液用________(填瓶塞材质)细口瓶保存。
[实验1]分别将100 mL 1.0 mol·L-1的FeCl3溶液和Na2SO3溶液装入两个烧杯中,按下图进行实验,观察到电流汁指针发生偏转。
(2)请写出左侧烧杯中的电极反应式____________________________________________。
盐桥中的阳离子向____________(填“左侧”或“右侧”)烧杯中迁移。
[实验2]在试管1中加入2 mL 1.0 mo1·L-1Na2SO3溶液,然后滴加两滴1.0 mol·L-1 FeCl3溶液,溶液中立刻变成红褐色。对试管l进行加热至沸腾,产生红褐色沉淀。取出几漓混合液,加K3[Fe(CN)6]溶液,无蓝色沉淀出现。整个过程中来观察到明显的气泡产生。
[实验3]在试管2中加入5 mol 1.0 mol·L-1 FeCl3溶液,然后再滴加l mL 1.0 mol·L-1 Na2SO3溶液,溶液立刻变成红褐色。取出几滴混合液,加K3[Fe(CN)6】溶液,产生蓝色沉淀。
(3)实验3中生成蓝色沉淀的离子方程式为________________________________________。
请设计实验证明SO被氧化____________________________________________________。
(反思与研讨]
资料显示:H2SO3的Kal=1.7×10-2 Ka2=6.0 × 10-8;Fe(OH)3的Ksp=4 × 10-38;
反应2Fe3++ SO+ H2O2Fe2++SO+ 2H+的平衡常数K= 1020.6。
(4)反应2Fe3++ 3SO+6H2O2Fe(OH)3↓+ 3H2SO3的平衡常数K的数量级为________。由此可判断FeCl3溶液和Na2SO3溶液发生________________________(填“互促水解”或“氧化还原”)反应的趋势更大。
18.(14分)铼(Re)是熔点和沸点较高的金属单质之一,用于制造高效能喷射引擎和火箭引擎。钼酸锂(Li2MoO4)的外观为白色结晶粉末,用于电极材料、金属陶瓷的制作。从辉钼矿氧化焙烧后的烟道灰(主要成分有SiO2、Re2O7、MoO3、CuO、Fe3O4)中提取铼粉和制钼酸锂的流程如下图所示。
已知:
Ⅰ.Re2O7是酸性氧化物,过铼酸(HReO4)是易溶于水的一元强酸,但不具有强氧化性。
Ⅱ.过铼酸铵(NH4ReO4)是白色片状晶体,微溶于冷水,溶于热水。
回答下列问题:
(1)“碱浸”时,Re2O7和MoO3分别与NaOH发生以下反应________________(填写化学方程式)、MoO3+2NaOH NaMoO4+H2O,则“滤渣I”的主要成分为________(填化学式)。
(2)“还原”时,Zn被氧化成ZnO2 2-,铼的化合物被还原生成难溶的2ReO2·2H2O,该反应的离子方程式为________________________________。
(3)“沉铼”时,加入热NH4C1溶液至产生白色沉淀,为使沉淀充分析出并分离得到纯净NH4ReO4晶体,“操作I”包括________、________、洗涤、干燥。
(4)“热解”时,发生反应的化学方程式为____________________。
(5)“酸化沉钼”过程溶液pH和反应时间对钼酸的析出有很大影响,根据图2中数据判断最佳的“酸化沉钼”条件:反应时间为____________min、pH为____________。
(6)电氧化法是一种极具发展前景的钼精矿冶金工艺,其工作原理如图3所示。电解时,若维持电流强度为0.5A(相当于每秒通过5×10-6mol电子),电解90min,理论上消耗MoS2的质量为________g。
19.(14分)甲醇是重要的化工原料,研究甲醇的制备及用途在工业上有重要的意义。
(1)一种重要的工业制备甲醇的反应为CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H。
已知:①CO(g)+H2O(g)CO2(g)+H2(g) △H1=-40.9kJ·mol-1
②CO(g)+2H2O(g)CH3OH(g) △H2=-90.4kJ·mol-1
试计算制备反应的△H=__________。
(2)对于反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),v正=k正p(CO2)·p3(H2),v逆=k逆·p(CH3OH)
·p(H2O)。其中k正、k逆分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。
在540K下,按初始投料比n(CO2):n(H2)=3:l、n(CO2):n(H2)=1:1、n(CO2):n(H2)=1:3,得到不同压强条件下H2的平衡转化率关系图:
①比较a、b、c各曲线所表示的投料比大小顺序为________________(用字母表示)。
②点N在线b上,计算540K的压强平衡常数Kp=____________(用平衡分压代替平衡浓度计算)。
③540K条件下,某容器测得某时刻p(CO2)=0.2MPa,p(CH3OH)=p(H2O)=0.1MPa,
p(H2)=0.4MPa,此时v正:v逆=____________。
(3)甲醇催化可制取丙烯,反应为:
3CH3OH(g)C3H6(g)+3H2O(g),反应的Arrhenius经验公式的实验数据如下图中曲线a所示,己知Arrhenius经验公式为R lnk=(Ea为活化能,k为速率常数,R和C为常数)
①该反应的活化能Ea=____________kJ·mol-1。
②当使用更高效催化剂时,在图中画出R lnk与关系的示意图。
(4)在饱和KHCO3电解液中,电解活化的CO2也可以制备CH3OH,其原理如下图所示,则
阴极的电极反应式为_______。
(二)选考题:共14分。请考生从2道题中任选一题作答。如果多做,则按所做的第一题计分。
20.[选修3:物质结构与性质】(14分)
(1)据世界权威刊物《自然》最近报道,我国科学家选择碲化锆(ZrTe2)和砷化镉(Cd3As2)
为材料验证了三维量子霍尔效应,并发现了金属-绝缘体的转换。回答下列问题:
①基态锌原子的电子排布式为________,原子中运动的电子有两种相反的自旋状态,若一种自旋状态用表示,与之相反的用表示,称为电子的自旋磁量子数。对于基态的锌原子,其价电子自旋磁量子数的代数和为________。
②Cd与Zn同族,价电子数相同,若配离子[Cd(CN)x](x-2)-的中心离子价电子数与配体提供的电子数之和为18,则x=________。
③碲和硫同主族,TeO32-的空间构型为________,写出一个与TeO32-互为等电子体的分子________。
(2)石墨烯是一种二维碳纳米材料,具有优异的光学、力学、电学特性,在材料学、微纳加工、能源、生物医学和药物传递方面具有重要应用前景。1 mol石墨烯含六元环的数目为________;石墨烯中部分碳原子被氧化后,其平面结构将发生改变,转化为氧化石墨烯(如
下图4),氧化石墨烯中键角α________(填“>”、“<”或“=”)键角β,原因是____________。
(3)立方氮化硼晶体的结构和硬度都与金刚石相似,晶胞结构如图5所示,B原子填在由N原子构成的________(填“四面体”、“八两体”或“立方体”)空隙中。若晶胞边长为a pm,B原子半径为b pm,N原子半径为c pm,则该晶胞的空间利用率为________(列出计算式),氮硼原子间的最短距离为________ pm。
21.[选修5:有机化学基础](14分)某药物中间体I的合成路线如图所示:
已知:
回答下列问题:
(1)A的结构简式为________;H的官能团名称为________。
(2)反应②中的化学方程式为________________________。
(3)反应⑤的化学反应类型为____________。
(4)同时满足下列条件的F的同分异构体的数目为________。
①分子结构中含六元碳环、甲基和酮羰基;②既能发生水解反应,又能发生银镜反应写出其中核磁共振氢谱有4组峰,峰面积比为4:4:3:1的结构简式____________。
(5)参照上述合成路线和信息,以和为原料(无机试剂任选),设计三步制备
的合成路线。
化学参考答案
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11-16小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
题号 1 2 3 4 5 6 7 8 9 10
答案 B A B C B B D A A D
题号 11 12 13 14 15 16
答案 D C B B C D
二、非选择题:共56分。第17~19题为必考题,考生都必须作答。第20~21题为选考题,考生根据要求作答。
17.(14分)
(1)先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度(2分) 橡胶(1分)
(2) Fe3++e-=Fe2+(2分) 左侧(1分)
(3)3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓(2分) 取少许试管中的混合液,加入盐酸酸化,再加入BaCl2溶液,有白色沉淀生成(2分)
(4) 1017(2分) 氧化还原(2分)
18.(14分)
(1)Re2O7+2NaOH2NaReO4+H2O(2分);CuO、Fe3O4(每个1分,共2分)
(2)3Zn+2ReO4-+4OH-=3ZnO22-+2ReO2·2H2O(2分)
(3)冷却结晶、过滤(2分)
(4)4NH4ReO4+3O22N2+8H2O+2Re2O7(2分)
(5)60 1.0(每个1分,共2分)
(6)0.24(2分)
19.(14分)
(1)-49.5kJ·mol-1(2分)
(2)①a>b>c(2分) ②0.5 (MPa)-2(2分)③0.64 (2分)
(3)①31(2分) ②(2分)
(4) 7CO2 +6e-+5H2O=CH3OH+6HCO3-(2分)
【选修3:物质结构与性质】(14分)
(1)①1s22s22p63s23p63d104s2或[Ar]3d104s2(1分);0(1分)
②4(2分)
③三角锥形(1分);PCl3、NF3、SOCl2等(1分)
(2) 0.5NA(1分);<(1分);
键角α对应的碳为sp3杂化,键角β对应的碳为sp2杂化(2分)
(3)四面体(1分);(2分);(1分)
21.[选修5:有机化学基础](14分)
(1)(2分);碳碳双键、酶基(2分)
(2)(2分)
(3)加成反应或还原反应(1分)
(4) 13 (2分);(2分)
(5)(每步1分,共3分,每步反应物、生成物、试剂和条件都正确才得分)
同课章节目录
