青海省西宁市海湖中学2021-2022学年高三下学期3月开学考试理科综合化学试题(Word版含答案)
文档属性
| 名称 | 青海省西宁市海湖中学2021-2022学年高三下学期3月开学考试理科综合化学试题(Word版含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 319.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-09 09:32:30 | ||
图片预览


文档简介
西宁市海湖中学2022 届高三 下学期开学 考试卷
理 科 综 合 化 学
考试时间: 150 分钟 分值 :300 分
第I 卷(选择题,共126 分)
一 、选择题:本题共 13 小题,每小题 6 分。共 78 分, 在每小题给出的四个选项中,只有一项是符合题目要求的。
7. 化学与生产、生活、科技等方面密切相关,下列有关说法错误的是
A.修建“火神山”医院所用的高密度聚乙烯膜是一种无毒无味的高分子材料
B.“墨子号”卫星成功发射实现了光纤量子通信,生产光纤的原料为晶体二氧化硅
C.棉、麻、丝、毛等天然纤维完全燃烧都只生成 CO2 和 H2O
D.核酸检测是确认病毒类型的有效手段,核酸是一类含磷的生物高分子化合物
8.下列叙述中正确的是
A.相同条件下,N2和 O3混合气与等体积的 N2 所含原子数相等
B.等物质的量的甲基(—CH3 )和羟基(—OH)所含电子数相等
C.常温常压下 28 g CO 与 22.4 L O2 所含分子数相等
D.16g CH4 与 18 g NH4+ 所含质子数相等
9.硫代硫酸钠溶液常用于氯气泄漏的喷洒剂,具有非常好的处理效果,其与氯气能发生反应:Na2S2O3 +4Cl2 +5H2O=2NaCl+6HCl+2H2SO4 。下列说法错误的是
A.Na2S2O3 在该反应中做还原剂
B.处理氯气时当 Na2S2O3 过量时,喷洒后的溶液中会出现浑浊的现象
C.1molNa2S2O3 与氯气完全反应转移电子 4mol
D.氧化产物与还原产物的物质的量之比为 1:4
10.亚硝酸钠(NaNO2)是一种常用的发色剂和防腐剂,某学习小组利用如图装置(夹持装置略去)制取亚硝酸钠,已知:2NO+Na2O2 =2NaNO2 ,2NO2 +Na2O2 =2NaNO3 ;
NO 能被酸性高锰酸钾氧化为 NO3- 。下列说法正确的是
A.可将 B 中的药品换为浓硫酸
B.实验开始前通一段时间 CO2,可制得比较纯净的NaNO2
C.开始滴加稀硝酸时,A 中会有少量红棕色气体
D.装置 D 中溶液完全褪色后再停止滴加稀硝酸
11. 下列化学方程式中,不能正确表达反应颜色变化的是
A.向 CuSO4 溶液中加入足量 Zn 粉,溶液蓝色消失 Zn+CuSO4 ==Cu+ZnSO4
B.澄清的石灰水久置后出现白色固体 Ca(OH)2 +CO2 ==CaCO3 ↓+H2O
C. Na2O2 在空气中放置后由淡黄色变为白色 2Na2O2 ==2Na2O+O2 ↑
D.向 Mg(OH)2悬浊液中滴加足量 FeCl3 溶液出现红褐色沉淀3Mg(OH)2 +2FeCl3=2Fe(OH)3 +3MgCl2
12. 分别进行如下表所示实验,现象和结论均正确的是
13. X、Y、Z、W、R 是原子序数依次增大的短周期主族元素,Y 的同位素常用于判定古文物的年代,R 与 Y 位于同一主族,W 的电子层数与主族序数相同,X、Y、Z 组成的化合物甲的球棍模型如图所示,甲在疫情期间可用做消毒剂。下列说法正确的是
A.X 与 Y 只能形成两种二元化合物
B.最高价氧化物对应水化物的酸性:R>Y
C.原子半径的大小关系:W>R>Z>Y>X
D.化合物甲中存在极性共价键、非极性共价键,具有强氧化性
第II 卷(非选择题,共174 分)
三、非选择题:包括必考题和选考题两部分。第 22~32 题为必考题,每个试题考生都做答;第 33题~39 题为选考题,考生根据要求作答.
(一)必考题(共 129 分)
26 .(16分) ) 工业废气、汽车尾气排放出的 SO2 、NOx 等,是形成雾霾的重要因素.霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)SO2 在烟尘的催化下形成硫酸的反应方程式是______________。
(2)NO x 和 SO2 在空气中存在下列平衡:
2NO(g)+O2 (g) 2NO2(g) △H=﹣113.0kJ mol﹣1
2SO2(g)+O2(g) 2SO3(g) △H=﹣196.6kJ mol﹣1
SO2 通常在二氧化氮的存在下,进一步被氧化,生成 SO3 .
①写出 NO2 和 SO2 反应的热化学方程式为__________________。
②随温度升高,该反应化学平衡常数变化趋势是________________。
(3)提高 2SO2 +O2 2SO3 反应中 SO2 的转化率,是减少 SO2 排放的有效措施.
①T 温度时,在 1L 的密闭容器中加入 2.0mol SO2 和 1.0mol O2 ,5min 后反应达到平衡,二氧化硫的转化率为 50%,该反应的平衡常数是__________________。
②在①中条件下,反应达到平衡后,改变下列条件,能使 SO2 的转化率提高的是______(填
字母)。
a.温度和容器体积不变,充入 1.0mol He b.温度和容器体积不变,充入 1.0mol O2
c.在其他条件不变时,减少容器的体积 d.在其他条件不变时,改用高效催化剂
e.在其他条件不变时,升高体系温度
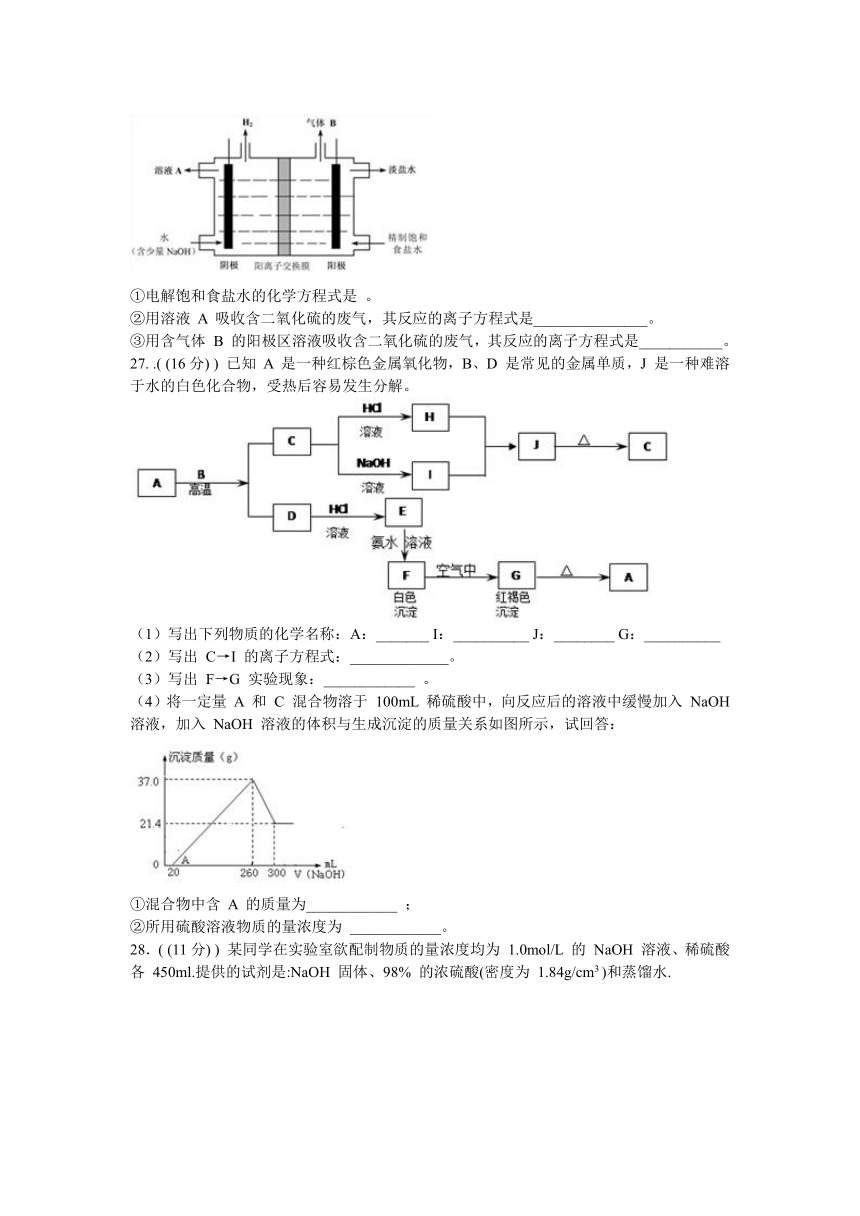
(4)工业上利用氯碱工业产品治理含二氧化硫的废气.如图是氯碱工业中电解饱和食盐水的原理示意图。
①电解饱和食盐水的化学方程式是 。
②用溶液 A 吸收含二氧化硫的废气,其反应的离子方程式是_______________。
③用含气体 B 的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是___________。
27. .( (16分) ) 已知 A 是一种红棕色金属氧化物,B、D 是常见的金属单质,J 是一种难溶于水的白色化合物,受热后容易发生分解。
(1)写出下列物质的化学名称:A:_______ I:__________ J:________ G:__________
(2)写出 C→I 的离子方程式:_____________。
(3)写出 F→G 实验现象:____________ 。
(4)将一定量 A 和 C 混合物溶于 100mL 稀硫酸中,向反应后的溶液中缓慢加入 NaOH 溶液,加入 NaOH 溶液的体积与生成沉淀的质量关系如图所示,试回答:
①混合物中含 A 的质量为____________ ;
②所用硫酸溶液物质的量浓度为 ____________。
28.( (11分) ) 某同学在实验室欲配制物质的量浓度均为 1.0mol/L 的 NaOH 溶液、稀硫酸各 450ml.提供的试剂是:NaOH 固体、98% 的浓硫酸(密度为 1.84g/cm3 )和蒸馏水.
(1)请你观察图示判断其中错误的操作有___________(填序号).
(2)应用托盘天平称量NaOH________ g,应用量筒量取浓硫酸__________mL.
(3)浓硫酸溶于水的正确操作方法是_____________。
(4)在配制 H2SO4 溶液实验中,下列操作引起结果偏高的有___________。
A.该学生在量取浓硫酸时,俯视刻度线
B.溶解硫酸后没有冷却至室温就立即完成后面的配制操作
C.在烧杯中溶解搅拌时,溅出少量溶液
D.没有用蒸馏水洗涤烧杯 2~3 次,并将洗液移入容量瓶中
E.将量筒洗涤 2~3 次,并全部转移至容量瓶中
F.容量瓶中原来存有少量蒸馏水
G.胶头滴管加水定容时俯视刻度
(二) 选考题: :共45 分。请考生从各学科的两题中选做 1题 。 如果多做, , 则按各学科所做的第一题计分。
35.[ 化学 —— 选修 3: 物质结构与性质 ]( 略) )
36.[ 化学 —— 选修 5: 有机化学基础5 ](15分) )
乙酸香兰酯是一种食用香精,常用于调配奶油、冰淇淋。如图是用一种苯的同系物 A 为原料合成乙酸香兰酯的流程。
回答下列问题:
(1)A 的分子式为 C7H8 ,其化学名称为_________,F 中的含氧官能团是_______。
(2)D 的结构简式为____________。
(3)写出由 G 合成乙酸香兰酯的化学方程式__________;该反应的类型是__________。
(4)H 是 G 的同分异构体,具备以下条件,则满足条件的 H 有 种;其中核磁共振氢谱有5 组峰,且峰面积之比为 2:2:2:1:1 的结构简式为 (不考虑立体异构)。
①含有苯环,且苯环上只有两个取代基;
②遇到 FeCl3 溶液会显紫色;
③能发生水解反应。
(5)请参照上述合成路线,以苯和 CH3COCl 为原料,设计制备的合成路线,其他所需试剂任选_________________。
化学答案
一、选择题:
题号 7 8 9 10 11 12 13
答案 C B C C C A D
三、非选择题:共58分。第26~28为必考题,每个试题考生都必须作答。第35~36为选考题,考生根据要求作答。
(一)必考题:共43分。
26、(每空2分,共16分) (1)SO2+H2O=H2SO3, 2H2SO3+O2═2H2SO4
(2)NO2(g)+SO2(g)=SO3(g)+NO(g)△H=﹣41.8 kJ mol﹣1; 减小
(3)2;b c
(4)2NaCl+2H2O 2NaOH+H2↑+Cl2↑;
SO2+OH﹣=HSO3﹣(或SO2+2OH﹣=SO32﹣+H2O); SO2+Cl2+H2O=4H++SO42﹣+2Cl﹣
27、(每空2分,共16分)
(1)三氧化二铁;偏铝酸钠;氢氧化铝;氢氧化铁
(2)Al2O3+2OH-=2AlO2-+H2O
(3)白色絮状沉淀迅速变成灰绿色,最后变成红褐色C
(4)16g; 6.5mol/L
(共11分)(1)①②⑤ (2分) (2)20.0;(2分) 27.2(2分)
(3)先在烧杯中倒入适量水,然后将浓硫酸沿烧杯内壁慢慢倒入,并用玻璃棒搅拌(2分)
(4)B;E;G(3分)
(二)选考题:共15分。请考生从2道化学题中任选一道作答。如果多做,则按所做的第一题计分。
36、(每小问3分,共15分)
(1)甲苯;酯基、醚键 (2)
(3)+CH3COCl+HC; 取代反应
(4)9; (5)
理 科 综 合 化 学
考试时间: 150 分钟 分值 :300 分
第I 卷(选择题,共126 分)
一 、选择题:本题共 13 小题,每小题 6 分。共 78 分, 在每小题给出的四个选项中,只有一项是符合题目要求的。
7. 化学与生产、生活、科技等方面密切相关,下列有关说法错误的是
A.修建“火神山”医院所用的高密度聚乙烯膜是一种无毒无味的高分子材料
B.“墨子号”卫星成功发射实现了光纤量子通信,生产光纤的原料为晶体二氧化硅
C.棉、麻、丝、毛等天然纤维完全燃烧都只生成 CO2 和 H2O
D.核酸检测是确认病毒类型的有效手段,核酸是一类含磷的生物高分子化合物
8.下列叙述中正确的是
A.相同条件下,N2和 O3混合气与等体积的 N2 所含原子数相等
B.等物质的量的甲基(—CH3 )和羟基(—OH)所含电子数相等
C.常温常压下 28 g CO 与 22.4 L O2 所含分子数相等
D.16g CH4 与 18 g NH4+ 所含质子数相等
9.硫代硫酸钠溶液常用于氯气泄漏的喷洒剂,具有非常好的处理效果,其与氯气能发生反应:Na2S2O3 +4Cl2 +5H2O=2NaCl+6HCl+2H2SO4 。下列说法错误的是
A.Na2S2O3 在该反应中做还原剂
B.处理氯气时当 Na2S2O3 过量时,喷洒后的溶液中会出现浑浊的现象
C.1molNa2S2O3 与氯气完全反应转移电子 4mol
D.氧化产物与还原产物的物质的量之比为 1:4
10.亚硝酸钠(NaNO2)是一种常用的发色剂和防腐剂,某学习小组利用如图装置(夹持装置略去)制取亚硝酸钠,已知:2NO+Na2O2 =2NaNO2 ,2NO2 +Na2O2 =2NaNO3 ;
NO 能被酸性高锰酸钾氧化为 NO3- 。下列说法正确的是
A.可将 B 中的药品换为浓硫酸
B.实验开始前通一段时间 CO2,可制得比较纯净的NaNO2
C.开始滴加稀硝酸时,A 中会有少量红棕色气体
D.装置 D 中溶液完全褪色后再停止滴加稀硝酸
11. 下列化学方程式中,不能正确表达反应颜色变化的是
A.向 CuSO4 溶液中加入足量 Zn 粉,溶液蓝色消失 Zn+CuSO4 ==Cu+ZnSO4
B.澄清的石灰水久置后出现白色固体 Ca(OH)2 +CO2 ==CaCO3 ↓+H2O
C. Na2O2 在空气中放置后由淡黄色变为白色 2Na2O2 ==2Na2O+O2 ↑
D.向 Mg(OH)2悬浊液中滴加足量 FeCl3 溶液出现红褐色沉淀3Mg(OH)2 +2FeCl3=2Fe(OH)3 +3MgCl2
12. 分别进行如下表所示实验,现象和结论均正确的是
13. X、Y、Z、W、R 是原子序数依次增大的短周期主族元素,Y 的同位素常用于判定古文物的年代,R 与 Y 位于同一主族,W 的电子层数与主族序数相同,X、Y、Z 组成的化合物甲的球棍模型如图所示,甲在疫情期间可用做消毒剂。下列说法正确的是
A.X 与 Y 只能形成两种二元化合物
B.最高价氧化物对应水化物的酸性:R>Y
C.原子半径的大小关系:W>R>Z>Y>X
D.化合物甲中存在极性共价键、非极性共价键,具有强氧化性
第II 卷(非选择题,共174 分)
三、非选择题:包括必考题和选考题两部分。第 22~32 题为必考题,每个试题考生都做答;第 33题~39 题为选考题,考生根据要求作答.
(一)必考题(共 129 分)
26 .(16分) ) 工业废气、汽车尾气排放出的 SO2 、NOx 等,是形成雾霾的重要因素.霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)SO2 在烟尘的催化下形成硫酸的反应方程式是______________。
(2)NO x 和 SO2 在空气中存在下列平衡:
2NO(g)+O2 (g) 2NO2(g) △H=﹣113.0kJ mol﹣1
2SO2(g)+O2(g) 2SO3(g) △H=﹣196.6kJ mol﹣1
SO2 通常在二氧化氮的存在下,进一步被氧化,生成 SO3 .
①写出 NO2 和 SO2 反应的热化学方程式为__________________。
②随温度升高,该反应化学平衡常数变化趋势是________________。
(3)提高 2SO2 +O2 2SO3 反应中 SO2 的转化率,是减少 SO2 排放的有效措施.
①T 温度时,在 1L 的密闭容器中加入 2.0mol SO2 和 1.0mol O2 ,5min 后反应达到平衡,二氧化硫的转化率为 50%,该反应的平衡常数是__________________。
②在①中条件下,反应达到平衡后,改变下列条件,能使 SO2 的转化率提高的是______(填
字母)。
a.温度和容器体积不变,充入 1.0mol He b.温度和容器体积不变,充入 1.0mol O2
c.在其他条件不变时,减少容器的体积 d.在其他条件不变时,改用高效催化剂
e.在其他条件不变时,升高体系温度
(4)工业上利用氯碱工业产品治理含二氧化硫的废气.如图是氯碱工业中电解饱和食盐水的原理示意图。
①电解饱和食盐水的化学方程式是 。
②用溶液 A 吸收含二氧化硫的废气,其反应的离子方程式是_______________。
③用含气体 B 的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是___________。
27. .( (16分) ) 已知 A 是一种红棕色金属氧化物,B、D 是常见的金属单质,J 是一种难溶于水的白色化合物,受热后容易发生分解。
(1)写出下列物质的化学名称:A:_______ I:__________ J:________ G:__________
(2)写出 C→I 的离子方程式:_____________。
(3)写出 F→G 实验现象:____________ 。
(4)将一定量 A 和 C 混合物溶于 100mL 稀硫酸中,向反应后的溶液中缓慢加入 NaOH 溶液,加入 NaOH 溶液的体积与生成沉淀的质量关系如图所示,试回答:
①混合物中含 A 的质量为____________ ;
②所用硫酸溶液物质的量浓度为 ____________。
28.( (11分) ) 某同学在实验室欲配制物质的量浓度均为 1.0mol/L 的 NaOH 溶液、稀硫酸各 450ml.提供的试剂是:NaOH 固体、98% 的浓硫酸(密度为 1.84g/cm3 )和蒸馏水.
(1)请你观察图示判断其中错误的操作有___________(填序号).
(2)应用托盘天平称量NaOH________ g,应用量筒量取浓硫酸__________mL.
(3)浓硫酸溶于水的正确操作方法是_____________。
(4)在配制 H2SO4 溶液实验中,下列操作引起结果偏高的有___________。
A.该学生在量取浓硫酸时,俯视刻度线
B.溶解硫酸后没有冷却至室温就立即完成后面的配制操作
C.在烧杯中溶解搅拌时,溅出少量溶液
D.没有用蒸馏水洗涤烧杯 2~3 次,并将洗液移入容量瓶中
E.将量筒洗涤 2~3 次,并全部转移至容量瓶中
F.容量瓶中原来存有少量蒸馏水
G.胶头滴管加水定容时俯视刻度
(二) 选考题: :共45 分。请考生从各学科的两题中选做 1题 。 如果多做, , 则按各学科所做的第一题计分。
35.[ 化学 —— 选修 3: 物质结构与性质 ]( 略) )
36.[ 化学 —— 选修 5: 有机化学基础5 ](15分) )
乙酸香兰酯是一种食用香精,常用于调配奶油、冰淇淋。如图是用一种苯的同系物 A 为原料合成乙酸香兰酯的流程。
回答下列问题:
(1)A 的分子式为 C7H8 ,其化学名称为_________,F 中的含氧官能团是_______。
(2)D 的结构简式为____________。
(3)写出由 G 合成乙酸香兰酯的化学方程式__________;该反应的类型是__________。
(4)H 是 G 的同分异构体,具备以下条件,则满足条件的 H 有 种;其中核磁共振氢谱有5 组峰,且峰面积之比为 2:2:2:1:1 的结构简式为 (不考虑立体异构)。
①含有苯环,且苯环上只有两个取代基;
②遇到 FeCl3 溶液会显紫色;
③能发生水解反应。
(5)请参照上述合成路线,以苯和 CH3COCl 为原料,设计制备的合成路线,其他所需试剂任选_________________。
化学答案
一、选择题:
题号 7 8 9 10 11 12 13
答案 C B C C C A D
三、非选择题:共58分。第26~28为必考题,每个试题考生都必须作答。第35~36为选考题,考生根据要求作答。
(一)必考题:共43分。
26、(每空2分,共16分) (1)SO2+H2O=H2SO3, 2H2SO3+O2═2H2SO4
(2)NO2(g)+SO2(g)=SO3(g)+NO(g)△H=﹣41.8 kJ mol﹣1; 减小
(3)2;b c
(4)2NaCl+2H2O 2NaOH+H2↑+Cl2↑;
SO2+OH﹣=HSO3﹣(或SO2+2OH﹣=SO32﹣+H2O); SO2+Cl2+H2O=4H++SO42﹣+2Cl﹣
27、(每空2分,共16分)
(1)三氧化二铁;偏铝酸钠;氢氧化铝;氢氧化铁
(2)Al2O3+2OH-=2AlO2-+H2O
(3)白色絮状沉淀迅速变成灰绿色,最后变成红褐色C
(4)16g; 6.5mol/L
(共11分)(1)①②⑤ (2分) (2)20.0;(2分) 27.2(2分)
(3)先在烧杯中倒入适量水,然后将浓硫酸沿烧杯内壁慢慢倒入,并用玻璃棒搅拌(2分)
(4)B;E;G(3分)
(二)选考题:共15分。请考生从2道化学题中任选一道作答。如果多做,则按所做的第一题计分。
36、(每小问3分,共15分)
(1)甲苯;酯基、醚键 (2)
(3)+CH3COCl+HC; 取代反应
(4)9; (5)
同课章节目录
