湖北省安陆市2021-2022学年高一下学期3月开学考试化学试题(Word版含答案)
文档属性
| 名称 | 湖北省安陆市2021-2022学年高一下学期3月开学考试化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 538.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-09 10:16:32 | ||
图片预览



文档简介
安陆市2021-2022学年高一下学期开学考试
化学试题
第I卷 (选择题 共45分)
可能用到的相对原子质量H:1 C:12 N:14 O:16 Ca:40 Ba:137 S:32 Na:23 Cl:35.5
一、选择题:(只有一个正确选项,每小题3分)
1.东汉晚期的青铜奔马(马踏飞燕)充分体现了我国光辉灿烂的古代科技,已成为我国的旅游标志,下列说法错误的是( )
A.青铜的机械性能优良,硬度和熔点均高于纯铜
B.铜器表面的铜绿是盐
C.青铜是我国使用最早的合金,含铜、锡、铅等元素
D.“曾青(CuSO4)得铁则化为铜”的过程发生了置换反应
2.化学科学需要借助化学专用语言描述,下列化学用语表达正确的是( )
A.CO2的电子式 B.Cl﹣的结构示意图为
C.氮气的结构式为N﹣N D.质量数为37的氯原子为Cl
3.下列叙述正确的是( )
①发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔;
②过氧化钠比氧化钠稳定,两种氧化物均可作潜艇中的供氧剂;
③碳酸钠在医疗上是治疗胃酸过多的一种药剂;
④氧化铁常用于制作红色油漆和涂料;
⑤铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物;
⑥焰色试验体现的是化合物的物理性质;
⑦雾霾天,汽车车灯照出通路的现象属于丁达尔效应。
A.①③⑤⑦ B.②③⑤⑥ C.①③④⑤ D.①④⑤⑦
4.下列物质能使紫色石蕊试液先变红后褪色的是( )
①Cl2 ②氯水 ③盐酸 ④盐酸酸化的漂白粉 ⑤Na2O2 ⑥木炭 ⑦SO2
A.①②④ B.①②⑤⑥ C.②③④⑦ D.①③④⑥
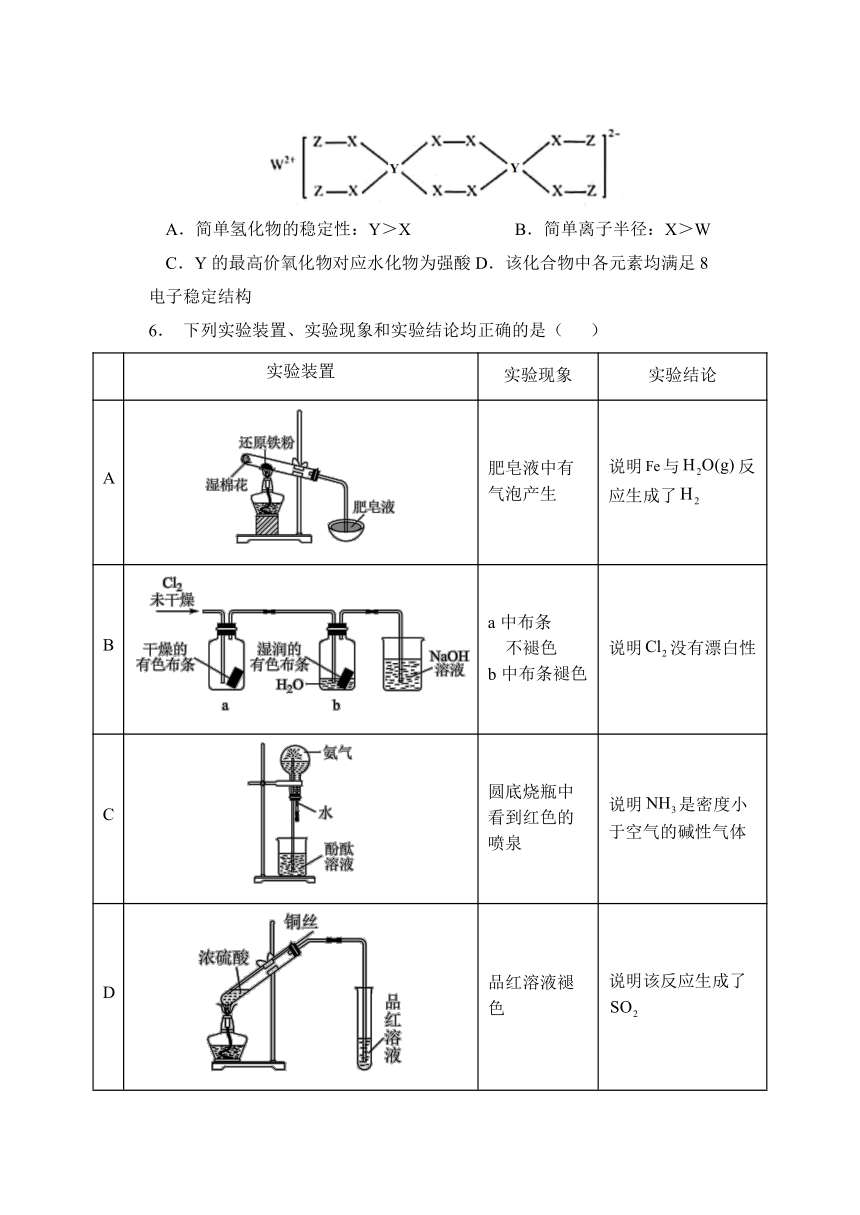
5. W、X、Y、Z为原子序数依次减小的短周期主族元素,已知W、Y、Z的最外层电子数之和等于X的最外层电子数;由四种元素形成某化合物的结构如图所示。下列叙述正确的是( )
A.简单氢化物的稳定性:Y>X B.简单离子半径:X>W
C.Y的最高价氧化物对应水化物为强酸D.该化合物中各元素均满足8电子稳定结构
6. 下列实验装置、实验现象和实验结论均正确的是( )
实验装置 实验现象 实验结论
A 肥皂液中有气泡产生 说明与反应生成了
B a中布条 不褪色 b中布条褪色 说明没有漂白性
C 圆底烧瓶中看到红色的喷泉 说明是密度小于空气的碱性气体
D 品红溶液褪色 说明该反应生成了
7.三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:NF3+H2O→NO+HNO3+HF(未配平),下列有关该反应的说法正确的是( )
A.NF3是氧化剂,HF是还原产物 B.还原剂与氧化剂的分子数目之比为1:2
C.若生成2mol HNO3,则转移电子数为2NA D.NO的摩尔质量是30
8.除去下列括号内的杂质,所加试剂和操作均正确的是( )
选项 需除杂的物质 试剂 操作
A NaCl(Na2CO3) 稀硫酸 蒸发结晶
B Fe2O3(Al2O3) 氨水 过滤
C SO2(SO3) 饱和NaHSO3溶液 或98.3%的浓硫酸 将气体通过洗气瓶
D HCl(SO2) 酸性KMnO4溶液 将气体通过洗气瓶
A.A B.B C.C D.D
9.配制一定物质的量浓度的溶液是一个重要的定量实验,下列有关说法正确的是( )
A. 定容时,为防止液滴飞溅,胶头滴管紧贴容量瓶内壁
B. 配制一定物质的量浓度的稀盐酸时,用量筒量取9.82 mL浓盐酸
C. 配制1 L 0.1 mol·L-1的NaCl溶液时,用托盘天平称量5.85 g NaCl固体
D. 容量瓶用蒸馏水洗净后,可不经干燥直接用于配制溶液
10.向新制的饱和氯水中加入下列物质,表中现象及解释均正确的是
选项 加入物质 现象 解释
A 有色布条 有色布条褪色 有漂白性
B 紫色石蕊试液 显红色 氯水中有盐酸、次氯酸
C CaCO3 有气体放出 盐酸、次氯酸酸性比碳酸强
D 酸化的AgNO3溶液 有白色沉淀生成 氯水中含有Cl-
11、锂离子电池的正极材料为LiMn2O4、碳粉及铝箔,某小组设计下列室温下的流程处理废旧锂离子电池的正极材料,下列离子反应方程式书写错误的是( )
A.加入过量NaOH溶液:2Al+2OH-+2H2O=2AlO2-+3H2↑
B.LiMn2O4被氧化:4Mn2O4- +O2+4H+=4MnO2+2H2O
C.滤液Ⅱ加入饱和碳酸钠溶液:CO32-+2Li+= Li2CO3↓
D.滤液I加入过量CO2:CO2+OH-=HCO3-、AlO2-+2H2O+ CO2=Al(OH)3↓+HCO3-
12. 某溶液中存在以下离子中的几种:Ag+、NH、Fe2+、Na+、K+、AlO、I-、SO、SO、NO,且存在的离子具有相同的物质的量浓度。向该溶液中加入过量的盐酸酸化的BaCl2溶液,产生了白色沉淀和气体。则下列说法正确的是
A.溶液中可能同时存在Ag+、NO B.溶液中可能同时存在SO、I-
C.沉淀和气体可能同时是BaSO4和SO2 D.溶液中可能同时存在Fe2+、I-
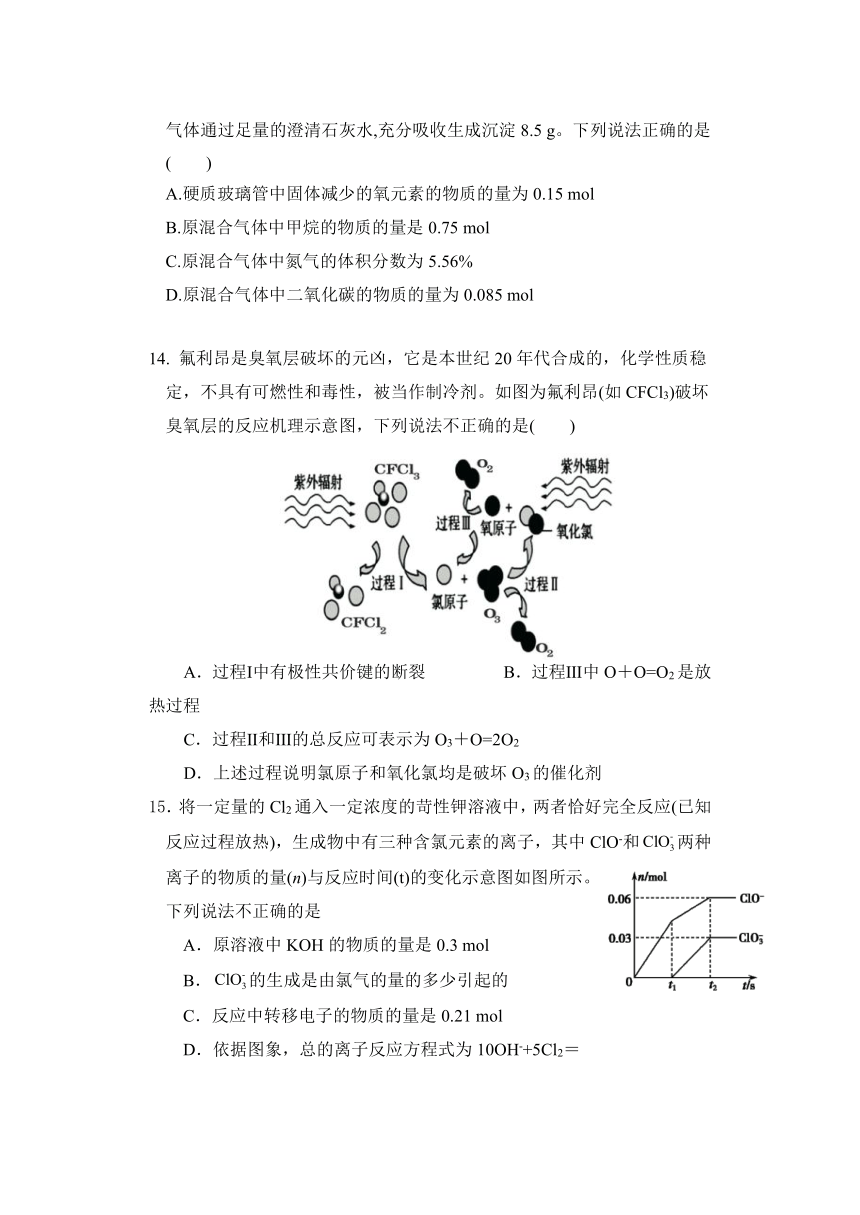
13. 生态农业涉及农家废料的综合利用,某种肥料经发酵得到一种含甲烷、二氧化碳、氮气的混合气体。2.016 L(标准状况)该气体通过盛有足量红热CuO粉末的硬质玻璃管,发 生的反应为:CH4+4CuOCO2+2H2O(g)+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8 g。将反应后产生的气体通过足量的澄清石灰水,充分吸收生成沉淀8.5 g。下列说法正确的是( )
A.硬质玻璃管中固体减少的氧元素的物质的量为0.15 mol
B.原混合气体中甲烷的物质的量是0.75 mol
C.原混合气体中氮气的体积分数为5.56%
D.原混合气体中二氧化碳的物质的量为0.085 mol
14. 氟利昂是臭氧层破坏的元凶,它是本世纪20年代合成的,化学性质稳定,不具有可燃性和毒性,被当作制冷剂。如图为氟利昂(如CFCl3)破坏臭氧层的反应机理示意图,下列说法不正确的是( )
A.过程Ⅰ中有极性共价键的断裂 B.过程Ⅲ中O+O=O2是放热过程
C.过程Ⅱ和Ⅲ的总反应可表示为O3+O=2O2
D.上述过程说明氯原子和氧化氯均是破坏O3的催化剂
15.将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是
A.原溶液中KOH的物质的量是0.3 mol
B.的生成是由氯气的量的多少引起的
C.反应中转移电子的物质的量是0.21 mol
D.依据图象,总的离子反应方程式为10OH-+5Cl2=2C1O-++7Cl-+5H2O
第II卷(非选择题共55分)
二、非选择题(本题包括4小题,共55分)
16. (15分)元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,并回答下列问题:
(1)元素⑩在常见周期表中的位置是____________________。元素⑥的最高价氧化物对应的水化物的电子式为______________________,用电子式表示元素②、⑧形成化合物的过程_________________________________
(2)元素③、④、⑤形成的简单氢化物,稳定性最强的是___________;(填结构式)
元素④、⑧、⑨的最高价氧化物对应的水化物,酸性最强的是__________(填化学式)
(3)元素⑥、⑦、⑧对应的简单离子的半径由大到小的顺序为_____ ______
(用离子符号表示)。
(4)元素①、⑤和元素①、⑧均能形成18电子的化合物,这两种化合物发生反应可生成一种黄色晶体,其化学方程式为__________________________。
(5)请设计简单实验,比较元素②、⑦的金属性强弱。
实验步骤 实验现象 实验结论
___________ __________ _ 金属性:②>⑦
17.A~J十种物质有下图所示关系,每个方框表示有一种反应物或生成物(反应条件及生成的H2O已略去),其中A为单质,C为一种正盐,D、F为气体,且D为最轻的气体,J为既不溶于水也不溶于酸的白色固体。试回答下列问题:
(1)写出化学式:B ,H
(2)写出将F通入溴水中反应的化学方程式 。
(3)写出离子反应方程式:反应④ ;
反应⑤ 。
18.某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验.请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是______ __,其中发生反应的化学方程式为:__________________________________________________________________;
(2)实验过程中,装置B、C中发生的现象分别是___________ ___、_______ _____ __,这些现象分别说明SO2具有还原性和氧化性;装置B、C中发生反应的离子方程式分别为_________________ __________ 、
.
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象____ ;
(4)尾气可采用________溶液吸收.
19.立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。回答下列问题:
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为__________(填标号)。
A.黄色 B.红色 C.紫色 D.黄绿色
(2)以重晶石(BaSO4)为原料,可按如下工艺生产立德粉:
①在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为
________________ ______。
回转炉尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,该反应的化学方程式为________ ______________。
②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是“还原料”表面生成了难溶于水的___________(填化学式)。
③沉淀器中反应的离子方程式为_________ _____________。
(3)成品中S2 的含量可以用“碘量法”测得。称取m g样品,置于碘量瓶中,移取
25.00 mL 0.1000 mol·L 1的I2 KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min,有单质硫析出。以淀粉为指示剂,过量的I2用0.1000 mol·L 1Na2S2O3溶液滴定, 反应式为I2+22I +。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为____________ _____,
样品中S2 的百分含量为_____ ______ (只需写出表达式)。
安陆市2021-2022学年高一下学期开学考试
化学参考答案
1-5. ABDAB 6-10. DBCDD 11-15. BDCDB
16.(除标注外,每空2分,共15分)
(1) 第四周期第IIA族(1分), (1分), (1分)
(2) H-O-H HClO4 (3)
(4) (5)将打磨干净的形状、体积均
相同的钠块和铝块投入等体积的冷水中 ; 钠与水反应更剧烈
17.(每空2分,共10分)
(1)H2SO4 FeCl3 (2)SO2+2H2O+Br2 =H2SO4+2HBr
(3)Ba2++SO42-=BaSO4↓ 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
18. (每空2分,共16分)
(1)蒸馏烧瓶 Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O
(2)B中溶液由紫红色变为无色, C中无色溶液中出现浅黄色浑浊
5SO2+2MnO+2H2O===2Mn2++5SO+4H+,2S2-+5SO2+2H2O=3S ↓+4HSO3-
(3)品红溶液褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,溶液恢复为红色
(4)NaOH
19. (每空2分,共14分)
(1)D
(2)① CO+H2OCO2+H2
②BaCO3 ③S2 +Ba2++Zn2++ SO42 BaSO4·ZnS↓
(3)浅蓝色至无色
化学试题
第I卷 (选择题 共45分)
可能用到的相对原子质量H:1 C:12 N:14 O:16 Ca:40 Ba:137 S:32 Na:23 Cl:35.5
一、选择题:(只有一个正确选项,每小题3分)
1.东汉晚期的青铜奔马(马踏飞燕)充分体现了我国光辉灿烂的古代科技,已成为我国的旅游标志,下列说法错误的是( )
A.青铜的机械性能优良,硬度和熔点均高于纯铜
B.铜器表面的铜绿是盐
C.青铜是我国使用最早的合金,含铜、锡、铅等元素
D.“曾青(CuSO4)得铁则化为铜”的过程发生了置换反应
2.化学科学需要借助化学专用语言描述,下列化学用语表达正确的是( )
A.CO2的电子式 B.Cl﹣的结构示意图为
C.氮气的结构式为N﹣N D.质量数为37的氯原子为Cl
3.下列叙述正确的是( )
①发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔;
②过氧化钠比氧化钠稳定,两种氧化物均可作潜艇中的供氧剂;
③碳酸钠在医疗上是治疗胃酸过多的一种药剂;
④氧化铁常用于制作红色油漆和涂料;
⑤铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物;
⑥焰色试验体现的是化合物的物理性质;
⑦雾霾天,汽车车灯照出通路的现象属于丁达尔效应。
A.①③⑤⑦ B.②③⑤⑥ C.①③④⑤ D.①④⑤⑦
4.下列物质能使紫色石蕊试液先变红后褪色的是( )
①Cl2 ②氯水 ③盐酸 ④盐酸酸化的漂白粉 ⑤Na2O2 ⑥木炭 ⑦SO2
A.①②④ B.①②⑤⑥ C.②③④⑦ D.①③④⑥
5. W、X、Y、Z为原子序数依次减小的短周期主族元素,已知W、Y、Z的最外层电子数之和等于X的最外层电子数;由四种元素形成某化合物的结构如图所示。下列叙述正确的是( )
A.简单氢化物的稳定性:Y>X B.简单离子半径:X>W
C.Y的最高价氧化物对应水化物为强酸D.该化合物中各元素均满足8电子稳定结构
6. 下列实验装置、实验现象和实验结论均正确的是( )
实验装置 实验现象 实验结论
A 肥皂液中有气泡产生 说明与反应生成了
B a中布条 不褪色 b中布条褪色 说明没有漂白性
C 圆底烧瓶中看到红色的喷泉 说明是密度小于空气的碱性气体
D 品红溶液褪色 说明该反应生成了
7.三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:NF3+H2O→NO+HNO3+HF(未配平),下列有关该反应的说法正确的是( )
A.NF3是氧化剂,HF是还原产物 B.还原剂与氧化剂的分子数目之比为1:2
C.若生成2mol HNO3,则转移电子数为2NA D.NO的摩尔质量是30
8.除去下列括号内的杂质,所加试剂和操作均正确的是( )
选项 需除杂的物质 试剂 操作
A NaCl(Na2CO3) 稀硫酸 蒸发结晶
B Fe2O3(Al2O3) 氨水 过滤
C SO2(SO3) 饱和NaHSO3溶液 或98.3%的浓硫酸 将气体通过洗气瓶
D HCl(SO2) 酸性KMnO4溶液 将气体通过洗气瓶
A.A B.B C.C D.D
9.配制一定物质的量浓度的溶液是一个重要的定量实验,下列有关说法正确的是( )
A. 定容时,为防止液滴飞溅,胶头滴管紧贴容量瓶内壁
B. 配制一定物质的量浓度的稀盐酸时,用量筒量取9.82 mL浓盐酸
C. 配制1 L 0.1 mol·L-1的NaCl溶液时,用托盘天平称量5.85 g NaCl固体
D. 容量瓶用蒸馏水洗净后,可不经干燥直接用于配制溶液
10.向新制的饱和氯水中加入下列物质,表中现象及解释均正确的是
选项 加入物质 现象 解释
A 有色布条 有色布条褪色 有漂白性
B 紫色石蕊试液 显红色 氯水中有盐酸、次氯酸
C CaCO3 有气体放出 盐酸、次氯酸酸性比碳酸强
D 酸化的AgNO3溶液 有白色沉淀生成 氯水中含有Cl-
11、锂离子电池的正极材料为LiMn2O4、碳粉及铝箔,某小组设计下列室温下的流程处理废旧锂离子电池的正极材料,下列离子反应方程式书写错误的是( )
A.加入过量NaOH溶液:2Al+2OH-+2H2O=2AlO2-+3H2↑
B.LiMn2O4被氧化:4Mn2O4- +O2+4H+=4MnO2+2H2O
C.滤液Ⅱ加入饱和碳酸钠溶液:CO32-+2Li+= Li2CO3↓
D.滤液I加入过量CO2:CO2+OH-=HCO3-、AlO2-+2H2O+ CO2=Al(OH)3↓+HCO3-
12. 某溶液中存在以下离子中的几种:Ag+、NH、Fe2+、Na+、K+、AlO、I-、SO、SO、NO,且存在的离子具有相同的物质的量浓度。向该溶液中加入过量的盐酸酸化的BaCl2溶液,产生了白色沉淀和气体。则下列说法正确的是
A.溶液中可能同时存在Ag+、NO B.溶液中可能同时存在SO、I-
C.沉淀和气体可能同时是BaSO4和SO2 D.溶液中可能同时存在Fe2+、I-
13. 生态农业涉及农家废料的综合利用,某种肥料经发酵得到一种含甲烷、二氧化碳、氮气的混合气体。2.016 L(标准状况)该气体通过盛有足量红热CuO粉末的硬质玻璃管,发 生的反应为:CH4+4CuOCO2+2H2O(g)+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8 g。将反应后产生的气体通过足量的澄清石灰水,充分吸收生成沉淀8.5 g。下列说法正确的是( )
A.硬质玻璃管中固体减少的氧元素的物质的量为0.15 mol
B.原混合气体中甲烷的物质的量是0.75 mol
C.原混合气体中氮气的体积分数为5.56%
D.原混合气体中二氧化碳的物质的量为0.085 mol
14. 氟利昂是臭氧层破坏的元凶,它是本世纪20年代合成的,化学性质稳定,不具有可燃性和毒性,被当作制冷剂。如图为氟利昂(如CFCl3)破坏臭氧层的反应机理示意图,下列说法不正确的是( )
A.过程Ⅰ中有极性共价键的断裂 B.过程Ⅲ中O+O=O2是放热过程
C.过程Ⅱ和Ⅲ的总反应可表示为O3+O=2O2
D.上述过程说明氯原子和氧化氯均是破坏O3的催化剂
15.将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是
A.原溶液中KOH的物质的量是0.3 mol
B.的生成是由氯气的量的多少引起的
C.反应中转移电子的物质的量是0.21 mol
D.依据图象,总的离子反应方程式为10OH-+5Cl2=2C1O-++7Cl-+5H2O
第II卷(非选择题共55分)
二、非选择题(本题包括4小题,共55分)
16. (15分)元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,并回答下列问题:
(1)元素⑩在常见周期表中的位置是____________________。元素⑥的最高价氧化物对应的水化物的电子式为______________________,用电子式表示元素②、⑧形成化合物的过程_________________________________
(2)元素③、④、⑤形成的简单氢化物,稳定性最强的是___________;(填结构式)
元素④、⑧、⑨的最高价氧化物对应的水化物,酸性最强的是__________(填化学式)
(3)元素⑥、⑦、⑧对应的简单离子的半径由大到小的顺序为_____ ______
(用离子符号表示)。
(4)元素①、⑤和元素①、⑧均能形成18电子的化合物,这两种化合物发生反应可生成一种黄色晶体,其化学方程式为__________________________。
(5)请设计简单实验,比较元素②、⑦的金属性强弱。
实验步骤 实验现象 实验结论
___________ __________ _ 金属性:②>⑦
17.A~J十种物质有下图所示关系,每个方框表示有一种反应物或生成物(反应条件及生成的H2O已略去),其中A为单质,C为一种正盐,D、F为气体,且D为最轻的气体,J为既不溶于水也不溶于酸的白色固体。试回答下列问题:
(1)写出化学式:B ,H
(2)写出将F通入溴水中反应的化学方程式 。
(3)写出离子反应方程式:反应④ ;
反应⑤ 。
18.某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验.请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是______ __,其中发生反应的化学方程式为:__________________________________________________________________;
(2)实验过程中,装置B、C中发生的现象分别是___________ ___、_______ _____ __,这些现象分别说明SO2具有还原性和氧化性;装置B、C中发生反应的离子方程式分别为_________________ __________ 、
.
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象____ ;
(4)尾气可采用________溶液吸收.
19.立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。回答下列问题:
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为__________(填标号)。
A.黄色 B.红色 C.紫色 D.黄绿色
(2)以重晶石(BaSO4)为原料,可按如下工艺生产立德粉:
①在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为
________________ ______。
回转炉尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,该反应的化学方程式为________ ______________。
②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是“还原料”表面生成了难溶于水的___________(填化学式)。
③沉淀器中反应的离子方程式为_________ _____________。
(3)成品中S2 的含量可以用“碘量法”测得。称取m g样品,置于碘量瓶中,移取
25.00 mL 0.1000 mol·L 1的I2 KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min,有单质硫析出。以淀粉为指示剂,过量的I2用0.1000 mol·L 1Na2S2O3溶液滴定, 反应式为I2+22I +。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为____________ _____,
样品中S2 的百分含量为_____ ______ (只需写出表达式)。
安陆市2021-2022学年高一下学期开学考试
化学参考答案
1-5. ABDAB 6-10. DBCDD 11-15. BDCDB
16.(除标注外,每空2分,共15分)
(1) 第四周期第IIA族(1分), (1分), (1分)
(2) H-O-H HClO4 (3)
(4) (5)将打磨干净的形状、体积均
相同的钠块和铝块投入等体积的冷水中 ; 钠与水反应更剧烈
17.(每空2分,共10分)
(1)H2SO4 FeCl3 (2)SO2+2H2O+Br2 =H2SO4+2HBr
(3)Ba2++SO42-=BaSO4↓ 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
18. (每空2分,共16分)
(1)蒸馏烧瓶 Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O
(2)B中溶液由紫红色变为无色, C中无色溶液中出现浅黄色浑浊
5SO2+2MnO+2H2O===2Mn2++5SO+4H+,2S2-+5SO2+2H2O=3S ↓+4HSO3-
(3)品红溶液褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,溶液恢复为红色
(4)NaOH
19. (每空2分,共14分)
(1)D
(2)① CO+H2OCO2+H2
②BaCO3 ③S2 +Ba2++Zn2++ SO42 BaSO4·ZnS↓
(3)浅蓝色至无色
同课章节目录
