第七单元常见的酸和碱测试题-2021-2022学年九年级化学鲁教版下册 (word版 含答案)
文档属性
| 名称 | 第七单元常见的酸和碱测试题-2021-2022学年九年级化学鲁教版下册 (word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 160.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-08 16:23:55 | ||
图片预览



文档简介
第七单元《常见的酸和碱》测试题
一、单选题
1.下列推理正确的是
A.向某无色溶液中滴加两滴酚酞试液无现象,则溶液一定呈中性
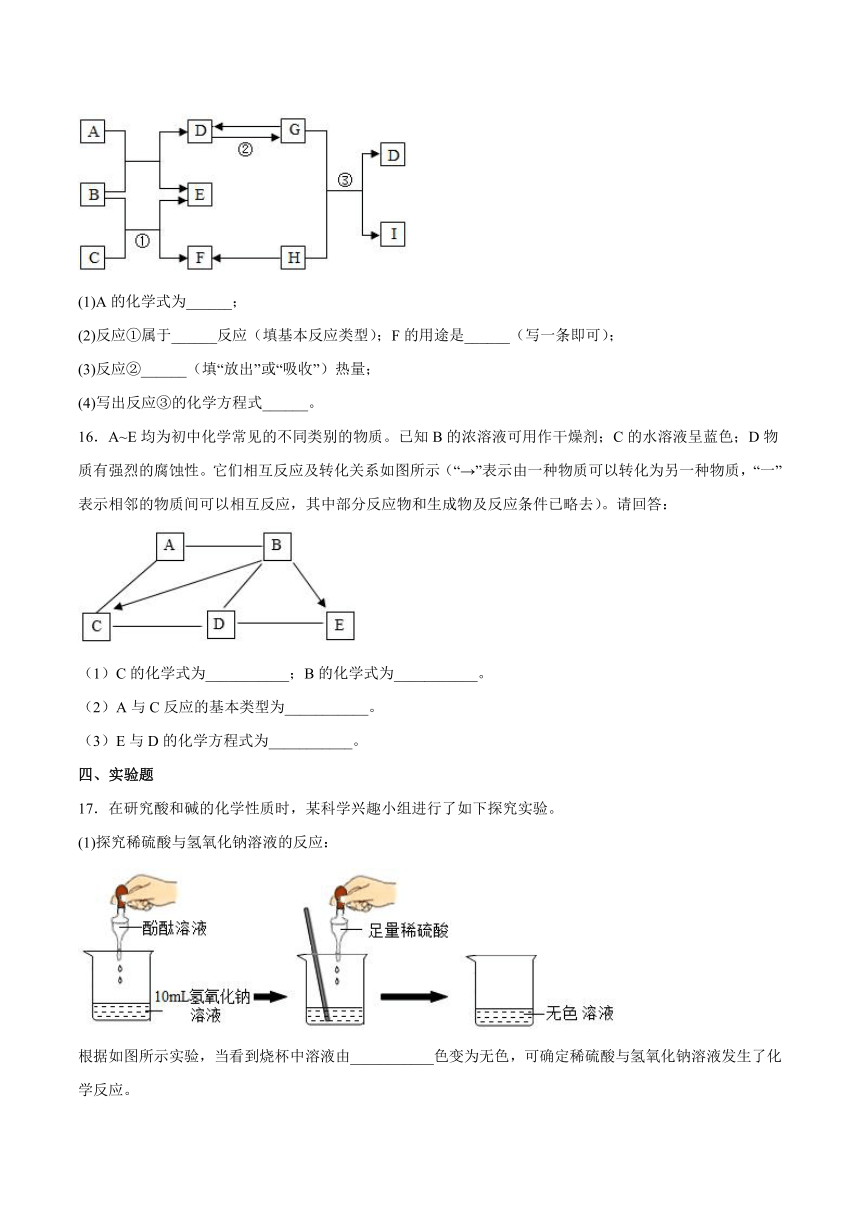
B.酸碱中和反应生成盐和水,则生成盐和水的反应一定是中和反应
C.在同一化合物中,金属元素显正价,则非金属元素一定显负价
D.含碳元素的物质充分燃烧会生成CO2,所以燃烧能生成CO2的物质一定含碳元素
2.下列有关实验现象的描述正确的是
A.镁条放入食醋时没有明显现象 B.铁丝生锈后产生一种红棕色固体
C.磷在氧气中燃烧产生大量烟雾 D.木炭在氧气中燃烧发出白光,生成二氧化碳
3.根据你的生活经验,判断下列做法中正确的是
A.过量的镁条在密闭容器中燃烧 B.夜晚发现煤气泄漏立即开灯检查
C.用活性炭把硬水软化 D.在家里可用食醋除去烧水壶中的水垢(含碳酸钙)
4.宏观辨识与微观探析是化学学科的核心素养之一。对下列事实的微观解释不正确的是
A.春天花香四溢——分子不断运动
B.氧气和液氧都能支持燃烧——同种分子的化学性质相同
C.夏天汽车轮胎爆炸——轮胎内气体分子变大
D.氢氧化钠溶液能导电——溶液中存在可自由移动的离子
5.下列有关现象描述中,正确的是( )
A.将二氧化碳通入无色酚酞试液后溶液变成红色
B.生锈的铁钉放在稀硫酸中,片刻后溶液变成浅绿色
C.固体硝酸铵溶于水时,溶液温度降低
D.铁丝在空气中燃烧,火星四射,有黑色固体生成
6.下列有关图标或实验操作正确的是
A.检验氧气 B.稀释浓硫酸
C.吸取液体 D.禁止带火种
7.小明发现红萝卜皮的酒精浸泡液能够起到酸碱指示剂的效果:当pH<7时显红色,pH在7-8时显紫红色,pH在8-10时显绿色,pH>10时显黄色。现将少量红萝卜皮的酒精浸泡液滴入柠檬汁中,颜色为
A.红色 B.紫红色 C.绿色 D.黄色
8.以下是根据一些事实推理出的结论,其中不正确的是
A.硫在纯氧中燃烧比在空气中更快、更剧烈,说明反应速率与反应物的浓度有关
B.复分解反应生成两种化合物,所以生成两种化合物的反应一定是复分解反应
C.碳完全燃烧生成二氧化碳,那么C60完全燃烧也一定生成二氧化碳
D.碱性溶液能使酚酞变红,因此能使酚酞变红的溶液显碱性
9.学习化学的过程中,常常对所学知识进行归纳总结,下列归纳总结完全正确的是
A.化学中的“三” B.化学与安全
①三种可燃性气体:H2、CO2、O2 ②构成物质的三种微粒:分子、原子、离子 ①夜晚厨房燃气泄漏——立即开灯检查 ②做铁丝在氧气中燃烧的实验时,瓶底预先加少量水——防止集气瓶炸裂
C.化学中的“不一定” D.化学与类比推理
①由同种元素组成的物质不一定是单质 ②能与稀盐酸反应放出气体的不一定是金属 ①CO2能与NaOH溶液发生反应,则CO也能 ②浓硫酸具有吸水性,则浓盐酸也具有吸水性
A.A B.B C.C D.D
10.下列有关化学史实的描述错误的是
A.拉瓦锡通过定性的方法测定了空气中氧气的含量
B.张青莲主持测定了几种元素的相对原子质量
C.道尔顿和阿伏加德罗提出的原子论和分子学说奠定近代化学基础
D.波义耳通过紫罗兰花的变色实验发现酸碱指示剂
11.正确的实验操作是科学探究成功的基础。下列操作中正确的是
A.氧气验满 B.过滤
C.闻气体气昧 D.稀释浓硫酸
二、简答题
12.化学与人类社会生活密不可分,请回答下列问题。
(1)我们倡导“低碳”生活,“低碳”是指哪种物质的较低量排放?
(2)用化学方程式表示用含Mg(OH)2的药物治疗胃酸(HCl)过多症的原理。
13.写出稀盐酸和澄清石灰水的鉴别方法,只要求写出方法,不要求写现象和结论,同类别的物质只能用一种方法。_________;___________;__________。
三、推断题
14.A-F是初中化学常见的物质,它们之间的转化关系如图所示。图中“一”表示两种物质间能发生化学反应,“→”表示两种物质间的转化关系。已知A在农业上用来改良酸性土壤,B、E是两种组成元素相同的液体,C、F是两种组成元素相同的气体(其中部分反应条件、反应物及生成物已略去)。请回答下列问题:
(1)写出E、D物质的化学式:E______,D______。
(2)写出A和C反应的化学方程式:______
(3)F的用途是______
15.A~I表示初中化学常见的物质。A、C、E的物质类别相同,其中A是相对分子质量最小的气体,E为紫红色金属,G可用来改良酸性土壤。它们之间有如下转换关系,反条件及部分反应物、生成物已略去,“→”表示物质转化。
(1)A的化学式为______;
(2)反应①属于______反应(填基本反应类型);F的用途是______(写一条即可);
(3)反应②______(填“放出”或“吸收”)热量;
(4)写出反应③的化学方程式______。
16.A~E均为初中化学常见的不同类别的物质。已知B的浓溶液可用作干燥剂;C的水溶液呈蓝色;D物质有强烈的腐蚀性。它们相互反应及转化关系如图所示(“→”表示由一种物质可以转化为另一种物质,“一”表示相邻的物质间可以相互反应,其中部分反应物和生成物及反应条件已略去)。请回答:
(1)C的化学式为___________;B的化学式为___________。
(2)A与C反应的基本类型为___________。
(3)E与D的化学方程式为___________。
四、实验题
17.在研究酸和碱的化学性质时,某科学兴趣小组进行了如下探究实验。
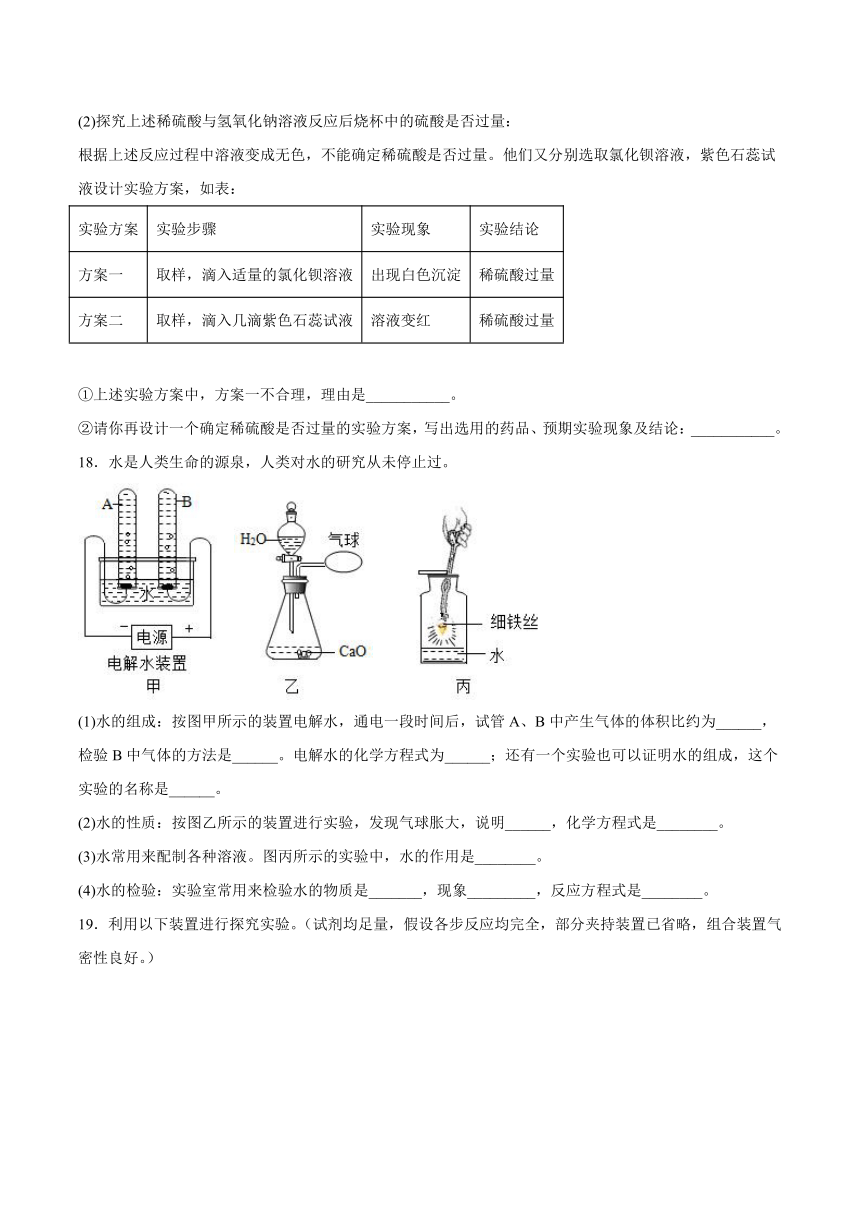
(1)探究稀硫酸与氢氧化钠溶液的反应:
根据如图所示实验,当看到烧杯中溶液由___________色变为无色,可确定稀硫酸与氢氧化钠溶液发生了化学反应。
(2)探究上述稀硫酸与氢氧化钠溶液反应后烧杯中的硫酸是否过量:
根据上述反应过程中溶液变成无色,不能确定稀硫酸是否过量。他们又分别选取氯化钡溶液,紫色石蕊试液设计实验方案,如表:
实验方案 实验步骤 实验现象 实验结论
方案一 取样,滴入适量的氯化钡溶液 出现白色沉淀 稀硫酸过量
方案二 取样,滴入几滴紫色石蕊试液 溶液变红 稀硫酸过量
①上述实验方案中,方案一不合理,理由是___________。
②请你再设计一个确定稀硫酸是否过量的实验方案,写出选用的药品、预期实验现象及结论:___________。
18.水是人类生命的源泉,人类对水的研究从未停止过。
(1)水的组成:按图甲所示的装置电解水,通电一段时间后,试管A、B中产生气体的体积比约为______,检验B中气体的方法是______。电解水的化学方程式为______;还有一个实验也可以证明水的组成,这个实验的名称是______。
(2)水的性质:按图乙所示的装置进行实验,发现气球胀大,说明______,化学方程式是________。
(3)水常用来配制各种溶液。图丙所示的实验中,水的作用是________。
(4)水的检验:实验室常用来检验水的物质是_______,现象_________,反应方程式是________。
19.利用以下装置进行探究实验。(试剂均足量,假设各步反应均完全,部分夹持装置已省略,组合装置气密性良好。)
X气体可能是CO、CO2、CH4中的一种或几种,为确定其成分,进行如下实验。
资料:CH4+4CuO4Cu+CO2+2H2O。
实验步骤:
I.B的玻璃管中盛放足量的CuO固体;
II.向A中广口瓶内滴入3.0g NaOH浓溶液,左侧导管液封,关闭活塞;
III.按A→D→B→E→C的顺序连接装置,打开K1、K2,通入X气体,排尽B中空气,加热CuO固体,充分反应;
IV.反应结束后,测得A中溶液的质量为3.1g,B中固体的质量减少了0.48g,E中固体的质量增加了0.18g。
(1)A中左侧导管液封的原因是________。
(2)A中溶液质量增加说明X气体中有_____,B中观察的现象是____,D的作用是____。
(3)能否省略C装置并说明理由:_______。
(4)判断X气体中含有一氧化碳的依据是_______。
a.B中固体质量的变化
b.B中的实验现象
c.C中的实验现象
d.E中固体质量的变化
(5)C增加的质量为______g。
(6)本实验设计需完善的是______。
五、计算题
20.实验室要测定一瓶标签破损的稀硫酸的溶质质量分数。取20g该稀硫酸样品于烧杯中,将5%的氢氧化钠溶液逐滴滴入到样品中,并不断搅拌,测得溶液的pH随滴入氢氧化钠溶液体积的变化关系如图所示。请分析并完成下列问题:
(1)a点时溶液显______性(填“酸”、“碱”或“中”);
(2)b点时加入氢氧化钠的质量是______g;
(3)计算该稀硫酸的溶质质量分数。
21.向10 g氯化镁溶液中不断滴入一定溶质质量分数的氢氧化钠溶液,反应的化学方程式是MgC12+2NaOH=Mg(OH)2↓+2NaC1,有关数据如下图所示:
(1)生成沉淀的质量为________g。
(2)计算氯化镁溶液中溶质的质量分数。(计算结果精确到0.1%)
参考答案:
1.D 2.B 3.D 4.C 5.C 6.D 7.A 8.B 9.C 10.A
11.D
12.(1)“低碳”是指二氧化碳的较低量排放。
(2)
13. 取两种溶液少量分别加入两支试管中,分别滴入几滴酚酞试液 取两种溶液少量分别加入两支试管中,分别通入二氧化碳 取两种溶液少量分别加入两支试管中,分别加入镁条
14.(1) H2O2 O2
(2)
(3)作燃料或冶炼金属
15.(1)H2
(2) 置换 灭火(答案合理均可)
(3)放出
(4)Ca(OH)2+2HCl=CaCl2+2H2O(答案合理均可)
16. CuSO4 H2SO4 置换反应
17.(1)红
(2) 硫酸钠也能和氯化钡反应生成白色沉淀硫酸钡 药品:锌粒;
实验步骤:把锌粒放入试管中,加入适量溶液;
实验现象:锌粒表面产生气泡;
实验结论:稀硫酸过量
18.(1) 2:1 伸入带火星木条,木条复燃说明是氧气 2H2O2H2↑+O2↑ 氢气在氧气中燃烧或者水的合成
(2) 氧化钙和水反应放热 CaO+H2O=Ca(OH)2
(3)防止集气瓶炸裂
(4) 无水硫酸铜 变蓝 CuSO4+5H2O=CuSO4 5H2O
19.(1)使X气体与NaOH溶液充分接触
(2) 二氧化碳 黑色粉末逐渐变红 干燥通过A装置后的气体,防止其影响E处水蒸气的检验与测量
(3)可以;通过E中固体质量增加可以判断X气体中含有CH4,通过B、E中固体质量的变化可以计算出X中是否含有CO
(4)ad
(5)0.66
(6)增加尾气处理装置
20.(1)酸
(2)1.6
(3)解:跟1.6g氢氧化钠反应所需H2SO4的质量为xH2SO4+2NaOH= Na2SO4+ 2H2O9880x1.6g
x=1.96g
答:该稀硫酸的溶质质量分数是9.8%。
21.(1)0.58或0.580
(2)解:氯化镁溶液中溶质的质量为x
=
x=0.95g
×100%=9.5%
答:氯化镁溶液中溶质的质量分数为9.5%。
一、单选题
1.下列推理正确的是
A.向某无色溶液中滴加两滴酚酞试液无现象,则溶液一定呈中性
B.酸碱中和反应生成盐和水,则生成盐和水的反应一定是中和反应
C.在同一化合物中,金属元素显正价,则非金属元素一定显负价
D.含碳元素的物质充分燃烧会生成CO2,所以燃烧能生成CO2的物质一定含碳元素
2.下列有关实验现象的描述正确的是
A.镁条放入食醋时没有明显现象 B.铁丝生锈后产生一种红棕色固体
C.磷在氧气中燃烧产生大量烟雾 D.木炭在氧气中燃烧发出白光,生成二氧化碳
3.根据你的生活经验,判断下列做法中正确的是
A.过量的镁条在密闭容器中燃烧 B.夜晚发现煤气泄漏立即开灯检查
C.用活性炭把硬水软化 D.在家里可用食醋除去烧水壶中的水垢(含碳酸钙)
4.宏观辨识与微观探析是化学学科的核心素养之一。对下列事实的微观解释不正确的是
A.春天花香四溢——分子不断运动
B.氧气和液氧都能支持燃烧——同种分子的化学性质相同
C.夏天汽车轮胎爆炸——轮胎内气体分子变大
D.氢氧化钠溶液能导电——溶液中存在可自由移动的离子
5.下列有关现象描述中,正确的是( )
A.将二氧化碳通入无色酚酞试液后溶液变成红色
B.生锈的铁钉放在稀硫酸中,片刻后溶液变成浅绿色
C.固体硝酸铵溶于水时,溶液温度降低
D.铁丝在空气中燃烧,火星四射,有黑色固体生成
6.下列有关图标或实验操作正确的是
A.检验氧气 B.稀释浓硫酸
C.吸取液体 D.禁止带火种
7.小明发现红萝卜皮的酒精浸泡液能够起到酸碱指示剂的效果:当pH<7时显红色,pH在7-8时显紫红色,pH在8-10时显绿色,pH>10时显黄色。现将少量红萝卜皮的酒精浸泡液滴入柠檬汁中,颜色为
A.红色 B.紫红色 C.绿色 D.黄色
8.以下是根据一些事实推理出的结论,其中不正确的是
A.硫在纯氧中燃烧比在空气中更快、更剧烈,说明反应速率与反应物的浓度有关
B.复分解反应生成两种化合物,所以生成两种化合物的反应一定是复分解反应
C.碳完全燃烧生成二氧化碳,那么C60完全燃烧也一定生成二氧化碳
D.碱性溶液能使酚酞变红,因此能使酚酞变红的溶液显碱性
9.学习化学的过程中,常常对所学知识进行归纳总结,下列归纳总结完全正确的是
A.化学中的“三” B.化学与安全
①三种可燃性气体:H2、CO2、O2 ②构成物质的三种微粒:分子、原子、离子 ①夜晚厨房燃气泄漏——立即开灯检查 ②做铁丝在氧气中燃烧的实验时,瓶底预先加少量水——防止集气瓶炸裂
C.化学中的“不一定” D.化学与类比推理
①由同种元素组成的物质不一定是单质 ②能与稀盐酸反应放出气体的不一定是金属 ①CO2能与NaOH溶液发生反应,则CO也能 ②浓硫酸具有吸水性,则浓盐酸也具有吸水性
A.A B.B C.C D.D
10.下列有关化学史实的描述错误的是
A.拉瓦锡通过定性的方法测定了空气中氧气的含量
B.张青莲主持测定了几种元素的相对原子质量
C.道尔顿和阿伏加德罗提出的原子论和分子学说奠定近代化学基础
D.波义耳通过紫罗兰花的变色实验发现酸碱指示剂
11.正确的实验操作是科学探究成功的基础。下列操作中正确的是
A.氧气验满 B.过滤
C.闻气体气昧 D.稀释浓硫酸
二、简答题
12.化学与人类社会生活密不可分,请回答下列问题。
(1)我们倡导“低碳”生活,“低碳”是指哪种物质的较低量排放?
(2)用化学方程式表示用含Mg(OH)2的药物治疗胃酸(HCl)过多症的原理。
13.写出稀盐酸和澄清石灰水的鉴别方法,只要求写出方法,不要求写现象和结论,同类别的物质只能用一种方法。_________;___________;__________。
三、推断题
14.A-F是初中化学常见的物质,它们之间的转化关系如图所示。图中“一”表示两种物质间能发生化学反应,“→”表示两种物质间的转化关系。已知A在农业上用来改良酸性土壤,B、E是两种组成元素相同的液体,C、F是两种组成元素相同的气体(其中部分反应条件、反应物及生成物已略去)。请回答下列问题:
(1)写出E、D物质的化学式:E______,D______。
(2)写出A和C反应的化学方程式:______
(3)F的用途是______
15.A~I表示初中化学常见的物质。A、C、E的物质类别相同,其中A是相对分子质量最小的气体,E为紫红色金属,G可用来改良酸性土壤。它们之间有如下转换关系,反条件及部分反应物、生成物已略去,“→”表示物质转化。
(1)A的化学式为______;
(2)反应①属于______反应(填基本反应类型);F的用途是______(写一条即可);
(3)反应②______(填“放出”或“吸收”)热量;
(4)写出反应③的化学方程式______。
16.A~E均为初中化学常见的不同类别的物质。已知B的浓溶液可用作干燥剂;C的水溶液呈蓝色;D物质有强烈的腐蚀性。它们相互反应及转化关系如图所示(“→”表示由一种物质可以转化为另一种物质,“一”表示相邻的物质间可以相互反应,其中部分反应物和生成物及反应条件已略去)。请回答:
(1)C的化学式为___________;B的化学式为___________。
(2)A与C反应的基本类型为___________。
(3)E与D的化学方程式为___________。
四、实验题
17.在研究酸和碱的化学性质时,某科学兴趣小组进行了如下探究实验。
(1)探究稀硫酸与氢氧化钠溶液的反应:
根据如图所示实验,当看到烧杯中溶液由___________色变为无色,可确定稀硫酸与氢氧化钠溶液发生了化学反应。
(2)探究上述稀硫酸与氢氧化钠溶液反应后烧杯中的硫酸是否过量:
根据上述反应过程中溶液变成无色,不能确定稀硫酸是否过量。他们又分别选取氯化钡溶液,紫色石蕊试液设计实验方案,如表:
实验方案 实验步骤 实验现象 实验结论
方案一 取样,滴入适量的氯化钡溶液 出现白色沉淀 稀硫酸过量
方案二 取样,滴入几滴紫色石蕊试液 溶液变红 稀硫酸过量
①上述实验方案中,方案一不合理,理由是___________。
②请你再设计一个确定稀硫酸是否过量的实验方案,写出选用的药品、预期实验现象及结论:___________。
18.水是人类生命的源泉,人类对水的研究从未停止过。
(1)水的组成:按图甲所示的装置电解水,通电一段时间后,试管A、B中产生气体的体积比约为______,检验B中气体的方法是______。电解水的化学方程式为______;还有一个实验也可以证明水的组成,这个实验的名称是______。
(2)水的性质:按图乙所示的装置进行实验,发现气球胀大,说明______,化学方程式是________。
(3)水常用来配制各种溶液。图丙所示的实验中,水的作用是________。
(4)水的检验:实验室常用来检验水的物质是_______,现象_________,反应方程式是________。
19.利用以下装置进行探究实验。(试剂均足量,假设各步反应均完全,部分夹持装置已省略,组合装置气密性良好。)
X气体可能是CO、CO2、CH4中的一种或几种,为确定其成分,进行如下实验。
资料:CH4+4CuO4Cu+CO2+2H2O。
实验步骤:
I.B的玻璃管中盛放足量的CuO固体;
II.向A中广口瓶内滴入3.0g NaOH浓溶液,左侧导管液封,关闭活塞;
III.按A→D→B→E→C的顺序连接装置,打开K1、K2,通入X气体,排尽B中空气,加热CuO固体,充分反应;
IV.反应结束后,测得A中溶液的质量为3.1g,B中固体的质量减少了0.48g,E中固体的质量增加了0.18g。
(1)A中左侧导管液封的原因是________。
(2)A中溶液质量增加说明X气体中有_____,B中观察的现象是____,D的作用是____。
(3)能否省略C装置并说明理由:_______。
(4)判断X气体中含有一氧化碳的依据是_______。
a.B中固体质量的变化
b.B中的实验现象
c.C中的实验现象
d.E中固体质量的变化
(5)C增加的质量为______g。
(6)本实验设计需完善的是______。
五、计算题
20.实验室要测定一瓶标签破损的稀硫酸的溶质质量分数。取20g该稀硫酸样品于烧杯中,将5%的氢氧化钠溶液逐滴滴入到样品中,并不断搅拌,测得溶液的pH随滴入氢氧化钠溶液体积的变化关系如图所示。请分析并完成下列问题:
(1)a点时溶液显______性(填“酸”、“碱”或“中”);
(2)b点时加入氢氧化钠的质量是______g;
(3)计算该稀硫酸的溶质质量分数。
21.向10 g氯化镁溶液中不断滴入一定溶质质量分数的氢氧化钠溶液,反应的化学方程式是MgC12+2NaOH=Mg(OH)2↓+2NaC1,有关数据如下图所示:
(1)生成沉淀的质量为________g。
(2)计算氯化镁溶液中溶质的质量分数。(计算结果精确到0.1%)
参考答案:
1.D 2.B 3.D 4.C 5.C 6.D 7.A 8.B 9.C 10.A
11.D
12.(1)“低碳”是指二氧化碳的较低量排放。
(2)
13. 取两种溶液少量分别加入两支试管中,分别滴入几滴酚酞试液 取两种溶液少量分别加入两支试管中,分别通入二氧化碳 取两种溶液少量分别加入两支试管中,分别加入镁条
14.(1) H2O2 O2
(2)
(3)作燃料或冶炼金属
15.(1)H2
(2) 置换 灭火(答案合理均可)
(3)放出
(4)Ca(OH)2+2HCl=CaCl2+2H2O(答案合理均可)
16. CuSO4 H2SO4 置换反应
17.(1)红
(2) 硫酸钠也能和氯化钡反应生成白色沉淀硫酸钡 药品:锌粒;
实验步骤:把锌粒放入试管中,加入适量溶液;
实验现象:锌粒表面产生气泡;
实验结论:稀硫酸过量
18.(1) 2:1 伸入带火星木条,木条复燃说明是氧气 2H2O2H2↑+O2↑ 氢气在氧气中燃烧或者水的合成
(2) 氧化钙和水反应放热 CaO+H2O=Ca(OH)2
(3)防止集气瓶炸裂
(4) 无水硫酸铜 变蓝 CuSO4+5H2O=CuSO4 5H2O
19.(1)使X气体与NaOH溶液充分接触
(2) 二氧化碳 黑色粉末逐渐变红 干燥通过A装置后的气体,防止其影响E处水蒸气的检验与测量
(3)可以;通过E中固体质量增加可以判断X气体中含有CH4,通过B、E中固体质量的变化可以计算出X中是否含有CO
(4)ad
(5)0.66
(6)增加尾气处理装置
20.(1)酸
(2)1.6
(3)解:跟1.6g氢氧化钠反应所需H2SO4的质量为xH2SO4+2NaOH= Na2SO4+ 2H2O9880x1.6g
x=1.96g
答:该稀硫酸的溶质质量分数是9.8%。
21.(1)0.58或0.580
(2)解:氯化镁溶液中溶质的质量为x
=
x=0.95g
×100%=9.5%
答:氯化镁溶液中溶质的质量分数为9.5%。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
