人教版(2019)化学必修第二册 5.1.1硫和二氧化硫 课件
文档属性
| 名称 | 人教版(2019)化学必修第二册 5.1.1硫和二氧化硫 课件 |

|
|
| 格式 | ppt | ||
| 文件大小 | 475.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-09 14:30:19 | ||
图片预览






文档简介
(共29张PPT)
第1讲 硫和二氧化硫
课标要求
1、了解二氧化硫与氧气、与水的反应,认识亚硫酸的不稳定性。认识二氧化硫的漂白作用与次氯酸漂白作用的区别。
2、了解硫的性质及用途。
高考在本部分考查的知识点较多,归纳起来主要集中在: ①SO2、SO32-的氧化性和还原性,特别是SO2的性质。 ②硫及其化合物的相互转化关系;
高考考点分析:
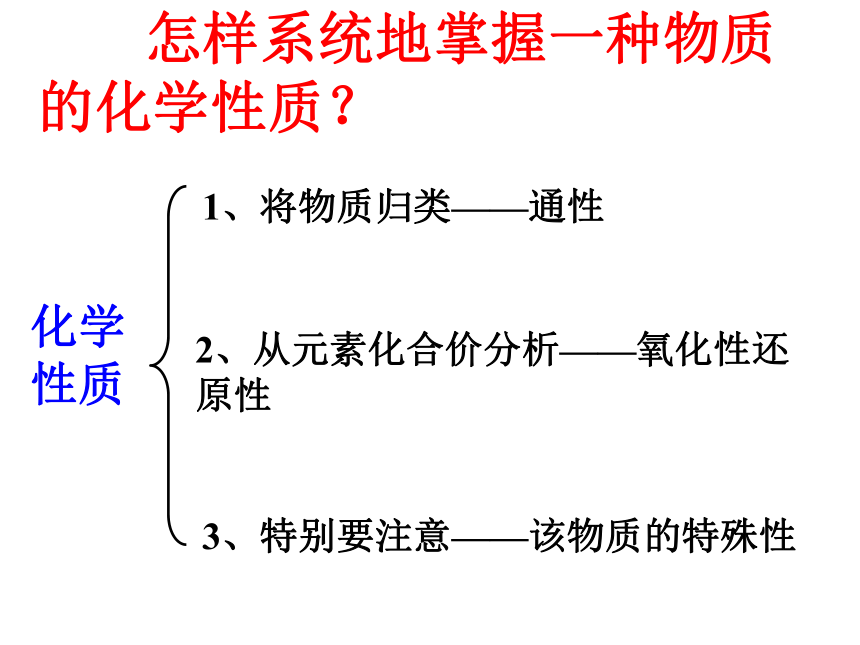
怎样系统地掌握一种物质的化学性质?
化学性质
1、将物质归类——通性
2、从元素化合价分析——氧化性还原性
3、特别要注意——该物质的特殊性
一、硫
1、硫物理性质:
俗称 ,是一种 色粉末,
易溶于 : 微溶于: 不溶于:
硫黄
淡黄
CS2
洒精
水
2、硫化学性质:
(既有氧化性又有还原性)
(1)与金属反应:(生成低价离子)
(2)与氧化剂的反应:
课前检测
写出下列反应的化学方程式
(1)S+Fe=
(2)S+Cu =
(3)S+O2 =
____色, __________气味的_____毒气体,密度比空气____,沸点是-10 oC易______, ____ 溶于水(常温常压下一体积水能溶解_____体积的二氧化硫)。
无
有刺激性
有
大
液化
易
40
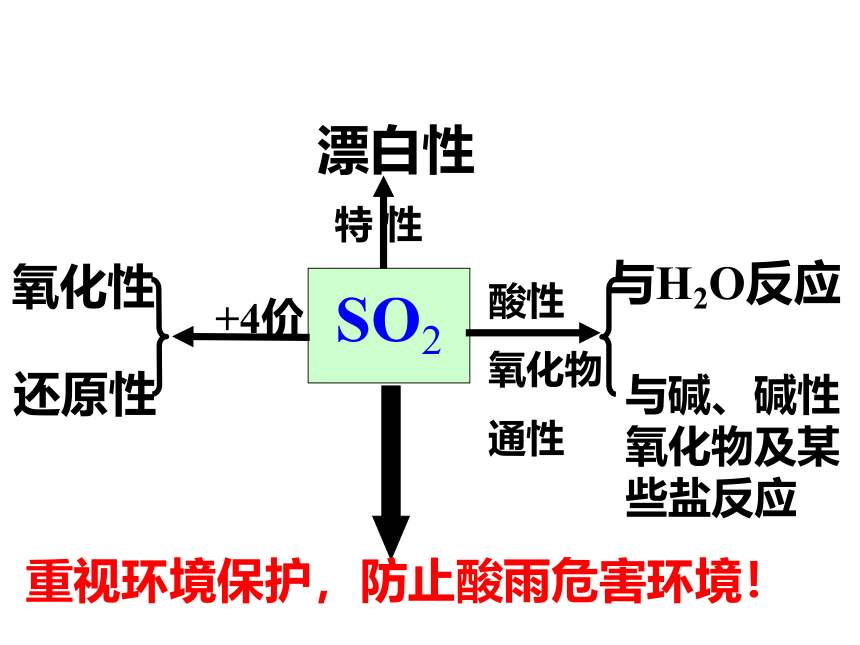
二、二氧化硫
1、物理性质
SO2
与H2O反应
与碱、碱性氧化物及某些盐反应
氧化性
还原性
酸性
氧化物
通性
+4价
漂白性
特 性
重视环境保护,防止酸雨危害环境!
(1)、具有酸性氧化物通性:
(与CO2相似)
2、 SO2化学性质:
b 与碱反应
C 与碱性氧化物反应
d与某些盐反应
a 与水反应 (能使石蕊试液变红)
请写出SO2和H2O、Ca(OH)2、Na2CO3、NaHCO3反应化学方程式。
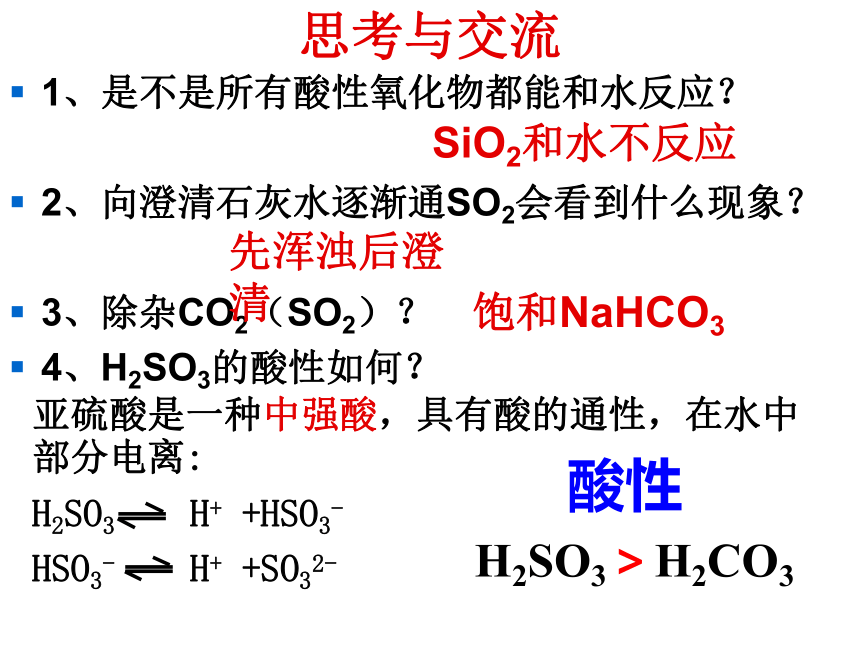
思考与交流
1、是不是所有酸性氧化物都能和水反应?
2、向澄清石灰水逐渐通SO2会看到什么现象?
3、除杂CO2(SO2)?
4、H2SO3的酸性如何?
SiO2和水不反应
先浑浊后澄清
饱和NaHCO3
亚硫酸是一种中强酸,具有酸的通性,在水中部分电离:
H2SO3 H+ +HSO3-
HSO3- H+ +SO32-
酸性
H2SO3>H2CO3
(2)、还原性:
设计实验验证SO2的还原性 ?
与KMnO4(H+)、卤素单质水溶液等氧化剂的反应
较强
还原性:SO2〉I -〉Fe2+〉Br-〉Cl-
请写出SO2和FeCl3溶液、氯水、O2反应方程式。
思考:
1、 SO2气体通入BaCl2溶液是否有白色沉淀?为什么?
2、若分别再滴入氯水或稀氨水,是否有沉淀?为什么?
无明显现象
SO3是一种无色固体,熔点(16.8℃),沸点(44.8 ℃ ),关注SO3的状态。SO3与H2O反应生成H2SO4,同时放出大量的热。工业上常用这两个反应制造硫酸。
2SO2+O2 2SO3
催化剂
△
关注SO3的状态
SO2和O2需在一定温度和催化剂存在条件下才能反应;
但由SO2转化成的H2SO3或亚硫酸盐在常温下就能被氧化,
所以亚硫酸盐应密闭保存,以防变质。
2H2SO3+O2=2H2SO4
2Na2SO3+O2=2Na2SO4
(3)、氧化性:
SO2
+4
+6
0
2H2S+SO2 3S +2H2O
-2 +4 0
较弱
(4)、漂白性:
思考1:
SO2和氯水的漂白有何不同
品红
SO2
褪色
加热
变红
可以用品红来检验SO2的存在
氯水
二氧化硫
原理
氯水中HClO将有色物质氧化成无色物质
SO2溶于水产生的
H2SO3与有色物质直接结合生成不稳定的无色物质
实质
氧化还原反应
非氧化还原反应
效果
永久性
暂时性
范围
可漂白大多数有色
物质,能使紫色石
蕊试液褪色
漂白某些有色物质,
不能使紫色石蕊试
液褪色
思考2: SO2能使溴水、KMnO4溶液褪色与SO2使品红褪色,实质相同吗
前者缘于SO2的还原性,发生的是氧化还原反应;
后者缘于其漂白性,发生的是非氧化还原反应。
不同!
思考3、若将等物质的量的SO2和Cl2这两种气体混合后,同时作用于潮湿的红色布条,可观察到红布条( )
A、慢慢褪色 B、立即褪色
C、先褪色后恢复原来颜色
D、不褪色
SO2+Cl2+2H2O = 2HCl+H2SO4
D
思考4、CO2和SO2在化学性质上既有相似性又有差异性,如何区分这两种气体呢 能用澄清石灰水鉴别吗
(1)品红溶液
(2)KMnO4溶液或Br2水
SO2均褪色
相似性:均为酸性氧化物
差异性:SO2具有还原性、漂白性
区分:
思考5、已知炭与浓硫酸在加热条件下的反应:C+ 2H2SO4 = CO2↑+ 2SO2↑+ 2H2O
请设计实验来验证反应中的三种产物。
仪器连接如下
酸雨:指pH<5.6的酸性降水
酸雨的危害:
1、影响水生生物的繁殖
2、土壤中钙、镁、磷等营养元素溶出并迅速流失,导致土壤肥力下降并酸化
3、农作物和树木生长遭到破坏
4、建筑物腐蚀加快
3、 SO2对环境的影响:
硫酸型酸雨的形成过程
二氧化硫的作用
形成过程① SO2+H2O H2SO3
2H2SO3+O2 = 2H2SO4
② 2SO2+O2 2SO3
SO3+H2O = H2SO4
酸雨的防治
1、含硫燃料预先脱硫处理
2、释放出的二氧化硫进行处理或利用回收
3、研究新能源
4、大力提倡植树造林,尤其栽种吸收SO2较多的柳杉、银槐、银杏等。
5、提高全民的环境保护意识。从1974年起,每年由联合国环境规划署确定一个主题,开展“世界环境日”的活动,其中1983年的主题是防治酸雨。
4、二氧化硫的用途:
制硫酸
漂白纸浆、毛、丝、草帽等
杀菌消毒
一分为二看问题!
过关训练
1、关于SO2的叙述中正确的是 ( )
A.可采用排水集气法收集SO2
B.它与水作用生成H2SO4
C.它能使溴水褪色,体现SO2 具有漂白性
D.实验室可用氢氧化钠溶液处理含有二氧化硫的尾气
D
过关训练
2. 下列变化中不属于化学变化的是( )
A. 二氧化硫使品红褪色
B. 氯水使有色布条褪色
C.活性炭使红墨水褪色
D.漂白粉使某些染料褪色
C
3.将SO2通入显红色的酚酞试剂中,发现红色消失,主要是因为SO2( )
A.有漂白性 B.有还原性
C.溶于水后显酸性 D.有氧化性
C
4.把少量的SO2分别通入下列浓度相等的①Ba(NO3)2溶液② Ba(OH)2溶液③溶有氨的BaCl2溶液中.预计能观察到白色沉淀的溶液是( )
A. ①和② B.只有②
C. ②和③ D.全部
D
5、与图中曲线相符合的是( )
A.向饱和H2SO3中通入H2S
B.向澄清石灰水中通入CO2
C.向氯水中通入SO2
D.向饱和H2S溶液中通入SO2气体
pH
V(气)
D
第1讲 硫和二氧化硫
课标要求
1、了解二氧化硫与氧气、与水的反应,认识亚硫酸的不稳定性。认识二氧化硫的漂白作用与次氯酸漂白作用的区别。
2、了解硫的性质及用途。
高考在本部分考查的知识点较多,归纳起来主要集中在: ①SO2、SO32-的氧化性和还原性,特别是SO2的性质。 ②硫及其化合物的相互转化关系;
高考考点分析:
怎样系统地掌握一种物质的化学性质?
化学性质
1、将物质归类——通性
2、从元素化合价分析——氧化性还原性
3、特别要注意——该物质的特殊性
一、硫
1、硫物理性质:
俗称 ,是一种 色粉末,
易溶于 : 微溶于: 不溶于:
硫黄
淡黄
CS2
洒精
水
2、硫化学性质:
(既有氧化性又有还原性)
(1)与金属反应:(生成低价离子)
(2)与氧化剂的反应:
课前检测
写出下列反应的化学方程式
(1)S+Fe=
(2)S+Cu =
(3)S+O2 =
____色, __________气味的_____毒气体,密度比空气____,沸点是-10 oC易______, ____ 溶于水(常温常压下一体积水能溶解_____体积的二氧化硫)。
无
有刺激性
有
大
液化
易
40
二、二氧化硫
1、物理性质
SO2
与H2O反应
与碱、碱性氧化物及某些盐反应
氧化性
还原性
酸性
氧化物
通性
+4价
漂白性
特 性
重视环境保护,防止酸雨危害环境!
(1)、具有酸性氧化物通性:
(与CO2相似)
2、 SO2化学性质:
b 与碱反应
C 与碱性氧化物反应
d与某些盐反应
a 与水反应 (能使石蕊试液变红)
请写出SO2和H2O、Ca(OH)2、Na2CO3、NaHCO3反应化学方程式。
思考与交流
1、是不是所有酸性氧化物都能和水反应?
2、向澄清石灰水逐渐通SO2会看到什么现象?
3、除杂CO2(SO2)?
4、H2SO3的酸性如何?
SiO2和水不反应
先浑浊后澄清
饱和NaHCO3
亚硫酸是一种中强酸,具有酸的通性,在水中部分电离:
H2SO3 H+ +HSO3-
HSO3- H+ +SO32-
酸性
H2SO3>H2CO3
(2)、还原性:
设计实验验证SO2的还原性 ?
与KMnO4(H+)、卤素单质水溶液等氧化剂的反应
较强
还原性:SO2〉I -〉Fe2+〉Br-〉Cl-
请写出SO2和FeCl3溶液、氯水、O2反应方程式。
思考:
1、 SO2气体通入BaCl2溶液是否有白色沉淀?为什么?
2、若分别再滴入氯水或稀氨水,是否有沉淀?为什么?
无明显现象
SO3是一种无色固体,熔点(16.8℃),沸点(44.8 ℃ ),关注SO3的状态。SO3与H2O反应生成H2SO4,同时放出大量的热。工业上常用这两个反应制造硫酸。
2SO2+O2 2SO3
催化剂
△
关注SO3的状态
SO2和O2需在一定温度和催化剂存在条件下才能反应;
但由SO2转化成的H2SO3或亚硫酸盐在常温下就能被氧化,
所以亚硫酸盐应密闭保存,以防变质。
2H2SO3+O2=2H2SO4
2Na2SO3+O2=2Na2SO4
(3)、氧化性:
SO2
+4
+6
0
2H2S+SO2 3S +2H2O
-2 +4 0
较弱
(4)、漂白性:
思考1:
SO2和氯水的漂白有何不同
品红
SO2
褪色
加热
变红
可以用品红来检验SO2的存在
氯水
二氧化硫
原理
氯水中HClO将有色物质氧化成无色物质
SO2溶于水产生的
H2SO3与有色物质直接结合生成不稳定的无色物质
实质
氧化还原反应
非氧化还原反应
效果
永久性
暂时性
范围
可漂白大多数有色
物质,能使紫色石
蕊试液褪色
漂白某些有色物质,
不能使紫色石蕊试
液褪色
思考2: SO2能使溴水、KMnO4溶液褪色与SO2使品红褪色,实质相同吗
前者缘于SO2的还原性,发生的是氧化还原反应;
后者缘于其漂白性,发生的是非氧化还原反应。
不同!
思考3、若将等物质的量的SO2和Cl2这两种气体混合后,同时作用于潮湿的红色布条,可观察到红布条( )
A、慢慢褪色 B、立即褪色
C、先褪色后恢复原来颜色
D、不褪色
SO2+Cl2+2H2O = 2HCl+H2SO4
D
思考4、CO2和SO2在化学性质上既有相似性又有差异性,如何区分这两种气体呢 能用澄清石灰水鉴别吗
(1)品红溶液
(2)KMnO4溶液或Br2水
SO2均褪色
相似性:均为酸性氧化物
差异性:SO2具有还原性、漂白性
区分:
思考5、已知炭与浓硫酸在加热条件下的反应:C+ 2H2SO4 = CO2↑+ 2SO2↑+ 2H2O
请设计实验来验证反应中的三种产物。
仪器连接如下
酸雨:指pH<5.6的酸性降水
酸雨的危害:
1、影响水生生物的繁殖
2、土壤中钙、镁、磷等营养元素溶出并迅速流失,导致土壤肥力下降并酸化
3、农作物和树木生长遭到破坏
4、建筑物腐蚀加快
3、 SO2对环境的影响:
硫酸型酸雨的形成过程
二氧化硫的作用
形成过程① SO2+H2O H2SO3
2H2SO3+O2 = 2H2SO4
② 2SO2+O2 2SO3
SO3+H2O = H2SO4
酸雨的防治
1、含硫燃料预先脱硫处理
2、释放出的二氧化硫进行处理或利用回收
3、研究新能源
4、大力提倡植树造林,尤其栽种吸收SO2较多的柳杉、银槐、银杏等。
5、提高全民的环境保护意识。从1974年起,每年由联合国环境规划署确定一个主题,开展“世界环境日”的活动,其中1983年的主题是防治酸雨。
4、二氧化硫的用途:
制硫酸
漂白纸浆、毛、丝、草帽等
杀菌消毒
一分为二看问题!
过关训练
1、关于SO2的叙述中正确的是 ( )
A.可采用排水集气法收集SO2
B.它与水作用生成H2SO4
C.它能使溴水褪色,体现SO2 具有漂白性
D.实验室可用氢氧化钠溶液处理含有二氧化硫的尾气
D
过关训练
2. 下列变化中不属于化学变化的是( )
A. 二氧化硫使品红褪色
B. 氯水使有色布条褪色
C.活性炭使红墨水褪色
D.漂白粉使某些染料褪色
C
3.将SO2通入显红色的酚酞试剂中,发现红色消失,主要是因为SO2( )
A.有漂白性 B.有还原性
C.溶于水后显酸性 D.有氧化性
C
4.把少量的SO2分别通入下列浓度相等的①Ba(NO3)2溶液② Ba(OH)2溶液③溶有氨的BaCl2溶液中.预计能观察到白色沉淀的溶液是( )
A. ①和② B.只有②
C. ②和③ D.全部
D
5、与图中曲线相符合的是( )
A.向饱和H2SO3中通入H2S
B.向澄清石灰水中通入CO2
C.向氯水中通入SO2
D.向饱和H2S溶液中通入SO2气体
pH
V(气)
D
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
