第二单元 微粒之间的相互作用之共价键_苏教版
文档属性
| 名称 | 第二单元 微粒之间的相互作用之共价键_苏教版 |

|
|
| 格式 | zip | ||
| 文件大小 | 831.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-12-23 08:41:32 | ||
图片预览







文档简介
课件35张PPT。共价键Review离子键的定义?
哪些微粒化合时可形成离子键?
用电子式表示出k、S、K+、S2-、K2S? 使阴、阳离子结合成化合物的静电作用。1、活泼的金属元素(IA、IIA)和活泼的非金属元素
(VIA、VIIA)形成的化合物;
2、活泼的金属元素和酸根离子(或氢氧根离子)形成的化合物;
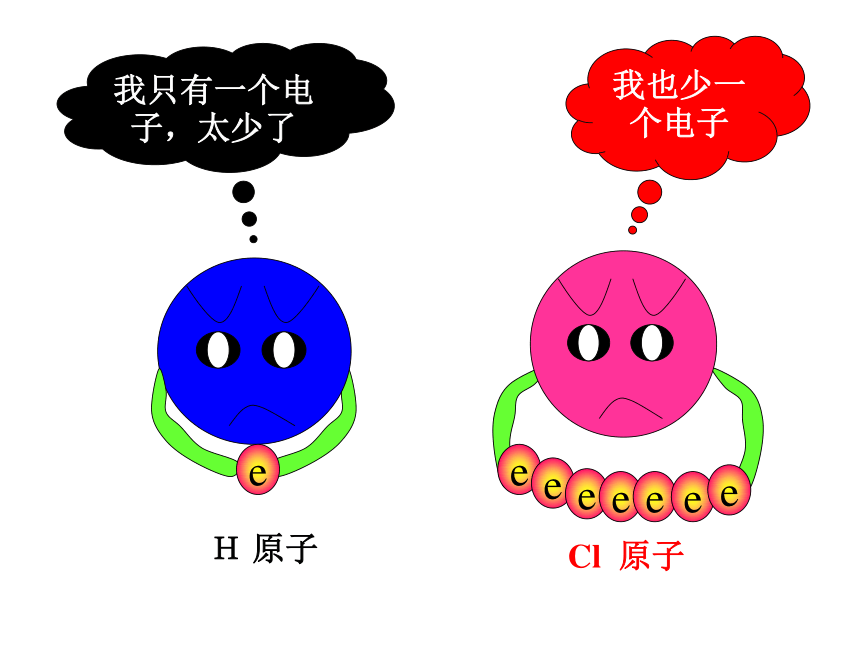
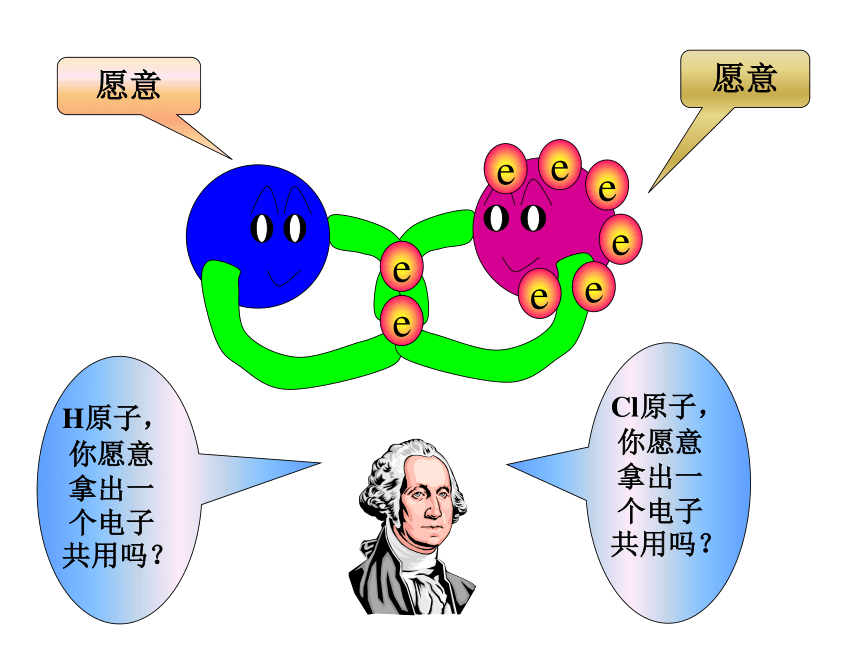
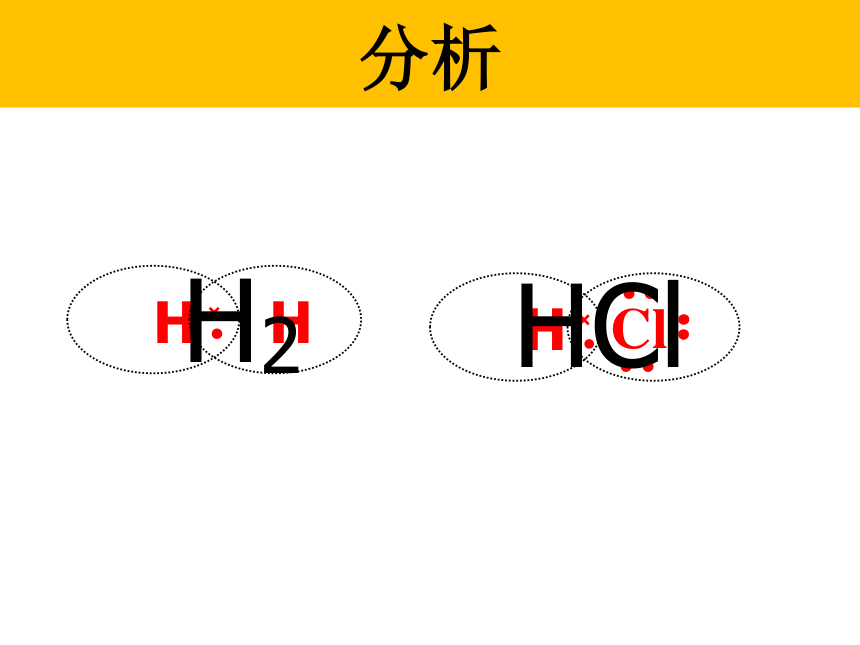
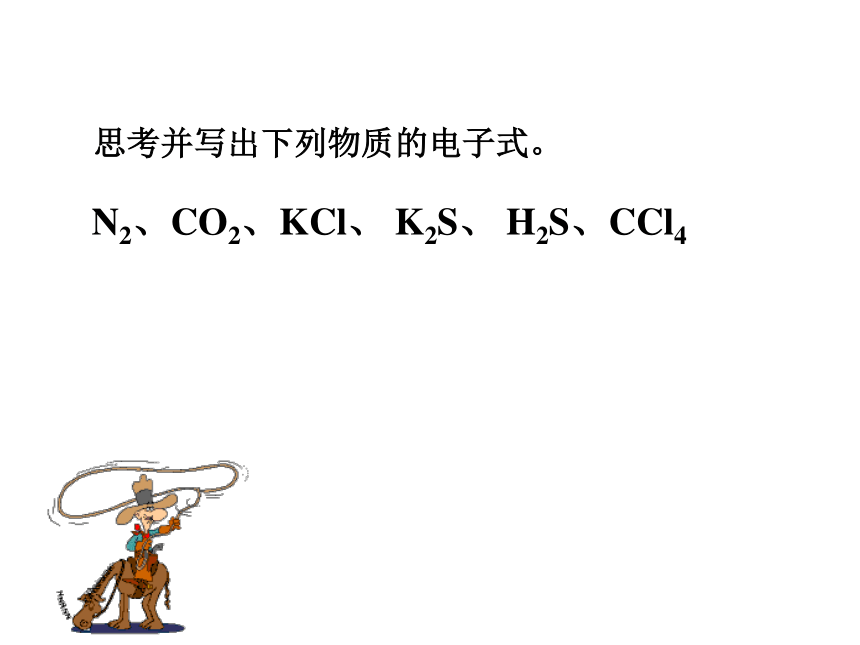
3、铵根和酸根离子(或活泼非金属元素离子)形成的盐。QuestionsH· 和 原子形成HCl过程中,能否形成离子键?为什么?HCl分子不是通过离子键来形成,是通过什么方式结合的呢?不能,因非金属元素的原子均有获得电子的倾向。我只有一个电子,太少了我也少一个电子eH 原子Cl 原子eeeeeee二位好!我有一个好办法.你们每人拿出一个电子共用,就象共同分享快乐一样共同拥有,行吗?eeeeeee愿意愿意H原子,你愿意拿出一个电子共用吗?Cl原子,你愿意拿出一个电子共用吗?eeeeeeee分析 H2HCl氢分子的形成: H · 氯化氢分子的形成: ·· · Cl ·· :· H+→H ·+→ 原子之间通过共用电子对所形成的强烈的相互作用,叫做共价键。newknowledge 分子中相邻的原子间均以共价键结合形成的化合物属于共价化合物2、成键微粒:原子3、成键作用力:“共用电子对”与两原子核的作用4、成键规律:一般同种或不同种非金属元素之间特殊:AlCl3、BeCl2 一、共价键的相关概念Newknowledge1、定义:原子间通过共用电子对所形成的相互作用只有非金属间才能形成共价键?非金属单质、共价化合物,也可能存在离子化合物中5、存在:非金属元素之间活泼金属与非金属元素之间阳离子~阴离子原子 ~原子静电作用共用电子对离子键和共价键的比较只存于离子化合物存于非金属单质、共价化合物、也可能存在离子化合物Review思考并写出下列物质的电子式。N2、CO2、KCl、 K2S、 H2S、CCl4
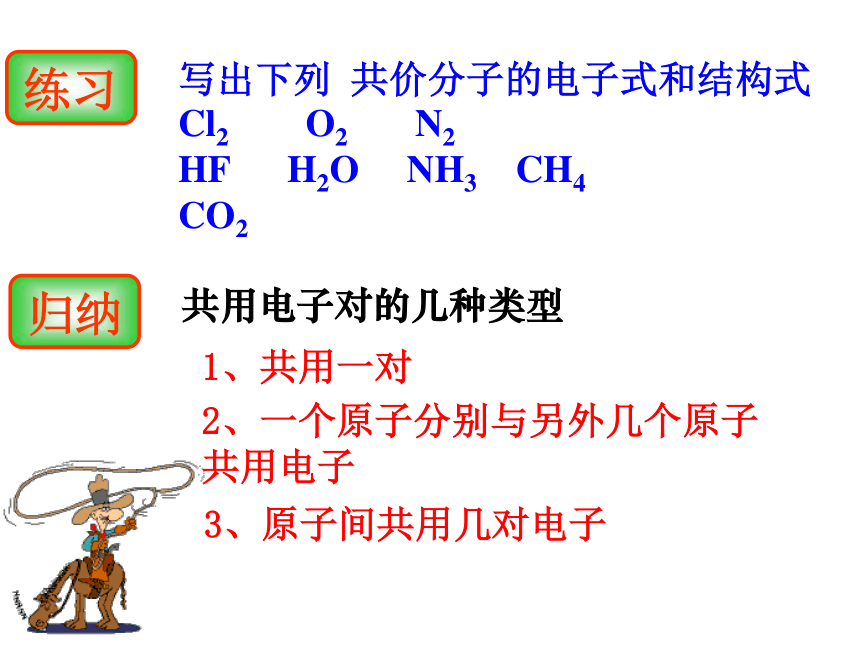
写出下列 共价分子的电子式和结构式 Cl2 O2 N2
HF H2O NH3 CH4
CO21、共用一对2、一个原子分别与另外几个原子共用电子共用电子对的几种类型3、原子间共用几对电子
练习归纳用电子式表示共价分子2、每个原子均应达到稳定的结构;3、不加中括号[ ],不标正负电荷数;4、8减去原子最外层电子数电子,就等于共用电子对对数(即几个共价键);书写要求:5、标出的电子总数等于各原子最外层电子数之和。1、判断化学键类型;口诀:判键型,排原子,算键数,画点叉。一对共用电子对两对共用电子对三对共用电子对用一条短线来表示原子间的一对共用电子对,省略其余的电子H-HCl-ClO=C=O结构式:trainingO=C=OH-O-O-HNH3CH4CO2折线型或V字形直线型H2O三角锥型正四面体球棍模型比例模型观察与思考 p14碳原子之间的连接 请判断NaOH、Na2O2属于离子化合物还是共价化合物?
写出其相应的电子式,并分析两化合物中的成键情况?1、共价化合物:只含有共价键的化合物物质类型:酸、非金属氧化物、非金属氢化物离子化合物离子化合物2、离子化合物:含有离子键的化合物(可含共价键)判断下列化合物的类型
NaOH、H2S、MgCl2、H2SO4、KNO3、CO2
离子化合物
共价化合物
含共价键的离子化合物练习:NaOHH2SNaOHMgCl2H2SO4KNO3KNO3CO2一.共价键的相关概念(定义,成键微粒、规律、作用力,存在等)
二.共价化合物定义
三.共价分子电子式书写规则
四.共价分子的结构式、空间构型
五.有机物中碳的成键特点
六.共价化合物、离子化合物的区分课堂小结写出下列物质的电子式,并指出化合物的类型H2O HClONaOH NH4Cl共价化合物共价化合物离子化合物离子化合物training下列说法是否正确?并举例说明1、离子化合物中可能含有共价键。2、共价化合物中可能含有离子键。3、非金属原子间不可能形成离子键。4、活泼金属和活泼非金属一定形成离子化合物。对 如KOH Na2SO4等错错 如NH4Cl NH4NO3错 如AlCl3 BeCl22、下列说法中正确的是 ( )
(A)含有共价键的分子一定是共价分子
(B)只含有共价键的物质一定是共价化合物
(C)离子化合物中可能含有极性共价键或非极性共价键
(D)氦分子中含有共价键也可能是单质分子,如氯气,氮气。 正确氦气是单原子分子,不存在化学健。C 也可能是离子化合物,如 NaOH, Na2O2 。training某元素的原子最外层电子只有一个,它跟
VIIA元素化合时,可形成的化学键是( )
A.一定是离子键 B.一定是共价键
C.可能是离子键,也可能是共价键
D.上述说法都不正确trainingC分子间作用力和氢键水液化、气化现象是物理变化还是化学变化?水液化、气化过程中有没有破坏其中的化学键?那为什么水液化、气化过程仍要吸收能量呢?一、分子间作用力(1)存在:分子间概念:分子间存在的将分子聚集在一起的作用力称为分子间作用力,又称为范德华力。(2)强弱:比化学键弱(3)主要影响物质的物理性质(熔沸点)原子之间分子之间微弱作用分子间作用力与化学键的比较强烈作用125--836KJ/mol2--20KJ/mol分子间的作用力强弱(范德华力)组成和结构相似的物质,相对分子质量越大,分子间作用力越大、熔沸点越高。结论练习2、下列物质变化时,需克服的作用力不属于化学键的是
A 、HCl溶于水 B 、 I2升华
C 、 H2O电解 D、 烧碱熔化 练习 1、比较下列物质的沸点高低
HCl HBr HI 物质中微粒间的作用力的类型与物质性质有密切关系。请与同学讨论下列问题,加深对物质结构与性质关系的认识。
1.氯化钠在熔化状态或水溶液中具有导电性,而液态氯化氢却不具有导电性。这是为什么?
2.干冰受热汽化转化为二氧化碳气体,而二氧化碳气体在加热条件下却不易被分解。这是为什么?CH4 SiH4 GeH4 SnH4NH3 PH3 AsH3 SbH3H2O H2S H2Se H2TeHF HCl HBr HI沸点如何变化?二、氢键1.氢键是一种特殊的分子间作用力,不是化学键2.强弱:比化学键弱而比范德华力强3.氢键的表示方法:X—H…YX、Y可以相同,也可以不同,(主要F、O、N)。氢键对物质性质的影响⑴氢键的存在使物质的熔沸点相对较高(如HF、H2O)。(3)解释一些反常现象:如水结成冰时,为什么体积会膨胀。(2)氢键的形成使某些物质在水中的溶解度增大(如NH3溶于水) 共价键键的强弱根据共价键的成因,共价键的强弱取决于成键原子的半径大小,原子的半径越小,共价键越强。
如比较金刚石和晶体硅 H2O和H2S两个氢原子的电子云
哪些微粒化合时可形成离子键?
用电子式表示出k、S、K+、S2-、K2S? 使阴、阳离子结合成化合物的静电作用。1、活泼的金属元素(IA、IIA)和活泼的非金属元素
(VIA、VIIA)形成的化合物;
2、活泼的金属元素和酸根离子(或氢氧根离子)形成的化合物;
3、铵根和酸根离子(或活泼非金属元素离子)形成的盐。QuestionsH· 和 原子形成HCl过程中,能否形成离子键?为什么?HCl分子不是通过离子键来形成,是通过什么方式结合的呢?不能,因非金属元素的原子均有获得电子的倾向。我只有一个电子,太少了我也少一个电子eH 原子Cl 原子eeeeeee二位好!我有一个好办法.你们每人拿出一个电子共用,就象共同分享快乐一样共同拥有,行吗?eeeeeee愿意愿意H原子,你愿意拿出一个电子共用吗?Cl原子,你愿意拿出一个电子共用吗?eeeeeeee分析 H2HCl氢分子的形成: H · 氯化氢分子的形成: ·· · Cl ·· :· H+→H ·+→ 原子之间通过共用电子对所形成的强烈的相互作用,叫做共价键。newknowledge 分子中相邻的原子间均以共价键结合形成的化合物属于共价化合物2、成键微粒:原子3、成键作用力:“共用电子对”与两原子核的作用4、成键规律:一般同种或不同种非金属元素之间特殊:AlCl3、BeCl2 一、共价键的相关概念Newknowledge1、定义:原子间通过共用电子对所形成的相互作用只有非金属间才能形成共价键?非金属单质、共价化合物,也可能存在离子化合物中5、存在:非金属元素之间活泼金属与非金属元素之间阳离子~阴离子原子 ~原子静电作用共用电子对离子键和共价键的比较只存于离子化合物存于非金属单质、共价化合物、也可能存在离子化合物Review思考并写出下列物质的电子式。N2、CO2、KCl、 K2S、 H2S、CCl4
写出下列 共价分子的电子式和结构式 Cl2 O2 N2
HF H2O NH3 CH4
CO21、共用一对2、一个原子分别与另外几个原子共用电子共用电子对的几种类型3、原子间共用几对电子
练习归纳用电子式表示共价分子2、每个原子均应达到稳定的结构;3、不加中括号[ ],不标正负电荷数;4、8减去原子最外层电子数电子,就等于共用电子对对数(即几个共价键);书写要求:5、标出的电子总数等于各原子最外层电子数之和。1、判断化学键类型;口诀:判键型,排原子,算键数,画点叉。一对共用电子对两对共用电子对三对共用电子对用一条短线来表示原子间的一对共用电子对,省略其余的电子H-HCl-ClO=C=O结构式:trainingO=C=OH-O-O-HNH3CH4CO2折线型或V字形直线型H2O三角锥型正四面体球棍模型比例模型观察与思考 p14碳原子之间的连接 请判断NaOH、Na2O2属于离子化合物还是共价化合物?
写出其相应的电子式,并分析两化合物中的成键情况?1、共价化合物:只含有共价键的化合物物质类型:酸、非金属氧化物、非金属氢化物离子化合物离子化合物2、离子化合物:含有离子键的化合物(可含共价键)判断下列化合物的类型
NaOH、H2S、MgCl2、H2SO4、KNO3、CO2
离子化合物
共价化合物
含共价键的离子化合物练习:NaOHH2SNaOHMgCl2H2SO4KNO3KNO3CO2一.共价键的相关概念(定义,成键微粒、规律、作用力,存在等)
二.共价化合物定义
三.共价分子电子式书写规则
四.共价分子的结构式、空间构型
五.有机物中碳的成键特点
六.共价化合物、离子化合物的区分课堂小结写出下列物质的电子式,并指出化合物的类型H2O HClONaOH NH4Cl共价化合物共价化合物离子化合物离子化合物training下列说法是否正确?并举例说明1、离子化合物中可能含有共价键。2、共价化合物中可能含有离子键。3、非金属原子间不可能形成离子键。4、活泼金属和活泼非金属一定形成离子化合物。对 如KOH Na2SO4等错错 如NH4Cl NH4NO3错 如AlCl3 BeCl22、下列说法中正确的是 ( )
(A)含有共价键的分子一定是共价分子
(B)只含有共价键的物质一定是共价化合物
(C)离子化合物中可能含有极性共价键或非极性共价键
(D)氦分子中含有共价键也可能是单质分子,如氯气,氮气。 正确氦气是单原子分子,不存在化学健。C 也可能是离子化合物,如 NaOH, Na2O2 。training某元素的原子最外层电子只有一个,它跟
VIIA元素化合时,可形成的化学键是( )
A.一定是离子键 B.一定是共价键
C.可能是离子键,也可能是共价键
D.上述说法都不正确trainingC分子间作用力和氢键水液化、气化现象是物理变化还是化学变化?水液化、气化过程中有没有破坏其中的化学键?那为什么水液化、气化过程仍要吸收能量呢?一、分子间作用力(1)存在:分子间概念:分子间存在的将分子聚集在一起的作用力称为分子间作用力,又称为范德华力。(2)强弱:比化学键弱(3)主要影响物质的物理性质(熔沸点)原子之间分子之间微弱作用分子间作用力与化学键的比较强烈作用125--836KJ/mol2--20KJ/mol分子间的作用力强弱(范德华力)组成和结构相似的物质,相对分子质量越大,分子间作用力越大、熔沸点越高。结论练习2、下列物质变化时,需克服的作用力不属于化学键的是
A 、HCl溶于水 B 、 I2升华
C 、 H2O电解 D、 烧碱熔化 练习 1、比较下列物质的沸点高低
HCl HBr HI 物质中微粒间的作用力的类型与物质性质有密切关系。请与同学讨论下列问题,加深对物质结构与性质关系的认识。
1.氯化钠在熔化状态或水溶液中具有导电性,而液态氯化氢却不具有导电性。这是为什么?
2.干冰受热汽化转化为二氧化碳气体,而二氧化碳气体在加热条件下却不易被分解。这是为什么?CH4 SiH4 GeH4 SnH4NH3 PH3 AsH3 SbH3H2O H2S H2Se H2TeHF HCl HBr HI沸点如何变化?二、氢键1.氢键是一种特殊的分子间作用力,不是化学键2.强弱:比化学键弱而比范德华力强3.氢键的表示方法:X—H…YX、Y可以相同,也可以不同,(主要F、O、N)。氢键对物质性质的影响⑴氢键的存在使物质的熔沸点相对较高(如HF、H2O)。(3)解释一些反常现象:如水结成冰时,为什么体积会膨胀。(2)氢键的形成使某些物质在水中的溶解度增大(如NH3溶于水) 共价键键的强弱根据共价键的成因,共价键的强弱取决于成键原子的半径大小,原子的半径越小,共价键越强。
如比较金刚石和晶体硅 H2O和H2S两个氢原子的电子云
