10.1常见的酸和碱练习-2021-2022学年九年级化学人教版下册(word版 含答案)
文档属性
| 名称 | 10.1常见的酸和碱练习-2021-2022学年九年级化学人教版下册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 79.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-09 08:41:41 | ||
图片预览

文档简介
10.1常见的酸和碱练习
1.氢氧化钠和氢氧化钙是两种常见的碱,下列说法错误的是( )
A.溶解性:氢氧化钠易溶于水,氢氧化钙微溶于水
B.保存:在空气中易变质,都需密封保存
C.鉴别:对两者的溶液,取样后分别滴入酚酞溶液
D.用途:氢氧化钠可用于制炉具清洗剂,氢氧化钙可用于改良酸性土壤
2.水是生命之源,下列“水”可以使石蕊溶液变红的是( )
A.蒸馏水 B.糖水 C.氨水 D.柠檬水
3.下列物质的名称(或俗名)与化学式一致的是( )
A.酒精、CH4 B.石灰石、Ca(OH)2
C.火碱、NaOH D.生石灰、CaCO3
4.物质存放在烧杯中一段时间后,质量变大且变质的是( )
①浓盐酸 ②浓硫酸 ③烧碱 ④生石灰 ⑤熟石灰
A.③④⑤ B.②③④⑤ C.①②③④⑤ D.④⑤
5.下列实验现象描述正确的是( )
A.镁条在空气中燃烧发出耀眼的白光,生成白色固体
B.打开盛有浓盐酸的试剂瓶盖,瓶口上方会出现白烟
C.将CO2气体通入紫色石蕊溶液,溶液变蓝
D.将木炭在空气中点燃后伸至氧气瓶中,生成二氧化碳气体
6.下列各组物质中,利用括号内的试剂或物品不能将它们一一鉴别出来的是( )
A.稀盐酸、氢氧化钠溶液、氯化钠溶液(无色酚酞)
B.空气、氧气、二氧化碳气体(燃着的木条)
C.氧化铁、铜和红磷三种红色固体(稀盐酸)
D.硝酸铵、氢氧化钠和氯化钠三种白色固体(水)
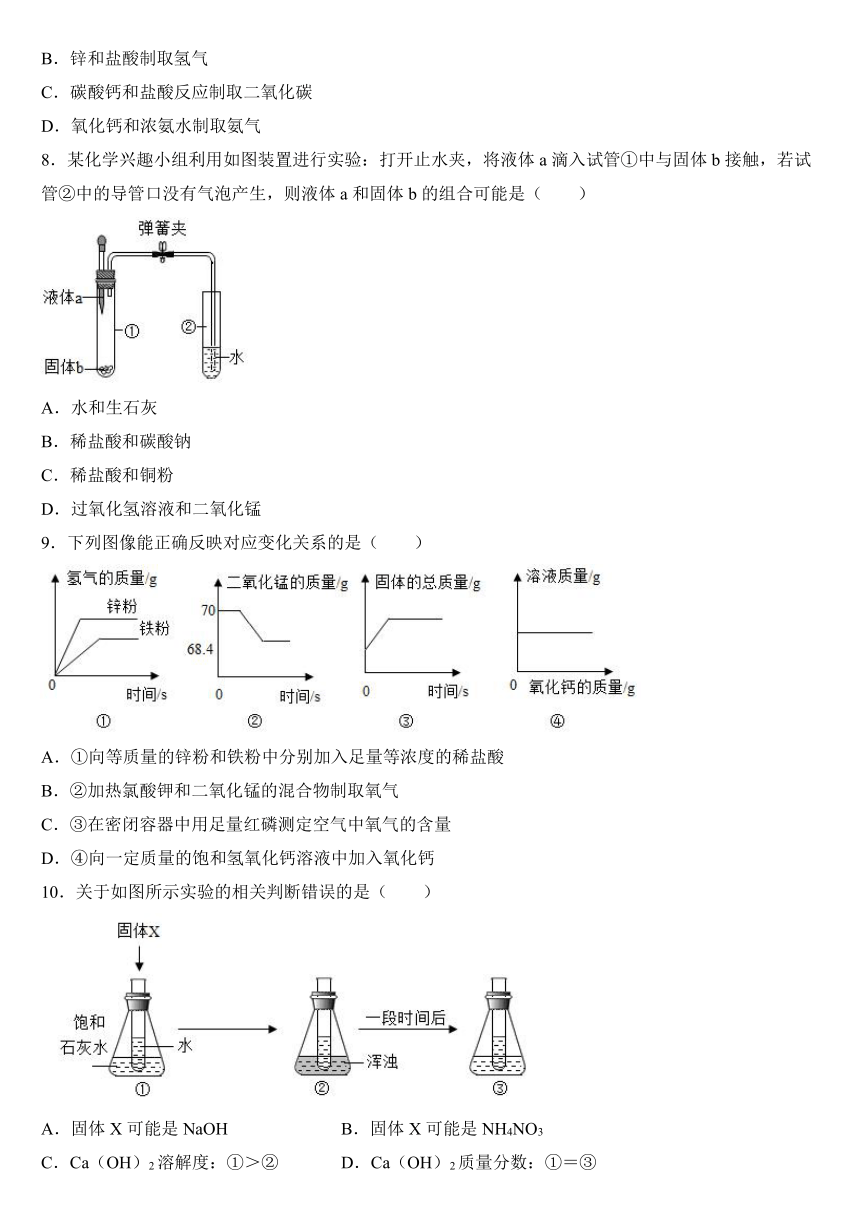
7.下图装置可以用来发生、洗涤、干燥、收集气体(不考虑尾气处理),该装置可用于( )
A.二氧化锰和浓盐酸加热制取氯气
B.锌和盐酸制取氢气
C.碳酸钙和盐酸反应制取二氧化碳
D.氧化钙和浓氨水制取氨气
8.某化学兴趣小组利用如图装置进行实验:打开止水夹,将液体a滴入试管①中与固体b接触,若试管②中的导管口没有气泡产生,则液体a和固体b的组合可能是( )
A.水和生石灰
B.稀盐酸和碳酸钠
C.稀盐酸和铜粉
D.过氧化氢溶液和二氧化锰
9.下列图像能正确反映对应变化关系的是( )
A.①向等质量的锌粉和铁粉中分别加入足量等浓度的稀盐酸
B.②加热氯酸钾和二氧化锰的混合物制取氧气
C.③在密闭容器中用足量红磷测定空气中氧气的含量
D.④向一定质量的饱和氢氧化钙溶液中加入氧化钙
10.关于如图所示实验的相关判断错误的是( )
A.固体X可能是NaOH B.固体X可能是NH4NO3
C.Ca(OH)2溶解度:①>② D.Ca(OH)2质量分数:①=③
11.甲、乙两种固体物质(均不含结晶水)的溶解度曲线如图所示。下列说法正确的是( )
A、t1℃时,甲、乙饱和溶液的溶质质量相等
B、t1℃时,65g乙饱和溶液中溶质的质量为15g
C、t2℃时,100g甲物质可以配制200g溶质质量分数为50%的溶液
D、t2℃时,向70g乙饱和溶液中加入_______g水,可得到溶质质量分数为20%的乙溶液
12.为应对全球气候变化,中国争取在2060年前实现碳中和。下图为“捕捉”CO2的某流程图(提示:氧化钙可与水反应生成微溶性的氢氧化钙)。
(1)将二氧化碳含量高的气体从吸收塔的下方通入,是因为二氧化碳_________(填性质)。
(2)在吸收塔中将氢氧化钠溶液喷成“雾状”的目的是__________;用氢氧化钠溶液“捕捉”CO2后生成碳酸钠和一种氧化物,该反应的化学方程式是___________。
(3)反应后的沉淀池中所含固体物质有__________(写化学式)以及未完全反应的CaO。
(4)操作a的名称是_____________。
13.A、B、C、D、E、F是初中化学常见的六种物质,已知A是一种单质,B为红棕色固体,D常用于改良酸性土壤,F与B属于同类物质,其相互反应情况如图所示(短线“-”相连的物质间能反应,箭头“→”表示能生成)。
(1)A的化学式为______, F是______的主要成分,写出F的一种用途______。
(2)写出下列反应或转化的化学方程式:①B与C反应______②D转化为E______
14.某化学兴趣小组为了测定某黄铜(铜、锌合金)样品中锌的组成,取黄铜样品50g放入锥形瓶中,向其中分5次共加入250克稀硫酸,测得数据记录如下表:
1 第1次 第2次 第3次 第4次 第5次
累计加入稀硫酸的质量/g 50 100 150 200 250
累计产生气体的质量/g 0.2 m 0.6 0.7 0.7
(1)表中m=______g;
(2)黄铜样品中铜的质量分数______;
(3)求所用稀硫酸中溶质的质量分数?(写出计算过程)
试卷第1页,共3页
答案
1.C 2.D 3.C 4.A 5.A 6.C 7.B 8.C 9.C 10.B
11. B 30
12.(1)密度比空气大
(2) 增大反应物的接触面积 2NaOH+CO2=Na2CO3+H2O
(3)CaCO3、Ca(OH)2
(4)过滤
13.(1) Fe 生石灰 食品干燥剂
(2) ①Fe2O3+6HCl=2FeCl3+3H2O (或Fe2O3+3H2SO4=Fe2(SO4)3+3H2O其它合理答案均可) Ca(OH)2+CO2=CaCO3↓+H2O (或Ca(OH)2+Na2CO3=CaCO3↓+2NaOH其它合理答案)
14.(1)0.4
(2)54.5%
(3)解:设50g稀硫酸中硫酸的质量为
=9.8g
所用稀硫酸中溶质的质量分数为×100%=19.6%
答:所用稀硫酸中溶质的质量分数为19.6%。
答案第1页,共2页
答案第1页,共2页
1.氢氧化钠和氢氧化钙是两种常见的碱,下列说法错误的是( )
A.溶解性:氢氧化钠易溶于水,氢氧化钙微溶于水
B.保存:在空气中易变质,都需密封保存
C.鉴别:对两者的溶液,取样后分别滴入酚酞溶液
D.用途:氢氧化钠可用于制炉具清洗剂,氢氧化钙可用于改良酸性土壤
2.水是生命之源,下列“水”可以使石蕊溶液变红的是( )
A.蒸馏水 B.糖水 C.氨水 D.柠檬水
3.下列物质的名称(或俗名)与化学式一致的是( )
A.酒精、CH4 B.石灰石、Ca(OH)2
C.火碱、NaOH D.生石灰、CaCO3
4.物质存放在烧杯中一段时间后,质量变大且变质的是( )
①浓盐酸 ②浓硫酸 ③烧碱 ④生石灰 ⑤熟石灰
A.③④⑤ B.②③④⑤ C.①②③④⑤ D.④⑤
5.下列实验现象描述正确的是( )
A.镁条在空气中燃烧发出耀眼的白光,生成白色固体
B.打开盛有浓盐酸的试剂瓶盖,瓶口上方会出现白烟
C.将CO2气体通入紫色石蕊溶液,溶液变蓝
D.将木炭在空气中点燃后伸至氧气瓶中,生成二氧化碳气体
6.下列各组物质中,利用括号内的试剂或物品不能将它们一一鉴别出来的是( )
A.稀盐酸、氢氧化钠溶液、氯化钠溶液(无色酚酞)
B.空气、氧气、二氧化碳气体(燃着的木条)
C.氧化铁、铜和红磷三种红色固体(稀盐酸)
D.硝酸铵、氢氧化钠和氯化钠三种白色固体(水)
7.下图装置可以用来发生、洗涤、干燥、收集气体(不考虑尾气处理),该装置可用于( )
A.二氧化锰和浓盐酸加热制取氯气
B.锌和盐酸制取氢气
C.碳酸钙和盐酸反应制取二氧化碳
D.氧化钙和浓氨水制取氨气
8.某化学兴趣小组利用如图装置进行实验:打开止水夹,将液体a滴入试管①中与固体b接触,若试管②中的导管口没有气泡产生,则液体a和固体b的组合可能是( )
A.水和生石灰
B.稀盐酸和碳酸钠
C.稀盐酸和铜粉
D.过氧化氢溶液和二氧化锰
9.下列图像能正确反映对应变化关系的是( )
A.①向等质量的锌粉和铁粉中分别加入足量等浓度的稀盐酸
B.②加热氯酸钾和二氧化锰的混合物制取氧气
C.③在密闭容器中用足量红磷测定空气中氧气的含量
D.④向一定质量的饱和氢氧化钙溶液中加入氧化钙
10.关于如图所示实验的相关判断错误的是( )
A.固体X可能是NaOH B.固体X可能是NH4NO3
C.Ca(OH)2溶解度:①>② D.Ca(OH)2质量分数:①=③
11.甲、乙两种固体物质(均不含结晶水)的溶解度曲线如图所示。下列说法正确的是( )
A、t1℃时,甲、乙饱和溶液的溶质质量相等
B、t1℃时,65g乙饱和溶液中溶质的质量为15g
C、t2℃时,100g甲物质可以配制200g溶质质量分数为50%的溶液
D、t2℃时,向70g乙饱和溶液中加入_______g水,可得到溶质质量分数为20%的乙溶液
12.为应对全球气候变化,中国争取在2060年前实现碳中和。下图为“捕捉”CO2的某流程图(提示:氧化钙可与水反应生成微溶性的氢氧化钙)。
(1)将二氧化碳含量高的气体从吸收塔的下方通入,是因为二氧化碳_________(填性质)。
(2)在吸收塔中将氢氧化钠溶液喷成“雾状”的目的是__________;用氢氧化钠溶液“捕捉”CO2后生成碳酸钠和一种氧化物,该反应的化学方程式是___________。
(3)反应后的沉淀池中所含固体物质有__________(写化学式)以及未完全反应的CaO。
(4)操作a的名称是_____________。
13.A、B、C、D、E、F是初中化学常见的六种物质,已知A是一种单质,B为红棕色固体,D常用于改良酸性土壤,F与B属于同类物质,其相互反应情况如图所示(短线“-”相连的物质间能反应,箭头“→”表示能生成)。
(1)A的化学式为______, F是______的主要成分,写出F的一种用途______。
(2)写出下列反应或转化的化学方程式:①B与C反应______②D转化为E______
14.某化学兴趣小组为了测定某黄铜(铜、锌合金)样品中锌的组成,取黄铜样品50g放入锥形瓶中,向其中分5次共加入250克稀硫酸,测得数据记录如下表:
1 第1次 第2次 第3次 第4次 第5次
累计加入稀硫酸的质量/g 50 100 150 200 250
累计产生气体的质量/g 0.2 m 0.6 0.7 0.7
(1)表中m=______g;
(2)黄铜样品中铜的质量分数______;
(3)求所用稀硫酸中溶质的质量分数?(写出计算过程)
试卷第1页,共3页
答案
1.C 2.D 3.C 4.A 5.A 6.C 7.B 8.C 9.C 10.B
11. B 30
12.(1)密度比空气大
(2) 增大反应物的接触面积 2NaOH+CO2=Na2CO3+H2O
(3)CaCO3、Ca(OH)2
(4)过滤
13.(1) Fe 生石灰 食品干燥剂
(2) ①Fe2O3+6HCl=2FeCl3+3H2O (或Fe2O3+3H2SO4=Fe2(SO4)3+3H2O其它合理答案均可) Ca(OH)2+CO2=CaCO3↓+H2O (或Ca(OH)2+Na2CO3=CaCO3↓+2NaOH其它合理答案)
14.(1)0.4
(2)54.5%
(3)解:设50g稀硫酸中硫酸的质量为
=9.8g
所用稀硫酸中溶质的质量分数为×100%=19.6%
答:所用稀硫酸中溶质的质量分数为19.6%。
答案第1页,共2页
答案第1页,共2页
同课章节目录
