第九单元溶液测试题—2021-2022学年九年级化学人教版下册(word版 含答案)
文档属性
| 名称 | 第九单元溶液测试题—2021-2022学年九年级化学人教版下册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 146.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-09 08:43:43 | ||
图片预览




文档简介
第九单元《溶液》测试题
一、单选题
1.下列少量物质分散到水中,能形成无色透明溶液的是
A.冰块 B.芝麻油 C.酒精 D.硫酸铜
2.如图为两种物质的溶解度曲线,下列说法正确的是
A.两种物质的溶解度都随温度升高而增大
B.20℃时,Na2Cr2O7饱和溶液的溶质质量分数为80%
C.60℃时,Na2SO4的溶解度大于 Na2Cr2O7的溶解度
D.可以配制溶质质量分数相同的 Na2Cr2O7、Na2SO4溶液
3.常温下,向各盛有100g水的甲、乙两个烧杯中分别加入等质量的M、N两种固体物质,搅拌,充分溶解后,发现只有甲烧杯底部有未溶固体存在。下列说法正确的是
A.所得两溶液质量相等 B.N溶液可能是饱和溶液
C.M、N两种物质都是易溶的 D.升高温度,M物质一定能继续溶解
4.下列说法正确的是
A.H2O和H2O2组成元素相同,化学性质也一定相同
B.溶液中有晶体析出时,溶质质量减小,溶液质量也一定减小
C.置换反应生成单质和化合物,有单质和化合物生成的反应也一定是置换反应
D.20℃,称取5.0gCa(OH)2固体,加入95.0mL蒸馏水充分搅拌,得到5.0%的澄清石灰水
5.如图是“膜分离技术”淡化海水的原理图,分析正确的是
A.海水淡化的过程无需外界提供能量 B.加压后浓海水中只含Na+、Cl-、H2O
C.加压后浓海水中溶质的质量分数增大 D.这种半透膜可用滤纸代替
6.物质的鉴别和除杂是重要的实验技能。下列实验方案正确的是
选项 实验目的 实验方案
A 鉴别N2和CO2 用燃着的木条
B 鉴别NaOH和NH4NO3 加水溶解
C 除去Fe中的Cu 加足量盐酸,过滤
D 除去KNO3中的少量NaCl 加水溶解,蒸发结晶
A.A B.B C.C D.D
7.下列实验操作或原理能达到实验目的的是
选项 实验目的 主要操作或原理
A 测定空气中氧气含量 利用铁丝燃烧消耗氧气来测定
B 区别氢氧化钠和硝酸铵固体 分别取样,加适量水溶解后测温度变化
C 检验二氧化碳中混有的少量氧气 将带火星的木条伸入,观察是否复燃
D 鉴别氮气和二氧化碳 将燃着的木条分别伸入,观察现象
A.A B.B C.C D.D
8.下列关于溶液的说法中正确的是
A.溶液中各部分性质相同 B.无色透明的液体一定是溶液
C.硝酸铵固体溶于水,温度升高 D.溶质只能是固体
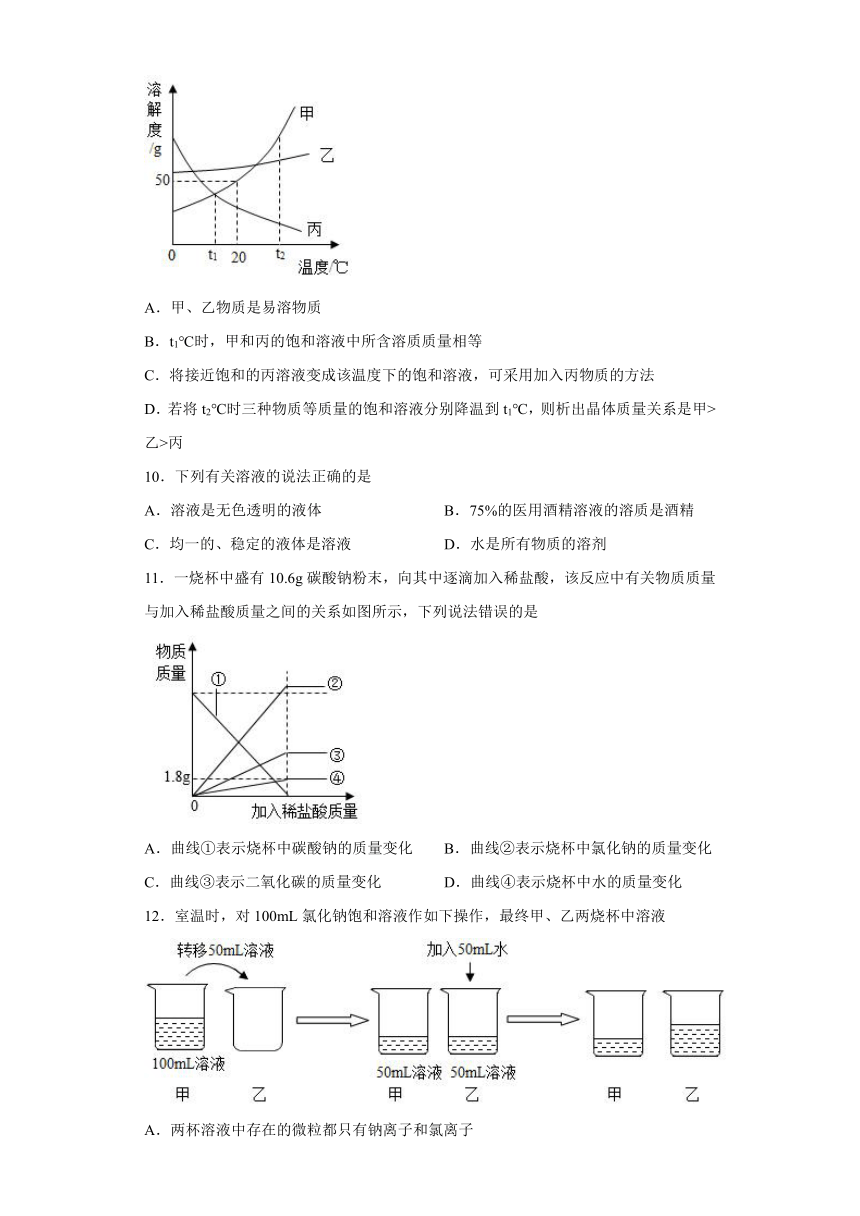
9.甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线如图所示,下列说法不正确的是
A.甲、乙物质是易溶物质
B.t1℃时,甲和丙的饱和溶液中所含溶质质量相等
C.将接近饱和的丙溶液变成该温度下的饱和溶液,可采用加入丙物质的方法
D.若将t2℃时三种物质等质量的饱和溶液分别降温到t1℃,则析出晶体质量关系是甲>乙>丙
10.下列有关溶液的说法正确的是
A.溶液是无色透明的液体 B.75%的医用酒精溶液的溶质是酒精
C.均一的、稳定的液体是溶液 D.水是所有物质的溶剂
11.一烧杯中盛有10.6g碳酸钠粉末,向其中逐滴加入稀盐酸,该反应中有关物质质量与加入稀盐酸质量之间的关系如图所示,下列说法错误的是
A.曲线①表示烧杯中碳酸钠的质量变化 B.曲线②表示烧杯中氯化钠的质量变化
C.曲线③表示二氧化碳的质量变化 D.曲线④表示烧杯中水的质量变化
12.室温时,对100mL氯化钠饱和溶液作如下操作,最终甲、乙两烧杯中溶液
A.两杯溶液中存在的微粒都只有钠离子和氯离子
B.甲溶液一定饱和,乙溶液可能饱和
C.甲溶液中氯化钠溶解度不变,乙溶液中氯化钠溶解度降低
D.甲、乙溶液中溶质质量相等
13.下列物质的性质与用途对应关系不正确的是:
A.甲烷具有可燃性——作燃料 B.氮气无色味——食品保护气
C.金刚石硬度大——切割玻璃 D.洗洁精具有乳化作用——清洗油污
14.NaCl和KNO3的溶解度曲线如图所示,下列说法正确的是
A.NaCl的溶解度一定大于KNO3
B.NaCl的溶解度受温度影响的程度比KNO3大
C.40℃时,100gKNO3饱和溶液中含有63.9gKNO3
D.将60℃时210gKNO3饱和溶液降温至20℃,析出KNO3晶体78.4g
15.氨氧化法制硝酸的反应原理可表示如下:NH3+2O2=HNO3+H2O。向反应后所得的溶液中加入一定量的水可制得溶质质量分数为60%的硝酸溶液,将反应后所得的溶液脱水可制得溶质质量分数为90%的硝酸溶液。现以17kg氨气为原料,反应后既不加水也不脱水,理论上可制得60%和90%的硝酸溶液的质量比为
A.5:8 B.8:11 C.11:25 D.11:16
二、填空题
16.新冠肺炎是一种急性感染性肺炎,做好自身防护是防止感染的重要措施。家庭和学校应常备75%的酒精溶液 温度计 84消毒液等。请根据所学化学知识回答下列问题。
(1)75%的酒精溶液中属于溶质的是_______。
(2)水银温度计是常见的温度计,温度升高,水银柱会上升,从微观角度来解释是_______。
(3)“84”消毒液的有效成分为NaClO,所含的阳离子为______(写离子符号)。
(4)“84”消毒液的消毒原理为,生成的HClO(次氯酸)具有较强的杀菌作用。化学方程式中X的化学式为_____。
17.溶液在生产、生活中应用广泛。请回答下列问题。
(1)用洗洁精洗去餐具上的油污,这是利用了洗洁精的______作用。
(2)烧开水时,在煮沸前会看到壶底有气泡冒出,说明气体的溶解度随温度升高而______(选填“增大”或“减小”)。
(3)生理盐水是0.9%的氯化钠溶液生理盐水密封放置一段时间后,______(选填“会”或“不会”)出现浑浊现象,其理由是溶液具有______。
(4)某化学兴趣小组欲配制1000g溶质质量分数为0.9%的生理盐水。需要称量氯化钠固体的质量为______g,需要量取______mL水。氯化钠固体溶解时需要用到玻璃棒,其作用是______。
(5)甲、乙两种固体物质(均不含结晶水)的溶解度曲线如图所示。
①甲、乙的溶解度在______℃时相等。
②t2℃时,将30g的甲物质加入50g水中,充分溶解并恢复至原温度,所得溶液的质量为______g。
③t1℃时,甲的饱和溶液的溶质质量分数为______(只列出表达式)。
④分别将t2℃时等质量的甲、乙的饱和溶液降温至t1℃,析出晶体的质量关系是甲______(选填“大于”、“等于”或“小于”)乙。
18.回答问题:
(1)2021年10月20日亚太绿色低碳反战高峰论坛在中国开幕,主题为“建碳中和愿景,写新增长未来”。中国将力争2030年前二氧化碳排放达到峰值,即“碳达峰”:争取在2060年前实现“碳中和”。我国对全世界宣布“碳中和”目标,彰显了大国的责任和担当。
①目前,人们使用的燃料大多来自化石燃料,化石燃料的大量使用,使大气中二氧化碳的含量持续上升,由此引发的环境问题是______。
②“碳中和”是指人为排放二氧化碳量与通过植树造林和人为碳捕集技术吸收二氧化碳量达到平衡。对于自然界中消耗二氧化碳的主要途径是______(写一条)。
③开发和利用新能源,有利于生态环境保护。氢氧燃料电池已得到广泛应用,在这种电池中,利用氢气作为能源的最大优点是______;写出该反应的化学方程式________。
④西班牙有一条酸河,经调查发现导致河水呈酸性的原因是上游排放的物质R在水中发生反应所导致,该反应的化学方程式是,则R的化学式为______。
(2)我国化学家侯德榜在氨碱法的基础上创立的“侯氏制碱法”,向滤出NaHCO3晶体后的NH4Cl溶液中加入NaCl粉末,析出NH4Cl。NH4Cl和NaCl两种物质的溶解度曲线如图所示。
①t1℃时,NH4Cl的溶解度______NaCl的溶解度。(填“大于”“等于”“小于”之一)
②t2℃时,NH4Cl的溶解度是______g。
③t2℃时,把50gNH4Cl加入100g水中,充分溶解,所得溶液的质量为______,此溶液为______溶液(填“饱和”或“不饱和”之一)
④通过NaCl的溶解度曲线,可判断出海水“晒盐”是用______(填“蒸发结晶”“降温结晶”之一)的方法从海水中得到NaCl。
19.硝酸钾的溶解度曲线如图一所示。
(1)20℃时硝酸钾的溶解度为___________。
(2)a、b、c三点对应的溶液的溶质质量分数大小关系为___________(填字母)。
A.c>a> b B.a=c>b C.a>b>c D.c>a=b
(3)40℃时硝酸钾饱和溶液中溶质的质量___________(填“一定”“一定不”或“不一定”)小于60℃时硝酸钾饱和溶液中溶质的质量。
(4)60℃时,向10g水中加入XgKNO3固体形成溶液,再逐渐降温到20(降温过程中,水分的蒸发忽略不计),析出固体的质量随时间的变化如图二所示。下列说法正确的是___________(填字母)。
A.X的数值为6.39
B.60℃时,溶液为饱和溶液
C.时间为t时,溶液温度为40℃
D.通过降温结晶的方式能从原溶液中回收到XgKNO3固体
(5)如图三所示,向烧杯中的水中加入某物质后,试管内未溶解的硝酸钾能完全溶解,加入的物质可能是___________(填序号)。
①冰块②生石灰③硝酸铵固体④氢氧化钠固体
三、推断题
20.A、B、C、D、E是初中化学中常见的五种物质,它们之间有如下图所示的关系(“→”表示物质间的转化关系,“—”表示相互能反应,部分物质和反应条件已经略去)。A是一种最常用的溶剂,A、B、D含有一种相同的元素,D是磁铁矿的主要成分,E为氧化物。则C的一种用途是______; B转化为D的基本反应类型为______;E与D反应的化学方程式______。
21.图中,甲是相对分子质量为16的有机物,乙是最常见的溶剂,丁是白色难溶固体,其中金属元素的质量分数为40%.甲的化学式 ________ .②的化学方程式为 ________ .丙的一种用途是 ________ .
四、实验题
22.实验室选用下列仪器,配制80g溶质质量分数为6%的氯化钠溶液。
(1)进行该实验的完整步骤为:___________、称取氯化钠、量取水、___________和转移。
(2)实验时,还缺少的一种仪器是___________,上图中用不到的一种仪器是___________;
(3)若所配氯化钠溶液的浓度偏大,可能的原因是___________(任答一条)。
(4)在常温下的氯化钠溶液中,浓度最大的阳离子是___________(写离子符号)。
23.根据图示实验回答下列问题。
(1)图1是测定空气中氧气含量的实验,写出红磷燃烧的化学方程式:_____,实验得出的结论是_____。
(2)图2是某同学配制一定溶质质量分数的氯化钠溶液的部分实验操作。甲图中玻璃棒的作用是_____,乙图是量取水的操作,若其它操作均正确,则所配制的氯化钠溶液的质量分数_____(填“偏大”“偏小”或“不变”)。
(3)图3是比较等质量的二氧化锰和氧化铁对过氧化氢溶液分解催化效率的实验,试剂X应该是_____。
五、计算题
24.化学兴趣小组为测定某大理石样品中碳酸钙的质量分数,向3g大理石样品(杂质不溶于水,也不与盐酸反应)分四次加入一定溶质质量分数的稀盐酸20克,每次充分反应后,经过滤、干燥等操作后称量,剩余固体质量变化如图所示。
稀盐酸的用量 剩余固体的质量
第一次加入5g 2g
第二次加入5g 1.0g
第三次加入5g 0.6g
第四次加入5g 0.6g
请计算:
(1)该大理石样品中杂质的质量为______g。
(2)计算所用稀盐酸的溶质质量分数。(写出计算过程)
25.“黄铜”是铜锌合金,具有较机械性能,比纯铜耐腐蚀。现将20g黄铜投入100g稀硫酸中,恰好完全反应,剩余的溶液和残余固体总质量为119.8g。
已知:Zn+H2 SO4=ZnSO4+ H2↑。
请计算:
(1)产生氢气的质量为________g。
(2)这种黄铜中锌的质量为多少?
(3)所用稀硫酸的溶质质量分数是多少?
参考答案:
1.C 2.D 3.B 4.B 5.C 6.B 7.B 8.A 9.B 10.B 11.D 12.D 13.B 14.D 15.D 16.(1)酒精
(2)温度升高,汞原子间间隔变大
(3)Na+
(4)Na2CO3
17.(1)乳化
(2)减小
(3) 不会 均一性、稳定性
(4) 9 991 加速溶解
(5) t1 75 大于
18.(1) 温室效应增强 绿色植物的光合作用 燃烧产物为水,不污染环境 FeS2
(2) 等于 48 148g 饱和 蒸发结晶
19.(1)31.6g
(2)D
(3)不一定
(4)AC
(5)②④
20. 高能燃料 化合反应
21. CH4 CO2+Ca(OH)2=CaCO3↓+H2O 灭火
22.(1) 计算 溶解
(2) 量筒 漏斗
(3)使用量筒读数时,俯视读数
(4)Na+
23.(1) 氧气约占空气体积的五分之一
(2) 搅拌,加快氯化钠的溶解 偏小
(3)10g5%H2O2溶液
24.(1)0.6
(2)解:设与1g碳酸钙反应需要HCl的质量为x
x=0.73g
1g碳酸钙与5g稀盐酸恰好完全反应,则该盐酸中溶质的质量分数为:
答:原稀盐酸中溶质的质量分数为14.6%。
25.(1)0.2
(2)解:设参加反应的锌的质量为x,稀硫酸中溶质的质量为y
解得:
为答:黄铜中锌的质量为6.5g。
(3)所用稀硫酸的溶质质量分数:
答:所用稀硫酸的溶质质量分数是9.8%。
一、单选题
1.下列少量物质分散到水中,能形成无色透明溶液的是
A.冰块 B.芝麻油 C.酒精 D.硫酸铜
2.如图为两种物质的溶解度曲线,下列说法正确的是
A.两种物质的溶解度都随温度升高而增大
B.20℃时,Na2Cr2O7饱和溶液的溶质质量分数为80%
C.60℃时,Na2SO4的溶解度大于 Na2Cr2O7的溶解度
D.可以配制溶质质量分数相同的 Na2Cr2O7、Na2SO4溶液
3.常温下,向各盛有100g水的甲、乙两个烧杯中分别加入等质量的M、N两种固体物质,搅拌,充分溶解后,发现只有甲烧杯底部有未溶固体存在。下列说法正确的是
A.所得两溶液质量相等 B.N溶液可能是饱和溶液
C.M、N两种物质都是易溶的 D.升高温度,M物质一定能继续溶解
4.下列说法正确的是
A.H2O和H2O2组成元素相同,化学性质也一定相同
B.溶液中有晶体析出时,溶质质量减小,溶液质量也一定减小
C.置换反应生成单质和化合物,有单质和化合物生成的反应也一定是置换反应
D.20℃,称取5.0gCa(OH)2固体,加入95.0mL蒸馏水充分搅拌,得到5.0%的澄清石灰水
5.如图是“膜分离技术”淡化海水的原理图,分析正确的是
A.海水淡化的过程无需外界提供能量 B.加压后浓海水中只含Na+、Cl-、H2O
C.加压后浓海水中溶质的质量分数增大 D.这种半透膜可用滤纸代替
6.物质的鉴别和除杂是重要的实验技能。下列实验方案正确的是
选项 实验目的 实验方案
A 鉴别N2和CO2 用燃着的木条
B 鉴别NaOH和NH4NO3 加水溶解
C 除去Fe中的Cu 加足量盐酸,过滤
D 除去KNO3中的少量NaCl 加水溶解,蒸发结晶
A.A B.B C.C D.D
7.下列实验操作或原理能达到实验目的的是
选项 实验目的 主要操作或原理
A 测定空气中氧气含量 利用铁丝燃烧消耗氧气来测定
B 区别氢氧化钠和硝酸铵固体 分别取样,加适量水溶解后测温度变化
C 检验二氧化碳中混有的少量氧气 将带火星的木条伸入,观察是否复燃
D 鉴别氮气和二氧化碳 将燃着的木条分别伸入,观察现象
A.A B.B C.C D.D
8.下列关于溶液的说法中正确的是
A.溶液中各部分性质相同 B.无色透明的液体一定是溶液
C.硝酸铵固体溶于水,温度升高 D.溶质只能是固体
9.甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线如图所示,下列说法不正确的是
A.甲、乙物质是易溶物质
B.t1℃时,甲和丙的饱和溶液中所含溶质质量相等
C.将接近饱和的丙溶液变成该温度下的饱和溶液,可采用加入丙物质的方法
D.若将t2℃时三种物质等质量的饱和溶液分别降温到t1℃,则析出晶体质量关系是甲>乙>丙
10.下列有关溶液的说法正确的是
A.溶液是无色透明的液体 B.75%的医用酒精溶液的溶质是酒精
C.均一的、稳定的液体是溶液 D.水是所有物质的溶剂
11.一烧杯中盛有10.6g碳酸钠粉末,向其中逐滴加入稀盐酸,该反应中有关物质质量与加入稀盐酸质量之间的关系如图所示,下列说法错误的是
A.曲线①表示烧杯中碳酸钠的质量变化 B.曲线②表示烧杯中氯化钠的质量变化
C.曲线③表示二氧化碳的质量变化 D.曲线④表示烧杯中水的质量变化
12.室温时,对100mL氯化钠饱和溶液作如下操作,最终甲、乙两烧杯中溶液
A.两杯溶液中存在的微粒都只有钠离子和氯离子
B.甲溶液一定饱和,乙溶液可能饱和
C.甲溶液中氯化钠溶解度不变,乙溶液中氯化钠溶解度降低
D.甲、乙溶液中溶质质量相等
13.下列物质的性质与用途对应关系不正确的是:
A.甲烷具有可燃性——作燃料 B.氮气无色味——食品保护气
C.金刚石硬度大——切割玻璃 D.洗洁精具有乳化作用——清洗油污
14.NaCl和KNO3的溶解度曲线如图所示,下列说法正确的是
A.NaCl的溶解度一定大于KNO3
B.NaCl的溶解度受温度影响的程度比KNO3大
C.40℃时,100gKNO3饱和溶液中含有63.9gKNO3
D.将60℃时210gKNO3饱和溶液降温至20℃,析出KNO3晶体78.4g
15.氨氧化法制硝酸的反应原理可表示如下:NH3+2O2=HNO3+H2O。向反应后所得的溶液中加入一定量的水可制得溶质质量分数为60%的硝酸溶液,将反应后所得的溶液脱水可制得溶质质量分数为90%的硝酸溶液。现以17kg氨气为原料,反应后既不加水也不脱水,理论上可制得60%和90%的硝酸溶液的质量比为
A.5:8 B.8:11 C.11:25 D.11:16
二、填空题
16.新冠肺炎是一种急性感染性肺炎,做好自身防护是防止感染的重要措施。家庭和学校应常备75%的酒精溶液 温度计 84消毒液等。请根据所学化学知识回答下列问题。
(1)75%的酒精溶液中属于溶质的是_______。
(2)水银温度计是常见的温度计,温度升高,水银柱会上升,从微观角度来解释是_______。
(3)“84”消毒液的有效成分为NaClO,所含的阳离子为______(写离子符号)。
(4)“84”消毒液的消毒原理为,生成的HClO(次氯酸)具有较强的杀菌作用。化学方程式中X的化学式为_____。
17.溶液在生产、生活中应用广泛。请回答下列问题。
(1)用洗洁精洗去餐具上的油污,这是利用了洗洁精的______作用。
(2)烧开水时,在煮沸前会看到壶底有气泡冒出,说明气体的溶解度随温度升高而______(选填“增大”或“减小”)。
(3)生理盐水是0.9%的氯化钠溶液生理盐水密封放置一段时间后,______(选填“会”或“不会”)出现浑浊现象,其理由是溶液具有______。
(4)某化学兴趣小组欲配制1000g溶质质量分数为0.9%的生理盐水。需要称量氯化钠固体的质量为______g,需要量取______mL水。氯化钠固体溶解时需要用到玻璃棒,其作用是______。
(5)甲、乙两种固体物质(均不含结晶水)的溶解度曲线如图所示。
①甲、乙的溶解度在______℃时相等。
②t2℃时,将30g的甲物质加入50g水中,充分溶解并恢复至原温度,所得溶液的质量为______g。
③t1℃时,甲的饱和溶液的溶质质量分数为______(只列出表达式)。
④分别将t2℃时等质量的甲、乙的饱和溶液降温至t1℃,析出晶体的质量关系是甲______(选填“大于”、“等于”或“小于”)乙。
18.回答问题:
(1)2021年10月20日亚太绿色低碳反战高峰论坛在中国开幕,主题为“建碳中和愿景,写新增长未来”。中国将力争2030年前二氧化碳排放达到峰值,即“碳达峰”:争取在2060年前实现“碳中和”。我国对全世界宣布“碳中和”目标,彰显了大国的责任和担当。
①目前,人们使用的燃料大多来自化石燃料,化石燃料的大量使用,使大气中二氧化碳的含量持续上升,由此引发的环境问题是______。
②“碳中和”是指人为排放二氧化碳量与通过植树造林和人为碳捕集技术吸收二氧化碳量达到平衡。对于自然界中消耗二氧化碳的主要途径是______(写一条)。
③开发和利用新能源,有利于生态环境保护。氢氧燃料电池已得到广泛应用,在这种电池中,利用氢气作为能源的最大优点是______;写出该反应的化学方程式________。
④西班牙有一条酸河,经调查发现导致河水呈酸性的原因是上游排放的物质R在水中发生反应所导致,该反应的化学方程式是,则R的化学式为______。
(2)我国化学家侯德榜在氨碱法的基础上创立的“侯氏制碱法”,向滤出NaHCO3晶体后的NH4Cl溶液中加入NaCl粉末,析出NH4Cl。NH4Cl和NaCl两种物质的溶解度曲线如图所示。
①t1℃时,NH4Cl的溶解度______NaCl的溶解度。(填“大于”“等于”“小于”之一)
②t2℃时,NH4Cl的溶解度是______g。
③t2℃时,把50gNH4Cl加入100g水中,充分溶解,所得溶液的质量为______,此溶液为______溶液(填“饱和”或“不饱和”之一)
④通过NaCl的溶解度曲线,可判断出海水“晒盐”是用______(填“蒸发结晶”“降温结晶”之一)的方法从海水中得到NaCl。
19.硝酸钾的溶解度曲线如图一所示。
(1)20℃时硝酸钾的溶解度为___________。
(2)a、b、c三点对应的溶液的溶质质量分数大小关系为___________(填字母)。
A.c>a> b B.a=c>b C.a>b>c D.c>a=b
(3)40℃时硝酸钾饱和溶液中溶质的质量___________(填“一定”“一定不”或“不一定”)小于60℃时硝酸钾饱和溶液中溶质的质量。
(4)60℃时,向10g水中加入XgKNO3固体形成溶液,再逐渐降温到20(降温过程中,水分的蒸发忽略不计),析出固体的质量随时间的变化如图二所示。下列说法正确的是___________(填字母)。
A.X的数值为6.39
B.60℃时,溶液为饱和溶液
C.时间为t时,溶液温度为40℃
D.通过降温结晶的方式能从原溶液中回收到XgKNO3固体
(5)如图三所示,向烧杯中的水中加入某物质后,试管内未溶解的硝酸钾能完全溶解,加入的物质可能是___________(填序号)。
①冰块②生石灰③硝酸铵固体④氢氧化钠固体
三、推断题
20.A、B、C、D、E是初中化学中常见的五种物质,它们之间有如下图所示的关系(“→”表示物质间的转化关系,“—”表示相互能反应,部分物质和反应条件已经略去)。A是一种最常用的溶剂,A、B、D含有一种相同的元素,D是磁铁矿的主要成分,E为氧化物。则C的一种用途是______; B转化为D的基本反应类型为______;E与D反应的化学方程式______。
21.图中,甲是相对分子质量为16的有机物,乙是最常见的溶剂,丁是白色难溶固体,其中金属元素的质量分数为40%.甲的化学式 ________ .②的化学方程式为 ________ .丙的一种用途是 ________ .
四、实验题
22.实验室选用下列仪器,配制80g溶质质量分数为6%的氯化钠溶液。
(1)进行该实验的完整步骤为:___________、称取氯化钠、量取水、___________和转移。
(2)实验时,还缺少的一种仪器是___________,上图中用不到的一种仪器是___________;
(3)若所配氯化钠溶液的浓度偏大,可能的原因是___________(任答一条)。
(4)在常温下的氯化钠溶液中,浓度最大的阳离子是___________(写离子符号)。
23.根据图示实验回答下列问题。
(1)图1是测定空气中氧气含量的实验,写出红磷燃烧的化学方程式:_____,实验得出的结论是_____。
(2)图2是某同学配制一定溶质质量分数的氯化钠溶液的部分实验操作。甲图中玻璃棒的作用是_____,乙图是量取水的操作,若其它操作均正确,则所配制的氯化钠溶液的质量分数_____(填“偏大”“偏小”或“不变”)。
(3)图3是比较等质量的二氧化锰和氧化铁对过氧化氢溶液分解催化效率的实验,试剂X应该是_____。
五、计算题
24.化学兴趣小组为测定某大理石样品中碳酸钙的质量分数,向3g大理石样品(杂质不溶于水,也不与盐酸反应)分四次加入一定溶质质量分数的稀盐酸20克,每次充分反应后,经过滤、干燥等操作后称量,剩余固体质量变化如图所示。
稀盐酸的用量 剩余固体的质量
第一次加入5g 2g
第二次加入5g 1.0g
第三次加入5g 0.6g
第四次加入5g 0.6g
请计算:
(1)该大理石样品中杂质的质量为______g。
(2)计算所用稀盐酸的溶质质量分数。(写出计算过程)
25.“黄铜”是铜锌合金,具有较机械性能,比纯铜耐腐蚀。现将20g黄铜投入100g稀硫酸中,恰好完全反应,剩余的溶液和残余固体总质量为119.8g。
已知:Zn+H2 SO4=ZnSO4+ H2↑。
请计算:
(1)产生氢气的质量为________g。
(2)这种黄铜中锌的质量为多少?
(3)所用稀硫酸的溶质质量分数是多少?
参考答案:
1.C 2.D 3.B 4.B 5.C 6.B 7.B 8.A 9.B 10.B 11.D 12.D 13.B 14.D 15.D 16.(1)酒精
(2)温度升高,汞原子间间隔变大
(3)Na+
(4)Na2CO3
17.(1)乳化
(2)减小
(3) 不会 均一性、稳定性
(4) 9 991 加速溶解
(5) t1 75 大于
18.(1) 温室效应增强 绿色植物的光合作用 燃烧产物为水,不污染环境 FeS2
(2) 等于 48 148g 饱和 蒸发结晶
19.(1)31.6g
(2)D
(3)不一定
(4)AC
(5)②④
20. 高能燃料 化合反应
21. CH4 CO2+Ca(OH)2=CaCO3↓+H2O 灭火
22.(1) 计算 溶解
(2) 量筒 漏斗
(3)使用量筒读数时,俯视读数
(4)Na+
23.(1) 氧气约占空气体积的五分之一
(2) 搅拌,加快氯化钠的溶解 偏小
(3)10g5%H2O2溶液
24.(1)0.6
(2)解:设与1g碳酸钙反应需要HCl的质量为x
x=0.73g
1g碳酸钙与5g稀盐酸恰好完全反应,则该盐酸中溶质的质量分数为:
答:原稀盐酸中溶质的质量分数为14.6%。
25.(1)0.2
(2)解:设参加反应的锌的质量为x,稀硫酸中溶质的质量为y
解得:
为答:黄铜中锌的质量为6.5g。
(3)所用稀硫酸的溶质质量分数:
答:所用稀硫酸的溶质质量分数是9.8%。
同课章节目录
