专题8金属和金属材料练习题—2021-2022学年九年级化学仁爱版下册(word版有答案)
文档属性
| 名称 | 专题8金属和金属材料练习题—2021-2022学年九年级化学仁爱版下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 149.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 仁爱科普版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-09 10:31:15 | ||
图片预览

文档简介
专题8《金属和金属材料》练习题
一、单选题
1.制造汽车各部件的材料中,不属于金属材料的是
A.钢铁外壳 B.铝合金轮廓
C.电路中的铜导线 D.玻璃车窗
2.人类利用自然界的物质制取所需物质的下列变化中,属于物理变化的是
A.铁矿石炼铁 B.石灰石制生石灰 C.泥土烧制陶瓷 D.海水晒盐
3.下列有关金属材料的说法正确的是
A.钢的性能优良,是很纯的铁 B.铝片表面易生成致密的氧化膜
C.金属单质在常温下都是固体 D.合金中一定不含非金属元素
4.下列物质的性质和用途对应关系不正确的是
A.二氧化碳能与水反应,可用于人工降雨 B.铁具有导热性,可用于制作炊具
C.木炭具有可燃性,可作为燃料 D.氧气可以供给呼吸,可用于医疗急救
5.将质量为4克的铁片放入200克质量分数为20%的硫酸铜溶液中,片刻后取出附有铜的铁片,洗涤烘干后称得质量为4.4克,这表明反应中
A.有4克铁参加了反应 B.有40克硫酸铜参加了反应
C.析出了3.2克铜 D.生成38g硫酸亚铁
6.常温下,往盛有一定质量稀H2SO4的烧杯中加入过量锌粒,测得烧杯内溶液温度随时间变化的关系如图。下列分析正确的是
A.Zn与稀H2SO4反应先放热后吸热
B.往y点对应的溶液中加入铁粉,有气泡产生
C.x、y点对应的溶液中,参加反应的Zn与H2SO4质量比相等
D.x、z点对应的溶液中ZnSO4质量相等
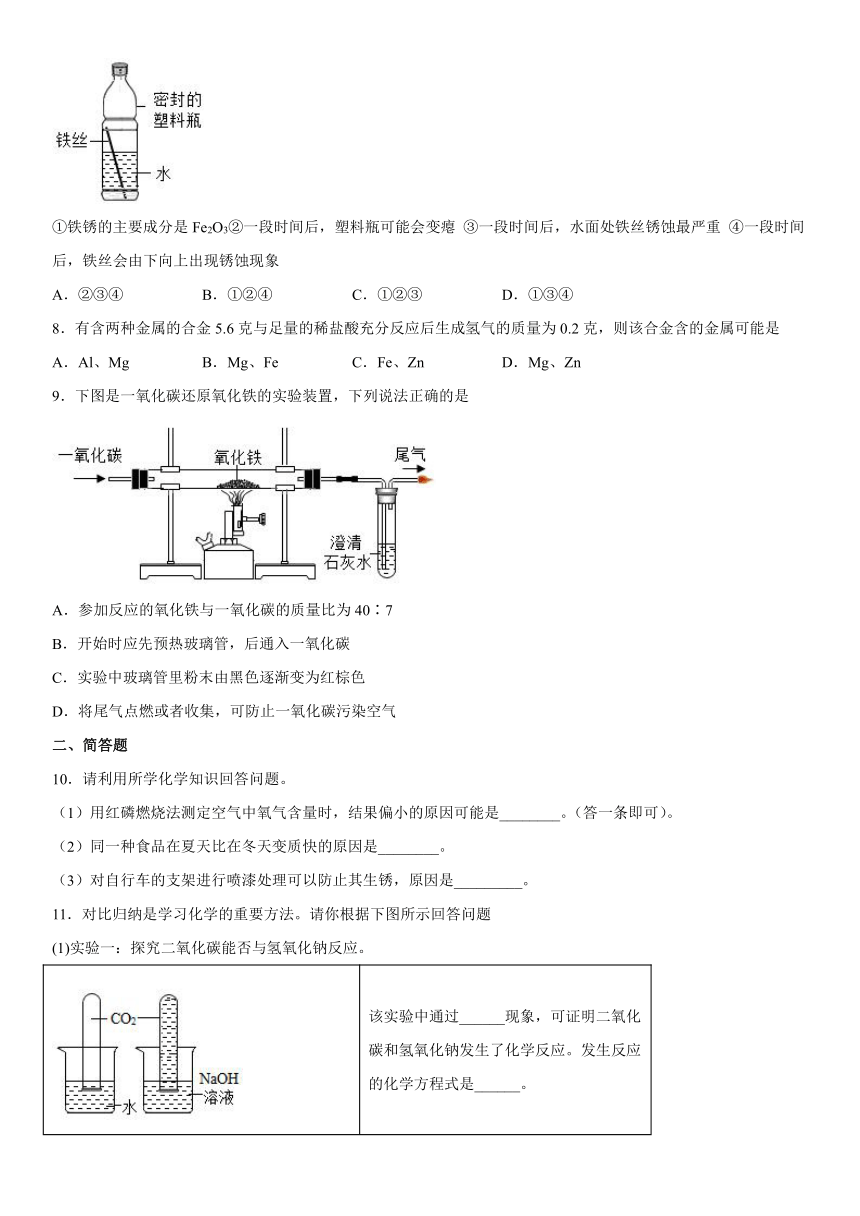
7.如图所示是某化学小组设计的铁制品锈蚀的实验装置。下列相关叙述中正确的是
①铁锈的主要成分是Fe2O3②一段时间后,塑料瓶可能会变瘪 ③一段时间后,水面处铁丝锈蚀最严重 ④一段时间后,铁丝会由下向上出现锈蚀现象
A.②③④ B.①②④ C.①②③ D.①③④
8.有含两种金属的合金5.6克与足量的稀盐酸充分反应后生成氢气的质量为0.2克,则该合金含的金属可能是
A.Al、Mg B.Mg、Fe C.Fe、Zn D.Mg、Zn
9.下图是一氧化碳还原氧化铁的实验装置,下列说法正确的是
A.参加反应的氧化铁与一氧化碳的质量比为40∶7
B.开始时应先预热玻璃管,后通入一氧化碳
C.实验中玻璃管里粉末由黑色逐渐变为红棕色
D.将尾气点燃或者收集,可防止一氧化碳污染空气
二、简答题
10.请利用所学化学知识回答问题。
(1)用红磷燃烧法测定空气中氧气含量时,结果偏小的原因可能是________。(答一条即可)。
(2)同一种食品在夏天比在冬天变质快的原因是________。
(3)对自行车的支架进行喷漆处理可以防止其生锈,原因是_________。
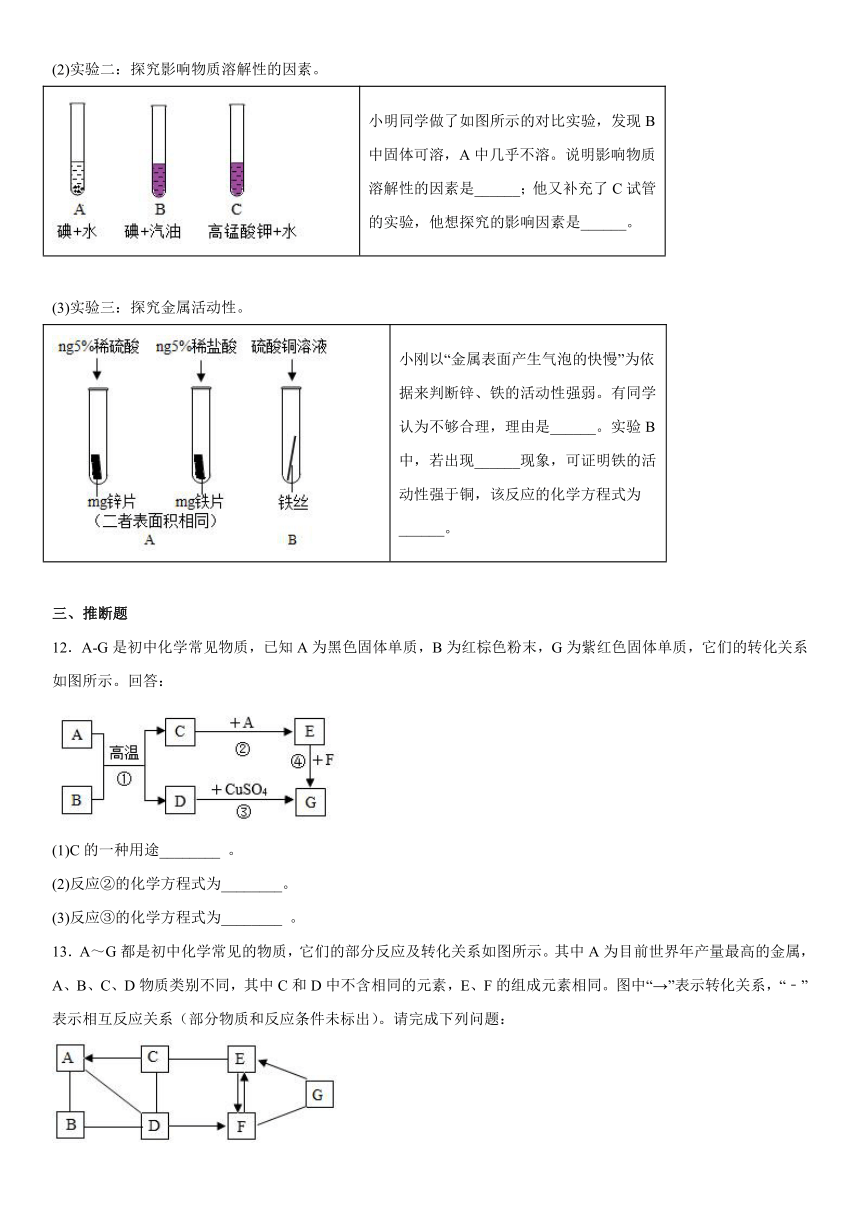
11.对比归纳是学习化学的重要方法。请你根据下图所示回答问题
(1)实验一:探究二氧化碳能否与氢氧化钠反应。
该实验中通过______现象,可证明二氧化碳和氢氧化钠发生了化学反应。发生反应的化学方程式是______。
(2)实验二:探究影响物质溶解性的因素。
小明同学做了如图所示的对比实验,发现B中固体可溶,A中几乎不溶。说明影响物质溶解性的因素是______;他又补充了C试管的实验,他想探究的影响因素是______。
(3)实验三:探究金属活动性。
小刚以“金属表面产生气泡的快慢”为依据来判断锌、铁的活动性强弱。有同学认为不够合理,理由是______。实验B中,若出现______现象,可证明铁的活动性强于铜,该反应的化学方程式为______。
三、推断题
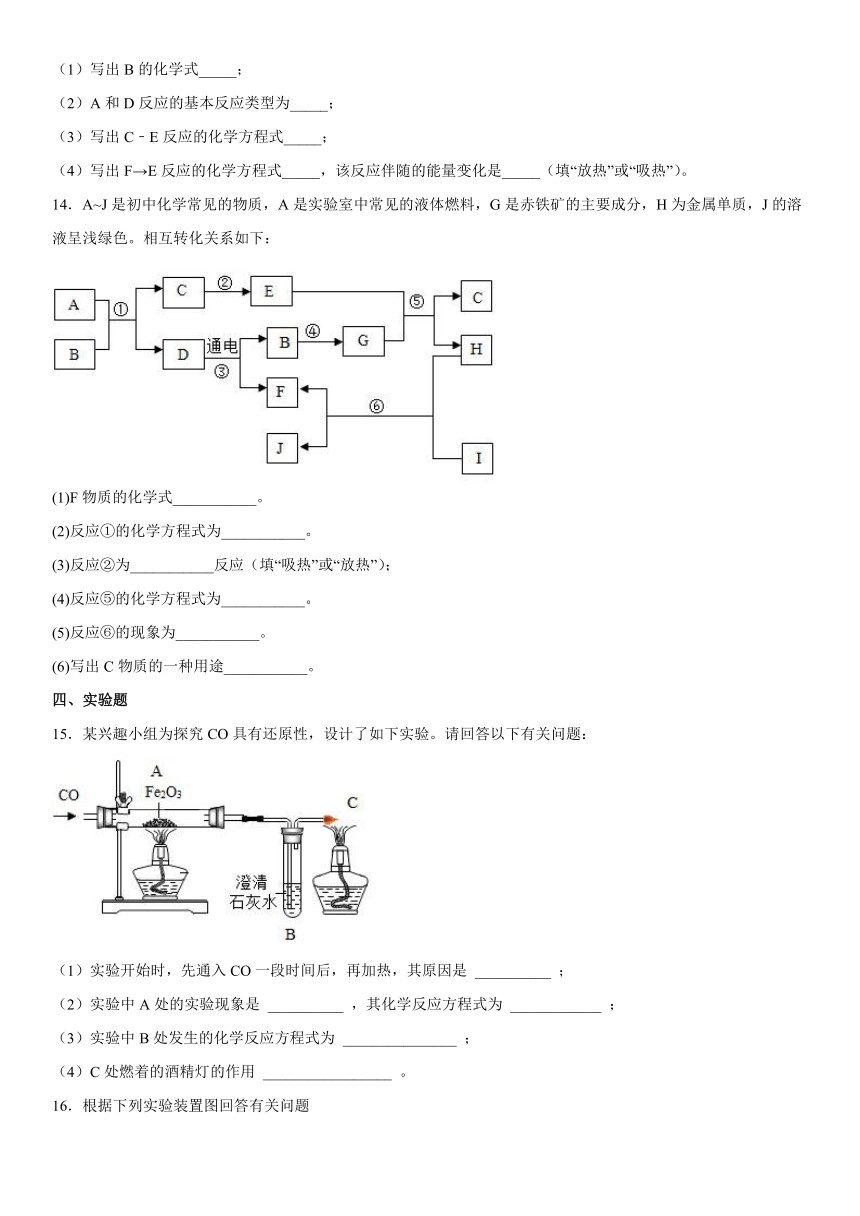
12.A-G是初中化学常见物质,已知A为黑色固体单质,B为红棕色粉末,G为紫红色固体单质,它们的转化关系如图所示。回答:
(1)C的一种用途________ 。
(2)反应②的化学方程式为________。
(3)反应③的化学方程式为________ 。
13.A~G都是初中化学常见的物质,它们的部分反应及转化关系如图所示。其中A为目前世界年产量最高的金属,A、B、C、D物质类别不同,其中C和D中不含相同的元素,E、F的组成元素相同。图中“→”表示转化关系,“﹣”表示相互反应关系(部分物质和反应条件未标出)。请完成下列问题:
(1)写出B的化学式_____;
(2)A和D反应的基本反应类型为_____;
(3)写出C﹣E反应的化学方程式_____;
(4)写出F→E反应的化学方程式_____,该反应伴随的能量变化是_____(填“放热”或“吸热”)。
14.A~J是初中化学常见的物质,A是实验室中常见的液体燃料,G是赤铁矿的主要成分,H为金属单质,J的溶液呈浅绿色。相互转化关系如下:
(1)F物质的化学式___________。
(2)反应①的化学方程式为___________。
(3)反应②为___________反应(填“吸热”或“放热”);
(4)反应⑤的化学方程式为___________。
(5)反应⑥的现象为___________。
(6)写出C物质的一种用途___________。
四、实验题
15.某兴趣小组为探究CO具有还原性,设计了如下实验。请回答以下有关问题:
(1)实验开始时,先通入CO一段时间后,再加热,其原因是 __________ ;
(2)实验中A处的实验现象是 __________ ,其化学反应方程式为 ____________ ;
(3)实验中B处发生的化学反应方程式为 _______________ ;
(4)C处燃着的酒精灯的作用 _________________ 。
16.根据下列实验装置图回答有关问题
(1)图中仪器a名称是______。
(2)图A是实验室用高锰酸钾制取氧气的装置,该反应化学方程式为______。试管口略向下斜的原因是:______
(3)图B装置中,热水的作用是______,铜片上红磷不能燃烧的原因是______。
(4)图C中玻璃棒搅拌的目的是______,当______时,停止加热。
(5)图D的实验目的是______,充分反应后,银片和锌片均有剩余,将两支试管内的物质倒入同一个洁净的烧杯中,充分反应后,溶液中一定含有的溶质是______。
17.某同学发现自己眼镜框中铜制部位表面有绿色的铜锈,他联想到探究铁生锈条件的实验,决定探究铜生锈的原因。查阅资料可知铜锈的主要成分是Cu2(OH)2CO3,俗称铜绿。
(1)提出猜想:铜生锈是铜与空气中的氧气、水和二氧化碳共同作用的结果,理由是______。
他设计并进行了如下四个实验(实验中用到的蒸馏水均已煮沸过,铜片已打磨干净)。
实验编号 ① ② ③ ④
实验装置
实验现象 铜片不生锈 铜片不生锈 铜片不生锈 铜片生锈
(2)根据实验①④所得的结论是______。
(3)能够证明铜生锈需要CO2参加反应的是______(填实验编号)。
(4)写出一条防止铁或铜制品生锈的具体方法______。
五、计算题
18.小鸿设计如下实验,探究粗锌粒中锌的质量分数(粗锌所含的杂质不跟稀硫酸反应)。
计算:(写出计算过程)
(1)粗锌中锌的质量分数。(精确到0.1%)
(2)100g稀硫酸中硫酸的质量。
19.我国第一艘国产航母的许多电子元件使用了黄铜(假设合金中仅含铜,锌),兴趣小组同学向盛有30g黄铜样品的烧杯中逐渐加入稀硫酸,生成氢的质量与加入稀硫酸的质量关系如图所示,计算:
(1)充分反应后生成氢气的质量为___________g。
(2)硫酸溶液中溶质的质量分数。
20.废旧金属的回收利用既能保护环境,又能节约资源和能源。某冶金厂回收了一批废黄铜屑,需测定其中铜元素的质量分数。现称取150.0g样品,加入足量稀硫酸,充分反应后得无色溶液,产生氢气的质量及剩余固体的质量与消耗稀硫酸的质量关系分别如图所示。(设该批次黄铜屑只含铜、锌和少量黄铜锈。黄铜锈与稀硫酸反应生成CuSO4、ZnSO4、CO2和H2O),请回答下列问题:
(1)完全反应时,样品消耗稀硫酸的质量为______g;
(2)样品中铜元素的质量分数为______%(计算结果精确到0.1%,下同);
(3)计算稀硫酸中溶质的质量分数(写出计算过程)。
试卷第1页,共3页
参考答案:
1.D
2.D
3.B
4.A
5.C
6.C
7.C
8.D
9.D
10. 红磷的量不足或装置漏气或未冷却至室温就打开止水夹 温度越高,化学反应速率越快 隔绝氧气和水
11.(1) 右边试管内液面明显高于左边试管内液面
(2) 溶剂的性质 溶质的性质
(3) 没控制相同的条件,选取酸的种类不同 铁丝的表面有红色物质生成,溶液由蓝色逐渐变为浅绿色
12.(1)灭火(不唯一)
(2)CO2+C2CO
(3)Fe+CuSO4=Cu+FeSO4
13. AgNO3 置换反应 3CO+Fe2O3 2Fe+3CO2 2CO+O22CO2 放热
14.(1)H2
(2)
(3)吸热
(4)
(5)有气泡生成,溶液由无色变为浅绿色
(6)灭火(合理均可)
15. 排出装置中的空气,防止爆炸(意思正确可给分) 红色固体变黑色 Fe2O3+3CO 2Fe+3CO2 Ca(OH)2+CO2=CaCO3↓+H2O 防止污染空气(其他合理答案也给分)
16.(1)铁架台
(2) 防止冷凝水倒流炸裂试管
(3) 为铜片上白磷、红磷提供热量、使水中白磷隔绝氧气 温度没有达到红磷着火点
(4) 使液体受热均匀 出现较多晶体
(5) 比较锌、铜、银的金属活动性顺序 硫酸锌
17.(1)根据质量守恒定律,化学变化前后元素的种类不变,铜锈中含有 Cu、C、O和H元素,可能来自空气中 O2、CO2、H2O
(2)铜生锈需要水
(3)③④
(4)保持金属制品表面干燥(其他合理答案也可得分)
18.(1)解:设粗锌中锌的质量为x,100g稀硫酸中硫酸的质量为y
解得x=6.5g,y=9.8g
所以粗锌中锌的质量分数
答:粗锌中锌的质量分数为65%。
(2)答:100g稀硫酸中硫酸的质量为9.8g。
19.(1)0.2
(2)解:设硫酸溶液中溶质的质量分数为x
x=9.8%
答:硫酸溶液中溶质的质量分数9.8%
20.(1)267.0
(2)60.0%
(3)解:设稀硫酸中溶质的质量分数为x
x=30.0%
答:稀硫酸中溶质的质量分数为30.0%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.制造汽车各部件的材料中,不属于金属材料的是
A.钢铁外壳 B.铝合金轮廓
C.电路中的铜导线 D.玻璃车窗
2.人类利用自然界的物质制取所需物质的下列变化中,属于物理变化的是
A.铁矿石炼铁 B.石灰石制生石灰 C.泥土烧制陶瓷 D.海水晒盐
3.下列有关金属材料的说法正确的是
A.钢的性能优良,是很纯的铁 B.铝片表面易生成致密的氧化膜
C.金属单质在常温下都是固体 D.合金中一定不含非金属元素
4.下列物质的性质和用途对应关系不正确的是
A.二氧化碳能与水反应,可用于人工降雨 B.铁具有导热性,可用于制作炊具
C.木炭具有可燃性,可作为燃料 D.氧气可以供给呼吸,可用于医疗急救
5.将质量为4克的铁片放入200克质量分数为20%的硫酸铜溶液中,片刻后取出附有铜的铁片,洗涤烘干后称得质量为4.4克,这表明反应中
A.有4克铁参加了反应 B.有40克硫酸铜参加了反应
C.析出了3.2克铜 D.生成38g硫酸亚铁
6.常温下,往盛有一定质量稀H2SO4的烧杯中加入过量锌粒,测得烧杯内溶液温度随时间变化的关系如图。下列分析正确的是
A.Zn与稀H2SO4反应先放热后吸热
B.往y点对应的溶液中加入铁粉,有气泡产生
C.x、y点对应的溶液中,参加反应的Zn与H2SO4质量比相等
D.x、z点对应的溶液中ZnSO4质量相等
7.如图所示是某化学小组设计的铁制品锈蚀的实验装置。下列相关叙述中正确的是
①铁锈的主要成分是Fe2O3②一段时间后,塑料瓶可能会变瘪 ③一段时间后,水面处铁丝锈蚀最严重 ④一段时间后,铁丝会由下向上出现锈蚀现象
A.②③④ B.①②④ C.①②③ D.①③④
8.有含两种金属的合金5.6克与足量的稀盐酸充分反应后生成氢气的质量为0.2克,则该合金含的金属可能是
A.Al、Mg B.Mg、Fe C.Fe、Zn D.Mg、Zn
9.下图是一氧化碳还原氧化铁的实验装置,下列说法正确的是
A.参加反应的氧化铁与一氧化碳的质量比为40∶7
B.开始时应先预热玻璃管,后通入一氧化碳
C.实验中玻璃管里粉末由黑色逐渐变为红棕色
D.将尾气点燃或者收集,可防止一氧化碳污染空气
二、简答题
10.请利用所学化学知识回答问题。
(1)用红磷燃烧法测定空气中氧气含量时,结果偏小的原因可能是________。(答一条即可)。
(2)同一种食品在夏天比在冬天变质快的原因是________。
(3)对自行车的支架进行喷漆处理可以防止其生锈,原因是_________。
11.对比归纳是学习化学的重要方法。请你根据下图所示回答问题
(1)实验一:探究二氧化碳能否与氢氧化钠反应。
该实验中通过______现象,可证明二氧化碳和氢氧化钠发生了化学反应。发生反应的化学方程式是______。
(2)实验二:探究影响物质溶解性的因素。
小明同学做了如图所示的对比实验,发现B中固体可溶,A中几乎不溶。说明影响物质溶解性的因素是______;他又补充了C试管的实验,他想探究的影响因素是______。
(3)实验三:探究金属活动性。
小刚以“金属表面产生气泡的快慢”为依据来判断锌、铁的活动性强弱。有同学认为不够合理,理由是______。实验B中,若出现______现象,可证明铁的活动性强于铜,该反应的化学方程式为______。
三、推断题
12.A-G是初中化学常见物质,已知A为黑色固体单质,B为红棕色粉末,G为紫红色固体单质,它们的转化关系如图所示。回答:
(1)C的一种用途________ 。
(2)反应②的化学方程式为________。
(3)反应③的化学方程式为________ 。
13.A~G都是初中化学常见的物质,它们的部分反应及转化关系如图所示。其中A为目前世界年产量最高的金属,A、B、C、D物质类别不同,其中C和D中不含相同的元素,E、F的组成元素相同。图中“→”表示转化关系,“﹣”表示相互反应关系(部分物质和反应条件未标出)。请完成下列问题:
(1)写出B的化学式_____;
(2)A和D反应的基本反应类型为_____;
(3)写出C﹣E反应的化学方程式_____;
(4)写出F→E反应的化学方程式_____,该反应伴随的能量变化是_____(填“放热”或“吸热”)。
14.A~J是初中化学常见的物质,A是实验室中常见的液体燃料,G是赤铁矿的主要成分,H为金属单质,J的溶液呈浅绿色。相互转化关系如下:
(1)F物质的化学式___________。
(2)反应①的化学方程式为___________。
(3)反应②为___________反应(填“吸热”或“放热”);
(4)反应⑤的化学方程式为___________。
(5)反应⑥的现象为___________。
(6)写出C物质的一种用途___________。
四、实验题
15.某兴趣小组为探究CO具有还原性,设计了如下实验。请回答以下有关问题:
(1)实验开始时,先通入CO一段时间后,再加热,其原因是 __________ ;
(2)实验中A处的实验现象是 __________ ,其化学反应方程式为 ____________ ;
(3)实验中B处发生的化学反应方程式为 _______________ ;
(4)C处燃着的酒精灯的作用 _________________ 。
16.根据下列实验装置图回答有关问题
(1)图中仪器a名称是______。
(2)图A是实验室用高锰酸钾制取氧气的装置,该反应化学方程式为______。试管口略向下斜的原因是:______
(3)图B装置中,热水的作用是______,铜片上红磷不能燃烧的原因是______。
(4)图C中玻璃棒搅拌的目的是______,当______时,停止加热。
(5)图D的实验目的是______,充分反应后,银片和锌片均有剩余,将两支试管内的物质倒入同一个洁净的烧杯中,充分反应后,溶液中一定含有的溶质是______。
17.某同学发现自己眼镜框中铜制部位表面有绿色的铜锈,他联想到探究铁生锈条件的实验,决定探究铜生锈的原因。查阅资料可知铜锈的主要成分是Cu2(OH)2CO3,俗称铜绿。
(1)提出猜想:铜生锈是铜与空气中的氧气、水和二氧化碳共同作用的结果,理由是______。
他设计并进行了如下四个实验(实验中用到的蒸馏水均已煮沸过,铜片已打磨干净)。
实验编号 ① ② ③ ④
实验装置
实验现象 铜片不生锈 铜片不生锈 铜片不生锈 铜片生锈
(2)根据实验①④所得的结论是______。
(3)能够证明铜生锈需要CO2参加反应的是______(填实验编号)。
(4)写出一条防止铁或铜制品生锈的具体方法______。
五、计算题
18.小鸿设计如下实验,探究粗锌粒中锌的质量分数(粗锌所含的杂质不跟稀硫酸反应)。
计算:(写出计算过程)
(1)粗锌中锌的质量分数。(精确到0.1%)
(2)100g稀硫酸中硫酸的质量。
19.我国第一艘国产航母的许多电子元件使用了黄铜(假设合金中仅含铜,锌),兴趣小组同学向盛有30g黄铜样品的烧杯中逐渐加入稀硫酸,生成氢的质量与加入稀硫酸的质量关系如图所示,计算:
(1)充分反应后生成氢气的质量为___________g。
(2)硫酸溶液中溶质的质量分数。
20.废旧金属的回收利用既能保护环境,又能节约资源和能源。某冶金厂回收了一批废黄铜屑,需测定其中铜元素的质量分数。现称取150.0g样品,加入足量稀硫酸,充分反应后得无色溶液,产生氢气的质量及剩余固体的质量与消耗稀硫酸的质量关系分别如图所示。(设该批次黄铜屑只含铜、锌和少量黄铜锈。黄铜锈与稀硫酸反应生成CuSO4、ZnSO4、CO2和H2O),请回答下列问题:
(1)完全反应时,样品消耗稀硫酸的质量为______g;
(2)样品中铜元素的质量分数为______%(计算结果精确到0.1%,下同);
(3)计算稀硫酸中溶质的质量分数(写出计算过程)。
试卷第1页,共3页
参考答案:
1.D
2.D
3.B
4.A
5.C
6.C
7.C
8.D
9.D
10. 红磷的量不足或装置漏气或未冷却至室温就打开止水夹 温度越高,化学反应速率越快 隔绝氧气和水
11.(1) 右边试管内液面明显高于左边试管内液面
(2) 溶剂的性质 溶质的性质
(3) 没控制相同的条件,选取酸的种类不同 铁丝的表面有红色物质生成,溶液由蓝色逐渐变为浅绿色
12.(1)灭火(不唯一)
(2)CO2+C2CO
(3)Fe+CuSO4=Cu+FeSO4
13. AgNO3 置换反应 3CO+Fe2O3 2Fe+3CO2 2CO+O22CO2 放热
14.(1)H2
(2)
(3)吸热
(4)
(5)有气泡生成,溶液由无色变为浅绿色
(6)灭火(合理均可)
15. 排出装置中的空气,防止爆炸(意思正确可给分) 红色固体变黑色 Fe2O3+3CO 2Fe+3CO2 Ca(OH)2+CO2=CaCO3↓+H2O 防止污染空气(其他合理答案也给分)
16.(1)铁架台
(2) 防止冷凝水倒流炸裂试管
(3) 为铜片上白磷、红磷提供热量、使水中白磷隔绝氧气 温度没有达到红磷着火点
(4) 使液体受热均匀 出现较多晶体
(5) 比较锌、铜、银的金属活动性顺序 硫酸锌
17.(1)根据质量守恒定律,化学变化前后元素的种类不变,铜锈中含有 Cu、C、O和H元素,可能来自空气中 O2、CO2、H2O
(2)铜生锈需要水
(3)③④
(4)保持金属制品表面干燥(其他合理答案也可得分)
18.(1)解:设粗锌中锌的质量为x,100g稀硫酸中硫酸的质量为y
解得x=6.5g,y=9.8g
所以粗锌中锌的质量分数
答:粗锌中锌的质量分数为65%。
(2)答:100g稀硫酸中硫酸的质量为9.8g。
19.(1)0.2
(2)解:设硫酸溶液中溶质的质量分数为x
x=9.8%
答:硫酸溶液中溶质的质量分数9.8%
20.(1)267.0
(2)60.0%
(3)解:设稀硫酸中溶质的质量分数为x
x=30.0%
答:稀硫酸中溶质的质量分数为30.0%
答案第1页,共2页
答案第1页,共2页
