专题8金属和金属材料章末复习-2021-2022学年九年级化学仁爱版下册(word版有答案)
文档属性
| 名称 | 专题8金属和金属材料章末复习-2021-2022学年九年级化学仁爱版下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 268.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 仁爱科普版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-09 10:38:25 | ||
图片预览


文档简介
专题8 金属和金属材料 章末复习
一、单选题
1.实验室中的试剂常因与空气中的一些成分作用而发生变化。对下列试剂在空气中发生变化的分析错误的是
A.铁粉生锈与空气中的水蒸气和氧气有关
B.氢氧化钠溶液变质与空气中的二氧化碳有关
C.氧化钙的变质与空气中的水和二氧化碳有关
D.浓盐酸变稀与空气中的水蒸气有关
2.除去物质中的少量杂质,下列实验方法不能达到目的的是
选项 物质(杂质) 实验方法
A KCl(KClO3) 加热至无气体产生
B Ag 粉(Zn 粉) 加入过量的稀盐酸
C CO2(CO) 通过足量灼热的氧化铜
D 铜粉(碳粉) 在空气中充分灼烧
A.A B.B C.C D.D
3.根据你的经验,下列关于实验现象的描述,科学准确的是
A.镁条在空气中燃烧,发出微弱的蓝紫色火焰
B.蜡烛燃烧产生二氧化碳和水
C.将锌粒加入稀盐酸中,锌粒表面有气泡生成
D.将一根小木条迅速平放入酒精灯火焰中1s后取出,焰心处最黑
4.现有一块合金,其质量为35g,使它与足量的稀硫酸完全反应后生成氢气2g,则此合金的组成可能为
A.和 B.和 C.和 D.和
5.已知12.4克Fe2O3和CuO的混合物与CO充分反应后,固体减少3.1克,则原混合物中Fe2O3和CuO的质量比是
A.3:2 B.3:1 C.2:1 D.1:1
6.下列物质的性质和用途对应关系不正确的是
A.二氧化碳能与水反应,可用于人工降雨 B.铁具有导热性,可用于制作炊具
C.木炭具有可燃性,可作为燃料 D.氧气可以供给呼吸,可用于医疗急救
7.某金属加工厂生产过程中的废液含有少量的硝酸铜和硝酸锌,为回收利用资源和防止污染,该厂向废液中加入一定量的铁粉,反应停止后过滤,向滤渣中加入少量的稀盐酸,无明显现象,则下列有关说法不正确的是
A.滤出的固体中一定含有铜,一定没有铁和锌
B.滤出的固体质量大于原铁粉的质量
C.滤液一定是无色溶液
D.滤液中一定含有硝酸亚铁和硝酸锌,可能含有硝酸铜
8.木炭还原氧化铜和一氧化碳还原氧化铜的实验装置如图所示:
下列说法不正确的是
A.两个实验中,木炭、一氧化碳都发生了氧化反应
B.两个实验的相关反应中,只有碳元素的化合价发生了改变
C.两个实验中氧化铜都转变成红色固体
D.点燃尾气是为了防止未反应的CO污染空气
二、简答题
9.坚持人与自然和谐共生,坚持节约资源。请回答下列问题:
(1)水是生命之源,爱护水资源,一方面要防治水体污染,另一方面要节约用水。请写出一条生活中节约用水的具体措施。
(2)回收利用废旧金属有什么意义?(答一点即可)
(3)在汽油中加入适量的乙醇作为汽车燃料(车用乙醇汽油),请写出使用乙醇汽油的一条优点。
10.将未经砂纸打磨的铝条放入盛有足量稀盐酸的密闭容器中,用传感器测得反应过程中压强、温度随时间变化的图像如下图所示。
(1)0~50s压强几乎不变的原因是什么?______。
(2)写出50~100s发生反应的化学方程式______。
(3)100s后压强逐渐减小的原因是什么?______。
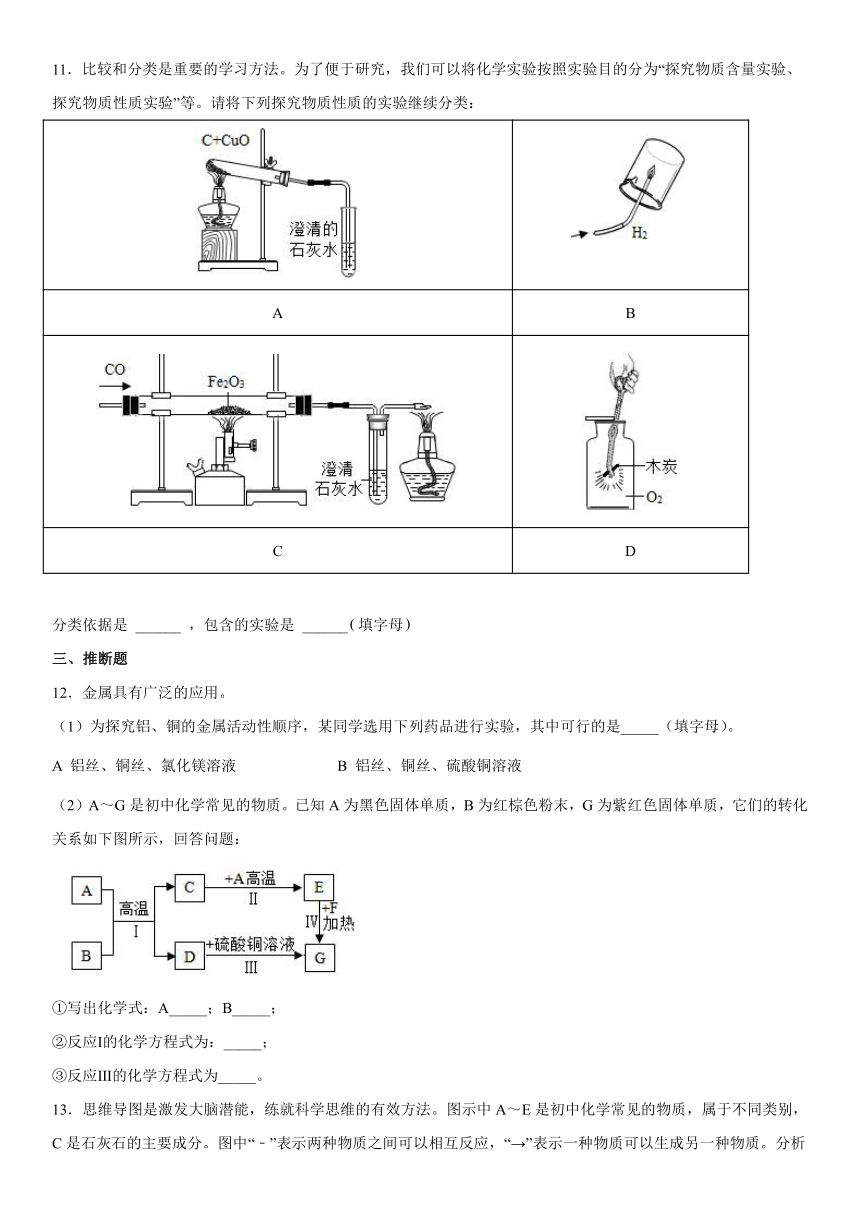
11.比较和分类是重要的学习方法。为了便于研究,我们可以将化学实验按照实验目的分为“探究物质含量实验、探究物质性质实验”等。请将下列探究物质性质的实验继续分类:
A B
C D
分类依据是 ______ ,包含的实验是 ______填字母
三、推断题
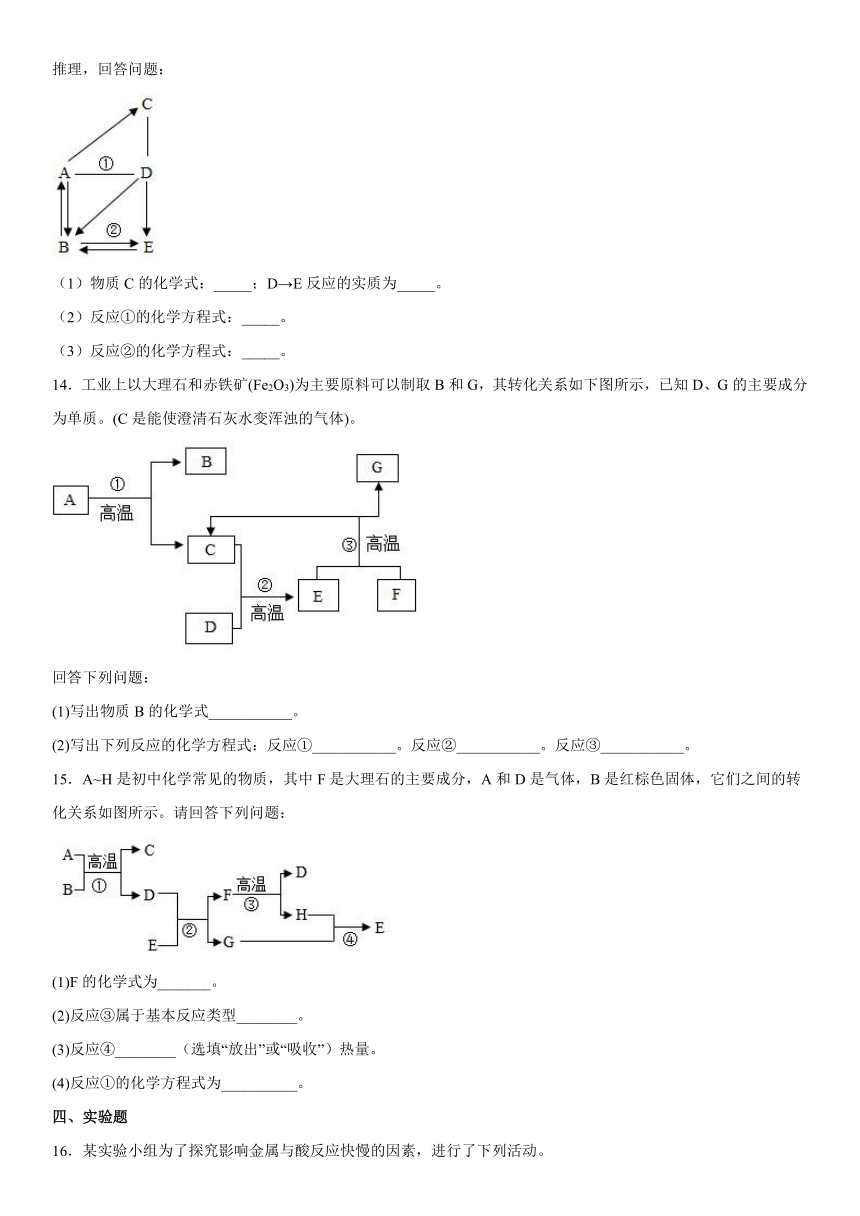
12.金属具有广泛的应用。
(1)为探究铝、铜的金属活动性顺序,某同学选用下列药品进行实验,其中可行的是_____(填字母)。
A 铝丝、铜丝、氯化镁溶液 B 铝丝、铜丝、硫酸铜溶液
(2)A~G是初中化学常见的物质。已知A为黑色固体单质,B为红棕色粉末,G为紫红色固体单质,它们的转化关系如下图所示,回答问题:
①写出化学式:A_____;B_____;
②反应Ⅰ的化学方程式为:_____;
③反应Ⅲ的化学方程式为_____。
13.思维导图是激发大脑潜能,练就科学思维的有效方法。图示中A~E是初中化学常见的物质,属于不同类别,C是石灰石的主要成分。图中“﹣”表示两种物质之间可以相互反应,“→”表示一种物质可以生成另一种物质。分析推理,回答问题:
(1)物质C的化学式:_____;D→E反应的实质为_____。
(2)反应①的化学方程式:_____。
(3)反应②的化学方程式:_____。
14.工业上以大理石和赤铁矿(Fe2O3)为主要原料可以制取B和G,其转化关系如下图所示,已知D、G的主要成分为单质。(C是能使澄清石灰水变浑浊的气体)。
回答下列问题:
(1)写出物质B的化学式___________。
(2)写出下列反应的化学方程式:反应①___________。反应②___________。反应③___________。
15.A~H是初中化学常见的物质,其中F是大理石的主要成分,A和D是气体,B是红棕色固体,它们之间的转化关系如图所示。请回答下列问题:
(1)F的化学式为_______。
(2)反应③属于基本反应类型________。
(3)反应④________(选填“放出”或“吸收”)热量。
(4)反应①的化学方程式为__________。
四、实验题
16.某实验小组为了探究影响金属与酸反应快慢的因素,进行了下列活动。
实验序号 实验过程 实验现象
1 镁粉和铁粉分别与5%盐酸反应 镁粉产生气体快
2 铁粉和铁片分别与15%盐酸反应 铁粉产生气体快
3 铁片分别与5%盐酸和15%盐酸反应 15%盐酸产生气体快
根据以上三个实验现象可得出的结论是:____________;_____________;____________。
17.以下为实验室探究铁生锈条件的实验
(1)试管1中观察到的现象是什么?
(2)试管2中的植物油的作用是什么?
(3)此实验得到的结论是什么?
18.某校化学兴趣小组的同学欲用含少量二氧化碳的一氧化碳气体测定赤铁矿石中氧化铁的含量(假设赤铁矿中的杂质不参加下列任何一项反应),实验所需装置如下图所示:
(1)赤铁矿石______(填“是”或“不是”)合金,写出C中反应的化学方程式:______,其中混合气体应在酒精喷灯点燃之______(填“前”或“后”)通入。
(2)所选仪器的连接顺序为:混合气体→A1→D→C→A2→B。
①若通过测量反应前后仪器A2的质量变化,计算赤铁矿石中氧化铁的含量。装置A1试剂足量的澄清石灰水,如果不连接仪器A1,则这样计算出的氧化铁含量与实际值比较将______(选填“偏小”“偏大”或“基本一致”)。
②实验结束后,若测得仪器A1中增加的质量与仪器C中固体减少的质量相等,那么仪器A1与仪器A2中增加质量的最简整数比为______。(A1、A2吸收气体完全)
五、计算题
19.(1)2021河南春晚《唐宫夜宴》曾被刷上热搜,节目中展出的青铜器历史悠久,西汉时期就记载有“曾青(硫酸铜)得铁则化为铜”。请用化学方程式表示其原理。
(2)硅芯片是很多电子产品的核心。下面是某种制取硅反应的微观示意图,请计算反应前后乙与丁变化的质量比是多少?
20.为测定某铜、锌合金中铜的质量分数,兴趣小组同学称取10g合金于烧杯中,将40g稀盐酸分四次加入,充分反应,测得实验数据如下表所示:
第一次 第二次 第三次 第四次
加入稀盐酸的质量(g) 10 10 10 10
烧杯中剩余物的质量(g) 19.96 29.92 39.90 49.90
(1)充分反应后产生气体的总质量______g。
(2)该铜、锌合金中铜的质量分数为多少?(写出计算过程)
试卷第1页,共3页
参考答案:
1.D
2.D
3.C
4.D
5.D
6.A
7.C
8.B
9.(1)淘米水浇花(或洗衣服水拖地)(合理即可)
(2)保护环境(或节约资源和能源)(合理即可)
(3)减少汽车尾气污染(或节省石油资源)(合理即可)
10. 铝表面有一层致密的氧化铝薄膜,0~50,稀盐酸与氧化铝反应不产生气体,故压强几乎不变 100s后,反应结束,温度逐渐降低,压强也随之而减小
11. 都是探究物质的还原性实验(合理即可) AC(合理即可)
12. B C Fe2O3 3C+2Fe2O34Fe+3CO2↑ Fe+CuSO4=FeSO4+Cu
13. CaCO3 锌原子和氢离子反应生成锌离子和氢分子 Ca(OH)2+2HCl=CaCl2+2H2O 2H2O2H2↑+O2↑
14.(1)CaO
(2)
15.(1)CaCO3
(2)分解反应
(3)放出
(4)
16. 金属活动性,活动性越强,反应速率越快 金属与酸的接触面,接触面越大,反应越快 酸的浓度,酸的浓度越大,反应越快
17.(1)铁钉生锈
(2)隔绝空气(氧气)
(3)铁与水和氧气接触易生锈
18.(1) 不是 3CO+Fe2O32Fe+3CO2 前
(2) 偏大 4:11
19.(1)
(2)2:73
20.(1)0.10
(2)解:设10克铜锌合金中锌的质量为x
x=3.25g
答:铜锌合金中铜的质量分数为67.5%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.实验室中的试剂常因与空气中的一些成分作用而发生变化。对下列试剂在空气中发生变化的分析错误的是
A.铁粉生锈与空气中的水蒸气和氧气有关
B.氢氧化钠溶液变质与空气中的二氧化碳有关
C.氧化钙的变质与空气中的水和二氧化碳有关
D.浓盐酸变稀与空气中的水蒸气有关
2.除去物质中的少量杂质,下列实验方法不能达到目的的是
选项 物质(杂质) 实验方法
A KCl(KClO3) 加热至无气体产生
B Ag 粉(Zn 粉) 加入过量的稀盐酸
C CO2(CO) 通过足量灼热的氧化铜
D 铜粉(碳粉) 在空气中充分灼烧
A.A B.B C.C D.D
3.根据你的经验,下列关于实验现象的描述,科学准确的是
A.镁条在空气中燃烧,发出微弱的蓝紫色火焰
B.蜡烛燃烧产生二氧化碳和水
C.将锌粒加入稀盐酸中,锌粒表面有气泡生成
D.将一根小木条迅速平放入酒精灯火焰中1s后取出,焰心处最黑
4.现有一块合金,其质量为35g,使它与足量的稀硫酸完全反应后生成氢气2g,则此合金的组成可能为
A.和 B.和 C.和 D.和
5.已知12.4克Fe2O3和CuO的混合物与CO充分反应后,固体减少3.1克,则原混合物中Fe2O3和CuO的质量比是
A.3:2 B.3:1 C.2:1 D.1:1
6.下列物质的性质和用途对应关系不正确的是
A.二氧化碳能与水反应,可用于人工降雨 B.铁具有导热性,可用于制作炊具
C.木炭具有可燃性,可作为燃料 D.氧气可以供给呼吸,可用于医疗急救
7.某金属加工厂生产过程中的废液含有少量的硝酸铜和硝酸锌,为回收利用资源和防止污染,该厂向废液中加入一定量的铁粉,反应停止后过滤,向滤渣中加入少量的稀盐酸,无明显现象,则下列有关说法不正确的是
A.滤出的固体中一定含有铜,一定没有铁和锌
B.滤出的固体质量大于原铁粉的质量
C.滤液一定是无色溶液
D.滤液中一定含有硝酸亚铁和硝酸锌,可能含有硝酸铜
8.木炭还原氧化铜和一氧化碳还原氧化铜的实验装置如图所示:
下列说法不正确的是
A.两个实验中,木炭、一氧化碳都发生了氧化反应
B.两个实验的相关反应中,只有碳元素的化合价发生了改变
C.两个实验中氧化铜都转变成红色固体
D.点燃尾气是为了防止未反应的CO污染空气
二、简答题
9.坚持人与自然和谐共生,坚持节约资源。请回答下列问题:
(1)水是生命之源,爱护水资源,一方面要防治水体污染,另一方面要节约用水。请写出一条生活中节约用水的具体措施。
(2)回收利用废旧金属有什么意义?(答一点即可)
(3)在汽油中加入适量的乙醇作为汽车燃料(车用乙醇汽油),请写出使用乙醇汽油的一条优点。
10.将未经砂纸打磨的铝条放入盛有足量稀盐酸的密闭容器中,用传感器测得反应过程中压强、温度随时间变化的图像如下图所示。
(1)0~50s压强几乎不变的原因是什么?______。
(2)写出50~100s发生反应的化学方程式______。
(3)100s后压强逐渐减小的原因是什么?______。
11.比较和分类是重要的学习方法。为了便于研究,我们可以将化学实验按照实验目的分为“探究物质含量实验、探究物质性质实验”等。请将下列探究物质性质的实验继续分类:
A B
C D
分类依据是 ______ ,包含的实验是 ______填字母
三、推断题
12.金属具有广泛的应用。
(1)为探究铝、铜的金属活动性顺序,某同学选用下列药品进行实验,其中可行的是_____(填字母)。
A 铝丝、铜丝、氯化镁溶液 B 铝丝、铜丝、硫酸铜溶液
(2)A~G是初中化学常见的物质。已知A为黑色固体单质,B为红棕色粉末,G为紫红色固体单质,它们的转化关系如下图所示,回答问题:
①写出化学式:A_____;B_____;
②反应Ⅰ的化学方程式为:_____;
③反应Ⅲ的化学方程式为_____。
13.思维导图是激发大脑潜能,练就科学思维的有效方法。图示中A~E是初中化学常见的物质,属于不同类别,C是石灰石的主要成分。图中“﹣”表示两种物质之间可以相互反应,“→”表示一种物质可以生成另一种物质。分析推理,回答问题:
(1)物质C的化学式:_____;D→E反应的实质为_____。
(2)反应①的化学方程式:_____。
(3)反应②的化学方程式:_____。
14.工业上以大理石和赤铁矿(Fe2O3)为主要原料可以制取B和G,其转化关系如下图所示,已知D、G的主要成分为单质。(C是能使澄清石灰水变浑浊的气体)。
回答下列问题:
(1)写出物质B的化学式___________。
(2)写出下列反应的化学方程式:反应①___________。反应②___________。反应③___________。
15.A~H是初中化学常见的物质,其中F是大理石的主要成分,A和D是气体,B是红棕色固体,它们之间的转化关系如图所示。请回答下列问题:
(1)F的化学式为_______。
(2)反应③属于基本反应类型________。
(3)反应④________(选填“放出”或“吸收”)热量。
(4)反应①的化学方程式为__________。
四、实验题
16.某实验小组为了探究影响金属与酸反应快慢的因素,进行了下列活动。
实验序号 实验过程 实验现象
1 镁粉和铁粉分别与5%盐酸反应 镁粉产生气体快
2 铁粉和铁片分别与15%盐酸反应 铁粉产生气体快
3 铁片分别与5%盐酸和15%盐酸反应 15%盐酸产生气体快
根据以上三个实验现象可得出的结论是:____________;_____________;____________。
17.以下为实验室探究铁生锈条件的实验
(1)试管1中观察到的现象是什么?
(2)试管2中的植物油的作用是什么?
(3)此实验得到的结论是什么?
18.某校化学兴趣小组的同学欲用含少量二氧化碳的一氧化碳气体测定赤铁矿石中氧化铁的含量(假设赤铁矿中的杂质不参加下列任何一项反应),实验所需装置如下图所示:
(1)赤铁矿石______(填“是”或“不是”)合金,写出C中反应的化学方程式:______,其中混合气体应在酒精喷灯点燃之______(填“前”或“后”)通入。
(2)所选仪器的连接顺序为:混合气体→A1→D→C→A2→B。
①若通过测量反应前后仪器A2的质量变化,计算赤铁矿石中氧化铁的含量。装置A1试剂足量的澄清石灰水,如果不连接仪器A1,则这样计算出的氧化铁含量与实际值比较将______(选填“偏小”“偏大”或“基本一致”)。
②实验结束后,若测得仪器A1中增加的质量与仪器C中固体减少的质量相等,那么仪器A1与仪器A2中增加质量的最简整数比为______。(A1、A2吸收气体完全)
五、计算题
19.(1)2021河南春晚《唐宫夜宴》曾被刷上热搜,节目中展出的青铜器历史悠久,西汉时期就记载有“曾青(硫酸铜)得铁则化为铜”。请用化学方程式表示其原理。
(2)硅芯片是很多电子产品的核心。下面是某种制取硅反应的微观示意图,请计算反应前后乙与丁变化的质量比是多少?
20.为测定某铜、锌合金中铜的质量分数,兴趣小组同学称取10g合金于烧杯中,将40g稀盐酸分四次加入,充分反应,测得实验数据如下表所示:
第一次 第二次 第三次 第四次
加入稀盐酸的质量(g) 10 10 10 10
烧杯中剩余物的质量(g) 19.96 29.92 39.90 49.90
(1)充分反应后产生气体的总质量______g。
(2)该铜、锌合金中铜的质量分数为多少?(写出计算过程)
试卷第1页,共3页
参考答案:
1.D
2.D
3.C
4.D
5.D
6.A
7.C
8.B
9.(1)淘米水浇花(或洗衣服水拖地)(合理即可)
(2)保护环境(或节约资源和能源)(合理即可)
(3)减少汽车尾气污染(或节省石油资源)(合理即可)
10. 铝表面有一层致密的氧化铝薄膜,0~50,稀盐酸与氧化铝反应不产生气体,故压强几乎不变 100s后,反应结束,温度逐渐降低,压强也随之而减小
11. 都是探究物质的还原性实验(合理即可) AC(合理即可)
12. B C Fe2O3 3C+2Fe2O34Fe+3CO2↑ Fe+CuSO4=FeSO4+Cu
13. CaCO3 锌原子和氢离子反应生成锌离子和氢分子 Ca(OH)2+2HCl=CaCl2+2H2O 2H2O2H2↑+O2↑
14.(1)CaO
(2)
15.(1)CaCO3
(2)分解反应
(3)放出
(4)
16. 金属活动性,活动性越强,反应速率越快 金属与酸的接触面,接触面越大,反应越快 酸的浓度,酸的浓度越大,反应越快
17.(1)铁钉生锈
(2)隔绝空气(氧气)
(3)铁与水和氧气接触易生锈
18.(1) 不是 3CO+Fe2O32Fe+3CO2 前
(2) 偏大 4:11
19.(1)
(2)2:73
20.(1)0.10
(2)解:设10克铜锌合金中锌的质量为x
x=3.25g
答:铜锌合金中铜的质量分数为67.5%。
答案第1页,共2页
答案第1页,共2页
