专题8金属和金属材料章末习题---2021-2022学年九年级化学仁爱版下册(word版有答案)
文档属性
| 名称 | 专题8金属和金属材料章末习题---2021-2022学年九年级化学仁爱版下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 94.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 仁爱科普版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-09 10:40:10 | ||
图片预览


文档简介
专题8《金属和金属材料》章末习题
一、单选题
1.下列变化属于物理变化的是
A.矿石粉碎 B.煤燃烧 C.大米酿出酒 D.钢铁生锈
2.物质的性质决定了物质的用途,下列对应关系正确的是
选项 物质 性质 用途
A 金刚石 折光性好 切割大理石
B 氧气 可燃性 火箭推进器
C 氮气 化学性质稳定 制作氮肥
D 铜 能导电 制作电线
A.A B.B C.C D.D
3.根据你的经验,下列关于实验现象的描述,科学准确的是
A.镁条在空气中燃烧,发出微弱的蓝紫色火焰
B.蜡烛燃烧产生二氧化碳和水
C.将锌粒加入稀盐酸中,锌粒表面有气泡生成
D.将一根小木条迅速平放入酒精灯火焰中1s后取出,焰心处最黑
4.在等质量的下列固体中,分别加入等质量的足量稀硫酸至反应完毕时,溶液质量最大的是
A.Fe B.Al C.Ba(OH)2 D.Na2CO3
5.下列有关金属材料的说法正确的是
A.钢的性能优良,是很纯的铁 B.铝片表面易生成致密的氧化膜
C.金属单质在常温下都是固体 D.合金中一定不含非金属元素
6.2019年三位科学家因对锂(Li)电池的开发而获诺贝尔化学奖。已知某锂电池的工作原理方程式为:,LiMnO2中Li的化合价为+1价,下列说法错误的是
A.上述反应证明金属活动性:Li>Mn B.反应后锰元素的化合价降低
C.该反应属于化合反应 D.锂电池使用时化学能会转化为电能
7.将质量为4克的铁片放入200克质量分数为20%的硫酸铜溶液中,片刻后取出附有铜的铁片,洗涤烘干后称得质量为4.4克,这表明反应中
A.有4克铁参加了反应 B.有40克硫酸铜参加了反应
C.析出了3.2克铜 D.生成38g硫酸亚铁
8.有 Mg Al Zn 的混合物共 7. 2g,与足量盐酸反应,生成 H2 的质量可能是
A.0. 2g B.0. 8g C.0. 5g D.0. 9g
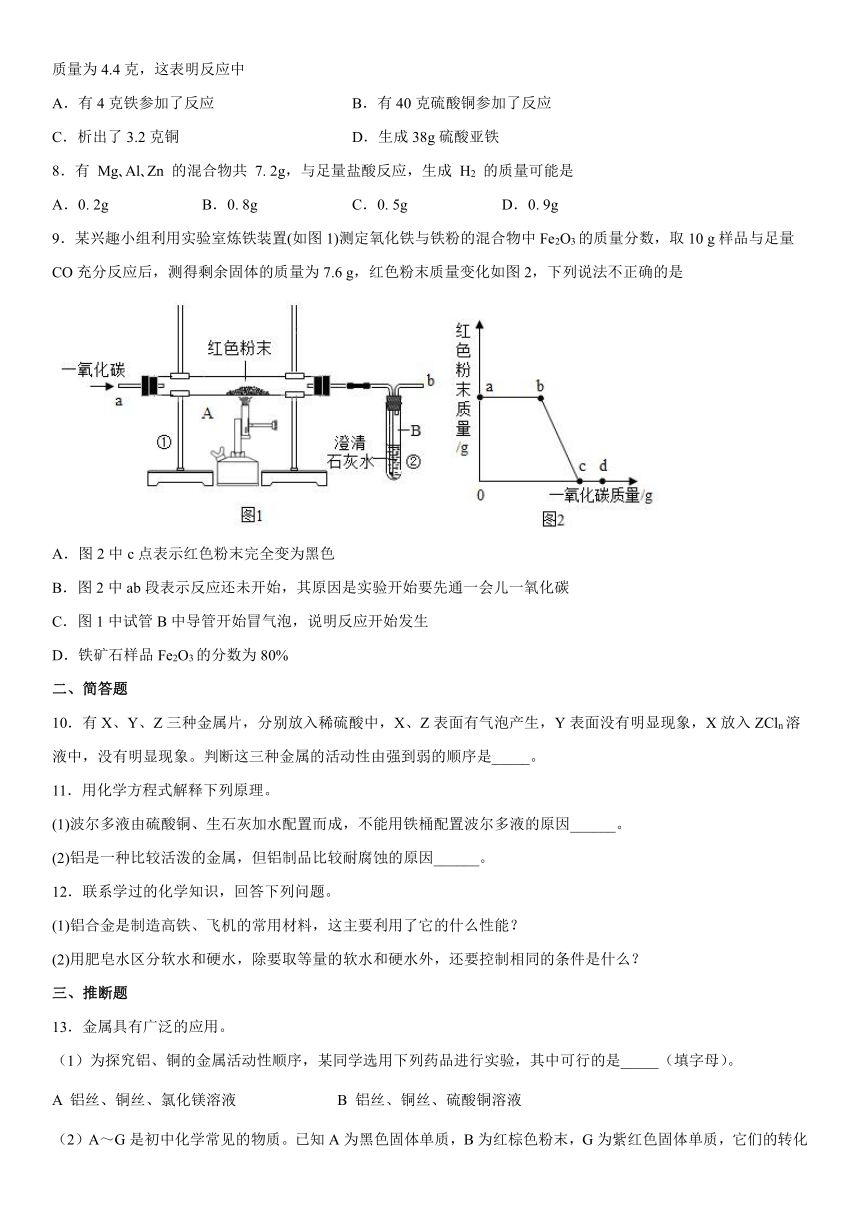
9.某兴趣小组利用实验室炼铁装置(如图1)测定氧化铁与铁粉的混合物中Fe2O3的质量分数,取10 g样品与足量CO充分反应后,测得剩余固体的质量为7.6 g,红色粉末质量变化如图2,下列说法不正确的是
A.图2中c点表示红色粉末完全变为黑色
B.图2中ab段表示反应还未开始,其原因是实验开始要先通一会儿一氧化碳
C.图1中试管B中导管开始冒气泡,说明反应开始发生
D.铁矿石样品Fe2O3的分数为80%
二、简答题
10.有X、Y、Z三种金属片,分别放入稀硫酸中,X、Z表面有气泡产生,Y表面没有明显现象,X放入ZCln溶液中,没有明显现象。判断这三种金属的活动性由强到弱的顺序是_____。
11.用化学方程式解释下列原理。
(1)波尔多液由硫酸铜、生石灰加水配置而成,不能用铁桶配置波尔多液的原因______。
(2)铝是一种比较活泼的金属,但铝制品比较耐腐蚀的原因______。
12.联系学过的化学知识,回答下列问题。
(1)铝合金是制造高铁、飞机的常用材料,这主要利用了它的什么性能?
(2)用肥皂水区分软水和硬水,除要取等量的软水和硬水外,还要控制相同的条件是什么?
三、推断题
13.金属具有广泛的应用。
(1)为探究铝、铜的金属活动性顺序,某同学选用下列药品进行实验,其中可行的是_____(填字母)。
A 铝丝、铜丝、氯化镁溶液 B 铝丝、铜丝、硫酸铜溶液
(2)A~G是初中化学常见的物质。已知A为黑色固体单质,B为红棕色粉末,G为紫红色固体单质,它们的转化关系如下图所示,回答问题:
①写出化学式:A_____;B_____;
②反应Ⅰ的化学方程式为:_____;
③反应Ⅲ的化学方程式为_____。
14.化学实验室要从X、银、铜、锌四种金属混合物中分离某重金属。流程如下:
请回答:(1)四种金属的活动性顺序由强到弱的是 _______________ 。
(2)固体丙中一定含有的金属是 ________ 。
(3)写出反应③中反应的化学方程式 ______________ 。
(4)为了检验滤液C中溶质的成分:向其中加入稀盐酸,有白色沉淀生成,则滤液C中一定含有的阳离子是 ______ 。
15.A—E是初中化学中常见的五种物质,它们的变化关系如下图所示。其中A和E都是金属单质且单质E呈紫红色,B的溶液呈浅绿色。
(1)A、B的化学名称分别是______和______;
(2)反应②的化学反应方程式为______;
(3)反应①和②的基本反应类型均为______。
16.A~G八种物质是氧气、碳、盐酸、氧化铜、一氧化碳、氧化铁、碳酸钙、甲烷中的一种,其中A为红色固体,F为液体,B、C、D均为气体,D、G为单质。它们之间发生如图所示的两两反应时,都有CO2生成(反应条件和其余生成物均已省略)。请回答下列问题:
(1)D的化学式为___________;F的名称为___________。
(2)反应③发生时,可以观察到的最明显现象是___________;反应②发生时,除CO2外的另一种生成物的化学式为___________。
(3)写出指定反应的化学方程式:①___________;④___________。
四、实验题
17.如图为CO还原Fe2O3的微型装置图。
(1)A处V型管内的现象是什么?_____。
(2)写出A处发生反应的化学方程式_____。
(3)B处V型管内的溶液变浑浊,写出化学方程式_____。
18.17中学化学兴趣小组的同学以“铁、铜、银的金属活动性强弱”为课题,进行了如下实验,请根据已学知识回答下列问题。
(1)写出在实验①中发生反应的化学方程式___________。
(2)实验②中,在液面下的铜丝表面能观察到的现象是___________。
(3)由此证明了三种金属的活动性顺序由强到弱依次是___________(用化学式表示)。
19.下图装置可做一氧化碳还原氧化铁的实验,并检验生成的气体产物。
(1)先通CO后加热的原因是________;
(2)C装置中可观察到的现象是_________;
(3)B中反应的化学方程式________;
(4)从环保角度考虑,请写出一种尾气处理方法_______。
五、计算题
20.已知锌和稀硫酸反应生成氢气和硫酸锌,实验室制取4克氢气,需要多少克锌?(Zn+H2SO4=ZnSO4+H2)
21.某化学兴趣小组同学为回收一块质量为40g的铜锌合金中铜的含量,将该合金放入烧杯中,逐渐加入稀硫酸至不再产生气泡时,恰好用去稀硫酸100g,此时称得烧杯中剩余物的质量为139.6g。请完成下列分析及计算。
(1)生成氢气的质量为___________g。
(2)计算该合金中铜的质量分数(精确到0.1%)。
试卷第1页,共3页
参考答案:
1.A
2.D
3.C
4.A
5.B
6.A
7.C
8.C
9.C
10.Z>X>Y
11.(1)
(2)
12.(1)密度小强度大
(2)滴加肥皂水的量
13. B C Fe2O3 3C+2Fe2O34Fe+3CO2↑ Fe+CuSO4=FeSO4+Cu
14. Zn>X>Cu>Ag Cu+2AgNO3= Cu(NO3)2+2Ag Ag Cu2+、Ag+
15.(1) 铁 氯化亚铁
(2)CuO+H2Cu+H2O或Cu2O+H22Cu+H2O;
(3)置换反应
16.(1) O2 盐酸
(2) 固体表面有大量气泡产生 H2O
(3)
17. 红色固体变黑色
18.(1)Fe+CuSO4=FeSO4+Cu
(2)铜丝表面有白色物质生成
(3)Fe、Cu、Ag
19.(1)排尽装置内的空气
(2)澄清石灰水变浑浊
(3)
(4)在装置末尾放一燃着的酒精灯点燃尾气一氧化碳。
20.解:设需要锌的质量为x
x=130g
答:实验室制取4克氢气,需要130克锌。
21.(1)0.4
(2)解:设合金中锌的质量为x。
x=13g
答:合金中铜的质量分数为: ×100=67.5%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列变化属于物理变化的是
A.矿石粉碎 B.煤燃烧 C.大米酿出酒 D.钢铁生锈
2.物质的性质决定了物质的用途,下列对应关系正确的是
选项 物质 性质 用途
A 金刚石 折光性好 切割大理石
B 氧气 可燃性 火箭推进器
C 氮气 化学性质稳定 制作氮肥
D 铜 能导电 制作电线
A.A B.B C.C D.D
3.根据你的经验,下列关于实验现象的描述,科学准确的是
A.镁条在空气中燃烧,发出微弱的蓝紫色火焰
B.蜡烛燃烧产生二氧化碳和水
C.将锌粒加入稀盐酸中,锌粒表面有气泡生成
D.将一根小木条迅速平放入酒精灯火焰中1s后取出,焰心处最黑
4.在等质量的下列固体中,分别加入等质量的足量稀硫酸至反应完毕时,溶液质量最大的是
A.Fe B.Al C.Ba(OH)2 D.Na2CO3
5.下列有关金属材料的说法正确的是
A.钢的性能优良,是很纯的铁 B.铝片表面易生成致密的氧化膜
C.金属单质在常温下都是固体 D.合金中一定不含非金属元素
6.2019年三位科学家因对锂(Li)电池的开发而获诺贝尔化学奖。已知某锂电池的工作原理方程式为:,LiMnO2中Li的化合价为+1价,下列说法错误的是
A.上述反应证明金属活动性:Li>Mn B.反应后锰元素的化合价降低
C.该反应属于化合反应 D.锂电池使用时化学能会转化为电能
7.将质量为4克的铁片放入200克质量分数为20%的硫酸铜溶液中,片刻后取出附有铜的铁片,洗涤烘干后称得质量为4.4克,这表明反应中
A.有4克铁参加了反应 B.有40克硫酸铜参加了反应
C.析出了3.2克铜 D.生成38g硫酸亚铁
8.有 Mg Al Zn 的混合物共 7. 2g,与足量盐酸反应,生成 H2 的质量可能是
A.0. 2g B.0. 8g C.0. 5g D.0. 9g
9.某兴趣小组利用实验室炼铁装置(如图1)测定氧化铁与铁粉的混合物中Fe2O3的质量分数,取10 g样品与足量CO充分反应后,测得剩余固体的质量为7.6 g,红色粉末质量变化如图2,下列说法不正确的是
A.图2中c点表示红色粉末完全变为黑色
B.图2中ab段表示反应还未开始,其原因是实验开始要先通一会儿一氧化碳
C.图1中试管B中导管开始冒气泡,说明反应开始发生
D.铁矿石样品Fe2O3的分数为80%
二、简答题
10.有X、Y、Z三种金属片,分别放入稀硫酸中,X、Z表面有气泡产生,Y表面没有明显现象,X放入ZCln溶液中,没有明显现象。判断这三种金属的活动性由强到弱的顺序是_____。
11.用化学方程式解释下列原理。
(1)波尔多液由硫酸铜、生石灰加水配置而成,不能用铁桶配置波尔多液的原因______。
(2)铝是一种比较活泼的金属,但铝制品比较耐腐蚀的原因______。
12.联系学过的化学知识,回答下列问题。
(1)铝合金是制造高铁、飞机的常用材料,这主要利用了它的什么性能?
(2)用肥皂水区分软水和硬水,除要取等量的软水和硬水外,还要控制相同的条件是什么?
三、推断题
13.金属具有广泛的应用。
(1)为探究铝、铜的金属活动性顺序,某同学选用下列药品进行实验,其中可行的是_____(填字母)。
A 铝丝、铜丝、氯化镁溶液 B 铝丝、铜丝、硫酸铜溶液
(2)A~G是初中化学常见的物质。已知A为黑色固体单质,B为红棕色粉末,G为紫红色固体单质,它们的转化关系如下图所示,回答问题:
①写出化学式:A_____;B_____;
②反应Ⅰ的化学方程式为:_____;
③反应Ⅲ的化学方程式为_____。
14.化学实验室要从X、银、铜、锌四种金属混合物中分离某重金属。流程如下:
请回答:(1)四种金属的活动性顺序由强到弱的是 _______________ 。
(2)固体丙中一定含有的金属是 ________ 。
(3)写出反应③中反应的化学方程式 ______________ 。
(4)为了检验滤液C中溶质的成分:向其中加入稀盐酸,有白色沉淀生成,则滤液C中一定含有的阳离子是 ______ 。
15.A—E是初中化学中常见的五种物质,它们的变化关系如下图所示。其中A和E都是金属单质且单质E呈紫红色,B的溶液呈浅绿色。
(1)A、B的化学名称分别是______和______;
(2)反应②的化学反应方程式为______;
(3)反应①和②的基本反应类型均为______。
16.A~G八种物质是氧气、碳、盐酸、氧化铜、一氧化碳、氧化铁、碳酸钙、甲烷中的一种,其中A为红色固体,F为液体,B、C、D均为气体,D、G为单质。它们之间发生如图所示的两两反应时,都有CO2生成(反应条件和其余生成物均已省略)。请回答下列问题:
(1)D的化学式为___________;F的名称为___________。
(2)反应③发生时,可以观察到的最明显现象是___________;反应②发生时,除CO2外的另一种生成物的化学式为___________。
(3)写出指定反应的化学方程式:①___________;④___________。
四、实验题
17.如图为CO还原Fe2O3的微型装置图。
(1)A处V型管内的现象是什么?_____。
(2)写出A处发生反应的化学方程式_____。
(3)B处V型管内的溶液变浑浊,写出化学方程式_____。
18.17中学化学兴趣小组的同学以“铁、铜、银的金属活动性强弱”为课题,进行了如下实验,请根据已学知识回答下列问题。
(1)写出在实验①中发生反应的化学方程式___________。
(2)实验②中,在液面下的铜丝表面能观察到的现象是___________。
(3)由此证明了三种金属的活动性顺序由强到弱依次是___________(用化学式表示)。
19.下图装置可做一氧化碳还原氧化铁的实验,并检验生成的气体产物。
(1)先通CO后加热的原因是________;
(2)C装置中可观察到的现象是_________;
(3)B中反应的化学方程式________;
(4)从环保角度考虑,请写出一种尾气处理方法_______。
五、计算题
20.已知锌和稀硫酸反应生成氢气和硫酸锌,实验室制取4克氢气,需要多少克锌?(Zn+H2SO4=ZnSO4+H2)
21.某化学兴趣小组同学为回收一块质量为40g的铜锌合金中铜的含量,将该合金放入烧杯中,逐渐加入稀硫酸至不再产生气泡时,恰好用去稀硫酸100g,此时称得烧杯中剩余物的质量为139.6g。请完成下列分析及计算。
(1)生成氢气的质量为___________g。
(2)计算该合金中铜的质量分数(精确到0.1%)。
试卷第1页,共3页
参考答案:
1.A
2.D
3.C
4.A
5.B
6.A
7.C
8.C
9.C
10.Z>X>Y
11.(1)
(2)
12.(1)密度小强度大
(2)滴加肥皂水的量
13. B C Fe2O3 3C+2Fe2O34Fe+3CO2↑ Fe+CuSO4=FeSO4+Cu
14. Zn>X>Cu>Ag Cu+2AgNO3= Cu(NO3)2+2Ag Ag Cu2+、Ag+
15.(1) 铁 氯化亚铁
(2)CuO+H2Cu+H2O或Cu2O+H22Cu+H2O;
(3)置换反应
16.(1) O2 盐酸
(2) 固体表面有大量气泡产生 H2O
(3)
17. 红色固体变黑色
18.(1)Fe+CuSO4=FeSO4+Cu
(2)铜丝表面有白色物质生成
(3)Fe、Cu、Ag
19.(1)排尽装置内的空气
(2)澄清石灰水变浑浊
(3)
(4)在装置末尾放一燃着的酒精灯点燃尾气一氧化碳。
20.解:设需要锌的质量为x
x=130g
答:实验室制取4克氢气,需要130克锌。
21.(1)0.4
(2)解:设合金中锌的质量为x。
x=13g
答:合金中铜的质量分数为: ×100=67.5%
答案第1页,共2页
答案第1页,共2页
