江苏省徐州市重点高中2022届高三下学期期初测试 化学试卷(PDF版)
文档属性
| 名称 | 江苏省徐州市重点高中2022届高三下学期期初测试 化学试卷(PDF版) |  | |
| 格式 | zip | ||
| 文件大小 | 603.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-10 19:39:35 | ||
图片预览




文档简介
2022 届高三年级第二学期期初测试
化学试题
可能用到的相对原子质量:H 1 C 1 2 O 1 6 N a 2 3 S 3 2 N i 5 9
一、单项选择题:共 14 题,每题 3 分,共 42 分。每题只有一个选项最符合题意。
1.化学与生产、生活、科技等方面密切相关,下列说法正确的是( )。
A.德尔塔新冠病毒有可能在空气中以气溶胶的形式传播,气溶胶属于胶体
B.中科院首次实现了CO 合成淀粉,淀粉、蛋白质和油脂是人体必需的高分子营养物质 2
C.光化学烟雾、臭氧层空洞、温室效应的形成都与二氧化碳有关
D.乙醇常用于医疗消毒,浓度越高消毒效果越好
2.肼 N2H4 是发射航天飞船常用的高能燃料,可通过反应2NH3 NaClO N2H4 NaCl H2O 制备。
下列有关微粒的描述不.正确的是( )。
H H
A. NH3分子空间构型为三角锥形 B.N2H4的结构式为 | |
H N N H
35
C.NaClO 既含离子键又含共价键 D.中子数为 18 的氯的核素:17 Cl
3.实验室处理FeBr3 废液,得到溴的四氯化碳溶液和FeCl3 6H2O。下列设计不.能.达到实验目的的是( )。
A.用装置甲制取氯气
B.用装置乙使Br 全部转化为溴单质
C.用装置丙分液时,先从下口放出有机层,再从上口倒出水层
D.用装置丁将分液后的水层蒸发结晶得到FeCl3 6H2O
4.钠盐在生产、生活中有广泛应用。下列性质与用途具有对应关系的是( )。
A.NaClO 有强氧化性,可用于消毒杀菌
B. NaHSO3 有还原性,可用于漂白纸浆
C. NaHCO3能与碱反应,可用作焙制糕点的膨松剂
D. Na2CO3溶液显碱性,可用于制抗酸药物
5.前 4 周期元素(非 0 族)X、Y、Z、W 的原子序数依次增大。最外层电子数满足 Z=X+Y;X 原子半径
小于 Y 原子半径,Y 是空气中含量最多的元素;基态 Z 原子的电子总数是其最高能级电子数的 2 倍;W 在前
4 周期中原子未成对电子数最多。下列叙述正确的是( )。
A.X、Y、Z 三种元素形成的化合物水溶液一定呈酸性
B.Z 的简单气态氢化物的热稳定性比 Y 的强
C.第一电离能:Z>Y>X>W
W3 5D. 的基态电子排布式: Ar 3d
阅读下列资料,完成 6~8 题:氯化亚铜的化学式 CuCl 或Cu2Cl2 ,为白色立方结晶或白色粉末。微溶于水,
2 3
可溶于不同浓度的 KCl 溶液,生成 CuCl2 、 CuCl3 和 CuCl4 等离子。例如:
2 CuCl s 2Cl aq CuCl3 aq H
氯化亚铜溶于氨水生成氯化二氨合亚铜 Cu NH 3 Cl ,不溶于乙醇。 2
6.下列说法正确的是( )。
A. NH3不能形成分子间氢键 B.HCuCl2 中有 3 个配位键
C. NH3的键角大于H2O 的键角 D. Cu NH Cl中提供孤电子对的原子是 N 和 Cl 3 2
7.在指定条件下,下列选项所示的物质间转化可以实现的是( )。
KOH aq
A.HClO aq 光 照 Cl2 g B.Cl2 g KClO aq
Cu s C.Cl2 g CuCl点燃 s
SO2 g D.KClO aq ClO2 g
2
8.对于反应CuCl s 2Cl aq CuCl3 aq ,下列说法正确的是( )。
A.该反应的 H 0
2
c CuCl3
B.该反应的平衡常数可表示为K
c CuCl c2 Cl
C.加水可使该平衡向逆向移动
2
D.其他条件相同,增大 CuCl 的量,可加快生成 CuCl3 的速率
9.连二亚硫酸钠 Na2S2O4 俗称保险粉,常用于纺织工业、食品漂白等领域。某种 Na2S2O4 的生产工艺流
程如图所示,若在实验室模拟该工艺流程,下列说法不.正确的是( )。
A.将锌粉投入水中形成悬浮液主要是为了加快反应速率
B.向 Na2S2O4 溶液中加 NaCl 溶液或固体对Na2S2O4 的产率无明显影响
C.洗涤 Na2S2O4 2H2O时用冰水效果好于常温蒸馏水
D.该流程中涉及化合反应、分解反应、复分解反应和氧化还原反应
10.化合物 Z 是制备药物洛索洛芬钠的关键中间体,可由下列反应制得。
下列有关 X、Y、Z 的说法正确的是( )。
A.CH3CH2OH中sp
3
杂化的原子有 3 个
B.Y 在水中的溶解度比 Z 在水中的溶解度小
C.一定条件下,1mol Z 最多可以和 1mol NaOH 溶液反应
D.X、Y、Z 分别与足量酸性KMnO4 溶液反应所得芳香族化合物不相同
2
11.某小组设计下列实验验证Ag 和Fe 的反应为可逆反应。
实验 1:将0.0100mol L 1 Ag2SO4 溶液与0.0400mol L
1 FeSO4 溶液 pH 1 等体积混合,产生灰黑色沉
淀,溶液呈黄色。
实验 2:取Ⅰ中沉淀,加入浓硝酸,灰黑色固体溶解,产生红棕色气体。
实验 3:向少量 Ag 粉中加入0.0100mol L Fe2 SO4 溶液 pH 1 ,固体完全溶解。 3
下列说法正确的是( )。
2
A.实验 1 中发生反应的离子方程式为Ag2SO4 2Fe 2Fe
3 2Ag SO2 4
B.实验 2 可证明实验 1 中灰黑色沉淀为 Ag,产生气体为 NO
C.实验 3 中Fe2 SO4 溶液不可以用Fe NO3 溶液代替 3 3
D.银的晶胞结构如图,Ag 的配位数为 8
12.用惰性电极电解法制备硼酸 H3BO3 的工作原理如图所示(阳膜和阴膜分别只允许阳离子和阴离子通过)。
下列有关说法正确的是( )。
A.a 极接电源正极
B.膜 A 为阴膜,膜 B 为阳膜
C.电解过程中,b 极附近溶液 pH 增大
D.产品室中发生的反应为B OH H H3BO4 3 H2O
13.室温下,通过下列实验探究 NH4Al SO4 溶液的性质(假设实验前后溶液体积不变)。 2
1
实验 1:用 pH 试纸测定0.1mol L NH4Al SO4 溶液的 pH,测得 pH 约为 6 2
实验 2:向0.1mol L 1 NH4Al SO4 溶液中加入少量的Ba OH 溶液,产生白色沉淀 2 2
0.1mol L 1实验 3:向 NH4Al SO4 溶液中通入一定量的NH 至沉淀完全 2 3
0.1mol L 1实验 4:向 NH4Al SO4 溶液中加入Na CO 产生沉淀和气体 2 2 3
下列说法正确的是( )。
A.0.1mol L 1 NH4Al SO4
8
溶液中由水电离出的c H 约为10 mol L 1 2
B.实验 2 发生反应离子方程式为
NH 3 2 2 4 Al SO4 Ba 4OH BaSO4 Al OH NH3 H2O 3
2
C.实验 3 得到的溶液中有c NH4 c SO4 c H c OH
K sp Al2 CO 2 3 3
3
D.实验 4 过滤后所得清液中一定存在:c Al
c3 CO2 3
14.工业上,以煤炭为原料,通入一定比例的空气,经过系列反应可以得到满足不同需求的原料气。在 C 和O2
的反应体系中发生如下反应:
反应Ⅰ C s O2 g CO
1
2 g H1 394kJ mol
1
反应Ⅱ 2CO g O2 g 2CO2 g H2 566kJ mol
反应Ⅲ 2C s O2 g 2CO g H3
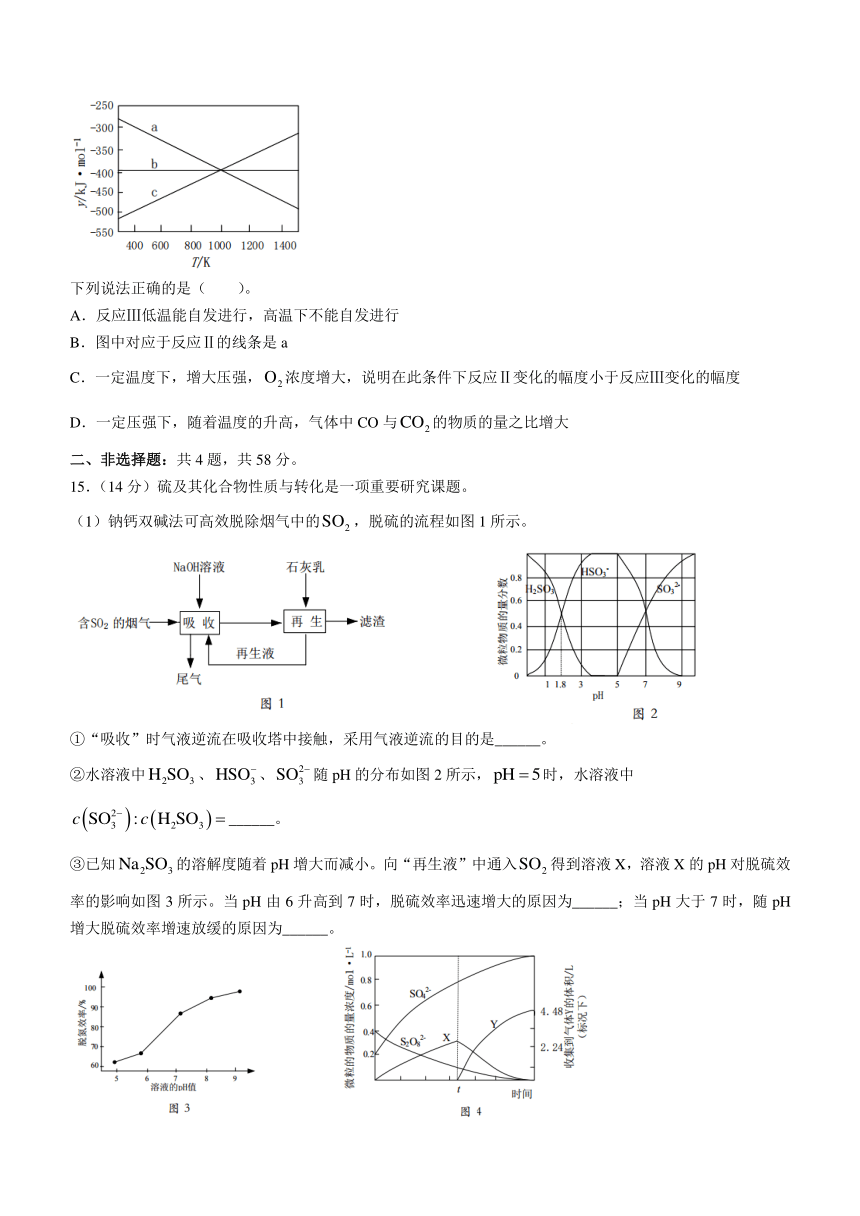
设 y H T S ,反应Ⅰ、Ⅱ和Ⅲ的 y 随温度的变化关系如图所示。
下列说法正确的是( )。
A.反应Ⅲ低温能自发进行,高温下不能自发进行
B.图中对应于反应Ⅱ的线条是 a
C.一定温度下,增大压强,O2 浓度增大,说明在此条件下反应Ⅱ变化的幅度小于反应Ⅲ变化的幅度
D.一定压强下,随着温度的升高,气体中 CO 与CO2的物质的量之比增大
二、非选择题:共 4 题,共 58 分。
15.(14 分)硫及其化合物性质与转化是一项重要研究课题。
(1)钠钙双碱法可高效脱除烟气中的SO2 ,脱硫的流程如图 1 所示。
①“吸收”时气液逆流在吸收塔中接触,采用气液逆流的目的是______。
②水溶液中H2SO3 、HSO
3 、SO
2
3 随 pH 的分布如图 2 所示,pH 5时,水溶液中
c SO2 3 :c H2SO3 ______。
③已知 Na2SO3 的溶解度随着 pH 增大而减小。向“再生液”中通入SO2 得到溶液 X,溶液 X 的 pH 对脱硫效
率的影响如图 3 所示。当 pH 由 6 升高到 7 时,脱硫效率迅速增大的原因为______;当 pH 大于 7 时,随 pH
增大脱硫效率增速放缓的原因为______。
(2)2.560g 硫单质与60.00mL 1.000mol L 1热 NaOH 溶液恰好完全反应,只生成Na2Sx 和 Na2S2O3,则
x ______。
(3)过硫酸钠 Na2S2O8 是白色晶状粉末,易溶于水,常用作漂白剂、氧化剂等。将 0.40mol 过硫酸钠与 0.20mol
硫酸配制成 1L溶液,在一定条件下,测得溶液中部分微粒的浓度如图 4所示(t时刻向溶液中加入少量MnO2 )。
①t 时刻前发生反应的离子方程式为______。
②图中气体 Y 的化学式为______。
16.(14 分)洛索洛芬钠(G)是一种抗炎镇痛药物,其一种合成路线如下:
(1)A 分子中碳原子的杂化方式为______。
(2)C 中所含官能团名称为______。
(3)B→C 的反应需经历 B→X→C 的过程。X 的分子式为C10H12O3 ,B→X 的反应类型为______。
(4)D 的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:______。
①含有苯环。
②能水解,且一定条件下完全水解后的产物都只含有两种不同化学环境的氢原子。
O
(5)写出以CH3CH2OH、 || 为原料制备 的合成路线流程图(涉
CH3CCH2COOC2H5
及题干中条件任用、无机试剂任用,合成路线流程图示例见本题题干)。
2
17.(15 分)一种利用废旧锂离子电池硫酸浸出液(含Li 、Cu 、Ni2 Mn2 Co2 Fe2 、 、 、 、Fe3 Al3 和 )
回收金属的工艺如下:
已知:①K sp Ni OH
14 17
2 1 10 K sp Fe OH 1 10 2
K sp Al OH 1 10
32.9
K sp Fe OH
39
3 3 1 10
5
②当溶液中离子的浓度小于1 10 mol L 1时认为沉淀完全
③Co2 、 Ni2 不易被氧化。
(1)加入NiCO3 固体调节 pH 时,需将溶液 pH 调至不低于______。
2
(2)“氧化沉铁”过程中,Fe 发生反应的离子方程式为______。
(3)本工艺中“沉铝”、“沉铁”过程均需将溶液加热煮沸,其目的是______。
(4)净化液经过一系列操作可提取硫酸镍,制得的粗硫酸镍固体中含有少量的FeSO4 、CuSO4 ,为了获得
高纯的硫酸镍固体(外界条件对 Ni 的回收率如图 1、图 2 所示),请补充实验方案:取一定量的粗硫酸镍固体
溶于足量稀硫酸中,______将滤液蒸发浓缩,冷却结晶,过滤,用冷水洗涤,干燥。(实验中可选择的试剂:O3 、
Cl 4mol L 1 12 、 NaOH 溶液,2mol L 的硫酸溶液,NiCO3 固体,蒸馏水,KSCN 溶液,K3 Fe CN 6
溶液。)
(5)测定粗产品中NiSO4 质量分数。取 2.000g 粗产品溶于水,配成 100mL 溶液,取 20.00mL 溶液,加入
NH 13 NH4Cl混合溶液调节 pH 为 9,加入指示剂后用0.05000mol L 的 EDTA Na2H2Y 标准溶液滴定至
终点(离子方程式为Ni2 H Y2 NiY2 2 2H ,消耗 EDTA 标准溶液 48.00mL,该硫酸镍的质量分数
为多少?(写出计算过程)
18.(15 分)
我国力争于 2030 年前做到碳达峰,2060 年前实现碳中和。资源化利用碳氧化合物能有效减少CO2排放,实
现自然界中的碳循环。
(1)以CO2、C2H6 为原料合成C2H4 涉及的主要反应如下:
1
Ⅰ.CO2 g C2H6 g C2H4 g H2O g CO g H 177kJ mol (主反应)
Ⅱ.C2H6 g CH4 g H2 g C s H 9kJ mol
1
(副反应)
反应Ⅰ的反应历程可分为如下两步:
ⅰ.C2H6 g C2H4 g H2 g H 1
ⅱ.H2 g CO2 g H2O g CO g
1
H 2 41kJ mol
① H1 ______。
②相比于提高c C2H6 ,提高c CO2 对反应Ⅰ速率影响更大,原因是______。
③0.1MPa 时,向一恒容密闭容器中充入物质的量之比为 2∶1 的CO2 g 和C2H6 g ,反应物转化率与反应
C2H4 g 的物质的量
温度的关系如图 1 所示。在 800℃,C2H4 g 的选择性[ ×100%]为______。
反应的C2H6 g 的物质的量
(2)CO2可制甲烷化,CO2可制甲烷化过程中,CO2活化的可能途径如图 2 所示。CO 是CO2活化的优势
中间体,可能的原因是______。
(3)CO2在熔融K2CO3中电解还原为正丙醇 CH3CH2CH2OH 的阴极反应式为______。
(4)CO2可用 CaO 吸收,发生反应:CaO s CO2 g CaCO3 s 。在不同温度下,达到平衡时体系
中CO2物质的量浓度 c CO2 与温度的关系如图 3 所示。900℃下的 c CO2 远大于 800℃下的c CO2 ,
其原因是______。
2022 届高三年级第二学期期初测试化学答案
1.A 2.B 3.D 4.A 5.B 6.C 7.B 8.C 9.B 10.A
11.C 12.D 13.C 14.D
15.(15 分)
(1)①增大接触面积,加快反应速率,提高SO2 吸收率。
101.2②
③“再生液”中 Na2SO3 的浓度增大,吸收SO2 的效率增强;随着 pH 进一步增大,“再生液”中Na2SO3 的
溶解度因 pH 增大而减小, Na2SO3 会析出,Na2SO3 浓度减小,脱硫效率增速放缓。
(2)3
一定条件
S O2 (3)① 2 8 2H O 2SO
2
2 4 H2O2 2H
②O2
16.(14 分)
2
(1)sp、sp 、 sp3
(2)碳溴键、羧基
(3)加成反应
(4) 或
浓H SO Br
(5)CH CH OH 2 4 CH CH 23 2 2 2 CH BrCH Br 170℃ 2 2
17.(15 分)
(1)4.7
MnO (2) 4 3Fe
2 7H2O MnO2 3Fe OH 5H
3
(3)破坏Al OH 、Fe OH 胶体,使沉淀颗粒变大,利于过滤
3 3
(4)边搅拌边缓慢通入O ,至取少量反应后溶液滴加3 K 3 Fe CN 溶液,无蓝色沉淀生成,停止通O 。6 3
将反应后液体置于 80℃水浴加热,分批加入碳酸镍并搅拌,至 pH4.5~5.0,充分反应,静置过滤
( )n H Y2 5 2 0.05mol L 1 0.048L 0.0024mol
1Ni2 1H Y2 2
20mL 溶液中n Ni2 n H Y2 2 0.0024mol
0.0024mol 155g mol 5
硫酸镍的质量分数 100%=93.00%
2.000g
18.(15 分)
1
(1)① 136kJ mol
②反应ⅱ速率较慢(活化能较大),是反应Ⅰ的决速步骤。
③80%
(2)生成中间体反应的活化能小,反应快;CO 中间体能量低,稳定,利于生成(或反应放热,利于中间体
的生成)。
(3)12CO2 18e
4H2O CH3CH2CH2OH 9CO
2
3
1
(4)由于CaO s CO2 g CaCO3 s H 0,温度升高 K 减小,K CO2 ,温度升高平衡体
c
系中c CO2 增大。
(反应的平衡常数也可以表述为反应正向进行程度,但描述成温度越高,平衡逆向移动)
化学试题
可能用到的相对原子质量:H 1 C 1 2 O 1 6 N a 2 3 S 3 2 N i 5 9
一、单项选择题:共 14 题,每题 3 分,共 42 分。每题只有一个选项最符合题意。
1.化学与生产、生活、科技等方面密切相关,下列说法正确的是( )。
A.德尔塔新冠病毒有可能在空气中以气溶胶的形式传播,气溶胶属于胶体
B.中科院首次实现了CO 合成淀粉,淀粉、蛋白质和油脂是人体必需的高分子营养物质 2
C.光化学烟雾、臭氧层空洞、温室效应的形成都与二氧化碳有关
D.乙醇常用于医疗消毒,浓度越高消毒效果越好
2.肼 N2H4 是发射航天飞船常用的高能燃料,可通过反应2NH3 NaClO N2H4 NaCl H2O 制备。
下列有关微粒的描述不.正确的是( )。
H H
A. NH3分子空间构型为三角锥形 B.N2H4的结构式为 | |
H N N H
35
C.NaClO 既含离子键又含共价键 D.中子数为 18 的氯的核素:17 Cl
3.实验室处理FeBr3 废液,得到溴的四氯化碳溶液和FeCl3 6H2O。下列设计不.能.达到实验目的的是( )。
A.用装置甲制取氯气
B.用装置乙使Br 全部转化为溴单质
C.用装置丙分液时,先从下口放出有机层,再从上口倒出水层
D.用装置丁将分液后的水层蒸发结晶得到FeCl3 6H2O
4.钠盐在生产、生活中有广泛应用。下列性质与用途具有对应关系的是( )。
A.NaClO 有强氧化性,可用于消毒杀菌
B. NaHSO3 有还原性,可用于漂白纸浆
C. NaHCO3能与碱反应,可用作焙制糕点的膨松剂
D. Na2CO3溶液显碱性,可用于制抗酸药物
5.前 4 周期元素(非 0 族)X、Y、Z、W 的原子序数依次增大。最外层电子数满足 Z=X+Y;X 原子半径
小于 Y 原子半径,Y 是空气中含量最多的元素;基态 Z 原子的电子总数是其最高能级电子数的 2 倍;W 在前
4 周期中原子未成对电子数最多。下列叙述正确的是( )。
A.X、Y、Z 三种元素形成的化合物水溶液一定呈酸性
B.Z 的简单气态氢化物的热稳定性比 Y 的强
C.第一电离能:Z>Y>X>W
W3 5D. 的基态电子排布式: Ar 3d
阅读下列资料,完成 6~8 题:氯化亚铜的化学式 CuCl 或Cu2Cl2 ,为白色立方结晶或白色粉末。微溶于水,
2 3
可溶于不同浓度的 KCl 溶液,生成 CuCl2 、 CuCl3 和 CuCl4 等离子。例如:
2 CuCl s 2Cl aq CuCl3 aq H
氯化亚铜溶于氨水生成氯化二氨合亚铜 Cu NH 3 Cl ,不溶于乙醇。 2
6.下列说法正确的是( )。
A. NH3不能形成分子间氢键 B.HCuCl2 中有 3 个配位键
C. NH3的键角大于H2O 的键角 D. Cu NH Cl中提供孤电子对的原子是 N 和 Cl 3 2
7.在指定条件下,下列选项所示的物质间转化可以实现的是( )。
KOH aq
A.HClO aq 光 照 Cl2 g B.Cl2 g KClO aq
Cu s C.Cl2 g CuCl点燃 s
SO2 g D.KClO aq ClO2 g
2
8.对于反应CuCl s 2Cl aq CuCl3 aq ,下列说法正确的是( )。
A.该反应的 H 0
2
c CuCl3
B.该反应的平衡常数可表示为K
c CuCl c2 Cl
C.加水可使该平衡向逆向移动
2
D.其他条件相同,增大 CuCl 的量,可加快生成 CuCl3 的速率
9.连二亚硫酸钠 Na2S2O4 俗称保险粉,常用于纺织工业、食品漂白等领域。某种 Na2S2O4 的生产工艺流
程如图所示,若在实验室模拟该工艺流程,下列说法不.正确的是( )。
A.将锌粉投入水中形成悬浮液主要是为了加快反应速率
B.向 Na2S2O4 溶液中加 NaCl 溶液或固体对Na2S2O4 的产率无明显影响
C.洗涤 Na2S2O4 2H2O时用冰水效果好于常温蒸馏水
D.该流程中涉及化合反应、分解反应、复分解反应和氧化还原反应
10.化合物 Z 是制备药物洛索洛芬钠的关键中间体,可由下列反应制得。
下列有关 X、Y、Z 的说法正确的是( )。
A.CH3CH2OH中sp
3
杂化的原子有 3 个
B.Y 在水中的溶解度比 Z 在水中的溶解度小
C.一定条件下,1mol Z 最多可以和 1mol NaOH 溶液反应
D.X、Y、Z 分别与足量酸性KMnO4 溶液反应所得芳香族化合物不相同
2
11.某小组设计下列实验验证Ag 和Fe 的反应为可逆反应。
实验 1:将0.0100mol L 1 Ag2SO4 溶液与0.0400mol L
1 FeSO4 溶液 pH 1 等体积混合,产生灰黑色沉
淀,溶液呈黄色。
实验 2:取Ⅰ中沉淀,加入浓硝酸,灰黑色固体溶解,产生红棕色气体。
实验 3:向少量 Ag 粉中加入0.0100mol L Fe2 SO4 溶液 pH 1 ,固体完全溶解。 3
下列说法正确的是( )。
2
A.实验 1 中发生反应的离子方程式为Ag2SO4 2Fe 2Fe
3 2Ag SO2 4
B.实验 2 可证明实验 1 中灰黑色沉淀为 Ag,产生气体为 NO
C.实验 3 中Fe2 SO4 溶液不可以用Fe NO3 溶液代替 3 3
D.银的晶胞结构如图,Ag 的配位数为 8
12.用惰性电极电解法制备硼酸 H3BO3 的工作原理如图所示(阳膜和阴膜分别只允许阳离子和阴离子通过)。
下列有关说法正确的是( )。
A.a 极接电源正极
B.膜 A 为阴膜,膜 B 为阳膜
C.电解过程中,b 极附近溶液 pH 增大
D.产品室中发生的反应为B OH H H3BO4 3 H2O
13.室温下,通过下列实验探究 NH4Al SO4 溶液的性质(假设实验前后溶液体积不变)。 2
1
实验 1:用 pH 试纸测定0.1mol L NH4Al SO4 溶液的 pH,测得 pH 约为 6 2
实验 2:向0.1mol L 1 NH4Al SO4 溶液中加入少量的Ba OH 溶液,产生白色沉淀 2 2
0.1mol L 1实验 3:向 NH4Al SO4 溶液中通入一定量的NH 至沉淀完全 2 3
0.1mol L 1实验 4:向 NH4Al SO4 溶液中加入Na CO 产生沉淀和气体 2 2 3
下列说法正确的是( )。
A.0.1mol L 1 NH4Al SO4
8
溶液中由水电离出的c H 约为10 mol L 1 2
B.实验 2 发生反应离子方程式为
NH 3 2 2 4 Al SO4 Ba 4OH BaSO4 Al OH NH3 H2O 3
2
C.实验 3 得到的溶液中有c NH4 c SO4 c H c OH
K sp Al2 CO 2 3 3
3
D.实验 4 过滤后所得清液中一定存在:c Al
c3 CO2 3
14.工业上,以煤炭为原料,通入一定比例的空气,经过系列反应可以得到满足不同需求的原料气。在 C 和O2
的反应体系中发生如下反应:
反应Ⅰ C s O2 g CO
1
2 g H1 394kJ mol
1
反应Ⅱ 2CO g O2 g 2CO2 g H2 566kJ mol
反应Ⅲ 2C s O2 g 2CO g H3
设 y H T S ,反应Ⅰ、Ⅱ和Ⅲ的 y 随温度的变化关系如图所示。
下列说法正确的是( )。
A.反应Ⅲ低温能自发进行,高温下不能自发进行
B.图中对应于反应Ⅱ的线条是 a
C.一定温度下,增大压强,O2 浓度增大,说明在此条件下反应Ⅱ变化的幅度小于反应Ⅲ变化的幅度
D.一定压强下,随着温度的升高,气体中 CO 与CO2的物质的量之比增大
二、非选择题:共 4 题,共 58 分。
15.(14 分)硫及其化合物性质与转化是一项重要研究课题。
(1)钠钙双碱法可高效脱除烟气中的SO2 ,脱硫的流程如图 1 所示。
①“吸收”时气液逆流在吸收塔中接触,采用气液逆流的目的是______。
②水溶液中H2SO3 、HSO
3 、SO
2
3 随 pH 的分布如图 2 所示,pH 5时,水溶液中
c SO2 3 :c H2SO3 ______。
③已知 Na2SO3 的溶解度随着 pH 增大而减小。向“再生液”中通入SO2 得到溶液 X,溶液 X 的 pH 对脱硫效
率的影响如图 3 所示。当 pH 由 6 升高到 7 时,脱硫效率迅速增大的原因为______;当 pH 大于 7 时,随 pH
增大脱硫效率增速放缓的原因为______。
(2)2.560g 硫单质与60.00mL 1.000mol L 1热 NaOH 溶液恰好完全反应,只生成Na2Sx 和 Na2S2O3,则
x ______。
(3)过硫酸钠 Na2S2O8 是白色晶状粉末,易溶于水,常用作漂白剂、氧化剂等。将 0.40mol 过硫酸钠与 0.20mol
硫酸配制成 1L溶液,在一定条件下,测得溶液中部分微粒的浓度如图 4所示(t时刻向溶液中加入少量MnO2 )。
①t 时刻前发生反应的离子方程式为______。
②图中气体 Y 的化学式为______。
16.(14 分)洛索洛芬钠(G)是一种抗炎镇痛药物,其一种合成路线如下:
(1)A 分子中碳原子的杂化方式为______。
(2)C 中所含官能团名称为______。
(3)B→C 的反应需经历 B→X→C 的过程。X 的分子式为C10H12O3 ,B→X 的反应类型为______。
(4)D 的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:______。
①含有苯环。
②能水解,且一定条件下完全水解后的产物都只含有两种不同化学环境的氢原子。
O
(5)写出以CH3CH2OH、 || 为原料制备 的合成路线流程图(涉
CH3CCH2COOC2H5
及题干中条件任用、无机试剂任用,合成路线流程图示例见本题题干)。
2
17.(15 分)一种利用废旧锂离子电池硫酸浸出液(含Li 、Cu 、Ni2 Mn2 Co2 Fe2 、 、 、 、Fe3 Al3 和 )
回收金属的工艺如下:
已知:①K sp Ni OH
14 17
2 1 10 K sp Fe OH 1 10 2
K sp Al OH 1 10
32.9
K sp Fe OH
39
3 3 1 10
5
②当溶液中离子的浓度小于1 10 mol L 1时认为沉淀完全
③Co2 、 Ni2 不易被氧化。
(1)加入NiCO3 固体调节 pH 时,需将溶液 pH 调至不低于______。
2
(2)“氧化沉铁”过程中,Fe 发生反应的离子方程式为______。
(3)本工艺中“沉铝”、“沉铁”过程均需将溶液加热煮沸,其目的是______。
(4)净化液经过一系列操作可提取硫酸镍,制得的粗硫酸镍固体中含有少量的FeSO4 、CuSO4 ,为了获得
高纯的硫酸镍固体(外界条件对 Ni 的回收率如图 1、图 2 所示),请补充实验方案:取一定量的粗硫酸镍固体
溶于足量稀硫酸中,______将滤液蒸发浓缩,冷却结晶,过滤,用冷水洗涤,干燥。(实验中可选择的试剂:O3 、
Cl 4mol L 1 12 、 NaOH 溶液,2mol L 的硫酸溶液,NiCO3 固体,蒸馏水,KSCN 溶液,K3 Fe CN 6
溶液。)
(5)测定粗产品中NiSO4 质量分数。取 2.000g 粗产品溶于水,配成 100mL 溶液,取 20.00mL 溶液,加入
NH 13 NH4Cl混合溶液调节 pH 为 9,加入指示剂后用0.05000mol L 的 EDTA Na2H2Y 标准溶液滴定至
终点(离子方程式为Ni2 H Y2 NiY2 2 2H ,消耗 EDTA 标准溶液 48.00mL,该硫酸镍的质量分数
为多少?(写出计算过程)
18.(15 分)
我国力争于 2030 年前做到碳达峰,2060 年前实现碳中和。资源化利用碳氧化合物能有效减少CO2排放,实
现自然界中的碳循环。
(1)以CO2、C2H6 为原料合成C2H4 涉及的主要反应如下:
1
Ⅰ.CO2 g C2H6 g C2H4 g H2O g CO g H 177kJ mol (主反应)
Ⅱ.C2H6 g CH4 g H2 g C s H 9kJ mol
1
(副反应)
反应Ⅰ的反应历程可分为如下两步:
ⅰ.C2H6 g C2H4 g H2 g H 1
ⅱ.H2 g CO2 g H2O g CO g
1
H 2 41kJ mol
① H1 ______。
②相比于提高c C2H6 ,提高c CO2 对反应Ⅰ速率影响更大,原因是______。
③0.1MPa 时,向一恒容密闭容器中充入物质的量之比为 2∶1 的CO2 g 和C2H6 g ,反应物转化率与反应
C2H4 g 的物质的量
温度的关系如图 1 所示。在 800℃,C2H4 g 的选择性[ ×100%]为______。
反应的C2H6 g 的物质的量
(2)CO2可制甲烷化,CO2可制甲烷化过程中,CO2活化的可能途径如图 2 所示。CO 是CO2活化的优势
中间体,可能的原因是______。
(3)CO2在熔融K2CO3中电解还原为正丙醇 CH3CH2CH2OH 的阴极反应式为______。
(4)CO2可用 CaO 吸收,发生反应:CaO s CO2 g CaCO3 s 。在不同温度下,达到平衡时体系
中CO2物质的量浓度 c CO2 与温度的关系如图 3 所示。900℃下的 c CO2 远大于 800℃下的c CO2 ,
其原因是______。
2022 届高三年级第二学期期初测试化学答案
1.A 2.B 3.D 4.A 5.B 6.C 7.B 8.C 9.B 10.A
11.C 12.D 13.C 14.D
15.(15 分)
(1)①增大接触面积,加快反应速率,提高SO2 吸收率。
101.2②
③“再生液”中 Na2SO3 的浓度增大,吸收SO2 的效率增强;随着 pH 进一步增大,“再生液”中Na2SO3 的
溶解度因 pH 增大而减小, Na2SO3 会析出,Na2SO3 浓度减小,脱硫效率增速放缓。
(2)3
一定条件
S O2 (3)① 2 8 2H O 2SO
2
2 4 H2O2 2H
②O2
16.(14 分)
2
(1)sp、sp 、 sp3
(2)碳溴键、羧基
(3)加成反应
(4) 或
浓H SO Br
(5)CH CH OH 2 4 CH CH 23 2 2 2 CH BrCH Br 170℃ 2 2
17.(15 分)
(1)4.7
MnO (2) 4 3Fe
2 7H2O MnO2 3Fe OH 5H
3
(3)破坏Al OH 、Fe OH 胶体,使沉淀颗粒变大,利于过滤
3 3
(4)边搅拌边缓慢通入O ,至取少量反应后溶液滴加3 K 3 Fe CN 溶液,无蓝色沉淀生成,停止通O 。6 3
将反应后液体置于 80℃水浴加热,分批加入碳酸镍并搅拌,至 pH4.5~5.0,充分反应,静置过滤
( )n H Y2 5 2 0.05mol L 1 0.048L 0.0024mol
1Ni2 1H Y2 2
20mL 溶液中n Ni2 n H Y2 2 0.0024mol
0.0024mol 155g mol 5
硫酸镍的质量分数 100%=93.00%
2.000g
18.(15 分)
1
(1)① 136kJ mol
②反应ⅱ速率较慢(活化能较大),是反应Ⅰ的决速步骤。
③80%
(2)生成中间体反应的活化能小,反应快;CO 中间体能量低,稳定,利于生成(或反应放热,利于中间体
的生成)。
(3)12CO2 18e
4H2O CH3CH2CH2OH 9CO
2
3
1
(4)由于CaO s CO2 g CaCO3 s H 0,温度升高 K 减小,K CO2 ,温度升高平衡体
c
系中c CO2 增大。
(反应的平衡常数也可以表述为反应正向进行程度,但描述成温度越高,平衡逆向移动)
同课章节目录
