第八章常见的酸、碱、盐章节复习—2021-2022学年九年级化学科粤版(2012)下册(word版有答案)
文档属性
| 名称 | 第八章常见的酸、碱、盐章节复习—2021-2022学年九年级化学科粤版(2012)下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 186.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-10 09:28:51 | ||
图片预览



文档简介
第八章常见的酸、碱、盐 章节复习2021-2022学年九年级下册化学科粤版(2012)
一、单选题
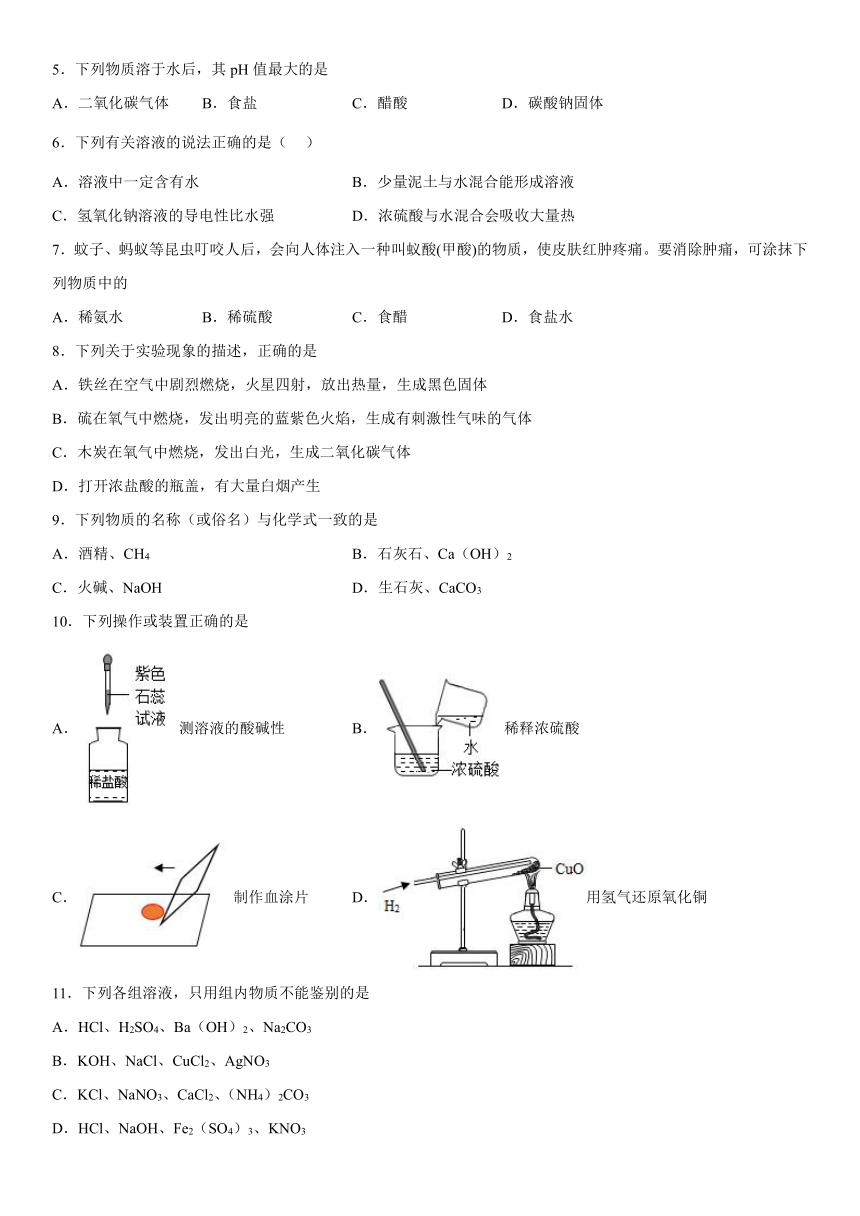
1.下列有关图标或实验操作正确的是
A.检验氧气 B.稀释浓硫酸
C.吸取液体 D.禁止带火种
2.下列实验现象描述正确的是
A.镁条在空气中燃烧发出耀眼的白光,生成白色固体
B.打开盛有浓盐酸的试剂瓶盖,瓶口上方会出现白烟
C.将CO2气体通入紫色石蕊溶液,溶液变蓝
D.将木炭在空气中点燃后伸至氧气瓶中,生成二氧化碳气体
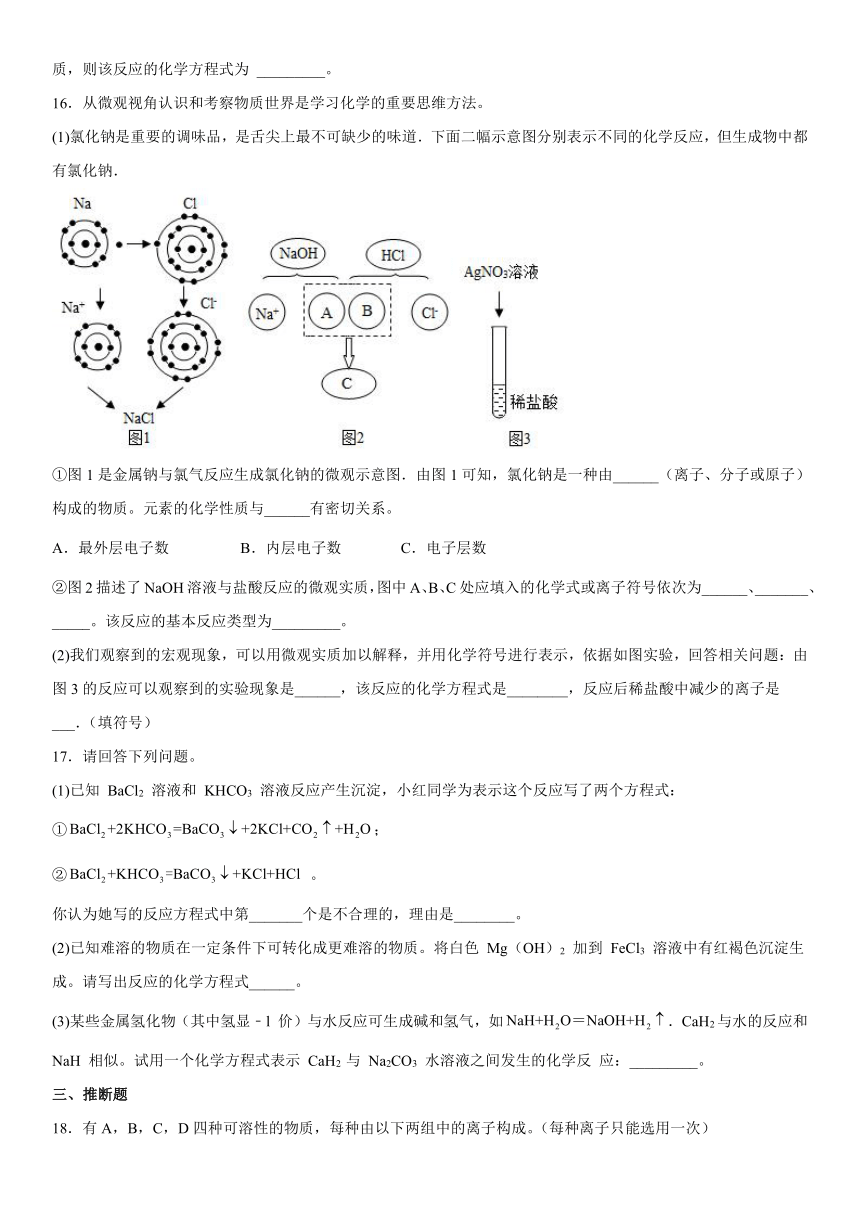
3.下列有关实验现象描述或数据记录正确的是
A.细铁丝在氧气中燃烧,火星四射,生成三氧化二铁
B.打开浓盐酸的瓶盖,瓶口看到白雾
C.用10mL的量筒量得液体体积为7.55mL
D.用pH试纸粗略测定某溶液的pH为8.5
4.如图所示,当胶头滴管中的液体滴入到锥形瓶中时,会引起气球膨胀的是
选项 A B C D
锥形瓶 二氧化锰 锌粒 二氧化碳 生石灰
胶头滴管 双氧水 稀硫酸 石灰水 水
A.A B.B C.C D.D
5.下列物质溶于水后,其pH值最大的是
A.二氧化碳气体 B.食盐 C.醋酸 D.碳酸钠固体
6.下列有关溶液的说法正确的是( )
A.溶液中一定含有水 B.少量泥土与水混合能形成溶液
C.氢氧化钠溶液的导电性比水强 D.浓硫酸与水混合会吸收大量热
7.蚊子、蚂蚁等昆虫叮咬人后,会向人体注入一种叫蚁酸(甲酸)的物质,使皮肤红肿疼痛。要消除肿痛,可涂抹下列物质中的
A.稀氨水 B.稀硫酸 C.食醋 D.食盐水
8.下列关于实验现象的描述,正确的是
A.铁丝在空气中剧烈燃烧,火星四射,放出热量,生成黑色固体
B.硫在氧气中燃烧,发出明亮的蓝紫色火焰,生成有刺激性气味的气体
C.木炭在氧气中燃烧,发出白光,生成二氧化碳气体
D.打开浓盐酸的瓶盖,有大量白烟产生
9.下列物质的名称(或俗名)与化学式一致的是
A.酒精、CH4 B.石灰石、Ca(OH)2
C.火碱、NaOH D.生石灰、CaCO3
10.下列操作或装置正确的是
A.测溶液的酸碱性 B.稀释浓硫酸
C.制作血涂片 D.用氢气还原氧化铜
11.下列各组溶液,只用组内物质不能鉴别的是
A.HCl、H2SO4、Ba(OH)2、Na2CO3
B.KOH、NaCl、CuCl2、AgNO3
C.KCl、NaNO3、CaCl2、(NH4)2CO3
D.HCl、NaOH、Fe2(SO4)3、KNO3
二、填空题
12.请用下列物质的化学式填空:
① 氧化钙 ②熟石灰 ③氯化铵 ④碳酸钾 ⑤碳酸氢钠
(1)常用作发酵粉的是________;
(2)常用作干燥剂的是_________;
(3)常用作化肥的是_________;
(4)可用于改良酸性土壤的是____________。
13.用适当的化学用语填空
(1)2个铵根离子______。
(2)氩气______。
(3)标出氧化铁中铁元素化合价______。
(4)常用于改良酸性土壤的碱______。
14.能源和矿石资源是人类活动的物质基础,化学反应伴随能量的变化。
(1)化石燃料为不可再生能源,包括煤、_____和天然气。
(2)煤燃烧时排放出_____、NO2等气体,溶于水会形成酸雨,为充分利用煤的燃烧,常将煤粉碎,其目的是_______。
(3)沼气是经过微生物发酵产生的可燃性气体,其主要成分是甲烷,甲烷燃烧的化学方程式为___。
(4)生石灰与水反应放热,该反应的化学方程式为_____。
(5)目前,德州市公交车已逐步更换为电动新能源车,请结合生活实际,写出一条符合节能环保主题的具体做法________。(答出一条即可)
15.新型高导热镁合金常用作电动汽车和消费电子产品的散热器。请根据如图回答有关问题。
(1)由图1可知,镁的相对原子质量为 ________。
(2)图2为镁离子的结构示意图,则x的数值为 _______,表示镁离子的符号为 _______。
(3)以化合价为纵坐标、物质类别为横坐标所绘制的图叫价类二维图。图3为镁的价类二维图,B处的物质类别是 _______。价类二维图中的物质在一定条件下可以相互转化,例如金属镁和水发生反应可以生成A和一种可燃性单质,则该反应的化学方程式为 _________。
16.从微观视角认识和考察物质世界是学习化学的重要思维方法。
(1)氯化钠是重要的调味品,是舌尖上最不可缺少的味道.下面二幅示意图分别表示不同的化学反应,但生成物中都有氯化钠.
①图1是金属钠与氯气反应生成氯化钠的微观示意图.由图1可知,氯化钠是一种由______(离子、分子或原子)构成的物质。元素的化学性质与______有密切关系。
A.最外层电子数 B.内层电子数 C.电子层数
②图2描述了NaOH溶液与盐酸反应的微观实质,图中A、B、C处应填入的化学式或离子符号依次为______、_______、_____。该反应的基本反应类型为_________。
(2)我们观察到的宏观现象,可以用微观实质加以解释,并用化学符号进行表示,依据如图实验,回答相关问题:由图3的反应可以观察到的实验现象是______,该反应的化学方程式是________,反应后稀盐酸中减少的离子是___.(填符号)
17.请回答下列问题。
(1)已知 BaCl2 溶液和 KHCO3 溶液反应产生沉淀,小红同学为表示这个反应写了两个方程式:
①;
② 。
你认为她写的反应方程式中第_______个是不合理的,理由是________。
(2)已知难溶的物质在一定条件下可转化成更难溶的物质。将白色 Mg(OH)2 加到 FeCl3 溶液中有红褐色沉淀生成。请写出反应的化学方程式______。
(3)某些金属氢化物(其中氢显﹣l 价)与水反应可生成碱和氢气,如.CaH2与水的反应和 NaH 相似。试用一个化学方程式表示 CaH2 与 Na2CO3 水溶液之间发生的化学反 应:_________。
三、推断题
18.有A,B,C,D四种可溶性的物质,每种由以下两组中的离子构成。(每种离子只能选用一次)
阳离子
阴离子
四种物质之间的反应有如下现象:
(1)A+B→白色沉淀,不溶于稀硝酸。
(2)B+D→蓝色沉淀。
(3)C+B→白色沉淀,再加稀硝酸沉淀溶解并生成C。
由此可推知:A为_____,B为_____,C为_____,D为_____。(写化学式)
19.为鉴别碳酸氢铵、氯化铵和尿素三种化肥,分别取三种样品编号为A、B、C,并进行如下实验:
(1)请分别写出B、C所对应化肥的化学式。_____、_____。
(2)请写出加入盐酸产生气体的化学方程式_____。
(3)铵态氮肥遇碱产生氨气,氨气与雨水作用可形成“碱雨”。请写一个中和“碱雨”的化学方程式_____。
20.A、B、C、D、E为初中化学常见的五种物质,它们之间的关系如下图所示,“→”表示转化关系,反应条件已略去。其中B可做干燥剂,C为光合作用的原料,D常温下为无色无味的液体。根据要
求回答下列问题:
(1)写出B的化学式__________。
(2)写出C与D发生的化学方程式:________;该反应属于基本反应类型的________。
(3)写出②发生的化学方程式________,该反应可用于_________。
21.A-G是初中化学的常见物质,AB和EF分别是由相同元素组成的化合物,D、E、F在通常状况下是气体,G是大理石的主要成分,其转化关系如图所示,部分反应物、生成物和反应条件未标出。
(1)写出下列物质的化学式:A_________;G _________。
(2)反应②是放热反应,则反应②的化学方程式是_________。
(3)F的用途有_________。
(4)写出反应④的化学方程式_________。(要求该反应不属于化合反应)
四、计算题
22.某同学发现张大爷家菜园中的蔬菜生长迟缓,便帮他购买施用了一包化肥,如图为该包化肥的外包装标签上的部分说明,请仔细阅读标签并回答下列问题(商品的标签或说明书上常常用质量分数来表示某物质的成分或纯度):
(1)硝酸铵中氮元素和氢元素的质量比为 (填最简整数比)。
(2)硝酸铵中氮元素的质量分数为 ,因此证明这包氮肥包装标签的说明 (填“有”或“没有” )虚假之处。
(3)经化验证明这包化肥的纯度为96%(其余成分中无氮元素),则这包化肥中共含有多少kg的氮元素。(写出计算过程)
23.工业上煅烧石灰石可以制得氧化钙和二氧化碳,计算如需生产4.4吨二氧化碳,理论上需要碳酸钙的质量是多少吨?
24.实验室有硫酸钠和碳酸钠混合的白色粉末,老师让小明利用这些白色粉末,进行如下图所示实验:
请结合实验及相关数据回答下列问题:
(1)请写出实验过程中生成沉淀的反应的化学方程式______;
(2)根据已知条件写出求解生成沉淀质量X的比例式为______;
(3)实验中所用稀硫酸的溶质的质量分数为______;
(4)硫酸钠和碳酸钠的质量比为______;
(5)加入的氢氧化钠的质量为______;
(6)所加氢氧化钡溶液的溶质的质量分数为______。
25.在烧杯中盛有22.3gNa2CO3和NaCl组成的固体混合物,向其中逐渐滴加质量分数为10%的稀盐酸,放出气体的质量与所滴入稀盐酸的质量关系曲线如图所示,请根据题意回答:
(1)在实验过程中发生反应的化学方程式为______。
(2)根据已知条件列出求解生成气体质量(X)的比例式______。
(3)固体混合物中氯化钠的质量为______。
(4)当滴入稀盐酸至图中B点时,烧杯中溶液里的溶质是(写化学式)______。
(5)当滴加稀盐酸至图中A点时,生成气体的质量是______。
(6)当滴加了73g稀盐酸时,要使溶液中溶质的质量分数为10%,需要再向溶液中加入水的质量为______。
试卷第1页,共3页
参考答案:
1.D
2.A
3.B
4.C
5.D
6.C
7.A
8.B
9.C
10.D
11.C
12.(1)NaHCO3
(2)CaO
(3)NH4Cl、K2CO3
(4)Ca(OH)2
13.(1)2
(2)Ar
(3)
(4)Ca(OH)2
14.(1)石油
(2) 二氧化硫##SO2 增加可燃物与氧气的接触面积,促进燃烧
(3)
(4)
(5)生活中出行少开私家车、多使用公共交通工具
15.(1)24.31
(2) 12 Mg2+
(3) 盐 Mg+2H2O=Mg(OH)2+H2↑
16.(1) 离子 A OH- H+ H2O 复分解反应
(2) 有白色沉淀产生
Cl-
17.(1) ② 生成物为碳酸钡和盐酸,二者可以反应生成氯化钡、二氧化碳和水,不能共存
(2)
(3)
18. Na2SO4 Ba(OH)2 Mg(NO3)2 CuCl2
19. NH4HCO3 NH4Cl NH4HCO3+HCl=NH4Cl+H2O+CO2↑ NH3H2O +HCl=NH4Cl+H2O
20.(1)CaO
(2)
化合反应
(3)
检验二氧化碳
21.(1) H2O2 CaCO3
(2)
(3)灭火等
(4)
22.(1)7:1;(2)35% ;有;(3)50kg×96%×35%=16.8kg
23.设理论上需要碳酸钙的质量为x,
x=10t
答:理论上需要碳酸钙的质量是10t。
24.(1)
(2)
(3)9.8%
(4)71:53
(5)4.5g
(6)17.1%
25.(1)2HCl+Na2CO3=2NaCl+H2O+CO2↑
(2)73g10%的稀盐酸中含HCl的质量是:73g×10%=7. 3g,设放出气体的总质量为x,参加反应的碳酸钠的质量为y, 反应生成的氯化钠的质量为z
生成气体质量(X)的比例式为
(3)根据题(2)可知,列比例式:,y=10.6g,碳酸钠的质量为10.6g,固体混合物中氯化钠的质量为22.3g-10.6g=11.7g
(4)NaCl、HCl
(5)根据题(2)可知,列比例式:,x=4.4g,当滴加稀盐酸至图中A点时,生成气体的质量是4.4g
(6)根据题(2)可知,列比例式:,z=11.7g,反应生成的氯化钠的质量为11.7g,烧杯里溶液中溶质的质量为:11. 7g+ (22. 3g-10. 6g) =23. 4g,烧杯里溶液质量为:22. 3g+73g-4. 4g=90. 9g,
烧杯里不饱和溶液中溶质的质量分数为:
设要使溶液中溶质的质量分数为10%,需要再向溶液中加入水的质量为m,
23. 4g=(90. 9g+m) ×10%
m=143. 1g
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列有关图标或实验操作正确的是
A.检验氧气 B.稀释浓硫酸
C.吸取液体 D.禁止带火种
2.下列实验现象描述正确的是
A.镁条在空气中燃烧发出耀眼的白光,生成白色固体
B.打开盛有浓盐酸的试剂瓶盖,瓶口上方会出现白烟
C.将CO2气体通入紫色石蕊溶液,溶液变蓝
D.将木炭在空气中点燃后伸至氧气瓶中,生成二氧化碳气体
3.下列有关实验现象描述或数据记录正确的是
A.细铁丝在氧气中燃烧,火星四射,生成三氧化二铁
B.打开浓盐酸的瓶盖,瓶口看到白雾
C.用10mL的量筒量得液体体积为7.55mL
D.用pH试纸粗略测定某溶液的pH为8.5
4.如图所示,当胶头滴管中的液体滴入到锥形瓶中时,会引起气球膨胀的是
选项 A B C D
锥形瓶 二氧化锰 锌粒 二氧化碳 生石灰
胶头滴管 双氧水 稀硫酸 石灰水 水
A.A B.B C.C D.D
5.下列物质溶于水后,其pH值最大的是
A.二氧化碳气体 B.食盐 C.醋酸 D.碳酸钠固体
6.下列有关溶液的说法正确的是( )
A.溶液中一定含有水 B.少量泥土与水混合能形成溶液
C.氢氧化钠溶液的导电性比水强 D.浓硫酸与水混合会吸收大量热
7.蚊子、蚂蚁等昆虫叮咬人后,会向人体注入一种叫蚁酸(甲酸)的物质,使皮肤红肿疼痛。要消除肿痛,可涂抹下列物质中的
A.稀氨水 B.稀硫酸 C.食醋 D.食盐水
8.下列关于实验现象的描述,正确的是
A.铁丝在空气中剧烈燃烧,火星四射,放出热量,生成黑色固体
B.硫在氧气中燃烧,发出明亮的蓝紫色火焰,生成有刺激性气味的气体
C.木炭在氧气中燃烧,发出白光,生成二氧化碳气体
D.打开浓盐酸的瓶盖,有大量白烟产生
9.下列物质的名称(或俗名)与化学式一致的是
A.酒精、CH4 B.石灰石、Ca(OH)2
C.火碱、NaOH D.生石灰、CaCO3
10.下列操作或装置正确的是
A.测溶液的酸碱性 B.稀释浓硫酸
C.制作血涂片 D.用氢气还原氧化铜
11.下列各组溶液,只用组内物质不能鉴别的是
A.HCl、H2SO4、Ba(OH)2、Na2CO3
B.KOH、NaCl、CuCl2、AgNO3
C.KCl、NaNO3、CaCl2、(NH4)2CO3
D.HCl、NaOH、Fe2(SO4)3、KNO3
二、填空题
12.请用下列物质的化学式填空:
① 氧化钙 ②熟石灰 ③氯化铵 ④碳酸钾 ⑤碳酸氢钠
(1)常用作发酵粉的是________;
(2)常用作干燥剂的是_________;
(3)常用作化肥的是_________;
(4)可用于改良酸性土壤的是____________。
13.用适当的化学用语填空
(1)2个铵根离子______。
(2)氩气______。
(3)标出氧化铁中铁元素化合价______。
(4)常用于改良酸性土壤的碱______。
14.能源和矿石资源是人类活动的物质基础,化学反应伴随能量的变化。
(1)化石燃料为不可再生能源,包括煤、_____和天然气。
(2)煤燃烧时排放出_____、NO2等气体,溶于水会形成酸雨,为充分利用煤的燃烧,常将煤粉碎,其目的是_______。
(3)沼气是经过微生物发酵产生的可燃性气体,其主要成分是甲烷,甲烷燃烧的化学方程式为___。
(4)生石灰与水反应放热,该反应的化学方程式为_____。
(5)目前,德州市公交车已逐步更换为电动新能源车,请结合生活实际,写出一条符合节能环保主题的具体做法________。(答出一条即可)
15.新型高导热镁合金常用作电动汽车和消费电子产品的散热器。请根据如图回答有关问题。
(1)由图1可知,镁的相对原子质量为 ________。
(2)图2为镁离子的结构示意图,则x的数值为 _______,表示镁离子的符号为 _______。
(3)以化合价为纵坐标、物质类别为横坐标所绘制的图叫价类二维图。图3为镁的价类二维图,B处的物质类别是 _______。价类二维图中的物质在一定条件下可以相互转化,例如金属镁和水发生反应可以生成A和一种可燃性单质,则该反应的化学方程式为 _________。
16.从微观视角认识和考察物质世界是学习化学的重要思维方法。
(1)氯化钠是重要的调味品,是舌尖上最不可缺少的味道.下面二幅示意图分别表示不同的化学反应,但生成物中都有氯化钠.
①图1是金属钠与氯气反应生成氯化钠的微观示意图.由图1可知,氯化钠是一种由______(离子、分子或原子)构成的物质。元素的化学性质与______有密切关系。
A.最外层电子数 B.内层电子数 C.电子层数
②图2描述了NaOH溶液与盐酸反应的微观实质,图中A、B、C处应填入的化学式或离子符号依次为______、_______、_____。该反应的基本反应类型为_________。
(2)我们观察到的宏观现象,可以用微观实质加以解释,并用化学符号进行表示,依据如图实验,回答相关问题:由图3的反应可以观察到的实验现象是______,该反应的化学方程式是________,反应后稀盐酸中减少的离子是___.(填符号)
17.请回答下列问题。
(1)已知 BaCl2 溶液和 KHCO3 溶液反应产生沉淀,小红同学为表示这个反应写了两个方程式:
①;
② 。
你认为她写的反应方程式中第_______个是不合理的,理由是________。
(2)已知难溶的物质在一定条件下可转化成更难溶的物质。将白色 Mg(OH)2 加到 FeCl3 溶液中有红褐色沉淀生成。请写出反应的化学方程式______。
(3)某些金属氢化物(其中氢显﹣l 价)与水反应可生成碱和氢气,如.CaH2与水的反应和 NaH 相似。试用一个化学方程式表示 CaH2 与 Na2CO3 水溶液之间发生的化学反 应:_________。
三、推断题
18.有A,B,C,D四种可溶性的物质,每种由以下两组中的离子构成。(每种离子只能选用一次)
阳离子
阴离子
四种物质之间的反应有如下现象:
(1)A+B→白色沉淀,不溶于稀硝酸。
(2)B+D→蓝色沉淀。
(3)C+B→白色沉淀,再加稀硝酸沉淀溶解并生成C。
由此可推知:A为_____,B为_____,C为_____,D为_____。(写化学式)
19.为鉴别碳酸氢铵、氯化铵和尿素三种化肥,分别取三种样品编号为A、B、C,并进行如下实验:
(1)请分别写出B、C所对应化肥的化学式。_____、_____。
(2)请写出加入盐酸产生气体的化学方程式_____。
(3)铵态氮肥遇碱产生氨气,氨气与雨水作用可形成“碱雨”。请写一个中和“碱雨”的化学方程式_____。
20.A、B、C、D、E为初中化学常见的五种物质,它们之间的关系如下图所示,“→”表示转化关系,反应条件已略去。其中B可做干燥剂,C为光合作用的原料,D常温下为无色无味的液体。根据要
求回答下列问题:
(1)写出B的化学式__________。
(2)写出C与D发生的化学方程式:________;该反应属于基本反应类型的________。
(3)写出②发生的化学方程式________,该反应可用于_________。
21.A-G是初中化学的常见物质,AB和EF分别是由相同元素组成的化合物,D、E、F在通常状况下是气体,G是大理石的主要成分,其转化关系如图所示,部分反应物、生成物和反应条件未标出。
(1)写出下列物质的化学式:A_________;G _________。
(2)反应②是放热反应,则反应②的化学方程式是_________。
(3)F的用途有_________。
(4)写出反应④的化学方程式_________。(要求该反应不属于化合反应)
四、计算题
22.某同学发现张大爷家菜园中的蔬菜生长迟缓,便帮他购买施用了一包化肥,如图为该包化肥的外包装标签上的部分说明,请仔细阅读标签并回答下列问题(商品的标签或说明书上常常用质量分数来表示某物质的成分或纯度):
(1)硝酸铵中氮元素和氢元素的质量比为 (填最简整数比)。
(2)硝酸铵中氮元素的质量分数为 ,因此证明这包氮肥包装标签的说明 (填“有”或“没有” )虚假之处。
(3)经化验证明这包化肥的纯度为96%(其余成分中无氮元素),则这包化肥中共含有多少kg的氮元素。(写出计算过程)
23.工业上煅烧石灰石可以制得氧化钙和二氧化碳,计算如需生产4.4吨二氧化碳,理论上需要碳酸钙的质量是多少吨?
24.实验室有硫酸钠和碳酸钠混合的白色粉末,老师让小明利用这些白色粉末,进行如下图所示实验:
请结合实验及相关数据回答下列问题:
(1)请写出实验过程中生成沉淀的反应的化学方程式______;
(2)根据已知条件写出求解生成沉淀质量X的比例式为______;
(3)实验中所用稀硫酸的溶质的质量分数为______;
(4)硫酸钠和碳酸钠的质量比为______;
(5)加入的氢氧化钠的质量为______;
(6)所加氢氧化钡溶液的溶质的质量分数为______。
25.在烧杯中盛有22.3gNa2CO3和NaCl组成的固体混合物,向其中逐渐滴加质量分数为10%的稀盐酸,放出气体的质量与所滴入稀盐酸的质量关系曲线如图所示,请根据题意回答:
(1)在实验过程中发生反应的化学方程式为______。
(2)根据已知条件列出求解生成气体质量(X)的比例式______。
(3)固体混合物中氯化钠的质量为______。
(4)当滴入稀盐酸至图中B点时,烧杯中溶液里的溶质是(写化学式)______。
(5)当滴加稀盐酸至图中A点时,生成气体的质量是______。
(6)当滴加了73g稀盐酸时,要使溶液中溶质的质量分数为10%,需要再向溶液中加入水的质量为______。
试卷第1页,共3页
参考答案:
1.D
2.A
3.B
4.C
5.D
6.C
7.A
8.B
9.C
10.D
11.C
12.(1)NaHCO3
(2)CaO
(3)NH4Cl、K2CO3
(4)Ca(OH)2
13.(1)2
(2)Ar
(3)
(4)Ca(OH)2
14.(1)石油
(2) 二氧化硫##SO2 增加可燃物与氧气的接触面积,促进燃烧
(3)
(4)
(5)生活中出行少开私家车、多使用公共交通工具
15.(1)24.31
(2) 12 Mg2+
(3) 盐 Mg+2H2O=Mg(OH)2+H2↑
16.(1) 离子 A OH- H+ H2O 复分解反应
(2) 有白色沉淀产生
Cl-
17.(1) ② 生成物为碳酸钡和盐酸,二者可以反应生成氯化钡、二氧化碳和水,不能共存
(2)
(3)
18. Na2SO4 Ba(OH)2 Mg(NO3)2 CuCl2
19. NH4HCO3 NH4Cl NH4HCO3+HCl=NH4Cl+H2O+CO2↑ NH3H2O +HCl=NH4Cl+H2O
20.(1)CaO
(2)
化合反应
(3)
检验二氧化碳
21.(1) H2O2 CaCO3
(2)
(3)灭火等
(4)
22.(1)7:1;(2)35% ;有;(3)50kg×96%×35%=16.8kg
23.设理论上需要碳酸钙的质量为x,
x=10t
答:理论上需要碳酸钙的质量是10t。
24.(1)
(2)
(3)9.8%
(4)71:53
(5)4.5g
(6)17.1%
25.(1)2HCl+Na2CO3=2NaCl+H2O+CO2↑
(2)73g10%的稀盐酸中含HCl的质量是:73g×10%=7. 3g,设放出气体的总质量为x,参加反应的碳酸钠的质量为y, 反应生成的氯化钠的质量为z
生成气体质量(X)的比例式为
(3)根据题(2)可知,列比例式:,y=10.6g,碳酸钠的质量为10.6g,固体混合物中氯化钠的质量为22.3g-10.6g=11.7g
(4)NaCl、HCl
(5)根据题(2)可知,列比例式:,x=4.4g,当滴加稀盐酸至图中A点时,生成气体的质量是4.4g
(6)根据题(2)可知,列比例式:,z=11.7g,反应生成的氯化钠的质量为11.7g,烧杯里溶液中溶质的质量为:11. 7g+ (22. 3g-10. 6g) =23. 4g,烧杯里溶液质量为:22. 3g+73g-4. 4g=90. 9g,
烧杯里不饱和溶液中溶质的质量分数为:
设要使溶液中溶质的质量分数为10%,需要再向溶液中加入水的质量为m,
23. 4g=(90. 9g+m) ×10%
m=143. 1g
答案第1页,共2页
答案第1页,共2页
