第八章常见的酸碱盐巩固—2021—2022学年九年级化学科粤版(2012)下册(word版有答案)
文档属性
| 名称 | 第八章常见的酸碱盐巩固—2021—2022学年九年级化学科粤版(2012)下册(word版有答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 120.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-10 00:00:00 | ||
图片预览


文档简介
第八章常见的酸碱盐巩固—2021—2022学年九年级化学科粤版(2012)下册
一、单选题
1.促进植物茎、叶生长茂盛,叶色浓绿,提高植物蛋白质含量的化肥是
A.K2SO4 B.NH4NO3 C.Ca3(PO4)2 D.Ca(H2PO4)2
2.下列有关物质的性质与用途对应关系正确的是
A.石墨质软,可用作电池电极
B.氮气难溶于水,可用作保护气
C.活性炭具有吸附性,可使硬水软化
D.生石灰与水反应,可做干燥剂
3.我们学习了一些物质,并能进行简单地分类。下列各组内物质表示同一种物质的是
A.氢氧化钠、烧碱 B.氢氧化钙、生石灰
C.紫铜、黄铜 D.干冰、水
4.某无色混合气体可能由CH4、H2、CO、CO2和HCl中的若干种气体组成,将此混合气体通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小,把剩余气体导出后,在O2中能够点燃,燃烧产物不能使白色CuSO4粉末变蓝色。则原混合气体中一定含有
A.HCl和CO B.HC1、H2和CO2 C.CH4和H2 D.CO和CO2
5.2021年“世界水日”的主题为“珍惜水、爱护水”。下列关于水的说法正确的是
A.过滤能将硬水转化为软水 B.用明矾对自来水进行杀菌消毒
C.用肥皂水区别硬水与软水 D.有水生成的反应一定是中和反应
6.下列有关物质的化学式、名称、俗名不完全对应的是
A.NaHCO3、碳酸氢钠、苏打 B.NaOH、氢氧化钠、烧碱
C.Na2CO3、碳酸钠、纯碱 D.NaCl、氯化钠、食盐
7.下列关于Ca(OH)2的说法错误的是( )
A.微溶于水,水溶液呈碱性
B.能与酸反应,可用于治疗胃酸过多
C.澄清溶液可用来检验CO2
D.与CuSO4溶液按一定比例混合,可配制波尔多液
8.分类学习是化学学习一种常用的方法,下列物质的分类正确的是
A.混合物:天然气、冰水混合物、生铁 B.酸:醋酸、碳酸、硝酸
C.碱:氢氧化钠、生石灰、一水合氨 D.盐:氯化镁、碳酸钠、干冰
9.某些金属氢化物与水反应可生成碱和氢气,如:NaH+H2O=NaOH+H2↑,CaH2与足量Na2CO3溶液之间发生反应的最终产物有
A.Ca(OH)2和H2
B.CaCO3、NaOH和H2
C.NaOH和Ca(OH)2
D.Ca(OH)2、CaCO3和H2
10.蚊子、蚂蚁等昆虫叮咬人后,会向人体注入一种叫蚁酸(甲酸)的物质,使皮肤红肿疼痛。要消除肿痛,可涂抹下列物质中的
A.稀氨水 B.稀硫酸 C.食醋 D.食盐水
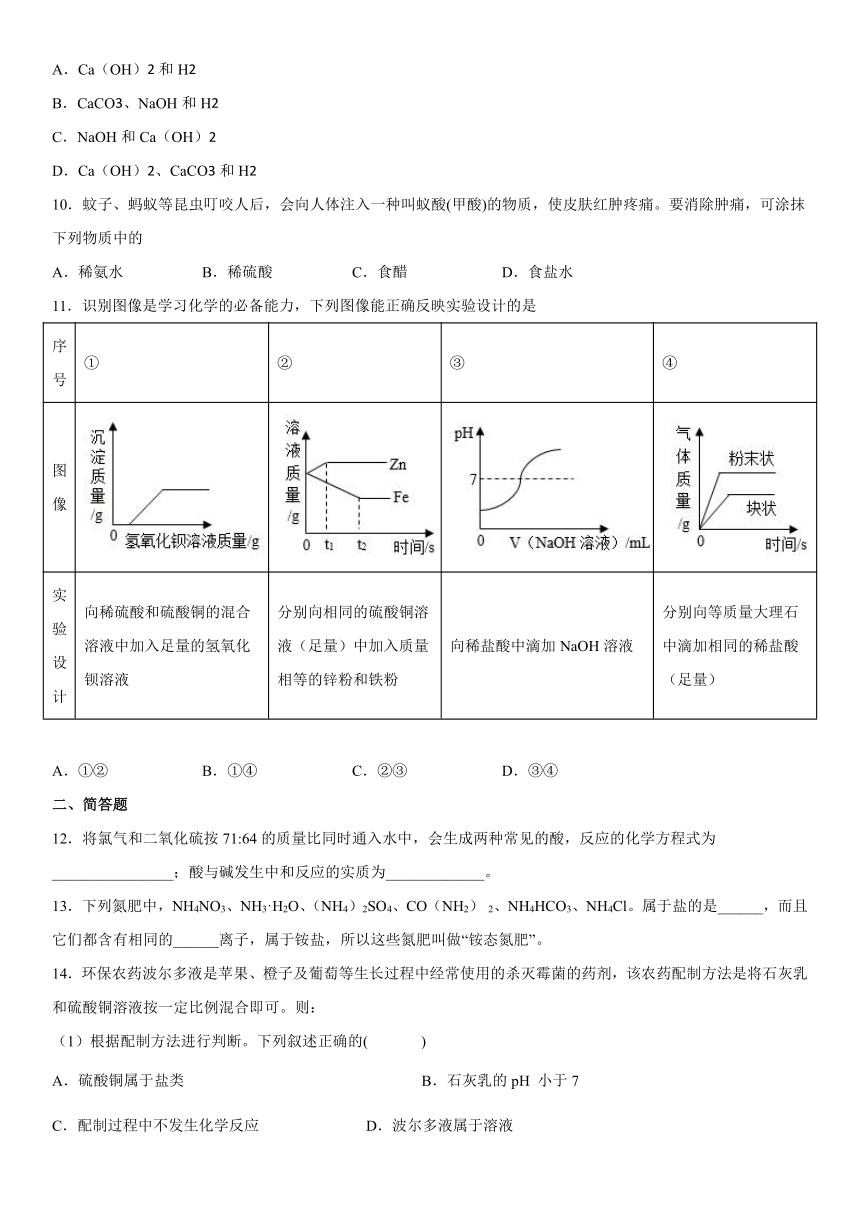
11.识别图像是学习化学的必备能力,下列图像能正确反映实验设计的是
序号 ① ② ③ ④
图像
实验 设计 向稀硫酸和硫酸铜的混合溶液中加入足量的氢氧化钡溶液 分别向相同的硫酸铜溶液(足量)中加入质量相等的锌粉和铁粉 向稀盐酸中滴加NaOH溶液 分别向等质量大理石中滴加相同的稀盐酸(足量)
A.①② B.①④ C.②③ D.③④
二、简答题
12.将氯气和二氧化硫按71:64的质量比同时通入水中,会生成两种常见的酸,反应的化学方程式为________________;酸与碱发生中和反应的实质为_____________。
13.下列氮肥中,NH4NO3、NH3·H2O、(NH4)2SO4、CO(NH2) 2、NH4HCO3、NH4Cl。属于盐的是______,而且它们都含有相同的______离子,属于铵盐,所以这些氮肥叫做“铵态氮肥”。
14.环保农药波尔多液是苹果、橙子及葡萄等生长过程中经常使用的杀灭霉菌的药剂,该农药配制方法是将石灰乳和硫酸铜溶液按一定比例混合即可。则:
(1)根据配制方法进行判断。下列叙述正确的( )
A.硫酸铜属于盐类 B.石灰乳的pH 小于7
C.配制过程中不发生化学反应 D.波尔多液属于溶液
(2)波尔多液是一种绿色农药,可替代多灵菌。配制和施用时不能用铁制容器,否则会___,其原因是(用化学方程式表示)______________________。
三、推断题
15.有A,B,C,D四种化合物,A是硝酸盐,B是酸,C是碱,D是含+3价元素的氯化物,发生以下反应:
(1)A,B的溶液混合后,出现不溶于稀硝酸的白色沉淀。
(2)B,C的溶液完全反应后,得到氯化钠溶液。
(3)C,D的溶液混合后,出现红褐色沉淀。试推断A,B,C,D的化学式。
A._____;B._____;C._____;D._____。
16.实验老师请化学兴趣小组的同学帮助他将失去标签的盐酸、氢氧化钠和硝酸钾三瓶溶液鉴别出来,重新贴好标签。为了鉴别这三种溶液,他们用试管各取三种溶液少许,编号为A、B、C,分别滴加酚酞试液,观察到A溶液变红色,B、C两溶液无变化;另用两支试管再各取B、C少许,分别滴加碳酸钠溶液,观察到C溶液有气泡产生,B溶液无变化。根据上述实验现象,请你推测:
(1)A溶液中溶质的化学式为___________,B溶液中溶质的化学式为_______________;
(2)C溶液滴加碳酸钠溶液后发生反应的化学方程式为_________。
17.A、B、C、D、E是初中化学常见的五种物质,A是石灰石的主要成分,E是能与血红蛋白结合的有毒气体,→表示转化关系,部分反应条件未注明。回答下列问题。
(1)物质E的化学式____________。
(2)写出物质E转化为物质C的化学反应方程式____________。
(3)物质B转化为物质D的过程会____________(填“吸收”或“放出”)热量。
18.已知A、B、C三种物质含有同种金属元素,其中A是大理石的主要成分,B为氧化物,E是易与血液中血红蛋白结合的有毒气体。它们之间的转化关系如图所示(部分转换关系反应条件已略去)。请回答:
(1)写出A、C、F的化学式:A___________,C___________,F___________。
(2)写出E与氧化铁反应的现象:___________,此反应说明E具有___________。
(3)写出A→B的反应化学方程式___________,该反应的基本反应类型为___________。
(4)写出E转化为D的化学方程式:___________。
四、实验题
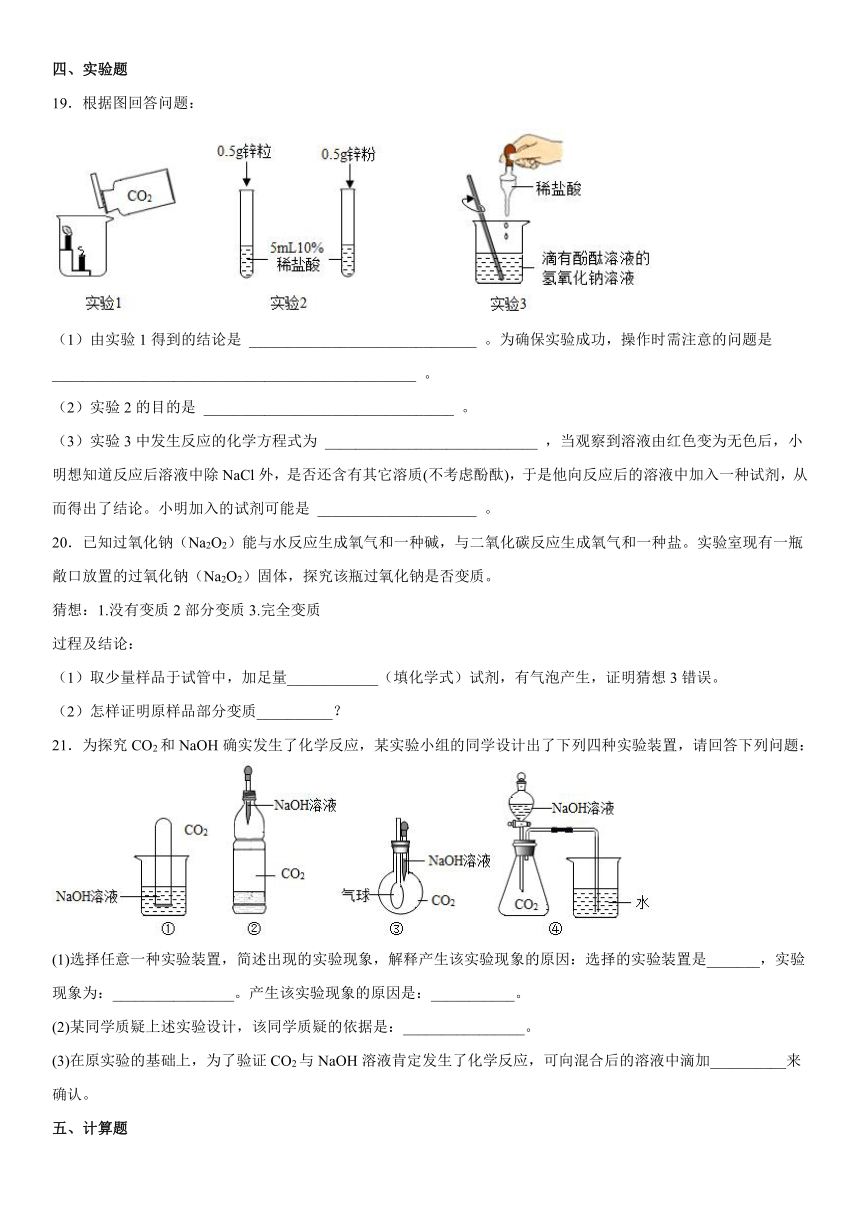
19.根据图回答问题:
(1)由实验1得到的结论是 ______________________________ 。为确保实验成功,操作时需注意的问题是 ________________________________________________ 。
(2)实验2的目的是 _________________________________ 。
(3)实验3中发生反应的化学方程式为 ____________________________ ,当观察到溶液由红色变为无色后,小明想知道反应后溶液中除NaCl外,是否还含有其它溶质(不考虑酚酞),于是他向反应后的溶液中加入一种试剂,从而得出了结论。小明加入的试剂可能是 _____________________ 。
20.已知过氧化钠(Na2O2)能与水反应生成氧气和一种碱,与二氧化碳反应生成氧气和一种盐。实验室现有一瓶敞口放置的过氧化钠(Na2O2)固体,探究该瓶过氧化钠是否变质。
猜想:1.没有变质2部分变质3.完全变质
过程及结论:
(1)取少量样品于试管中,加足量____________(填化学式)试剂,有气泡产生,证明猜想3错误。
(2)怎样证明原样品部分变质__________?
21.为探究CO2和NaOH确实发生了化学反应,某实验小组的同学设计出了下列四种实验装置,请回答下列问题:
(1)选择任意一种实验装置,简述出现的实验现象,解释产生该实验现象的原因:选择的实验装置是_______,实验现象为:________________。产生该实验现象的原因是:___________。
(2)某同学质疑上述实验设计,该同学质疑的依据是:________________。
(3)在原实验的基础上,为了验证CO2与NaOH溶液肯定发生了化学反应,可向混合后的溶液中滴加__________来确认。
五、计算题
22.某同学发现张大爷家菜园中的蔬菜生长迟缓,便帮他购买施用了一包化肥,如图为该包化肥的外包装标签上的部分说明,请仔细阅读标签并回答下列问题(商品的标签或说明书上常常用质量分数来表示某物质的成分或纯度):
(1)硝酸铵中氮元素和氢元素的质量比为 (填最简整数比)。
(2)硝酸铵中氮元素的质量分数为 ,因此证明这包氮肥包装标签的说明 (填“有”或“没有” )虚假之处。
(3)经化验证明这包化肥的纯度为96%(其余成分中无氮元素),则这包化肥中共含有多少kg的氮元素。(写出计算过程)
23.取NaOH和NaC1的混合物3.63g放入烧杯中,加水溶解配制成溶液,向该溶液滴加溶质质量分数为7.3%的稀盐酸,测得溶液pH与滴入稀盐酸的质量关系如图所示。
(1)当滴入稀盐酸的质量为11.2g时,溶液中的溶质是 (填化学式)。
(2)当pH=7时,计算所得溶液中溶质的质量(写出计算过程)。
24.高温煅烧100克含CaCO390%的石灰石一段时间后停止加热。反应过程中有如图所示关系:
(1)反应生成的二氧化碳质量为______g。
(2)求剩余固体中CaO的质量分数(计算结果保留到0.1%);
(3)结合计算判断C点固体中含的物质有______。(填化学式)
试卷第1页,共3页
参考答案:
1.B
2.D
3.A
4.A
5.C
6.A
7.B
8.B
9.B
10.A
11.C
12. 酸溶液中的H+与碱溶液中的OH-反应生成水。(或)
13. NH4NO3、(NH4)2SO4、NH4HCO3、NH4Cl 铵根
14. A 导致药效降低 Fe+CuSO4═FeSO4+Cu
15. AgNO3 HCl NaOH FeCl3
16. NaOH KNO3
17.(1)CO
(2)
(3)放热
18.(1) CaCO3 Ca(OH)2 C
(2) 红棕色粉末变成黑色 还原性
(3)
分解反应
(4)
19. 二氧化碳不燃烧也不支持燃烧,密度比空气大 沿蜡烛对面一侧烧杯内壁缓缓倾倒二氧化碳 探究反应物的状态对反应速率的影响 紫色石蕊溶液(或锌等活泼金属或碳酸钠溶液等)
20. H2O 向溶液中加入过量BaCl2溶液,产生白色沉淀静置,取上层清液滴加酚酞,若溶液变红,证明原样品部分变质
21.(1) ①/②/③/④ 试管内液面上升,烧杯内液面下降/软塑料瓶变瘪/气球胀大/烧杯内的水流入锥形瓶中 CO2与氢氧化钠溶液反应,使试管内气体压强减少,液体被压入试管中/CO2与氢氧化钠溶液反应,使塑料瓶内压强减少,大气压将软塑料瓶压瘪了/CO2与氢氧化钠溶液反应,使烧瓶内气体减少,大气压使气球胀大/CO2与氢氧化钠溶液反应,使锥形瓶内压强减少,大气压将水压入锥形瓶
(2)二氧化碳溶于水,使气体的体积减少,也可以产生类似的现象
(3)稀盐酸
22.(1)7:1;(2)35% ;有;(3)50kg×96%×35%=16.8kg
23.(1)NaCl、HCl;
(2)解:设氢氧化钠的质量为y,反应生成NaCl的质量为x
x=1.17g;
y=0.8g;
所得溶液中溶质的质量=(3.63g﹣0.8g)+1.17g=4g
答:所得溶液中溶质的质量4g
24.(1)22
(2)解:设反应生成氧化钙的质量为x,参加反应的碳酸钙的质量为y
x=28g
y=50g
剩余固体中氧化钙的质量分数为:
答:剩余固体中氧化钙的质量分数为35.9%
(3)CaCO3、CaO
答案第1页,共2页
答案第1页,共2页
一、单选题
1.促进植物茎、叶生长茂盛,叶色浓绿,提高植物蛋白质含量的化肥是
A.K2SO4 B.NH4NO3 C.Ca3(PO4)2 D.Ca(H2PO4)2
2.下列有关物质的性质与用途对应关系正确的是
A.石墨质软,可用作电池电极
B.氮气难溶于水,可用作保护气
C.活性炭具有吸附性,可使硬水软化
D.生石灰与水反应,可做干燥剂
3.我们学习了一些物质,并能进行简单地分类。下列各组内物质表示同一种物质的是
A.氢氧化钠、烧碱 B.氢氧化钙、生石灰
C.紫铜、黄铜 D.干冰、水
4.某无色混合气体可能由CH4、H2、CO、CO2和HCl中的若干种气体组成,将此混合气体通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小,把剩余气体导出后,在O2中能够点燃,燃烧产物不能使白色CuSO4粉末变蓝色。则原混合气体中一定含有
A.HCl和CO B.HC1、H2和CO2 C.CH4和H2 D.CO和CO2
5.2021年“世界水日”的主题为“珍惜水、爱护水”。下列关于水的说法正确的是
A.过滤能将硬水转化为软水 B.用明矾对自来水进行杀菌消毒
C.用肥皂水区别硬水与软水 D.有水生成的反应一定是中和反应
6.下列有关物质的化学式、名称、俗名不完全对应的是
A.NaHCO3、碳酸氢钠、苏打 B.NaOH、氢氧化钠、烧碱
C.Na2CO3、碳酸钠、纯碱 D.NaCl、氯化钠、食盐
7.下列关于Ca(OH)2的说法错误的是( )
A.微溶于水,水溶液呈碱性
B.能与酸反应,可用于治疗胃酸过多
C.澄清溶液可用来检验CO2
D.与CuSO4溶液按一定比例混合,可配制波尔多液
8.分类学习是化学学习一种常用的方法,下列物质的分类正确的是
A.混合物:天然气、冰水混合物、生铁 B.酸:醋酸、碳酸、硝酸
C.碱:氢氧化钠、生石灰、一水合氨 D.盐:氯化镁、碳酸钠、干冰
9.某些金属氢化物与水反应可生成碱和氢气,如:NaH+H2O=NaOH+H2↑,CaH2与足量Na2CO3溶液之间发生反应的最终产物有
A.Ca(OH)2和H2
B.CaCO3、NaOH和H2
C.NaOH和Ca(OH)2
D.Ca(OH)2、CaCO3和H2
10.蚊子、蚂蚁等昆虫叮咬人后,会向人体注入一种叫蚁酸(甲酸)的物质,使皮肤红肿疼痛。要消除肿痛,可涂抹下列物质中的
A.稀氨水 B.稀硫酸 C.食醋 D.食盐水
11.识别图像是学习化学的必备能力,下列图像能正确反映实验设计的是
序号 ① ② ③ ④
图像
实验 设计 向稀硫酸和硫酸铜的混合溶液中加入足量的氢氧化钡溶液 分别向相同的硫酸铜溶液(足量)中加入质量相等的锌粉和铁粉 向稀盐酸中滴加NaOH溶液 分别向等质量大理石中滴加相同的稀盐酸(足量)
A.①② B.①④ C.②③ D.③④
二、简答题
12.将氯气和二氧化硫按71:64的质量比同时通入水中,会生成两种常见的酸,反应的化学方程式为________________;酸与碱发生中和反应的实质为_____________。
13.下列氮肥中,NH4NO3、NH3·H2O、(NH4)2SO4、CO(NH2) 2、NH4HCO3、NH4Cl。属于盐的是______,而且它们都含有相同的______离子,属于铵盐,所以这些氮肥叫做“铵态氮肥”。
14.环保农药波尔多液是苹果、橙子及葡萄等生长过程中经常使用的杀灭霉菌的药剂,该农药配制方法是将石灰乳和硫酸铜溶液按一定比例混合即可。则:
(1)根据配制方法进行判断。下列叙述正确的( )
A.硫酸铜属于盐类 B.石灰乳的pH 小于7
C.配制过程中不发生化学反应 D.波尔多液属于溶液
(2)波尔多液是一种绿色农药,可替代多灵菌。配制和施用时不能用铁制容器,否则会___,其原因是(用化学方程式表示)______________________。
三、推断题
15.有A,B,C,D四种化合物,A是硝酸盐,B是酸,C是碱,D是含+3价元素的氯化物,发生以下反应:
(1)A,B的溶液混合后,出现不溶于稀硝酸的白色沉淀。
(2)B,C的溶液完全反应后,得到氯化钠溶液。
(3)C,D的溶液混合后,出现红褐色沉淀。试推断A,B,C,D的化学式。
A._____;B._____;C._____;D._____。
16.实验老师请化学兴趣小组的同学帮助他将失去标签的盐酸、氢氧化钠和硝酸钾三瓶溶液鉴别出来,重新贴好标签。为了鉴别这三种溶液,他们用试管各取三种溶液少许,编号为A、B、C,分别滴加酚酞试液,观察到A溶液变红色,B、C两溶液无变化;另用两支试管再各取B、C少许,分别滴加碳酸钠溶液,观察到C溶液有气泡产生,B溶液无变化。根据上述实验现象,请你推测:
(1)A溶液中溶质的化学式为___________,B溶液中溶质的化学式为_______________;
(2)C溶液滴加碳酸钠溶液后发生反应的化学方程式为_________。
17.A、B、C、D、E是初中化学常见的五种物质,A是石灰石的主要成分,E是能与血红蛋白结合的有毒气体,→表示转化关系,部分反应条件未注明。回答下列问题。
(1)物质E的化学式____________。
(2)写出物质E转化为物质C的化学反应方程式____________。
(3)物质B转化为物质D的过程会____________(填“吸收”或“放出”)热量。
18.已知A、B、C三种物质含有同种金属元素,其中A是大理石的主要成分,B为氧化物,E是易与血液中血红蛋白结合的有毒气体。它们之间的转化关系如图所示(部分转换关系反应条件已略去)。请回答:
(1)写出A、C、F的化学式:A___________,C___________,F___________。
(2)写出E与氧化铁反应的现象:___________,此反应说明E具有___________。
(3)写出A→B的反应化学方程式___________,该反应的基本反应类型为___________。
(4)写出E转化为D的化学方程式:___________。
四、实验题
19.根据图回答问题:
(1)由实验1得到的结论是 ______________________________ 。为确保实验成功,操作时需注意的问题是 ________________________________________________ 。
(2)实验2的目的是 _________________________________ 。
(3)实验3中发生反应的化学方程式为 ____________________________ ,当观察到溶液由红色变为无色后,小明想知道反应后溶液中除NaCl外,是否还含有其它溶质(不考虑酚酞),于是他向反应后的溶液中加入一种试剂,从而得出了结论。小明加入的试剂可能是 _____________________ 。
20.已知过氧化钠(Na2O2)能与水反应生成氧气和一种碱,与二氧化碳反应生成氧气和一种盐。实验室现有一瓶敞口放置的过氧化钠(Na2O2)固体,探究该瓶过氧化钠是否变质。
猜想:1.没有变质2部分变质3.完全变质
过程及结论:
(1)取少量样品于试管中,加足量____________(填化学式)试剂,有气泡产生,证明猜想3错误。
(2)怎样证明原样品部分变质__________?
21.为探究CO2和NaOH确实发生了化学反应,某实验小组的同学设计出了下列四种实验装置,请回答下列问题:
(1)选择任意一种实验装置,简述出现的实验现象,解释产生该实验现象的原因:选择的实验装置是_______,实验现象为:________________。产生该实验现象的原因是:___________。
(2)某同学质疑上述实验设计,该同学质疑的依据是:________________。
(3)在原实验的基础上,为了验证CO2与NaOH溶液肯定发生了化学反应,可向混合后的溶液中滴加__________来确认。
五、计算题
22.某同学发现张大爷家菜园中的蔬菜生长迟缓,便帮他购买施用了一包化肥,如图为该包化肥的外包装标签上的部分说明,请仔细阅读标签并回答下列问题(商品的标签或说明书上常常用质量分数来表示某物质的成分或纯度):
(1)硝酸铵中氮元素和氢元素的质量比为 (填最简整数比)。
(2)硝酸铵中氮元素的质量分数为 ,因此证明这包氮肥包装标签的说明 (填“有”或“没有” )虚假之处。
(3)经化验证明这包化肥的纯度为96%(其余成分中无氮元素),则这包化肥中共含有多少kg的氮元素。(写出计算过程)
23.取NaOH和NaC1的混合物3.63g放入烧杯中,加水溶解配制成溶液,向该溶液滴加溶质质量分数为7.3%的稀盐酸,测得溶液pH与滴入稀盐酸的质量关系如图所示。
(1)当滴入稀盐酸的质量为11.2g时,溶液中的溶质是 (填化学式)。
(2)当pH=7时,计算所得溶液中溶质的质量(写出计算过程)。
24.高温煅烧100克含CaCO390%的石灰石一段时间后停止加热。反应过程中有如图所示关系:
(1)反应生成的二氧化碳质量为______g。
(2)求剩余固体中CaO的质量分数(计算结果保留到0.1%);
(3)结合计算判断C点固体中含的物质有______。(填化学式)
试卷第1页,共3页
参考答案:
1.B
2.D
3.A
4.A
5.C
6.A
7.B
8.B
9.B
10.A
11.C
12. 酸溶液中的H+与碱溶液中的OH-反应生成水。(或)
13. NH4NO3、(NH4)2SO4、NH4HCO3、NH4Cl 铵根
14. A 导致药效降低 Fe+CuSO4═FeSO4+Cu
15. AgNO3 HCl NaOH FeCl3
16. NaOH KNO3
17.(1)CO
(2)
(3)放热
18.(1) CaCO3 Ca(OH)2 C
(2) 红棕色粉末变成黑色 还原性
(3)
分解反应
(4)
19. 二氧化碳不燃烧也不支持燃烧,密度比空气大 沿蜡烛对面一侧烧杯内壁缓缓倾倒二氧化碳 探究反应物的状态对反应速率的影响 紫色石蕊溶液(或锌等活泼金属或碳酸钠溶液等)
20. H2O 向溶液中加入过量BaCl2溶液,产生白色沉淀静置,取上层清液滴加酚酞,若溶液变红,证明原样品部分变质
21.(1) ①/②/③/④ 试管内液面上升,烧杯内液面下降/软塑料瓶变瘪/气球胀大/烧杯内的水流入锥形瓶中 CO2与氢氧化钠溶液反应,使试管内气体压强减少,液体被压入试管中/CO2与氢氧化钠溶液反应,使塑料瓶内压强减少,大气压将软塑料瓶压瘪了/CO2与氢氧化钠溶液反应,使烧瓶内气体减少,大气压使气球胀大/CO2与氢氧化钠溶液反应,使锥形瓶内压强减少,大气压将水压入锥形瓶
(2)二氧化碳溶于水,使气体的体积减少,也可以产生类似的现象
(3)稀盐酸
22.(1)7:1;(2)35% ;有;(3)50kg×96%×35%=16.8kg
23.(1)NaCl、HCl;
(2)解:设氢氧化钠的质量为y,反应生成NaCl的质量为x
x=1.17g;
y=0.8g;
所得溶液中溶质的质量=(3.63g﹣0.8g)+1.17g=4g
答:所得溶液中溶质的质量4g
24.(1)22
(2)解:设反应生成氧化钙的质量为x,参加反应的碳酸钙的质量为y
x=28g
y=50g
剩余固体中氧化钙的质量分数为:
答:剩余固体中氧化钙的质量分数为35.9%
(3)CaCO3、CaO
答案第1页,共2页
答案第1页,共2页
