从铝土矿中提取铝
图片预览

文档简介
从铝土矿中提取铝
班级_______姓名_________学号_______
[学习目标]
1、了解地壳中铝元素的含量,知道铝元素在自然界的主要存在形式。
2、了解工业上从铝土矿中提取铝的方法。
【课前检测】
1、⑴写出表示氧化铝是两性氧化物的离子方程式
,
⑵写出表示是氢氧化铝两性氢氧化物的离子方程式:
,
【情景设计】
铝是大自然赐予人类的宝物,但人们对它的认识经历了较为漫长的过程。在自然界,铝元素以稳定的化合态存在,如 ,因而早期制备铝比较困难。19世纪中期,铝十分昂贵,甚至超过了当时黄金的价格。直到1886年,电解法制取铝工艺的发明,才使得生产生活中的应用得以普及。成为现代文明不可缺少的物质基础。
从铝土矿中提取铝
1、铝元素占地壳总量的7.73%,是地壳中含量最多的 元素,它主要以 形式存在于 (主要成分为 ,还有少量的Fe2O3,SiO2等杂质)。
【交流讨论】
若给你一块铝矿石, 要想从中提取铝,你首先要对这块矿石做哪些处理
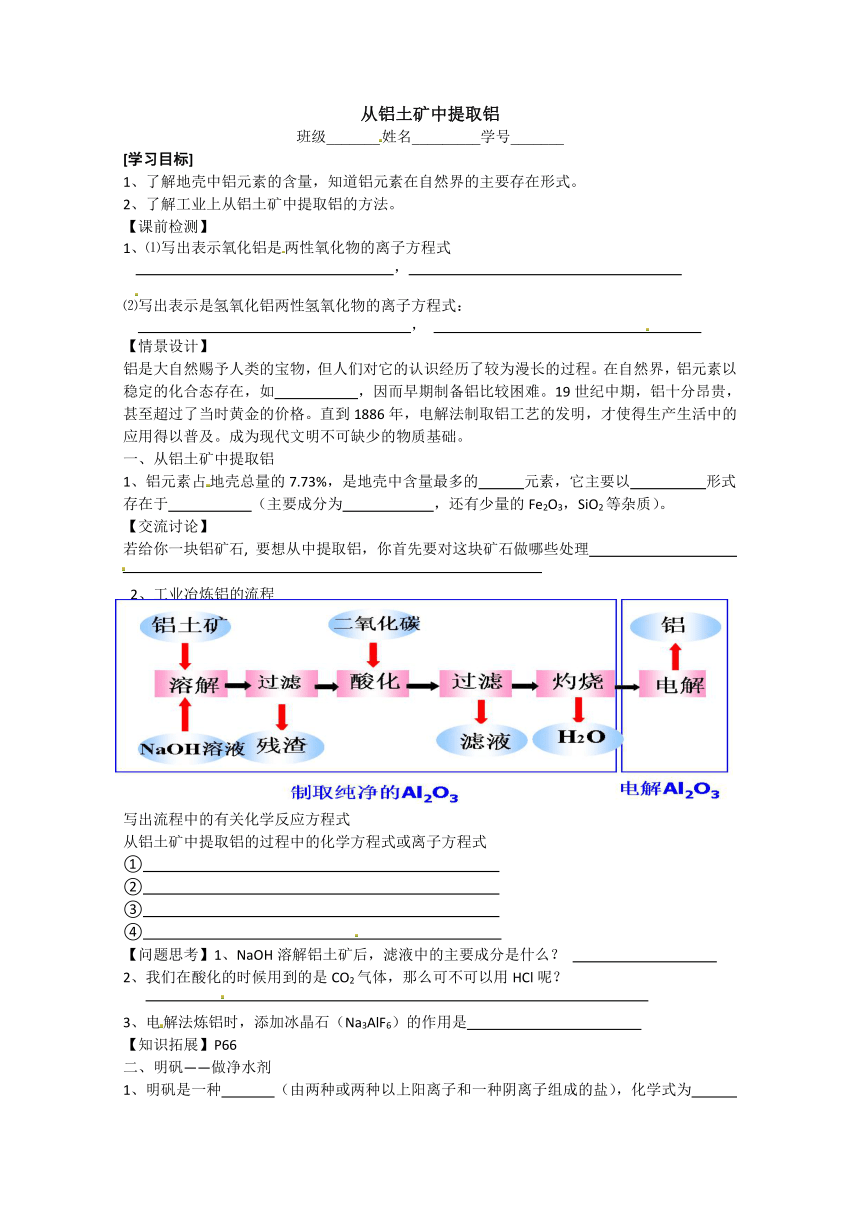
2、工业冶炼铝的流程
写出流程中的有关化学反应方程式
从铝土矿中提取铝的过程中的化学方程式或离子方程式
①
②
③
④
【问题思考】1、NaOH溶解铝土矿后,滤液中的主要成分是什么?
2、我们在酸化的时候用到的是CO2气体,那么可不可以用HCl呢?
3、电解法炼铝时,添加冰晶石(Na3AlF6)的作用是
【知识拓展】P66
明矾——做净水剂
1、明矾是一种 (由两种或两种以上阳离子和一种阴离子组成的盐),化学式为
是一种常见的 。
明矾溶于水后发生电离: ,电离出的Al3+与水反应生成 ,方程式为 。Al(OH)3胶体具有很强的吸附能力,它能凝聚水中的悬浮物并使之沉降,从而达到净水的目的。
2、向明矾溶液中加入氢氧化钡会有什么现象?并写出离子反应方程式
,
【当堂训练】1. 从铝土矿制备铝所涉及的下列有关反应中,属于氧化还原反应的是 ( )
A.铝土矿溶于NaOH溶液中B.偏铝酸钠溶液的酸化
C.灼烧氢氧化铝固体 D.电解熔融的氧化铝
2. 下列既能与酸反应,又能与碱反应的氧化物是 ( )
A. NaHCO3 B.Al2O3 C. CuO D. CO2
3.下列有关铝土矿中提炼铝的说法不正确的是 ( )A.铝土矿中的铝元素是以化合态存在的,需用化学方法把铝元素变成游离态
B.提炼过程中,先将铝土矿净化提取氧化铝,再进行冶炼
C.可用常见的还原剂把氧化铝中的铝还原出来
D.冶炼铝的方法同工业冶炼钠、镁相似, 可用电解法
4.将二氧化碳通入下列溶液中,最终一定会有沉淀的是 ( )
A.氢氧化钠溶液 B.澄清石灰水 C.偏铝酸钠溶液 D.氯化钙溶液
5.电解熔融的氧化铝制取金属铝,若有0.3mol电子发生转移,则理论上能得到金属铝多少克?需氧化铝多少摩尔?
【课堂小结】
[课外练习](选择题每题有1-2个答案)
1、电解法炼铝时,冰晶石的作用是 ( )
A.助熔剂 B.催化剂 C.还原剂 D.氧化剂
2、实验室制取Al(OH)3可选用的方法是 ( )
A.铝和氢氧化钠反应 B.氯化铝溶液中滴加足量氢氧化钠溶液
C.向NaAlO2溶液中通入足够的CO2气体 D.氯化铝溶液中滴加足量的氨水
3、将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是 ( )
A.稀硝酸 B.稀盐酸 C.硝酸铜 D.氢氧化钠
4、向下列溶液中滴加稀硫酸,一开始生成白色沉淀,继续滴加稀硫酸,沉淀又溶解的是( )
A.AlCl3 溶液 B.NaAlO2溶液 C.MgCl2溶液 D.BaCl2溶液
5、用含少量镁的铝片制取纯净的氢氧化铝,下列操作步骤: ①加盐酸溶解②加烧碱溶液溶解③过滤④通入过量CO2生成Al(OH)3沉淀⑤加入盐酸生成Al(OH)3沉淀⑥加入过量烧碱溶液生成Al(OH)3沉淀 ( )
A.①⑤⑥③ B.②③⑥③ C.②③④③ D.②③⑤③
6、某无色溶液能与铝粉作用生成氢气,则溶液中可能大量共存的离子组是 ( )
A.H+、Mg2+、Cl-、Cu2+ B.CH3COO-、K+、Na+、H+
C.Cl-、Ba2+、NO、OH- D.OH-、Cl-、HCO3-、Mg2+
7、下列既能与盐酸反应又能与氢氧化钠溶液反应的化合物是 ( )
①NaHCO3②Al2O3③Al(OH)3④NaAlO2⑤Al⑥(NH4)2CO3
A.②③ B.①②③⑥ C.①②③⑤⑥ D.全部
8、等体积的AlCl3和NaOH两种溶液混合后,沉淀物中含铝的质量与溶液中含铝的质量相等,则AlCl3和NaOH两种溶液的物质的量浓度之比是 ( )
A.1∶3 B.2∶3 C.1∶4 D.2∶7
9、镁、铝、铜三种金属粉末混合物, 加入过量盐酸充分反应, 过滤后向滤液中加入过量烧碱溶液, 再过滤, 滤液中存在的离子有 ( )
A. B.Cu2+ C.Al3+ D.Mg2+
10、将含有0.1 mol明矾[KAl(SO4)2·12H2O]的溶液和100 mL 2 mol / L的Ba(OH)2溶液混合后,下列叙述正确是?????????????????? ???????????????????????????????????????? ?? (? ???)
A. 反应完毕后,液体仍然澄清????????????????? B. 液体浑浊,沉淀物是BaSO4
C. 生成0.1 mol Al(OH)3和0.2 mol BaSO4?????? ??D. 液体浑浊,沉淀物是Al(OH)3
11、有4种含有铝元素的化合物A、B、C、D,且能发生下列反应
①A+NaOH→D+H2O ②BA+H2O ③C+NaOHB+NaCl
④在①溶液中滴入盐酸后有沉淀生成,盐酸过量沉淀又溶解生成C。则
⑴A、B、C、D的化学式分别是
A B C D
⑵写出上述过程中所发生的离子反应的离子方程式
,
,
12、向100mL 0.3mol/L的Al2(SO4)3溶液滴加100mlNaOH溶液时,恰好反应得到沉淀3.9g,求 NaOH溶液的物质的量浓度?
13、画出下列实验中n(↓)随n(x)的变化曲线图(请用直尺作图)①向1mol AlCl3溶液中滴加NaOH溶液至过量
②向物质的量各1mol的MgCl2、AlCl3混合溶液中滴加NaOH溶液至过量
③向物质的量各1mol的HCl、MgCl2、AlCl3混合溶液中滴加NaOH溶液至过量
14、将一定量的镁铝合金溶解在500ml 盐酸中,然后取出10mL溶液,向其中加入1mol/L的NaOH溶液,加入NaOH溶液时产生的沉淀的质量m与所加NaOH溶液的体积V的关系
如下图:求合金中镁铝的质量分别为多少?
班级_______姓名_________学号_______
[学习目标]
1、了解地壳中铝元素的含量,知道铝元素在自然界的主要存在形式。
2、了解工业上从铝土矿中提取铝的方法。
【课前检测】
1、⑴写出表示氧化铝是两性氧化物的离子方程式
,
⑵写出表示是氢氧化铝两性氢氧化物的离子方程式:
,
【情景设计】
铝是大自然赐予人类的宝物,但人们对它的认识经历了较为漫长的过程。在自然界,铝元素以稳定的化合态存在,如 ,因而早期制备铝比较困难。19世纪中期,铝十分昂贵,甚至超过了当时黄金的价格。直到1886年,电解法制取铝工艺的发明,才使得生产生活中的应用得以普及。成为现代文明不可缺少的物质基础。
从铝土矿中提取铝
1、铝元素占地壳总量的7.73%,是地壳中含量最多的 元素,它主要以 形式存在于 (主要成分为 ,还有少量的Fe2O3,SiO2等杂质)。
【交流讨论】
若给你一块铝矿石, 要想从中提取铝,你首先要对这块矿石做哪些处理
2、工业冶炼铝的流程
写出流程中的有关化学反应方程式
从铝土矿中提取铝的过程中的化学方程式或离子方程式
①
②
③
④
【问题思考】1、NaOH溶解铝土矿后,滤液中的主要成分是什么?
2、我们在酸化的时候用到的是CO2气体,那么可不可以用HCl呢?
3、电解法炼铝时,添加冰晶石(Na3AlF6)的作用是
【知识拓展】P66
明矾——做净水剂
1、明矾是一种 (由两种或两种以上阳离子和一种阴离子组成的盐),化学式为
是一种常见的 。
明矾溶于水后发生电离: ,电离出的Al3+与水反应生成 ,方程式为 。Al(OH)3胶体具有很强的吸附能力,它能凝聚水中的悬浮物并使之沉降,从而达到净水的目的。
2、向明矾溶液中加入氢氧化钡会有什么现象?并写出离子反应方程式
,
【当堂训练】1. 从铝土矿制备铝所涉及的下列有关反应中,属于氧化还原反应的是 ( )
A.铝土矿溶于NaOH溶液中B.偏铝酸钠溶液的酸化
C.灼烧氢氧化铝固体 D.电解熔融的氧化铝
2. 下列既能与酸反应,又能与碱反应的氧化物是 ( )
A. NaHCO3 B.Al2O3 C. CuO D. CO2
3.下列有关铝土矿中提炼铝的说法不正确的是 ( )A.铝土矿中的铝元素是以化合态存在的,需用化学方法把铝元素变成游离态
B.提炼过程中,先将铝土矿净化提取氧化铝,再进行冶炼
C.可用常见的还原剂把氧化铝中的铝还原出来
D.冶炼铝的方法同工业冶炼钠、镁相似, 可用电解法
4.将二氧化碳通入下列溶液中,最终一定会有沉淀的是 ( )
A.氢氧化钠溶液 B.澄清石灰水 C.偏铝酸钠溶液 D.氯化钙溶液
5.电解熔融的氧化铝制取金属铝,若有0.3mol电子发生转移,则理论上能得到金属铝多少克?需氧化铝多少摩尔?
【课堂小结】
[课外练习](选择题每题有1-2个答案)
1、电解法炼铝时,冰晶石的作用是 ( )
A.助熔剂 B.催化剂 C.还原剂 D.氧化剂
2、实验室制取Al(OH)3可选用的方法是 ( )
A.铝和氢氧化钠反应 B.氯化铝溶液中滴加足量氢氧化钠溶液
C.向NaAlO2溶液中通入足够的CO2气体 D.氯化铝溶液中滴加足量的氨水
3、将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是 ( )
A.稀硝酸 B.稀盐酸 C.硝酸铜 D.氢氧化钠
4、向下列溶液中滴加稀硫酸,一开始生成白色沉淀,继续滴加稀硫酸,沉淀又溶解的是( )
A.AlCl3 溶液 B.NaAlO2溶液 C.MgCl2溶液 D.BaCl2溶液
5、用含少量镁的铝片制取纯净的氢氧化铝,下列操作步骤: ①加盐酸溶解②加烧碱溶液溶解③过滤④通入过量CO2生成Al(OH)3沉淀⑤加入盐酸生成Al(OH)3沉淀⑥加入过量烧碱溶液生成Al(OH)3沉淀 ( )
A.①⑤⑥③ B.②③⑥③ C.②③④③ D.②③⑤③
6、某无色溶液能与铝粉作用生成氢气,则溶液中可能大量共存的离子组是 ( )
A.H+、Mg2+、Cl-、Cu2+ B.CH3COO-、K+、Na+、H+
C.Cl-、Ba2+、NO、OH- D.OH-、Cl-、HCO3-、Mg2+
7、下列既能与盐酸反应又能与氢氧化钠溶液反应的化合物是 ( )
①NaHCO3②Al2O3③Al(OH)3④NaAlO2⑤Al⑥(NH4)2CO3
A.②③ B.①②③⑥ C.①②③⑤⑥ D.全部
8、等体积的AlCl3和NaOH两种溶液混合后,沉淀物中含铝的质量与溶液中含铝的质量相等,则AlCl3和NaOH两种溶液的物质的量浓度之比是 ( )
A.1∶3 B.2∶3 C.1∶4 D.2∶7
9、镁、铝、铜三种金属粉末混合物, 加入过量盐酸充分反应, 过滤后向滤液中加入过量烧碱溶液, 再过滤, 滤液中存在的离子有 ( )
A. B.Cu2+ C.Al3+ D.Mg2+
10、将含有0.1 mol明矾[KAl(SO4)2·12H2O]的溶液和100 mL 2 mol / L的Ba(OH)2溶液混合后,下列叙述正确是?????????????????? ???????????????????????????????????????? ?? (? ???)
A. 反应完毕后,液体仍然澄清????????????????? B. 液体浑浊,沉淀物是BaSO4
C. 生成0.1 mol Al(OH)3和0.2 mol BaSO4?????? ??D. 液体浑浊,沉淀物是Al(OH)3
11、有4种含有铝元素的化合物A、B、C、D,且能发生下列反应
①A+NaOH→D+H2O ②BA+H2O ③C+NaOHB+NaCl
④在①溶液中滴入盐酸后有沉淀生成,盐酸过量沉淀又溶解生成C。则
⑴A、B、C、D的化学式分别是
A B C D
⑵写出上述过程中所发生的离子反应的离子方程式
,
,
12、向100mL 0.3mol/L的Al2(SO4)3溶液滴加100mlNaOH溶液时,恰好反应得到沉淀3.9g,求 NaOH溶液的物质的量浓度?
13、画出下列实验中n(↓)随n(x)的变化曲线图(请用直尺作图)①向1mol AlCl3溶液中滴加NaOH溶液至过量
②向物质的量各1mol的MgCl2、AlCl3混合溶液中滴加NaOH溶液至过量
③向物质的量各1mol的HCl、MgCl2、AlCl3混合溶液中滴加NaOH溶液至过量
14、将一定量的镁铝合金溶解在500ml 盐酸中,然后取出10mL溶液,向其中加入1mol/L的NaOH溶液,加入NaOH溶液时产生的沉淀的质量m与所加NaOH溶液的体积V的关系
如下图:求合金中镁铝的质量分别为多少?
