2021-2022学年九年级化学人教版下册第十一单元课题1生活中常见的盐同步练习(word版有答案)
文档属性
| 名称 | 2021-2022学年九年级化学人教版下册第十一单元课题1生活中常见的盐同步练习(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 112.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-10 11:43:38 | ||
图片预览



文档简介
2021——2022学年度人教版九年级化学下册 第十一单元 盐 化肥
课题1 生活中常见的盐 同步练习
一、选择题
1.下列化学用语表示正确的是
A.两个氢分子:2H B.氧化铁:FeO C.小苏打:NaHCO3 D.铜离子:Cu+2
2.下列各组物质中,能发生反应且反应前后溶液总质量变小的是
A.铝和稀硫酸 B.石灰水和稀盐酸
C.稀硫酸和硝酸钡溶液 D.氯化钾溶液和硫酸钠溶液
3.逻辑推理是化学学科核心素养的重要内容。下列推理正确的是
A.酸雨的pH<7,pH<7的雨水一定是酸雨
B.单质只含一种元素,只含一种元素的物质一定是单质
C.氯化钠、硫酸铜等盐中都含有金属元素,盐中一定含金属元素
D.软水与肥皂水混合产生泡沫多浮渣少,能使肥皂水产生泡沫多浮渣少的水一定是软水
4.航天员穿的舱外服内含有与氢氧化钠性质相似的氢氧化锂(LiOH),它不可能具有的化学性质是
A.与二氧化碳反应 B.与盐酸反应
C.与氯化钡反应 D.与氯化铜反应
5.下列有关叙述对应的化学方程式、所属基本反应类型都正确的是
A.拉瓦锡测定空气中氧气的含量: 化合反应
B.用氢氧化镁治疗胃酸过多: 中和反应
C.实验室用锌和稀硫酸制取氢气: 置换反应
D.石灰水检验二氧化碳: 复分解反应
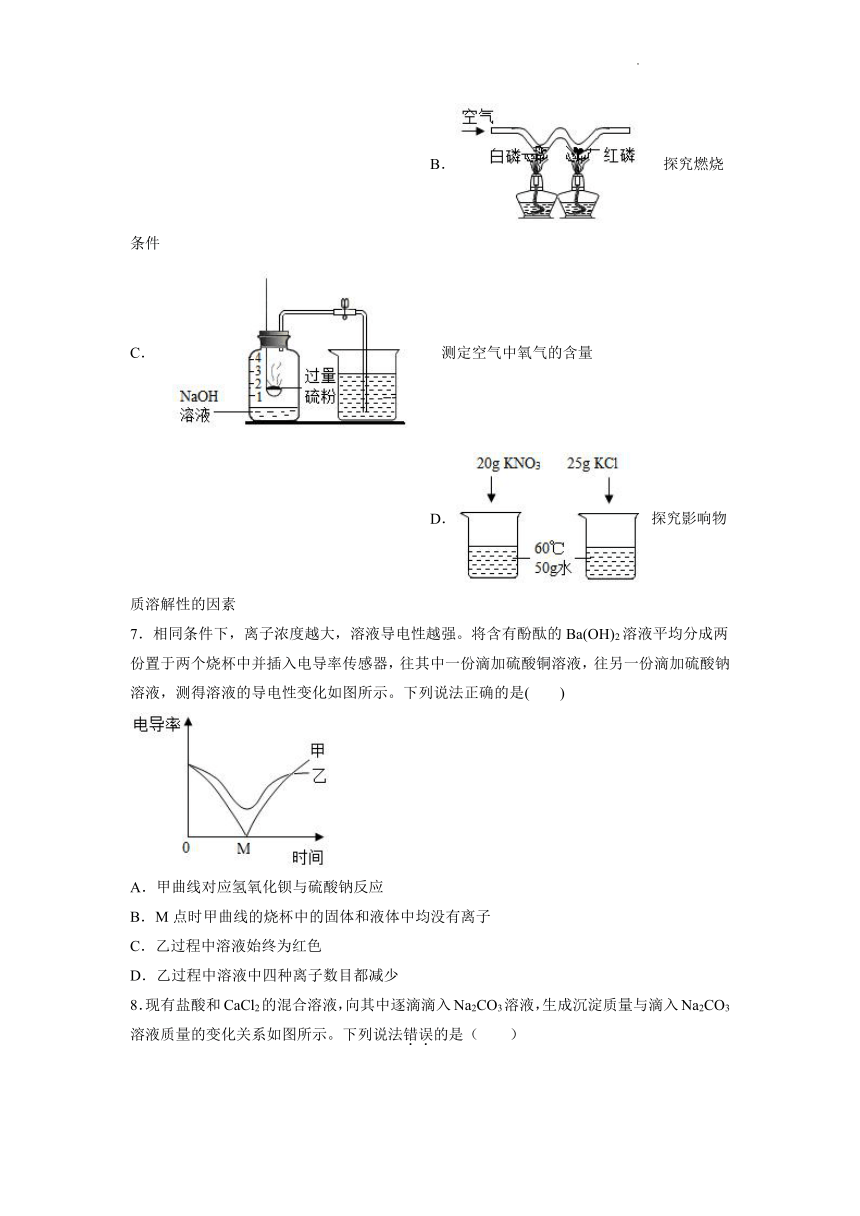
6.下列实验能达到目的的是
A.检验固体粉末是否含CO32- B.探究燃烧条件
C.测定空气中氧气的含量 D.探究影响物质溶解性的因素
7.相同条件下,离子浓度越大,溶液导电性越强。将含有酚酞的Ba(OH)2溶液平均分成两份置于两个烧杯中并插入电导率传感器,往其中一份滴加硫酸铜溶液,往另一份滴加硫酸钠溶液,测得溶液的导电性变化如图所示。下列说法正确的是( )
A.甲曲线对应氢氧化钡与硫酸钠反应
B.M点时甲曲线的烧杯中的固体和液体中均没有离子
C.乙过程中溶液始终为红色
D.乙过程中溶液中四种离子数目都减少
8.现有盐酸和CaCl2的混合溶液,向其中逐滴滴入Na2CO3溶液,生成沉淀质量与滴入Na2CO3溶液质量的变化关系如图所示。下列说法错误的是( )
A.滴加碳酸钠溶液质量为a~c克时,溶液中发生反应为CaCl2+Na2CO3=2NaCl+CaCO3↓
B.滴加碳酸钠溶液质量至b克时,溶液中含三种溶质
C.滴加碳酸钠溶液质量至c克时,溶液中溶质质量比原混合溶液中溶质质量大
D.滴加碳酸钠溶液质量至d克时,溶液pH>7
9.实验室有一包白色固体,其中含有Na2CO3,还可能含有Ba(NO3)2、Na2SO4、NaOH中的一种或几种。取该固体进行以下实验:取少量固体于烧杯中,加入足量水并不断搅拌,固体部分溶解,接着向烧杯中加入足量稀硝酸,变化如图所示。下列说法错误的是
A.a→b段对应的实验现象是固体部分溶解,有气泡产生
B.b→c段对应的溶液pH逐渐减小
C.原白色固体中一定含有NaOH
D.c点对应的溶液中一定含有NaNO3、HNO3、Ba(NO3)2
10.下列物质的检验、鉴别和除杂中两种方法都正确的是( )
选项 实验目的 方案一 方案二
A 鉴别食盐和纯碱 加水 加食醋
B 区分稀硫酸、澄清石灰水 滴入无色酚酞溶液 滴入氯化钡溶液
C 检验二氧化碳 通入澄清石灰水中 燃着的木条
D 除去氯化钠溶液中的氯化钡 滴加适量碳酸钾溶液,过滤 滴入适量硝酸银溶液,过滤
A.A B.B C.C D.D
11.下列各组物质的稀溶液仅用组内物质就能鉴别出来的是( )
A.NaOH BaCl2 H2SO4 KNO3
B.Ba(OH)2 K2SO4 HCl Na2CO3
C.HCl Ca(OH)2 K2SO4 CaCl2
D.NaNO3 KOH NaCl HCl
12.在托盘天平的两盘上各放一只质量相同的烧杯,在两只烧杯里分别加入等质量,等溶质质量分数的稀硫酸,将天平调至平衡。然后向左盘的烧杯中加入8.4g铁,反应物之间恰好完全反应。欲使天平恢复平衡,则可向右盘的烧杯加入( )
A.8.4g铜 B.8.4g氧化钙 C.8.4g铝 D.8.4g碳酸镁
13.某固体粉末可能含有碳酸钙、氧化铜、氧化铁、木炭粉中的几种,取mg该固体粉末按下列流程进行实验(本流程涉及到的反应均为初中化学常见的反应,且各步均恰好完全反应)。
下列说法中正确的是
A.溶液N中只含一种溶质
B.原固体粉末中一定含有木炭粉
C.白色沉淀Y一定是碳酸钙,气体W可能是氢气
D.原固体粉末中一定没有氧化铜,一定含有碳酸钙
14.甲、乙、丙三种物质均含同一种元素,他们之间存在如图所示的转化(“→”表示反应一步实现,部分物质和反应条件已略去),则符合要求的甲、乙、丙依次为
A.C、CO2、CO
B.Cu、CuO、CuSO4
C.CaCO3、Ca(OH)2、 CaO
D.H2O2、H2、H2O
二、填空题
15.写出下列反应的化学方程式。
(1)二氧化碳通过灼热的碳层:_________。
(2)锌粒投入稀硫酸:_________。
(3)碳酸钠溶液与澄清石灰水混合:_________。
16.用下图实验研究氢氧化钠溶液与氢氧化钙溶液的性质。
(1)实验1中,发生反应的化学方程式为___________。
(2)实验2中,证明盐酸能与两种碱溶液发生反应的现象是___________。
(3)能将两种溶液区分开的实验现象是___________。
17.某工厂排放的废水中含有K+、Cu2+、、四种离子。
(1)废水中离子个数比K+:Cu2+:NO3-=2:7:8,若K为3n个,则离子个数为______。
(2)为防止Cu2+排放对环境造成的污染,小组同学设计了两种方案:
①甲方案是往废水中加入铁,涉及反应的化学方程式为______(写出一个即可)。
②乙方案是往废水中加入____(写化学式),恰好反应后过滤,所得滤液蒸发后所得物质可作钾肥,写出钾肥的化学式:______(写一个)。
18.在盛有生锈铁钉的试管中,加入一定量的稀盐酸除去铁锈,观察到的现象是___________,写出化学反应方程式:___________,该化学反应的基本类型是___________反应,一段时间后,发现溶液中有气泡产生,请用化学方程式解释产生气泡的原因___________。
19.甲、乙、丙是初中化学常见三种物质,甲、乙、丙含有相同的一种元素,且丙是一种气体单质,它们相互转化关系如图.
则甲的化学式为___________.甲转化为丙的化学方程式为___________.其基本反应类型为___________.
20.二氧化碳、氢氧化钠、氢氧化钙、氯化钠等都是重要的化工原料,在生产和生活中,有着重要的应用。
(1)二氧化碳用于制汽水,这是利用了二氧化碳____________________________的性质。
(2)用石灰浆粉刷墙壁,干燥后又白又硬。这是因为________(用化学方程式表示)。
(3)厕所清洁剂和炉具清洁剂的作用是不同的。其中,炉具清洁剂中含有______________,利用其能与油脂反应的性质达到去除油污的目的。而厕所清洁剂因含有某些物质,呈强________(选填“酸”或“碱”)性,能达到消毒杀菌的效果。
(4)工业上,常用电解氯化钠溶液的方法制取氢氧化钠,同时还能获得氢气、氯气两种化工产品,其反应的化学方程式为______________________________________________。
三、简答题
21.现有甲、乙两组溶液,甲:H2SO4、K2CO3、Fe(NO3)2 乙:BaCl2、HCl、Ca(OH)2,甲组中只有________可以与乙组所有的溶液反应,乙组中只有________可以与甲组的所有物质反应.
22.两种抗胃酸药剂的主要成分及建议每次剂量见下表:
主要成分 NaHCO3 Mg(OH)2
主要成分相对分子质 量 84 58
建议每次剂量/g 0.5 0.3
(1)医生建议胃溃疡患者尽可能不要服用 NaHCO3 的可能原因是:_____.
(2)服用 Mg(OH)2的药 效比 服用 NaHCO3“ 强” 而且 “ 持久 ” 的可能原因是:_____.
(3)服用 Mg(OH)2的患者可能出现“轻泻”的原因是:_____.
23.为了除去KC1中含有的K2SO4、CaCl2、MgCl2三种杂质,小明设计如下操作步骤:①加水溶解后,依次加入过量的BaCl2溶液、过量的K2CO3溶液,过量的Ca(OH)2溶液;②过滤;③向滤液中加入适量稀盐酸;④蒸发滤液得到氯化钾固体。
(1)指出步骤中所加的试剂顺序的不足之处。
(2)改正步骤中所加试剂的顺序后,整个提纯过程中共发生多少个有沉淀生成的复分解反应?
(3)在蒸发过程中,玻璃棒的作用是什么?
24.某固体粉末可能含有碳酸钙、硫酸钠、氯化钠、氯化钡、硫酸铜中的一种或几种。为确定该固体粉末的成分,进行了如下实验:
回答下列问题:
(1)反应I的化学方程式为 ________ 。
(2)白色沉淀C是 ______ (填化学式)。
(3)原固体粉末中一定不含 ______ (填化学式)。
四、综合应用题
25.硫酸是化学实验室中常用的试剂,也是重要的化工原料。试回答下列问题:
(1)浓硫酸具有强烈的腐蚀性。如果不慎将浓硫酸沾到皮肤上,应立即用大量的水冲洗,然后涂上3%~5%的______(填“碳酸氢钠”“氢氧化钠”“硼酸”之一)溶液,以防灼伤皮肤。
(2)用硫单质制取硫酸的转化流程示意图如下:
在S、SO2、SO3、H2SO4四种物质中,硫元素的化合价表现为+4价的物质是______(填化学式)。写出上述转化流程步骤③中所发生反应的化学方程式______。
(3)现取100g稀硫酸倒入烧杯中,慢慢向烧杯中加入溶质质量分数为10%的BaCl2溶液,反应过程中产生沉淀的质量与所加入BaCl2溶液的质量关系如图所示。试回答:
①当加入BaCl2溶液200g时(即图中A点),烧杯中溶液里大量存在的酸根离子是______(填离子符号)。
②当加入BaCl2溶液416g时(即图中B点),恰好完全反应,试通过计算求产生沉淀的总质量______。(计算结果精确至0.1g)。
【参考答案】
1.C 2.C 3.D 4.C 5.C 6.C 7.C 8.B 9.C 10.B 11.B 12.C 13.B 14.A
15.
16. Na2CO3+Ca(OH)2=CaCO3↓+2NaOH 溶液由红色褪为无色 实验1、实验3中一支试管中产生白色沉淀,另一支试管无明显现象
17. 6n KOH K2SO4或KNO3
18. 红棕色逐渐消失,溶液由无色变成黄色 Fe2O3+6HCl=2FeCl3+3H2O 复分解 Fe+2HCl=FeCl2+H2↑
19. O2 O2+2C2CO 化合反应
20. 可与水反应生成碳酸 Ca(OH)2+CO2=CaCO3↓+H2O 氢氧化钠 酸 2NaCl+2H2O2NaOH+H2↑+Cl2↑
21. K2CO3 Ca(OH)2
22. NaHCO3 和 HCl 反应生成气态 CO2,使胃内气压骤然升高 0.3g Mg(OH)2 比 0.5 g NaHCO3 能中和更多的 HCl,所以药效强于NaHCO3,Mg(OH)2和HCl反应速率慢于NaHCO3和HCl,所以药效比服用NaHCO3 持久 Mg(OH)2和HCl反应生成 MgCl2和H2O,出现“轻泻”和 MgCl2或 Mg2+有关
23.(1)最后加入过量的K2CO3溶液应
(2)5
(3)搅拌,防止因局部温度过高,造成液滴飞溅
24. CaCO3+2HCl=CaCl2+CO2↑+H2O BaSO4 CuSO4、BaCl2.
25.(1)碳酸氢钠
(2) SO2
(3) 、Cl- 46.6g。
课题1 生活中常见的盐 同步练习
一、选择题
1.下列化学用语表示正确的是
A.两个氢分子:2H B.氧化铁:FeO C.小苏打:NaHCO3 D.铜离子:Cu+2
2.下列各组物质中,能发生反应且反应前后溶液总质量变小的是
A.铝和稀硫酸 B.石灰水和稀盐酸
C.稀硫酸和硝酸钡溶液 D.氯化钾溶液和硫酸钠溶液
3.逻辑推理是化学学科核心素养的重要内容。下列推理正确的是
A.酸雨的pH<7,pH<7的雨水一定是酸雨
B.单质只含一种元素,只含一种元素的物质一定是单质
C.氯化钠、硫酸铜等盐中都含有金属元素,盐中一定含金属元素
D.软水与肥皂水混合产生泡沫多浮渣少,能使肥皂水产生泡沫多浮渣少的水一定是软水
4.航天员穿的舱外服内含有与氢氧化钠性质相似的氢氧化锂(LiOH),它不可能具有的化学性质是
A.与二氧化碳反应 B.与盐酸反应
C.与氯化钡反应 D.与氯化铜反应
5.下列有关叙述对应的化学方程式、所属基本反应类型都正确的是
A.拉瓦锡测定空气中氧气的含量: 化合反应
B.用氢氧化镁治疗胃酸过多: 中和反应
C.实验室用锌和稀硫酸制取氢气: 置换反应
D.石灰水检验二氧化碳: 复分解反应
6.下列实验能达到目的的是
A.检验固体粉末是否含CO32- B.探究燃烧条件
C.测定空气中氧气的含量 D.探究影响物质溶解性的因素
7.相同条件下,离子浓度越大,溶液导电性越强。将含有酚酞的Ba(OH)2溶液平均分成两份置于两个烧杯中并插入电导率传感器,往其中一份滴加硫酸铜溶液,往另一份滴加硫酸钠溶液,测得溶液的导电性变化如图所示。下列说法正确的是( )
A.甲曲线对应氢氧化钡与硫酸钠反应
B.M点时甲曲线的烧杯中的固体和液体中均没有离子
C.乙过程中溶液始终为红色
D.乙过程中溶液中四种离子数目都减少
8.现有盐酸和CaCl2的混合溶液,向其中逐滴滴入Na2CO3溶液,生成沉淀质量与滴入Na2CO3溶液质量的变化关系如图所示。下列说法错误的是( )
A.滴加碳酸钠溶液质量为a~c克时,溶液中发生反应为CaCl2+Na2CO3=2NaCl+CaCO3↓
B.滴加碳酸钠溶液质量至b克时,溶液中含三种溶质
C.滴加碳酸钠溶液质量至c克时,溶液中溶质质量比原混合溶液中溶质质量大
D.滴加碳酸钠溶液质量至d克时,溶液pH>7
9.实验室有一包白色固体,其中含有Na2CO3,还可能含有Ba(NO3)2、Na2SO4、NaOH中的一种或几种。取该固体进行以下实验:取少量固体于烧杯中,加入足量水并不断搅拌,固体部分溶解,接着向烧杯中加入足量稀硝酸,变化如图所示。下列说法错误的是
A.a→b段对应的实验现象是固体部分溶解,有气泡产生
B.b→c段对应的溶液pH逐渐减小
C.原白色固体中一定含有NaOH
D.c点对应的溶液中一定含有NaNO3、HNO3、Ba(NO3)2
10.下列物质的检验、鉴别和除杂中两种方法都正确的是( )
选项 实验目的 方案一 方案二
A 鉴别食盐和纯碱 加水 加食醋
B 区分稀硫酸、澄清石灰水 滴入无色酚酞溶液 滴入氯化钡溶液
C 检验二氧化碳 通入澄清石灰水中 燃着的木条
D 除去氯化钠溶液中的氯化钡 滴加适量碳酸钾溶液,过滤 滴入适量硝酸银溶液,过滤
A.A B.B C.C D.D
11.下列各组物质的稀溶液仅用组内物质就能鉴别出来的是( )
A.NaOH BaCl2 H2SO4 KNO3
B.Ba(OH)2 K2SO4 HCl Na2CO3
C.HCl Ca(OH)2 K2SO4 CaCl2
D.NaNO3 KOH NaCl HCl
12.在托盘天平的两盘上各放一只质量相同的烧杯,在两只烧杯里分别加入等质量,等溶质质量分数的稀硫酸,将天平调至平衡。然后向左盘的烧杯中加入8.4g铁,反应物之间恰好完全反应。欲使天平恢复平衡,则可向右盘的烧杯加入( )
A.8.4g铜 B.8.4g氧化钙 C.8.4g铝 D.8.4g碳酸镁
13.某固体粉末可能含有碳酸钙、氧化铜、氧化铁、木炭粉中的几种,取mg该固体粉末按下列流程进行实验(本流程涉及到的反应均为初中化学常见的反应,且各步均恰好完全反应)。
下列说法中正确的是
A.溶液N中只含一种溶质
B.原固体粉末中一定含有木炭粉
C.白色沉淀Y一定是碳酸钙,气体W可能是氢气
D.原固体粉末中一定没有氧化铜,一定含有碳酸钙
14.甲、乙、丙三种物质均含同一种元素,他们之间存在如图所示的转化(“→”表示反应一步实现,部分物质和反应条件已略去),则符合要求的甲、乙、丙依次为
A.C、CO2、CO
B.Cu、CuO、CuSO4
C.CaCO3、Ca(OH)2、 CaO
D.H2O2、H2、H2O
二、填空题
15.写出下列反应的化学方程式。
(1)二氧化碳通过灼热的碳层:_________。
(2)锌粒投入稀硫酸:_________。
(3)碳酸钠溶液与澄清石灰水混合:_________。
16.用下图实验研究氢氧化钠溶液与氢氧化钙溶液的性质。
(1)实验1中,发生反应的化学方程式为___________。
(2)实验2中,证明盐酸能与两种碱溶液发生反应的现象是___________。
(3)能将两种溶液区分开的实验现象是___________。
17.某工厂排放的废水中含有K+、Cu2+、、四种离子。
(1)废水中离子个数比K+:Cu2+:NO3-=2:7:8,若K为3n个,则离子个数为______。
(2)为防止Cu2+排放对环境造成的污染,小组同学设计了两种方案:
①甲方案是往废水中加入铁,涉及反应的化学方程式为______(写出一个即可)。
②乙方案是往废水中加入____(写化学式),恰好反应后过滤,所得滤液蒸发后所得物质可作钾肥,写出钾肥的化学式:______(写一个)。
18.在盛有生锈铁钉的试管中,加入一定量的稀盐酸除去铁锈,观察到的现象是___________,写出化学反应方程式:___________,该化学反应的基本类型是___________反应,一段时间后,发现溶液中有气泡产生,请用化学方程式解释产生气泡的原因___________。
19.甲、乙、丙是初中化学常见三种物质,甲、乙、丙含有相同的一种元素,且丙是一种气体单质,它们相互转化关系如图.
则甲的化学式为___________.甲转化为丙的化学方程式为___________.其基本反应类型为___________.
20.二氧化碳、氢氧化钠、氢氧化钙、氯化钠等都是重要的化工原料,在生产和生活中,有着重要的应用。
(1)二氧化碳用于制汽水,这是利用了二氧化碳____________________________的性质。
(2)用石灰浆粉刷墙壁,干燥后又白又硬。这是因为________(用化学方程式表示)。
(3)厕所清洁剂和炉具清洁剂的作用是不同的。其中,炉具清洁剂中含有______________,利用其能与油脂反应的性质达到去除油污的目的。而厕所清洁剂因含有某些物质,呈强________(选填“酸”或“碱”)性,能达到消毒杀菌的效果。
(4)工业上,常用电解氯化钠溶液的方法制取氢氧化钠,同时还能获得氢气、氯气两种化工产品,其反应的化学方程式为______________________________________________。
三、简答题
21.现有甲、乙两组溶液,甲:H2SO4、K2CO3、Fe(NO3)2 乙:BaCl2、HCl、Ca(OH)2,甲组中只有________可以与乙组所有的溶液反应,乙组中只有________可以与甲组的所有物质反应.
22.两种抗胃酸药剂的主要成分及建议每次剂量见下表:
主要成分 NaHCO3 Mg(OH)2
主要成分相对分子质 量 84 58
建议每次剂量/g 0.5 0.3
(1)医生建议胃溃疡患者尽可能不要服用 NaHCO3 的可能原因是:_____.
(2)服用 Mg(OH)2的药 效比 服用 NaHCO3“ 强” 而且 “ 持久 ” 的可能原因是:_____.
(3)服用 Mg(OH)2的患者可能出现“轻泻”的原因是:_____.
23.为了除去KC1中含有的K2SO4、CaCl2、MgCl2三种杂质,小明设计如下操作步骤:①加水溶解后,依次加入过量的BaCl2溶液、过量的K2CO3溶液,过量的Ca(OH)2溶液;②过滤;③向滤液中加入适量稀盐酸;④蒸发滤液得到氯化钾固体。
(1)指出步骤中所加的试剂顺序的不足之处。
(2)改正步骤中所加试剂的顺序后,整个提纯过程中共发生多少个有沉淀生成的复分解反应?
(3)在蒸发过程中,玻璃棒的作用是什么?
24.某固体粉末可能含有碳酸钙、硫酸钠、氯化钠、氯化钡、硫酸铜中的一种或几种。为确定该固体粉末的成分,进行了如下实验:
回答下列问题:
(1)反应I的化学方程式为 ________ 。
(2)白色沉淀C是 ______ (填化学式)。
(3)原固体粉末中一定不含 ______ (填化学式)。
四、综合应用题
25.硫酸是化学实验室中常用的试剂,也是重要的化工原料。试回答下列问题:
(1)浓硫酸具有强烈的腐蚀性。如果不慎将浓硫酸沾到皮肤上,应立即用大量的水冲洗,然后涂上3%~5%的______(填“碳酸氢钠”“氢氧化钠”“硼酸”之一)溶液,以防灼伤皮肤。
(2)用硫单质制取硫酸的转化流程示意图如下:
在S、SO2、SO3、H2SO4四种物质中,硫元素的化合价表现为+4价的物质是______(填化学式)。写出上述转化流程步骤③中所发生反应的化学方程式______。
(3)现取100g稀硫酸倒入烧杯中,慢慢向烧杯中加入溶质质量分数为10%的BaCl2溶液,反应过程中产生沉淀的质量与所加入BaCl2溶液的质量关系如图所示。试回答:
①当加入BaCl2溶液200g时(即图中A点),烧杯中溶液里大量存在的酸根离子是______(填离子符号)。
②当加入BaCl2溶液416g时(即图中B点),恰好完全反应,试通过计算求产生沉淀的总质量______。(计算结果精确至0.1g)。
【参考答案】
1.C 2.C 3.D 4.C 5.C 6.C 7.C 8.B 9.C 10.B 11.B 12.C 13.B 14.A
15.
16. Na2CO3+Ca(OH)2=CaCO3↓+2NaOH 溶液由红色褪为无色 实验1、实验3中一支试管中产生白色沉淀,另一支试管无明显现象
17. 6n KOH K2SO4或KNO3
18. 红棕色逐渐消失,溶液由无色变成黄色 Fe2O3+6HCl=2FeCl3+3H2O 复分解 Fe+2HCl=FeCl2+H2↑
19. O2 O2+2C2CO 化合反应
20. 可与水反应生成碳酸 Ca(OH)2+CO2=CaCO3↓+H2O 氢氧化钠 酸 2NaCl+2H2O2NaOH+H2↑+Cl2↑
21. K2CO3 Ca(OH)2
22. NaHCO3 和 HCl 反应生成气态 CO2,使胃内气压骤然升高 0.3g Mg(OH)2 比 0.5 g NaHCO3 能中和更多的 HCl,所以药效强于NaHCO3,Mg(OH)2和HCl反应速率慢于NaHCO3和HCl,所以药效比服用NaHCO3 持久 Mg(OH)2和HCl反应生成 MgCl2和H2O,出现“轻泻”和 MgCl2或 Mg2+有关
23.(1)最后加入过量的K2CO3溶液应
(2)5
(3)搅拌,防止因局部温度过高,造成液滴飞溅
24. CaCO3+2HCl=CaCl2+CO2↑+H2O BaSO4 CuSO4、BaCl2.
25.(1)碳酸氢钠
(2) SO2
(3) 、Cl- 46.6g。
同课章节目录
