第九单元溶液测试题--2021-2022学年九年级化学人教版下册(word版 含答案)
文档属性
| 名称 | 第九单元溶液测试题--2021-2022学年九年级化学人教版下册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 140.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-10 11:46:48 | ||
图片预览



文档简介
第九单元《溶液》测试题
一、单选题
1.下列关于溶液的说法正确的是
A.能溶解其他物质的物质叫做溶剂 B.凡是均一的、稳定的液体一定是溶液
C.溶液一定是无色透明的 D.饱和溶液一定是浓溶液
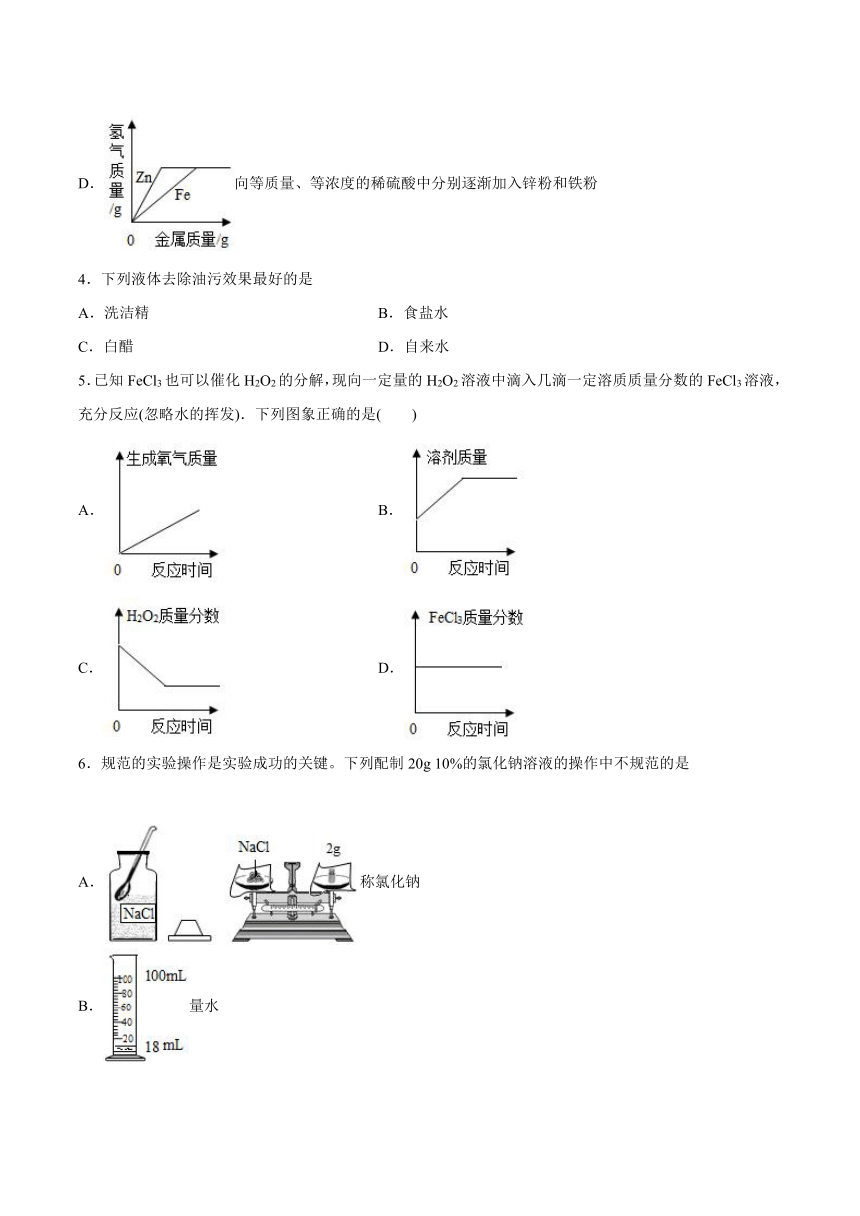
2.常温下,对100mL氯化钠饱和溶液进行图示实验。下列分析错误的是( )
A.实验1后,甲、乙中溶液的溶质质量分数相等
B.实验2后,乙中比甲中氯化钠的溶解度大
C.实验2后,甲中溶液为氯化钠的不饱和溶液
D.实验2后,甲、乙中溶液所含溶质质量相等
3.下列图象能正确反映其对应关系的是( )
A.电解水
B. 表示将等质量的大理石分别与足量的等体积等溶质质量分数的稀盐酸反应
C.两份完全相同的双氧水在有无MnO2的情况下产生O2
D.向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉
4.下列液体去除油污效果最好的是
A.洗洁精 B.食盐水
C.白醋 D.自来水
5.已知FeCl3也可以催化H2O2的分解,现向一定量的H2O2溶液中滴入几滴一定溶质质量分数的FeCl3溶液,充分反应(忽略水的挥发).下列图象正确的是( )
A. B.
C. D.
6.规范的实验操作是实验成功的关键。下列配制20g 10%的氯化钠溶液的操作中不规范的是
A.称氯化钠
B.量水
C.溶解
D.装瓶
7.NaCl和KNO3在不同温度时的溶解度如下表。下列说法错误的是
温度/℃ 0 20 40 60
NaCl的溶解度/g 35.7 36.0 36.6 37.3
KNO3的溶解度/g 13.3 31.6 63.9 110
A.20℃时,100gH2O最多能溶解36.0gNaCl
B.40℃时,KNO3饱和溶液的溶质质量分数小于63.9%
C.可用冷却海水的方法获取大量食盐
D.其他条件不变,升温可将KNO3饱和溶液变为不饱和溶液
8.向100 g质量分数为20%的NaCl溶液中加入3 g NaCl固体和12 g水,使其完全溶解,所得溶液中NaCl的质量分数是
A.20% B.22.5% C.25% D.30%
9.下列盐可由金属和盐酸反应直接制得的是( )
A.CuCl2 B.AlCl3 C.FeCl3 D.AgCl
10.把下列生活中常见的物质分别放入水中,充分搅拌,可以得到溶液的是
A.面粉 B.酒精 C.花生油 D.泥土
11.能使气体物质溶解度增大的操作是
A.增加溶剂 B.振荡溶液 C.增大压强 D.升高温度
二、简答题
12.硝酸钾和氯化钾的溶解度曲线如下图所示:
(1)t1℃时,硝酸钾的溶解度为________。
(2)t1℃时,将50g硝酸钾加入到50g水中,充分溶解后,所得溶液中溶质的质量分数为__________。
(3)t2℃时,氯化钾的饱和溶液中含有少量硝酸钾,提纯氯化钾的方法是_____。
(4)将t3℃时硝酸钾和氯化钾的饱和溶液各100g分别蒸发10g水,然后降温至t2℃,过滤,得到溶液a和溶液b。对于溶液a和溶液b,下列说法正确的是____。
A.都是饱和溶液 B.溶液质量a13.学习了溶液的概念后,老师的提问及同学的回答如图所示:
(1)以上三位同学中能够正确描述溶液特征的是_______同学。
老师接着问:“你们还想知道什么 ”
王华回答:“不溶于水的物质能溶于其他溶剂吗 ”
李佳回答:“物质在溶解过程中有热量的变化吗?”
(2)如果用实验回答王华的问题,则应该选择的溶质和溶剂分别是________。
(3)针对李佳的问题,他们一起设计实验:取三支试管,向试管中分别注入5 mL水,测得水的初温为20 ℃,再分别向三支试管中各加入3 g 氢氧化钠、氯化钠、硝酸铵,振荡。
①“振荡”试管的目的是________。
②用温度计分别测三支试管中溶液的温度,高于20 ℃的是_______溶液,这是因为__________。
③装有NH4N03溶液的试管外壁有水珠产生,原因是___________________。
④由此探究实验,可知_______溶于水温度没有明显的变化。
三、推断题
14.A、B、C、D、E、F均是初中化学中的常见物质,其中A、D为单质,其余均为化合物,B、C由两种相同元素组成。
(1)A在D中完全燃烧和不完全燃烧时,生成不同的气体。B溶液在一定条件下可反应生成C和无色气体D,C和D都与生命活动息息相关。B溶液中的溶质是_____(用化学式表示)
(2)如图所示将固体E放入大烧杯中的水里,小烧杯中F的饱和溶液变浑浊。则E的化学式可能为_____,产生此现象的原因是_____________。
15.图中,甲是相对分子质量为16的有机物,乙是最常见的溶剂,丁是白色难溶固体,其中金属元素的质量分数为40%.甲的化学式 ________ .②的化学方程式为 ________ .丙的一种用途是 ________ .
16.根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:
(1)t2℃时,向50g水中加入30g的b物质,得到b溶液的质量为______g
(2)将t2℃时a、b、c三种物质的饱和溶液降温至t1℃,三种溶液的溶质质量分数由大到小的顺序为______。
四、实验题
17.请从A~D中任选三个作答,若均作答,按前三个计分。如图,在Y形管中进行实验。补全实验方案。
序号 目的 操作 现象 结论
A 探究金属活动性 甲:放入铁片; 乙:放入银片; 向甲、乙处加入________ 甲中有红色固体生成,溶液变为浅绿色; 乙中无明显变化 金属活动性:铁>铜> 银
B 验证可燃物的燃烧条件 甲:放入红磷; 乙:放入白磷; 将甲、乙底部浸入80°C热水中 甲中无明显变化; 乙中白磷燃烧 ________
C 探究CO2的性质 甲:放入干燥的石蕊纸条; 乙:放入湿润的石蕊纸条; 向甲、乙处倒入CO2 ________ 二氧化碳能与水反应
D 比较________ 甲:放入一小粒高锰酸钾; 乙:放入一小粒碘; 向甲、乙处加入等量蒸馏水 甲中固体溶解形成紫色溶液; 乙中固体几乎不溶解 相同条件下,高锰酸钾在水中的溶解能力比碘强
18.如图甲是A、B、C三种固体物质的溶解度曲线图。
(1)甲图中,t2 ℃时,A、B、C三种物质中,溶解度最大的是 _____ ;P点所表示的含义为 _____ 。
(2)①将t2 ℃时A、B、C三种物质的饱和溶液降温到t1 ℃,三种物质的溶质质量分数由大到小的顺序是 _____ 。
②如乙图所示,20 ℃时,把试管放入盛有X的饱和溶液的烧杯中,在试管中加入几小段镁条,再加入5 mL稀盐酸,立即产生大量的气泡,同时烧杯中出现浑浊,则X可能为A、B、C三种固体物质中的哪一种? _____ 。
(3)t1 ℃时,将B物质的不饱和溶液转变成饱和溶液可采取的方法有: _____ 、 _____ (写两种方法)。
五、计算题
19.向盛有20.0 g稀硫酸的烧杯中倒入5.0 g黄铜(铜锌合金)样品粉末,恰好完全反应,称得未溶物质量为3.7 g。完成下列计算:
(1)该黄铜样品中含Zn的质量为________g。
(2)所用稀硫酸中溶质的质量分数为________。
(3)反应后所得溶液中溶质质量分数为________(结果保留一位小数)。
20.某校化学课外活动小组的同学在实验室的一次探究性活动中,他们将50g氢氧化钠溶液与50g硫酸铜溶液混合恰好完全反应,得到9.8g沉淀。请你计算氢氧化钠溶液中溶质的质量分数。_______
参考答案:
1.A 2.B 3.A 4.A 5.B 6.B 7.C 8.A 9.B 10.B
11.C
12. 25g 20% 蒸发结晶 ABDE
13. 王华、李佳 植物油、汽油 加速固体物质的溶解 氢氧化钠 氢氧化钠溶于水放热 硝酸铵溶于水吸热,溶液温度降低,使空气中的水蒸气凝结成水珠 氯化钠
14. H2O2 NaOH或CaO E溶于水放热
15. CH4 CO2+Ca(OH)2=CaCO3↓+H2O 灭火
16. 75 a>b>c
17. 硫酸铜溶液 可燃物燃烧需要温度达到着火点 甲中无明显变化,乙中石蕊纸条由紫色变为红色 高锰酸钾和碘在水中的溶解能力
18. A t1 ℃时,B、C两物质的溶解度相等 B>A>C C 增加溶质 降低温度
19.(1)1.3
(2)设稀硫酸中硫酸的质量分别为x、生成硫酸锌的质量为y,生成氢气质量为z。
解得:x=1.96g;
,解得:y=3.22g;
解得:z=0.04g;
稀硫酸中硫酸的质量分数=×100%=9.8%
答:稀硫酸中溶质的质量分数为9.8%;
(3)所得溶液中硫酸锌的质量分数=×100%≈15.1%
答:反应后所得溶液中硫酸锌的质量分数为15.1%。
20.16%
一、单选题
1.下列关于溶液的说法正确的是
A.能溶解其他物质的物质叫做溶剂 B.凡是均一的、稳定的液体一定是溶液
C.溶液一定是无色透明的 D.饱和溶液一定是浓溶液
2.常温下,对100mL氯化钠饱和溶液进行图示实验。下列分析错误的是( )
A.实验1后,甲、乙中溶液的溶质质量分数相等
B.实验2后,乙中比甲中氯化钠的溶解度大
C.实验2后,甲中溶液为氯化钠的不饱和溶液
D.实验2后,甲、乙中溶液所含溶质质量相等
3.下列图象能正确反映其对应关系的是( )
A.电解水
B. 表示将等质量的大理石分别与足量的等体积等溶质质量分数的稀盐酸反应
C.两份完全相同的双氧水在有无MnO2的情况下产生O2
D.向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉
4.下列液体去除油污效果最好的是
A.洗洁精 B.食盐水
C.白醋 D.自来水
5.已知FeCl3也可以催化H2O2的分解,现向一定量的H2O2溶液中滴入几滴一定溶质质量分数的FeCl3溶液,充分反应(忽略水的挥发).下列图象正确的是( )
A. B.
C. D.
6.规范的实验操作是实验成功的关键。下列配制20g 10%的氯化钠溶液的操作中不规范的是
A.称氯化钠
B.量水
C.溶解
D.装瓶
7.NaCl和KNO3在不同温度时的溶解度如下表。下列说法错误的是
温度/℃ 0 20 40 60
NaCl的溶解度/g 35.7 36.0 36.6 37.3
KNO3的溶解度/g 13.3 31.6 63.9 110
A.20℃时,100gH2O最多能溶解36.0gNaCl
B.40℃时,KNO3饱和溶液的溶质质量分数小于63.9%
C.可用冷却海水的方法获取大量食盐
D.其他条件不变,升温可将KNO3饱和溶液变为不饱和溶液
8.向100 g质量分数为20%的NaCl溶液中加入3 g NaCl固体和12 g水,使其完全溶解,所得溶液中NaCl的质量分数是
A.20% B.22.5% C.25% D.30%
9.下列盐可由金属和盐酸反应直接制得的是( )
A.CuCl2 B.AlCl3 C.FeCl3 D.AgCl
10.把下列生活中常见的物质分别放入水中,充分搅拌,可以得到溶液的是
A.面粉 B.酒精 C.花生油 D.泥土
11.能使气体物质溶解度增大的操作是
A.增加溶剂 B.振荡溶液 C.增大压强 D.升高温度
二、简答题
12.硝酸钾和氯化钾的溶解度曲线如下图所示:
(1)t1℃时,硝酸钾的溶解度为________。
(2)t1℃时,将50g硝酸钾加入到50g水中,充分溶解后,所得溶液中溶质的质量分数为__________。
(3)t2℃时,氯化钾的饱和溶液中含有少量硝酸钾,提纯氯化钾的方法是_____。
(4)将t3℃时硝酸钾和氯化钾的饱和溶液各100g分别蒸发10g水,然后降温至t2℃,过滤,得到溶液a和溶液b。对于溶液a和溶液b,下列说法正确的是____。
A.都是饱和溶液 B.溶液质量a13.学习了溶液的概念后,老师的提问及同学的回答如图所示:
(1)以上三位同学中能够正确描述溶液特征的是_______同学。
老师接着问:“你们还想知道什么 ”
王华回答:“不溶于水的物质能溶于其他溶剂吗 ”
李佳回答:“物质在溶解过程中有热量的变化吗?”
(2)如果用实验回答王华的问题,则应该选择的溶质和溶剂分别是________。
(3)针对李佳的问题,他们一起设计实验:取三支试管,向试管中分别注入5 mL水,测得水的初温为20 ℃,再分别向三支试管中各加入3 g 氢氧化钠、氯化钠、硝酸铵,振荡。
①“振荡”试管的目的是________。
②用温度计分别测三支试管中溶液的温度,高于20 ℃的是_______溶液,这是因为__________。
③装有NH4N03溶液的试管外壁有水珠产生,原因是___________________。
④由此探究实验,可知_______溶于水温度没有明显的变化。
三、推断题
14.A、B、C、D、E、F均是初中化学中的常见物质,其中A、D为单质,其余均为化合物,B、C由两种相同元素组成。
(1)A在D中完全燃烧和不完全燃烧时,生成不同的气体。B溶液在一定条件下可反应生成C和无色气体D,C和D都与生命活动息息相关。B溶液中的溶质是_____(用化学式表示)
(2)如图所示将固体E放入大烧杯中的水里,小烧杯中F的饱和溶液变浑浊。则E的化学式可能为_____,产生此现象的原因是_____________。
15.图中,甲是相对分子质量为16的有机物,乙是最常见的溶剂,丁是白色难溶固体,其中金属元素的质量分数为40%.甲的化学式 ________ .②的化学方程式为 ________ .丙的一种用途是 ________ .
16.根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:
(1)t2℃时,向50g水中加入30g的b物质,得到b溶液的质量为______g
(2)将t2℃时a、b、c三种物质的饱和溶液降温至t1℃,三种溶液的溶质质量分数由大到小的顺序为______。
四、实验题
17.请从A~D中任选三个作答,若均作答,按前三个计分。如图,在Y形管中进行实验。补全实验方案。
序号 目的 操作 现象 结论
A 探究金属活动性 甲:放入铁片; 乙:放入银片; 向甲、乙处加入________ 甲中有红色固体生成,溶液变为浅绿色; 乙中无明显变化 金属活动性:铁>铜> 银
B 验证可燃物的燃烧条件 甲:放入红磷; 乙:放入白磷; 将甲、乙底部浸入80°C热水中 甲中无明显变化; 乙中白磷燃烧 ________
C 探究CO2的性质 甲:放入干燥的石蕊纸条; 乙:放入湿润的石蕊纸条; 向甲、乙处倒入CO2 ________ 二氧化碳能与水反应
D 比较________ 甲:放入一小粒高锰酸钾; 乙:放入一小粒碘; 向甲、乙处加入等量蒸馏水 甲中固体溶解形成紫色溶液; 乙中固体几乎不溶解 相同条件下,高锰酸钾在水中的溶解能力比碘强
18.如图甲是A、B、C三种固体物质的溶解度曲线图。
(1)甲图中,t2 ℃时,A、B、C三种物质中,溶解度最大的是 _____ ;P点所表示的含义为 _____ 。
(2)①将t2 ℃时A、B、C三种物质的饱和溶液降温到t1 ℃,三种物质的溶质质量分数由大到小的顺序是 _____ 。
②如乙图所示,20 ℃时,把试管放入盛有X的饱和溶液的烧杯中,在试管中加入几小段镁条,再加入5 mL稀盐酸,立即产生大量的气泡,同时烧杯中出现浑浊,则X可能为A、B、C三种固体物质中的哪一种? _____ 。
(3)t1 ℃时,将B物质的不饱和溶液转变成饱和溶液可采取的方法有: _____ 、 _____ (写两种方法)。
五、计算题
19.向盛有20.0 g稀硫酸的烧杯中倒入5.0 g黄铜(铜锌合金)样品粉末,恰好完全反应,称得未溶物质量为3.7 g。完成下列计算:
(1)该黄铜样品中含Zn的质量为________g。
(2)所用稀硫酸中溶质的质量分数为________。
(3)反应后所得溶液中溶质质量分数为________(结果保留一位小数)。
20.某校化学课外活动小组的同学在实验室的一次探究性活动中,他们将50g氢氧化钠溶液与50g硫酸铜溶液混合恰好完全反应,得到9.8g沉淀。请你计算氢氧化钠溶液中溶质的质量分数。_______
参考答案:
1.A 2.B 3.A 4.A 5.B 6.B 7.C 8.A 9.B 10.B
11.C
12. 25g 20% 蒸发结晶 ABDE
13. 王华、李佳 植物油、汽油 加速固体物质的溶解 氢氧化钠 氢氧化钠溶于水放热 硝酸铵溶于水吸热,溶液温度降低,使空气中的水蒸气凝结成水珠 氯化钠
14. H2O2 NaOH或CaO E溶于水放热
15. CH4 CO2+Ca(OH)2=CaCO3↓+H2O 灭火
16. 75 a>b>c
17. 硫酸铜溶液 可燃物燃烧需要温度达到着火点 甲中无明显变化,乙中石蕊纸条由紫色变为红色 高锰酸钾和碘在水中的溶解能力
18. A t1 ℃时,B、C两物质的溶解度相等 B>A>C C 增加溶质 降低温度
19.(1)1.3
(2)设稀硫酸中硫酸的质量分别为x、生成硫酸锌的质量为y,生成氢气质量为z。
解得:x=1.96g;
,解得:y=3.22g;
解得:z=0.04g;
稀硫酸中硫酸的质量分数=×100%=9.8%
答:稀硫酸中溶质的质量分数为9.8%;
(3)所得溶液中硫酸锌的质量分数=×100%≈15.1%
答:反应后所得溶液中硫酸锌的质量分数为15.1%。
20.16%
同课章节目录
