河北省邢台市临城县普通高中2021-2022学年高二下学期3月开学考试化学试题(Word版含答案)
文档属性
| 名称 | 河北省邢台市临城县普通高中2021-2022学年高二下学期3月开学考试化学试题(Word版含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 262.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-10 00:00:00 | ||
图片预览


文档简介
临城县普通高中2021-2022学年高二下学期3月开学考试
化 学
本试卷满分100分,考试用时75分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.本试卷主要考试内容:人教版选择性必修1、选择性必修2第一章。
5.可能用到的相对原子质量:H1 C12 O16 Na23 S32 Zn 65
一、选择题:本题共9小题,每小题3分,共27分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与生产、生活密切相关,下列说法正确的是
A.硫酸铝可用来除去水体中的悬浮杂质且具有杀菌消毒的作用
B.燃煤时,适当地鼓入氧气,可减轻温室效应
C.干电池放置过久可能漏液失效,其原因是显酸性的氯化铵溶液和外壳锌反应
D.氢氧化镁、氢氧化铝和氢氧化钠都是常见的胃酸中和剂
2.下列物质间的能量变化与如图所示的能量变化相符的是
A.钠与水的反应
B.稀盐酸与碳酸氢钠的反应
C.氢氧化钡与氯化铵的反应
D.灼热的炭与二氧化碳的反应
3.下列各原子或离子的电子排布式错误的是
A.O2-:ls22s 22p6 B. Ne:ls22s 22p6
C. Ca:ls22s 22p63s23p6 D. Al3+ :ls22s 22p6
4.在某一密闭容器中,对于反应N2(g) +3H2(g) 2NH3g) ΔH<0, 下列措施有利于提高N2的平衡转化率的是
A.加入合适的催化剂 B.适当地降低温度
C.增大容器的体积 D.仅增大NH3的浓度
5.物质的量浓度为0.1 mol·L-1的KF溶液中,由于F- 的水解,使得c(F- )<0.1 mol·L-1。为了使c(F-)更接近0.1 mol·L-1 ,可采取的措施是
A.加入少量的稀硫酸 B.加入适量的水
C.适当地升高温度 D.加入适量的KOH固体
6.用标准氢氧化钠溶液滴定稀盐酸(用无色酚酞作指示剂)时,下列操作正确的是
A.锥形瓶用蒸馏水洗涤后,再用稀盐酸润洗
B.滴定时,边摇动锥形瓶边注视锥形瓶内颜色的变化
C.滴定管用蒸馏水洗涤后,立即装入标准氢氧化钠溶液进行滴定
D.当滴入最后半滴标准液时,溶液由红色变为无色且30 s内颜色不恢复至原色,即达到滴定终点
7.下列说法错误的是
A.同一原子中,1s、2s、3s中电子的能量逐渐升高
B.在基态多电子原子中,在离核越近区域内运动的电子能量越低
C.同一能层上,电子云形状相同的原子轨道的能量相等
D.p能级原子轨道呈纺锤形,随着能层的增加,p能级原子轨道数增多
8.在一定温度下,向某恒容密闭容器中,充入一定量的M、N气体.5 min后,反应M(g)+3N(g) 2P(g)达 到平衡,若平衡时各物质的浓度分别为c(M)=2.0 mol·L-1、c(N)= 2.0 mol· L-1、c(P)=1.0 mol·I.-1, 下列说法正确的是
A.起始时c(M)+c(N)= 6.0 mol· L-1
B.0~5 min内,v(N)=0.4 mol· L-1、·min-1
C.此温度下,该反应的平衡常数K=16 mol2· L-2
D.反应达到平衡后,混合气体中P的物质的量分数为40%
9.室温下,向100 mL0.2 mol· L-1、 Na2CO3溶液中逐滴滴入0. 1 mol· L-1、的盐酸(已知:H2CO3的电离常数Ka1=5×10-7、Ka2=5 × 10-11,不考虑溶液混合时温度和体积的变化,lg5=0.7)。下列说法错误的是
A.当滴入盐酸的体积为50 mL时,溶液中一定存在c(Na+ )+c(H+ )=2c(CO32- )+c(HCO3- )+c(OH- )+c(Cl- )
B.当滴入盐酸的体积为150 mL时,溶液中一定存在7c(Na+ )>8c(CO32- )+8c(HCO3- )+8c(H2CO3)
C.当c(CO32- )=c(H2CO3)时,溶液的pH=8.3
D.当滴入的盐酸体积为200 mL时,溶液中一定存在c(Na+ )二、选择题:本题共4小题每小题4分,共16分。在每小题给出的四个选项中,只有一项或两项是符合题目要求的。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得4分,但只要选错一个,该小题得0分。
10.向某密闭容器中,充入一定量的P 、Q气体,发生反应aP(g) + bQ(g) cR(g) ,平衡时测得Q的物质的量浓度为0.30 mol· L-1。保持温度不变,将容器的容积缩小至原来的一半,反应重新达到平衡后,测得Q的物质的量浓度为0.62 mol· L-1。下列说法正确的是
A.a+b>c
B.重新达到平衡后,P的转化率增大
C.重新达到平衡后,R的体积分数减小
D.该反应的平衡常数表达式为K=
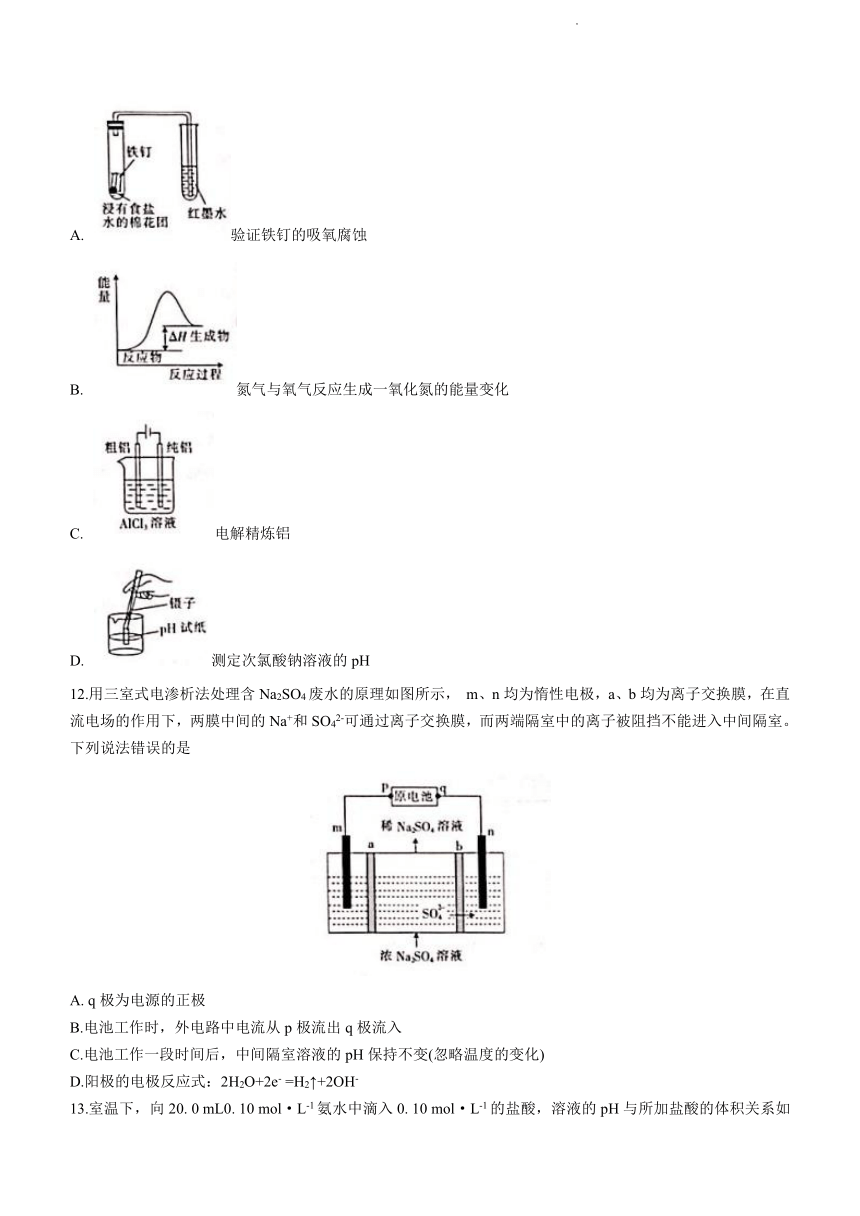
11.下列图示与对应的叙述相符的是
A. 验证铁钉的吸氧腐蚀
B. 氮气与氧气反应生成一氧化氮的能量变化
C. 电解精炼铝
D. 测定次氯酸钠溶液的pH
12.用三室式电渗析法处理含Na2SO4废水的原理如图所示, m、n均为惰性电极,a、b均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中的离子被阻挡不能进入中间隔室。下列说法错误的是
A. q极为电源的正极
B.电池工作时,外电路中电流从p极流出q极流入
C.电池工作一段时间后,中间隔室溶液的pH保持不变(忽略温度的变化)
D.阳极的电极反应式:2H2O+2e- =H2↑+2OH-
13.室温下,向20. 0 mL0. 10 mol·L-1氨水中滴入0. 10 mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示[已知:电离度= 100%。 室温下,K(NH3·H2O)=1. 6 ×10-5 ,lg2 =0.3,不考虑溶液混合时体积和温度的变化]。下列说法正确的是
A.m的值约为10.1
B.n点对应的溶液中,含有的溶质为NH4Cl和NH3·H2O
C.该温度下.0. 10 mol·L-1的氨水的电离度为4 ×10-1.5 ×100%
D.r点对应的溶液中
三、非选择题:本题共4小题,共57分。
14. (15分)前四周期原子序数依次增大的元素a、b、c、d中,a和b的价电子层中未成对电子均只有1个。并且a- 和b+的电子数相差8;c和d与b位于同一周期,c和d的价电子层中的未成对电子数分别为4和2,且原子序数相差2。
回答下列问题:
(1)a元素在元素周期表中的位置是_ ,属于 区。
(2)基态b原子中。电子占据最高能层的符号是_ , 基态b+占据的最高能级共有
个原子轨道。
(3)d元素基态原子的简化电子排布式为_ 。
(4)a、b、c、d四种元素中,电负性最大的为_____ (填元素符号)。
(5)a、b、d三种元素的第一电离能由大到小的顺序为_____(填元素符号).
(6)Mn和c两种元素的部分电离能数据如表所示:
元素 电离能/(kJ·mol-1)
I1 I2 I3
c元素 759 1561 2957
Mn元素 717 1509 3248
比较两元素的I2、 I3可知,气态Mn2+再失去一个电子比气态c2+再失去一个电子更难,原因是_
。
15. (14分)水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示.单位为mg·L-1。我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5 mg·L-1。某化学小组同学设计了下列装置(夹持装置略) ,测定某河水的DO。
I .测定原理:
①在碱性条件下,O2将Mn2+氧化为MnO(OH)2;
②在酸性条件下,MnO(OH)2将I-氧化为I2,反应为MnO(OH)2+2I-+4H+=Mn2++I2 + 3H2O
③用Na2S2O3标准溶液滴定生成的I2,反应为2S2O32- +I2=S4O62- +2I-。
II.测定步骤:
i.安装好装置,检验装置的气密性,充入氮气一段时间后,停止充氮气;
ii.向仪器a中加入200 mL水样;
iii.用注射器向仪器a中依次迅速加入1 mL MnSO4无氧溶液(过量)、2 mL碱性KI无氧溶液(过量) ,开启搅拌器,进行①中反应至完全;
iv.搅拌并用注射器向仪器a中加入2 mLH2SO4无氧溶液,至②中反应完全,溶液为中性或弱酸性;
v.用注射器从仪器a中取出40 mL溶液,用淀粉作指示剂,用0.01 mol·L-1 Na2S2O3溶液进行滴定,记录数据;
vi.重复步骤V的操作2~3次;
vii.处理数据(忽略氧气从水样中的逸出量和加入试剂后水样体积的变化)。
回答下列问题:
(1)仪器a的名称为 。
(2)写出①中反应的离子方程式:
(3)步骤i中起始充入氮气的目的是_ 。
(4)步骤v中达到滴定终点的标志为_ 。
(5)若某次滴定消耗Na2S2O3标准溶液3. 5 mL,则水样的DO= _mg·L-1。若为饮用水,则此次测得的DO (填“已”或“未”)达标,判断的理由是 (写出具体的计算过程)。
16. (13分)氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌(含有少量的FeO、MnO、NiO等杂质)的工艺流程如下:
已知:①在本实验条件下,Ni2+不能被氧化;高锰酸钾的还原产物是MnO2。
②氧化性:Ni2+> Zn2+。
回答下列问题:
(1)为了加快工业级ZnO与稀硫酸的反应速率,通常采用的方法是____ __ ( 填一种即可)。
(2)过滤时,常用到的玻璃仪器有玻璃棒、烧杯和 . ,其中玻璃棒的主要作用是
。
(3)在加高锰酸钾溶液前,若pH较低,则对除杂的影响是____ __。
(4)“过滤I”得到的滤液中含有的阳离子为______ (填离子符号)。
(5)写出②中发生反应的化学方程式: 。
(6) “滤饼”的主要成分可能是ZnCO3·xZn(OH)2。 取干燥后的滤饼21.1 g,煅烧后可得到产品16.2 g,则
x= 。
17. (15分)研究CO2的利用对构建低碳社会具有重要的意义。在一定条件下将CO2和H2转化为CH3OH和H2O(g)的相关反应有:
a. CO2(g)+ H2(g) CO(g)+H2O(g) ΔH1=- 38 kJ·mol-1;
b. CO(g)+ 2H2(g) CH3OH(g) ΔH2=-x kJ·mol-1;
c. CO2(g) + 3H2(g) CH3OH(g)+H2O(g) ΔH3=- 137 kJ·mol-1。
已知:①反应中部分化学键的键能数据如表所示。
化学键 C=O H-H C-H O- H
键能/(kJ·mol -1) 745 436 413 463
②x为大于零的数。
回答下列问题:
(1)反应c中C-O键的键能为 kJ·mol-1,反应b中每生成0.3 mol C- H键,该反应放出的热量为 _kJ。
(2)对于反应b,在_ (填“高温”、 “低温”或“任意温度”)下有利于该反应自发进行,判断的理由是
_ 。
(3)某温度下,向4 L的恒容密闭容器中,充入0. 2 mol CO2和0.8 mol H2,仅发生反应a和c,5min后.反应达到平衡,此时,测得平衡时混合气体的压强为起始压强的0.68倍,CO的物质的量为平衡时总物质的量的。
①0~5 min内,v(H2)= mol·L-1·min-1。
②CO2的转化率为_ %,c(CH3OH)= mol·L-1。
③反应达到平衡后,若此时的压强为p MPa,则反应c的平衡常数Kp=_ (列出计算式即可,以分压表示,分压=总压×物质的量分数)。
④下列说法正确的是 (填标号)。
A.仅及时移除部分产物H2O(g),反应a和c的平衡常数均增大
B.仅升高温度,ΔH1和ΔH3的值保持不变
C.当混合气体的密度不再随时间变化时,反应a和c达到平衡
D.每消耗0. 1 mol CO2的同时消耗0. 1 mol H2O(g),则反应a和c达到平衡
化学参考答案
1.C 2.A 3.C 4.B 5.D 6.B 7.D 8.A 9.D 10.C 11. AB 12. BD 13. BD
14. (1)第二周期第VIIA族(2分);p(1分)
(2)N(2分);3(2分)
(3)[Ar]3d84s2(2分)
(4)F(2分)
(5)F>Ni>K(2分)
(6)Mn2+的价电子排布式为3d5,d轨道电子为半充满结构,结构稳定,因此很难再失去电子;Fe2+的价电子
排布式为3d6 ,再失去一个电子为半充满稳定结构,因此再失去 一个电子较容易(或其他合理答案,2分)
15. (1)三颈烧瓶(或三口烧瓶,2分)
(2)2Mn2+ +O2 +4OH-=2MnO(OH)2 ↓(2分)
(3)除尽装置中空气,减小误差(或其他合理答案,2分)
(4)当滴入最后半滴标准液时,溶液由蓝色变为无色且30s内溶液不恢复至原色(2分)
(5)7(2分);已(2分);DO= mg·L-1=7 mg·L-1>5 mg· L-1,故已达标 (2分)
16. (1)搅拌(或其他合理答案,2分)
(2)漏斗(2分);引流(1分)
(3)铁离子和锰离子不能生成沉淀,从而无法除去铁和锰杂质(2分)
(4)H+、K+、Zn2+、Ni2+ (漏写错写均不给分,2分)
(5)5KOH+ 3FeSO4 + KMnO4 +2H2O=MnO2 ↓+ 3Fe(OH)3↓+3K2SO4(2分)
(6)3(2分)
17. (1)307(1分);9. 9(1分)
(2)低温(1分);反应b为熵减的放热反应,低温有利于该反应自发进行(2分)
(3)①0.025(2分) .
②90(2分);0.04(2分)
③ (Mpa)-2 (不写单位不扣分,2分)
④BD(2分)
化 学
本试卷满分100分,考试用时75分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.本试卷主要考试内容:人教版选择性必修1、选择性必修2第一章。
5.可能用到的相对原子质量:H1 C12 O16 Na23 S32 Zn 65
一、选择题:本题共9小题,每小题3分,共27分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与生产、生活密切相关,下列说法正确的是
A.硫酸铝可用来除去水体中的悬浮杂质且具有杀菌消毒的作用
B.燃煤时,适当地鼓入氧气,可减轻温室效应
C.干电池放置过久可能漏液失效,其原因是显酸性的氯化铵溶液和外壳锌反应
D.氢氧化镁、氢氧化铝和氢氧化钠都是常见的胃酸中和剂
2.下列物质间的能量变化与如图所示的能量变化相符的是
A.钠与水的反应
B.稀盐酸与碳酸氢钠的反应
C.氢氧化钡与氯化铵的反应
D.灼热的炭与二氧化碳的反应
3.下列各原子或离子的电子排布式错误的是
A.O2-:ls22s 22p6 B. Ne:ls22s 22p6
C. Ca:ls22s 22p63s23p6 D. Al3+ :ls22s 22p6
4.在某一密闭容器中,对于反应N2(g) +3H2(g) 2NH3g) ΔH<0, 下列措施有利于提高N2的平衡转化率的是
A.加入合适的催化剂 B.适当地降低温度
C.增大容器的体积 D.仅增大NH3的浓度
5.物质的量浓度为0.1 mol·L-1的KF溶液中,由于F- 的水解,使得c(F- )<0.1 mol·L-1。为了使c(F-)更接近0.1 mol·L-1 ,可采取的措施是
A.加入少量的稀硫酸 B.加入适量的水
C.适当地升高温度 D.加入适量的KOH固体
6.用标准氢氧化钠溶液滴定稀盐酸(用无色酚酞作指示剂)时,下列操作正确的是
A.锥形瓶用蒸馏水洗涤后,再用稀盐酸润洗
B.滴定时,边摇动锥形瓶边注视锥形瓶内颜色的变化
C.滴定管用蒸馏水洗涤后,立即装入标准氢氧化钠溶液进行滴定
D.当滴入最后半滴标准液时,溶液由红色变为无色且30 s内颜色不恢复至原色,即达到滴定终点
7.下列说法错误的是
A.同一原子中,1s、2s、3s中电子的能量逐渐升高
B.在基态多电子原子中,在离核越近区域内运动的电子能量越低
C.同一能层上,电子云形状相同的原子轨道的能量相等
D.p能级原子轨道呈纺锤形,随着能层的增加,p能级原子轨道数增多
8.在一定温度下,向某恒容密闭容器中,充入一定量的M、N气体.5 min后,反应M(g)+3N(g) 2P(g)达 到平衡,若平衡时各物质的浓度分别为c(M)=2.0 mol·L-1、c(N)= 2.0 mol· L-1、c(P)=1.0 mol·I.-1, 下列说法正确的是
A.起始时c(M)+c(N)= 6.0 mol· L-1
B.0~5 min内,v(N)=0.4 mol· L-1、·min-1
C.此温度下,该反应的平衡常数K=16 mol2· L-2
D.反应达到平衡后,混合气体中P的物质的量分数为40%
9.室温下,向100 mL0.2 mol· L-1、 Na2CO3溶液中逐滴滴入0. 1 mol· L-1、的盐酸(已知:H2CO3的电离常数Ka1=5×10-7、Ka2=5 × 10-11,不考虑溶液混合时温度和体积的变化,lg5=0.7)。下列说法错误的是
A.当滴入盐酸的体积为50 mL时,溶液中一定存在c(Na+ )+c(H+ )=2c(CO32- )+c(HCO3- )+c(OH- )+c(Cl- )
B.当滴入盐酸的体积为150 mL时,溶液中一定存在7c(Na+ )>8c(CO32- )+8c(HCO3- )+8c(H2CO3)
C.当c(CO32- )=c(H2CO3)时,溶液的pH=8.3
D.当滴入的盐酸体积为200 mL时,溶液中一定存在c(Na+ )
10.向某密闭容器中,充入一定量的P 、Q气体,发生反应aP(g) + bQ(g) cR(g) ,平衡时测得Q的物质的量浓度为0.30 mol· L-1。保持温度不变,将容器的容积缩小至原来的一半,反应重新达到平衡后,测得Q的物质的量浓度为0.62 mol· L-1。下列说法正确的是
A.a+b>c
B.重新达到平衡后,P的转化率增大
C.重新达到平衡后,R的体积分数减小
D.该反应的平衡常数表达式为K=
11.下列图示与对应的叙述相符的是
A. 验证铁钉的吸氧腐蚀
B. 氮气与氧气反应生成一氧化氮的能量变化
C. 电解精炼铝
D. 测定次氯酸钠溶液的pH
12.用三室式电渗析法处理含Na2SO4废水的原理如图所示, m、n均为惰性电极,a、b均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中的离子被阻挡不能进入中间隔室。下列说法错误的是
A. q极为电源的正极
B.电池工作时,外电路中电流从p极流出q极流入
C.电池工作一段时间后,中间隔室溶液的pH保持不变(忽略温度的变化)
D.阳极的电极反应式:2H2O+2e- =H2↑+2OH-
13.室温下,向20. 0 mL0. 10 mol·L-1氨水中滴入0. 10 mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示[已知:电离度= 100%。 室温下,K(NH3·H2O)=1. 6 ×10-5 ,lg2 =0.3,不考虑溶液混合时体积和温度的变化]。下列说法正确的是
A.m的值约为10.1
B.n点对应的溶液中,含有的溶质为NH4Cl和NH3·H2O
C.该温度下.0. 10 mol·L-1的氨水的电离度为4 ×10-1.5 ×100%
D.r点对应的溶液中
三、非选择题:本题共4小题,共57分。
14. (15分)前四周期原子序数依次增大的元素a、b、c、d中,a和b的价电子层中未成对电子均只有1个。并且a- 和b+的电子数相差8;c和d与b位于同一周期,c和d的价电子层中的未成对电子数分别为4和2,且原子序数相差2。
回答下列问题:
(1)a元素在元素周期表中的位置是_ ,属于 区。
(2)基态b原子中。电子占据最高能层的符号是_ , 基态b+占据的最高能级共有
个原子轨道。
(3)d元素基态原子的简化电子排布式为_ 。
(4)a、b、c、d四种元素中,电负性最大的为_____ (填元素符号)。
(5)a、b、d三种元素的第一电离能由大到小的顺序为_____(填元素符号).
(6)Mn和c两种元素的部分电离能数据如表所示:
元素 电离能/(kJ·mol-1)
I1 I2 I3
c元素 759 1561 2957
Mn元素 717 1509 3248
比较两元素的I2、 I3可知,气态Mn2+再失去一个电子比气态c2+再失去一个电子更难,原因是_
。
15. (14分)水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示.单位为mg·L-1。我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5 mg·L-1。某化学小组同学设计了下列装置(夹持装置略) ,测定某河水的DO。
I .测定原理:
①在碱性条件下,O2将Mn2+氧化为MnO(OH)2;
②在酸性条件下,MnO(OH)2将I-氧化为I2,反应为MnO(OH)2+2I-+4H+=Mn2++I2 + 3H2O
③用Na2S2O3标准溶液滴定生成的I2,反应为2S2O32- +I2=S4O62- +2I-。
II.测定步骤:
i.安装好装置,检验装置的气密性,充入氮气一段时间后,停止充氮气;
ii.向仪器a中加入200 mL水样;
iii.用注射器向仪器a中依次迅速加入1 mL MnSO4无氧溶液(过量)、2 mL碱性KI无氧溶液(过量) ,开启搅拌器,进行①中反应至完全;
iv.搅拌并用注射器向仪器a中加入2 mLH2SO4无氧溶液,至②中反应完全,溶液为中性或弱酸性;
v.用注射器从仪器a中取出40 mL溶液,用淀粉作指示剂,用0.01 mol·L-1 Na2S2O3溶液进行滴定,记录数据;
vi.重复步骤V的操作2~3次;
vii.处理数据(忽略氧气从水样中的逸出量和加入试剂后水样体积的变化)。
回答下列问题:
(1)仪器a的名称为 。
(2)写出①中反应的离子方程式:
(3)步骤i中起始充入氮气的目的是_ 。
(4)步骤v中达到滴定终点的标志为_ 。
(5)若某次滴定消耗Na2S2O3标准溶液3. 5 mL,则水样的DO= _mg·L-1。若为饮用水,则此次测得的DO (填“已”或“未”)达标,判断的理由是 (写出具体的计算过程)。
16. (13分)氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌(含有少量的FeO、MnO、NiO等杂质)的工艺流程如下:
已知:①在本实验条件下,Ni2+不能被氧化;高锰酸钾的还原产物是MnO2。
②氧化性:Ni2+> Zn2+。
回答下列问题:
(1)为了加快工业级ZnO与稀硫酸的反应速率,通常采用的方法是____ __ ( 填一种即可)。
(2)过滤时,常用到的玻璃仪器有玻璃棒、烧杯和 . ,其中玻璃棒的主要作用是
。
(3)在加高锰酸钾溶液前,若pH较低,则对除杂的影响是____ __。
(4)“过滤I”得到的滤液中含有的阳离子为______ (填离子符号)。
(5)写出②中发生反应的化学方程式: 。
(6) “滤饼”的主要成分可能是ZnCO3·xZn(OH)2。 取干燥后的滤饼21.1 g,煅烧后可得到产品16.2 g,则
x= 。
17. (15分)研究CO2的利用对构建低碳社会具有重要的意义。在一定条件下将CO2和H2转化为CH3OH和H2O(g)的相关反应有:
a. CO2(g)+ H2(g) CO(g)+H2O(g) ΔH1=- 38 kJ·mol-1;
b. CO(g)+ 2H2(g) CH3OH(g) ΔH2=-x kJ·mol-1;
c. CO2(g) + 3H2(g) CH3OH(g)+H2O(g) ΔH3=- 137 kJ·mol-1。
已知:①反应中部分化学键的键能数据如表所示。
化学键 C=O H-H C-H O- H
键能/(kJ·mol -1) 745 436 413 463
②x为大于零的数。
回答下列问题:
(1)反应c中C-O键的键能为 kJ·mol-1,反应b中每生成0.3 mol C- H键,该反应放出的热量为 _kJ。
(2)对于反应b,在_ (填“高温”、 “低温”或“任意温度”)下有利于该反应自发进行,判断的理由是
_ 。
(3)某温度下,向4 L的恒容密闭容器中,充入0. 2 mol CO2和0.8 mol H2,仅发生反应a和c,5min后.反应达到平衡,此时,测得平衡时混合气体的压强为起始压强的0.68倍,CO的物质的量为平衡时总物质的量的。
①0~5 min内,v(H2)= mol·L-1·min-1。
②CO2的转化率为_ %,c(CH3OH)= mol·L-1。
③反应达到平衡后,若此时的压强为p MPa,则反应c的平衡常数Kp=_ (列出计算式即可,以分压表示,分压=总压×物质的量分数)。
④下列说法正确的是 (填标号)。
A.仅及时移除部分产物H2O(g),反应a和c的平衡常数均增大
B.仅升高温度,ΔH1和ΔH3的值保持不变
C.当混合气体的密度不再随时间变化时,反应a和c达到平衡
D.每消耗0. 1 mol CO2的同时消耗0. 1 mol H2O(g),则反应a和c达到平衡
化学参考答案
1.C 2.A 3.C 4.B 5.D 6.B 7.D 8.A 9.D 10.C 11. AB 12. BD 13. BD
14. (1)第二周期第VIIA族(2分);p(1分)
(2)N(2分);3(2分)
(3)[Ar]3d84s2(2分)
(4)F(2分)
(5)F>Ni>K(2分)
(6)Mn2+的价电子排布式为3d5,d轨道电子为半充满结构,结构稳定,因此很难再失去电子;Fe2+的价电子
排布式为3d6 ,再失去一个电子为半充满稳定结构,因此再失去 一个电子较容易(或其他合理答案,2分)
15. (1)三颈烧瓶(或三口烧瓶,2分)
(2)2Mn2+ +O2 +4OH-=2MnO(OH)2 ↓(2分)
(3)除尽装置中空气,减小误差(或其他合理答案,2分)
(4)当滴入最后半滴标准液时,溶液由蓝色变为无色且30s内溶液不恢复至原色(2分)
(5)7(2分);已(2分);DO= mg·L-1=7 mg·L-1>5 mg· L-1,故已达标 (2分)
16. (1)搅拌(或其他合理答案,2分)
(2)漏斗(2分);引流(1分)
(3)铁离子和锰离子不能生成沉淀,从而无法除去铁和锰杂质(2分)
(4)H+、K+、Zn2+、Ni2+ (漏写错写均不给分,2分)
(5)5KOH+ 3FeSO4 + KMnO4 +2H2O=MnO2 ↓+ 3Fe(OH)3↓+3K2SO4(2分)
(6)3(2分)
17. (1)307(1分);9. 9(1分)
(2)低温(1分);反应b为熵减的放热反应,低温有利于该反应自发进行(2分)
(3)①0.025(2分) .
②90(2分);0.04(2分)
③ (Mpa)-2 (不写单位不扣分,2分)
④BD(2分)
同课章节目录
