高中化学人教版(2019)必修第二册5.2.2氨和铵盐(共21张ppt)
文档属性
| 名称 | 高中化学人教版(2019)必修第二册5.2.2氨和铵盐(共21张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 12.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-10 22:03:08 | ||
图片预览





文档简介
(共21张PPT)
第二节 氮及其化合物
第2课时 氨与铵盐
第五章 化工生产中的重要非金属元素
合成氨和尿素,可以说是化学工业最伟大的发明,对人类
的贡献无论如何夸大都不为过。
民以食为天,人类从诞生到1900年,几百万年时间,人口只有16亿。而1908年合成氨工业化,至现在100多年时间,人口增加到超过76亿,无疑合成氨是起了巨大的作用的。合成氨,诞生了化学肥料,使土地的粮食产量翻了几番,使地球才能养活这么多人口,而且不挨饿。这其中的意义是无法用语言来表达的。
同时氨还是重要的无机化工产品,在国民经济中占有重要地位。除了作为肥料,也是生产硝酸、各种含氮的无机盐及有机中间体、磺胺药、聚氨酯、聚酰胺纤维和丁腈橡胶等的重要原料。
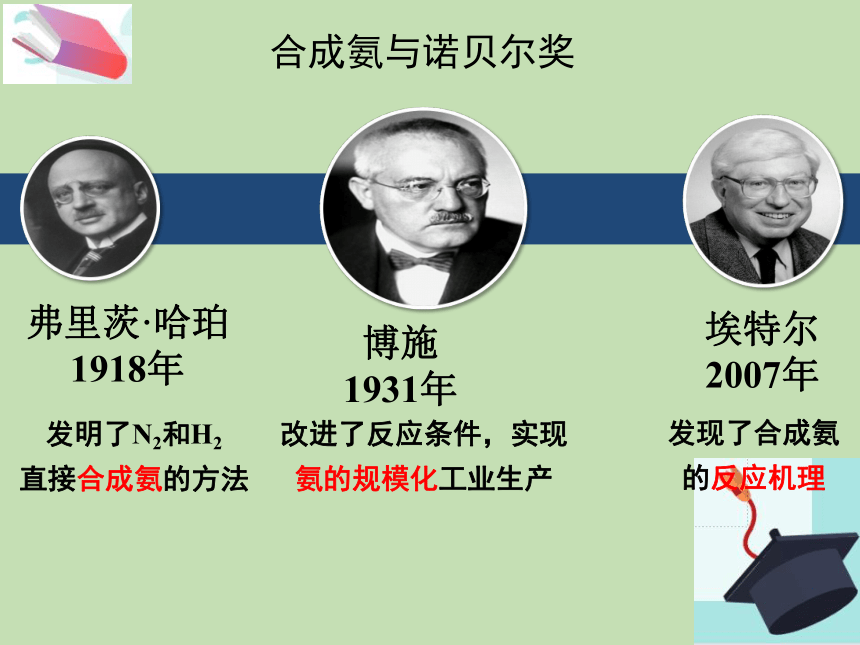
合成氨与诺贝尔奖
合成氨与诺贝尔奖
弗里茨·哈珀
1918年
博施
1931年
埃特尔
2007年
改进了反应条件,实现
氨的规模化工业生产
发现了合成氨
的反应机理
发明了N2和H2
直接合成氨的方法
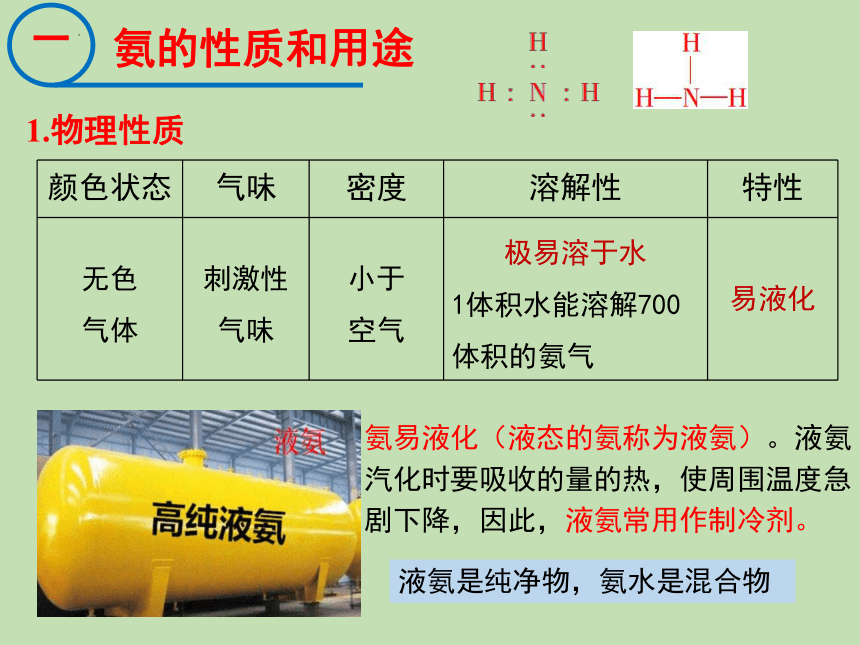
氨的性质和用途
一
1.物理性质
颜色状态 气味 密度 溶解性 特性
无色 气体 刺激性 气味 小于 空气 极易溶于水 1体积水能溶解700 体积的氨气 易液化
液氨是纯净物,氨水是混合物
氨易液化(液态的氨称为液氨)。液氨汽化时要吸收的量的热,使周围温度急剧下降,因此,液氨常用作制冷剂。
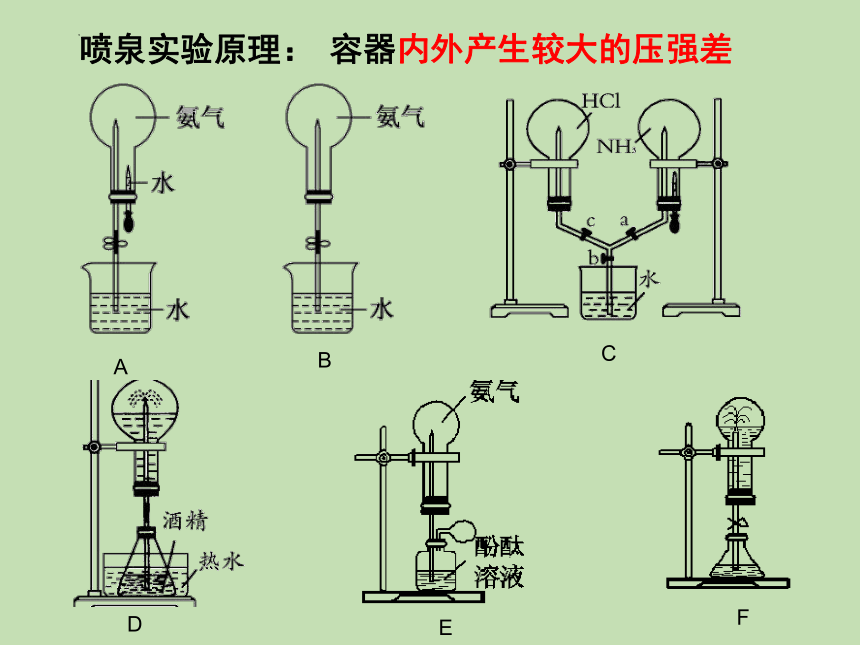
【实验5-6】喷泉实验
在干燥的圆底烧瓶里充满NH3,用带有玻璃管和胶头滴管(预先吸入水)的橡胶塞塞紧瓶口。倒置烧瓶,使玻璃管插入盛有水的烧杯中(预先在水里滴入少量酚酞溶液)。打开弹簧夹,挤压胶头滴管,使水进入烧瓶。观察并描述现象,分析出现这些现象的可能原因。
(1)喷泉实验的原理
因为烧瓶内气体易溶于水或易与水反应,使瓶内压强减小,形成压强差,大气压将烧杯中的水压入烧瓶而形成喷泉。
(2)常见的能形成喷泉实验的气体和吸收剂:
(3)实验成功的关键:
密:装置气密性良好。
干:圆底烧瓶要干燥。
纯:装置内气体的纯度要高。
此喷泉停止后,为什么烧瓶不能被水完全充满?
由于氨气是用向下排空气法收集的,一定含有少量空气。
气体 HCl NH3 CO2、Cl2、 SO2 NO2 NO、O2 (4∶3) NO2、O2
(4∶1)
吸收剂 水、NaOH 溶液 水或酸 NaOH 溶液 水 水 水
容器内外产生较大的压强差
喷泉实验原理:
A
B
C
D
E
F
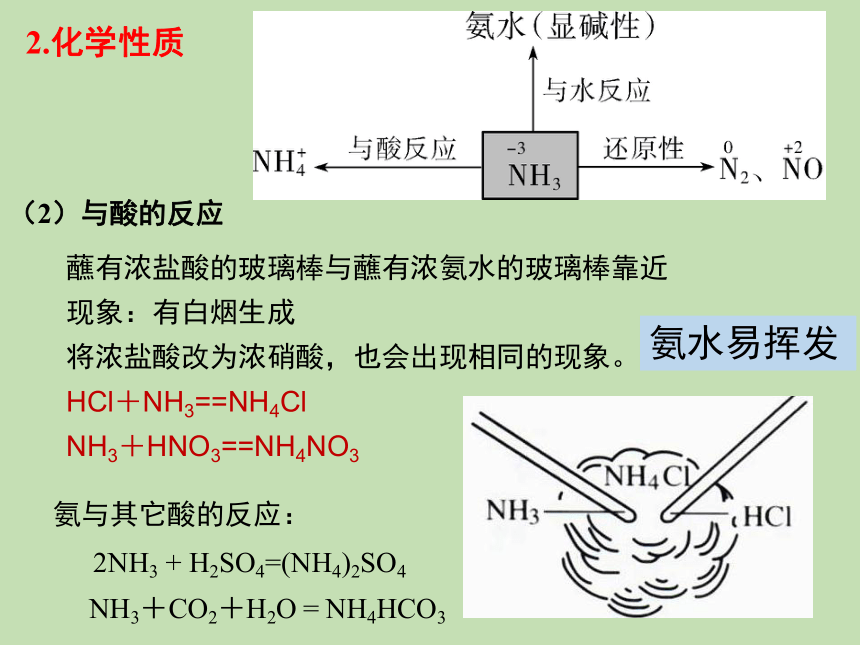
2.化学性质
(1)与水反应
反应原理为NH3+H2O NH3·H2O NH4++OH-。
氨气溶于水得氨水,显碱性,氨水中含有的粒子有:
NH3·H2O、H2O、NH3、NH4+、OH-、H+。
NH3·H2O为可溶性一元弱碱,不稳定,易分解,
NH3·H2O====NH3↑+H2O。
△
【温馨提醒】
1.求氨水的质量分数、物质的量浓度时,视溶质为NH3。
2.氨水密度小于1g/mL,且浓度越大,密度越小。
3.NH3是中学化学中唯一的碱性气体,能使湿润的红色石蕊试纸变蓝,在推断题中作为解题突破口。
2.化学性质
(2)与酸的反应
蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近
现象:有白烟生成
将浓盐酸改为浓硝酸,也会出现相同的现象。
HCl+NH3==NH4Cl
NH3+HNO3==NH4NO3
氨水易挥发
NH3+CO2+H2O = NH4HCO3
氨与其它酸的反应:
2NH3 + H2SO4=(NH4)2SO4
2.化学性质
(3)氨气的还原性
①催化氧化:
②被CuO氧化:
③被氯气氧化:
或
应用:管道工人用浓氨水检验氯气管道是否漏气
(工业制硝酸的基础)
3.用途
①液氨汽化时吸收大量的热,故用作制冷剂。
②制氮肥、硝酸、铵盐、纯碱等。
2NO + O2 = 2NO2
3NO2 +H2O = 2HNO3 +NO
4NH3 + 5O2 4NO + 6H2O
催化剂
△
N2 + 3H2 2NH3
高温、高压
催化剂
N2
O2
NH3
NO
NO2
HNO3
H2O
O2
步骤一:合成氨
步骤二:氨催化氧化
步骤三:冷却氧化
步骤四:吸收
工业制硝酸
1.判断正误(正确的打“√”,错误的打“×”)
(1)NH3溶于水溶液呈弱碱性故NH3为弱碱。 ( )
(2)氨的喷泉实验说明NH3易溶于水。 ( )
(3)NH3通入盐酸和氨水加入盐酸中,两离子反应方程式相同。( )
(4)NH3的催化氧化反应中还原产物只有H2O。( )
【课堂检测】
[答案] (1)× (2)√ (3)× (4)×
2.下列反应中说明氨气具有还原性和碱性的是( )
D. NH3+HCl = NH4Cl
B
B. 8NH3+3Cl2 = 6NH4Cl+N2
C.4NH3+5O2===4NO+6H2O
催化剂
A. 2NH3+3CuO = 3Cu+N2+3H2O
铵盐
二
NH3+H+=NH4+
铵盐是农业上常用的化肥,绝大多数易溶于水。
1.物理性质
2.化学性质
NH4Cl===NH3+HCl
NH4HCO3===NH3↑+H2O+CO2↑
(NH4)2CO3===NH3↑+H2O+CO2↑
△
△
△
5NH4NO3===4N2+2HNO3+9H2O
△
所有的铵盐受热均分解
但是分解不一定会产生氨气
NH3中N为-3价,具有较强的还原性,在硫酸铵、硝酸铵受热分解中会发生变价
5NH4NO3===4N2+2HNO3+9H2O
△
(1)受热易分解
3(NH4)2SO4 === N2+3SO2+4NH3+H2O
△
(2)与碱反应放氨气
【实验5-7】向盛有少量NH4Cl溶液、NH4NO3溶液和(NH4)2SO4溶液的三支试管中分别加入NaOH溶液并加热(注意通风),用镊子夹住一片湿润的红色石蕊试纸放在试管口。观察现象,分析现象产生的原因,写出反应的离子方程式。
OH— +NH4+=== H2O+NH3↑
(2)与碱反应放氨气
OH— +NH4+=== H2O+NH3↑
写出稀溶液中铵盐与强碱不加热反应的离子方程式:
NH4+ + OH-= NH3·H2O
写出溶液中铵盐与强碱浓或热反应的离子方程式:
OH - +NH4+= H2O+NH3↑
氨根检验
取溶液(或固体)少许于小试管中,滴加浓NaOH溶液,加热,能产生使湿润的红色石蕊试纸变蓝的气体或用蘸有浓盐酸的玻璃棒靠近,产生白烟,证明NH4+的存在,反之则没有。
稀溶液:NH3·H2O 浓溶液: NH3 ↑+H2O 加热时无论浓稀:NH3 ↑+H2O
氨气实验室制备
2NH4Cl+Ca(OH)2 === CaCl2+2NH3↑+2H2O
固+固→加热型
向下排空气法
湿润的红色石蕊试纸变蓝或蘸浓盐酸的玻璃棒有白烟
(与氧气相同)
碱石灰
装置:
收集:
验满:
干燥:
不能用浓硫酸、P2O5、无水CaCl2(形成CaCl2· 8NH3)
棉花的作用:
防止与空气对流,提高集气的速度与纯度。
尾气吸收:
酸溶液或水(防倒吸)
装置改进:
【温馨提醒】
1.本实验 制NH3 :
NH4HCO3
NH4HCO3受热分解产生CO2
NH4NO3
NaOH
容易吸水结块,不利于NH3产生和逸出,加热条件下NaOH容易腐蚀玻璃
2.不直接加热NH4Cl制取原因:
NH4Cl分解产生的NH3和HCl遇冷会再次化合为NH4Cl,不能用于制取NH3
NH4NO3受热时易发生爆炸
NH4Cl和NaCl混合 加热分离
I2和NaCl混合 加热分离
【思考】
原理不同
其它实验室制取NH3的简易方法
方法 化学方程式(或原理) 气体发生装置
加热浓氨水 NH3·H2O==NH3↑+H2O
浓氨水+固体NaOH ①NaOH溶于水放热 , 促使NH3·H2O分解 ;②OH-浓度的增大有利于NH3的生成
浓氨水+固体CaO ①CaO与水反应生成OH-,使溶剂(水)减少;②OH-浓度的增大有利于NH3的生成;③反应放热,促使NH3·H2O分解。NH3·H2O+CaO==NH3↑+Ca(OH)2
氨气的工业制法
N2+3H2 2NH3
高温高压
催化剂
提高产率:1、分离液氨 2、原料的循环利用
铵盐:庄稼要想长得好,施肥还得有技巧
1909,哈珀在德国首先实现工业化,成为氮肥工业大量生产的基础。
合成
氨
20世纪四五十年代,硫酸铵(NH4)2SO4是最主要的氮肥品种
硫酸铵
60年代,增加了硝酸NH4NO3
硝酸铵
70年代以来,尿素CO(NH2)2成为主导的氮肥品种
尿素
80年代,碳酸氢铵(NH4HCO3)是中国主要生产的氮肥品种之一
碳酸氢铵
①雨后追肥 (小雨,降温)
②避免与碱性肥料一起使用
【学以致用】
第二节 氮及其化合物
第2课时 氨与铵盐
第五章 化工生产中的重要非金属元素
合成氨和尿素,可以说是化学工业最伟大的发明,对人类
的贡献无论如何夸大都不为过。
民以食为天,人类从诞生到1900年,几百万年时间,人口只有16亿。而1908年合成氨工业化,至现在100多年时间,人口增加到超过76亿,无疑合成氨是起了巨大的作用的。合成氨,诞生了化学肥料,使土地的粮食产量翻了几番,使地球才能养活这么多人口,而且不挨饿。这其中的意义是无法用语言来表达的。
同时氨还是重要的无机化工产品,在国民经济中占有重要地位。除了作为肥料,也是生产硝酸、各种含氮的无机盐及有机中间体、磺胺药、聚氨酯、聚酰胺纤维和丁腈橡胶等的重要原料。
合成氨与诺贝尔奖
合成氨与诺贝尔奖
弗里茨·哈珀
1918年
博施
1931年
埃特尔
2007年
改进了反应条件,实现
氨的规模化工业生产
发现了合成氨
的反应机理
发明了N2和H2
直接合成氨的方法
氨的性质和用途
一
1.物理性质
颜色状态 气味 密度 溶解性 特性
无色 气体 刺激性 气味 小于 空气 极易溶于水 1体积水能溶解700 体积的氨气 易液化
液氨是纯净物,氨水是混合物
氨易液化(液态的氨称为液氨)。液氨汽化时要吸收的量的热,使周围温度急剧下降,因此,液氨常用作制冷剂。
【实验5-6】喷泉实验
在干燥的圆底烧瓶里充满NH3,用带有玻璃管和胶头滴管(预先吸入水)的橡胶塞塞紧瓶口。倒置烧瓶,使玻璃管插入盛有水的烧杯中(预先在水里滴入少量酚酞溶液)。打开弹簧夹,挤压胶头滴管,使水进入烧瓶。观察并描述现象,分析出现这些现象的可能原因。
(1)喷泉实验的原理
因为烧瓶内气体易溶于水或易与水反应,使瓶内压强减小,形成压强差,大气压将烧杯中的水压入烧瓶而形成喷泉。
(2)常见的能形成喷泉实验的气体和吸收剂:
(3)实验成功的关键:
密:装置气密性良好。
干:圆底烧瓶要干燥。
纯:装置内气体的纯度要高。
此喷泉停止后,为什么烧瓶不能被水完全充满?
由于氨气是用向下排空气法收集的,一定含有少量空气。
气体 HCl NH3 CO2、Cl2、 SO2 NO2 NO、O2 (4∶3) NO2、O2
(4∶1)
吸收剂 水、NaOH 溶液 水或酸 NaOH 溶液 水 水 水
容器内外产生较大的压强差
喷泉实验原理:
A
B
C
D
E
F
2.化学性质
(1)与水反应
反应原理为NH3+H2O NH3·H2O NH4++OH-。
氨气溶于水得氨水,显碱性,氨水中含有的粒子有:
NH3·H2O、H2O、NH3、NH4+、OH-、H+。
NH3·H2O为可溶性一元弱碱,不稳定,易分解,
NH3·H2O====NH3↑+H2O。
△
【温馨提醒】
1.求氨水的质量分数、物质的量浓度时,视溶质为NH3。
2.氨水密度小于1g/mL,且浓度越大,密度越小。
3.NH3是中学化学中唯一的碱性气体,能使湿润的红色石蕊试纸变蓝,在推断题中作为解题突破口。
2.化学性质
(2)与酸的反应
蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近
现象:有白烟生成
将浓盐酸改为浓硝酸,也会出现相同的现象。
HCl+NH3==NH4Cl
NH3+HNO3==NH4NO3
氨水易挥发
NH3+CO2+H2O = NH4HCO3
氨与其它酸的反应:
2NH3 + H2SO4=(NH4)2SO4
2.化学性质
(3)氨气的还原性
①催化氧化:
②被CuO氧化:
③被氯气氧化:
或
应用:管道工人用浓氨水检验氯气管道是否漏气
(工业制硝酸的基础)
3.用途
①液氨汽化时吸收大量的热,故用作制冷剂。
②制氮肥、硝酸、铵盐、纯碱等。
2NO + O2 = 2NO2
3NO2 +H2O = 2HNO3 +NO
4NH3 + 5O2 4NO + 6H2O
催化剂
△
N2 + 3H2 2NH3
高温、高压
催化剂
N2
O2
NH3
NO
NO2
HNO3
H2O
O2
步骤一:合成氨
步骤二:氨催化氧化
步骤三:冷却氧化
步骤四:吸收
工业制硝酸
1.判断正误(正确的打“√”,错误的打“×”)
(1)NH3溶于水溶液呈弱碱性故NH3为弱碱。 ( )
(2)氨的喷泉实验说明NH3易溶于水。 ( )
(3)NH3通入盐酸和氨水加入盐酸中,两离子反应方程式相同。( )
(4)NH3的催化氧化反应中还原产物只有H2O。( )
【课堂检测】
[答案] (1)× (2)√ (3)× (4)×
2.下列反应中说明氨气具有还原性和碱性的是( )
D. NH3+HCl = NH4Cl
B
B. 8NH3+3Cl2 = 6NH4Cl+N2
C.4NH3+5O2===4NO+6H2O
催化剂
A. 2NH3+3CuO = 3Cu+N2+3H2O
铵盐
二
NH3+H+=NH4+
铵盐是农业上常用的化肥,绝大多数易溶于水。
1.物理性质
2.化学性质
NH4Cl===NH3+HCl
NH4HCO3===NH3↑+H2O+CO2↑
(NH4)2CO3===NH3↑+H2O+CO2↑
△
△
△
5NH4NO3===4N2+2HNO3+9H2O
△
所有的铵盐受热均分解
但是分解不一定会产生氨气
NH3中N为-3价,具有较强的还原性,在硫酸铵、硝酸铵受热分解中会发生变价
5NH4NO3===4N2+2HNO3+9H2O
△
(1)受热易分解
3(NH4)2SO4 === N2+3SO2+4NH3+H2O
△
(2)与碱反应放氨气
【实验5-7】向盛有少量NH4Cl溶液、NH4NO3溶液和(NH4)2SO4溶液的三支试管中分别加入NaOH溶液并加热(注意通风),用镊子夹住一片湿润的红色石蕊试纸放在试管口。观察现象,分析现象产生的原因,写出反应的离子方程式。
OH— +NH4+=== H2O+NH3↑
(2)与碱反应放氨气
OH— +NH4+=== H2O+NH3↑
写出稀溶液中铵盐与强碱不加热反应的离子方程式:
NH4+ + OH-= NH3·H2O
写出溶液中铵盐与强碱浓或热反应的离子方程式:
OH - +NH4+= H2O+NH3↑
氨根检验
取溶液(或固体)少许于小试管中,滴加浓NaOH溶液,加热,能产生使湿润的红色石蕊试纸变蓝的气体或用蘸有浓盐酸的玻璃棒靠近,产生白烟,证明NH4+的存在,反之则没有。
稀溶液:NH3·H2O 浓溶液: NH3 ↑+H2O 加热时无论浓稀:NH3 ↑+H2O
氨气实验室制备
2NH4Cl+Ca(OH)2 === CaCl2+2NH3↑+2H2O
固+固→加热型
向下排空气法
湿润的红色石蕊试纸变蓝或蘸浓盐酸的玻璃棒有白烟
(与氧气相同)
碱石灰
装置:
收集:
验满:
干燥:
不能用浓硫酸、P2O5、无水CaCl2(形成CaCl2· 8NH3)
棉花的作用:
防止与空气对流,提高集气的速度与纯度。
尾气吸收:
酸溶液或水(防倒吸)
装置改进:
【温馨提醒】
1.本实验 制NH3 :
NH4HCO3
NH4HCO3受热分解产生CO2
NH4NO3
NaOH
容易吸水结块,不利于NH3产生和逸出,加热条件下NaOH容易腐蚀玻璃
2.不直接加热NH4Cl制取原因:
NH4Cl分解产生的NH3和HCl遇冷会再次化合为NH4Cl,不能用于制取NH3
NH4NO3受热时易发生爆炸
NH4Cl和NaCl混合 加热分离
I2和NaCl混合 加热分离
【思考】
原理不同
其它实验室制取NH3的简易方法
方法 化学方程式(或原理) 气体发生装置
加热浓氨水 NH3·H2O==NH3↑+H2O
浓氨水+固体NaOH ①NaOH溶于水放热 , 促使NH3·H2O分解 ;②OH-浓度的增大有利于NH3的生成
浓氨水+固体CaO ①CaO与水反应生成OH-,使溶剂(水)减少;②OH-浓度的增大有利于NH3的生成;③反应放热,促使NH3·H2O分解。NH3·H2O+CaO==NH3↑+Ca(OH)2
氨气的工业制法
N2+3H2 2NH3
高温高压
催化剂
提高产率:1、分离液氨 2、原料的循环利用
铵盐:庄稼要想长得好,施肥还得有技巧
1909,哈珀在德国首先实现工业化,成为氮肥工业大量生产的基础。
合成
氨
20世纪四五十年代,硫酸铵(NH4)2SO4是最主要的氮肥品种
硫酸铵
60年代,增加了硝酸NH4NO3
硝酸铵
70年代以来,尿素CO(NH2)2成为主导的氮肥品种
尿素
80年代,碳酸氢铵(NH4HCO3)是中国主要生产的氮肥品种之一
碳酸氢铵
①雨后追肥 (小雨,降温)
②避免与碱性肥料一起使用
【学以致用】
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
