第二单元常见的酸和碱达标检测卷(word版有答案)
文档属性
| 名称 | 第二单元常见的酸和碱达标检测卷(word版有答案) |  | |
| 格式 | doc | ||
| 文件大小 | 482.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-11 11:01:19 | ||
图片预览



文档简介
第二单元达标检测卷
可能用到的相对原子质量:H—1 C—12 O—16 Na—23 S—32 Cl—35.5 K—39 Cu—64
一、选择题(本题包括12小题,每题3分,共36分)
1.下列现象中,没有发生化学变化的是( )
A.敞口放置的澄清石灰水中有白色固体析出
B.敞口放置的氯化钠饱和溶液中有白色固体析出
C.浓硫酸溅到木材上,木材变黑
D.长期掩埋于地下的铁器上产生红褐色斑点
2.现有四种无色溶液:①白醋、②盐酸、③氨水、④氢氧化钾溶液,分别测定它们的pH,其中pH<7的是( )
A.①② B.③④ C.①③ D.②③
3.下列物质不需要密封保存的是( )
A.浓盐酸 B.氢氧化钠 C.石灰石 D.浓硫酸
4.稀释浓硫酸并进行硫酸性质实验的下列操作,正确的是( )
5.要除去CaCl2溶液中的稀盐酸得到CaCl2溶液,最好的方法是加入( )
A.生石灰 B.石灰石 C.熟石灰 D.苛性钠
6.下列化学方程式书写正确的是( )
A.2NaOH+CO2===Na2CO3+H2O B.Fe2O3+CO===Fe+CO2
C.2Fe+6HCl===2FeCl3+3H2↑ D.Cu+H2SO4(稀)===CuSO4+H2↑
7.下列关于酸、碱的说法错误的是( )
A.苛性钠、烧碱、火碱都是氢氧化钠
B.氢氧化钙可以用于改良酸性土壤
C.稀盐酸能够使酚酞试液变红
D.生活中许多常见的物质(如柠檬、柑橘)中含有酸
8.通过实验以及对实验现象的观察、记录和分析,可以发现和验证化学原理。下面是小兰同学在完成酸、碱的性质实验时记录的部分实验现象,其中正确的是( )
A.打开盛有浓盐酸的试剂瓶瓶塞,瓶口有白烟产生
B.向氧化铁中加入足量稀硫酸,红棕色固体溶解,溶液由无色变成浅绿色
C.向氯化铜溶液中加入几滴氢氧化钠溶液,产生蓝色沉淀
D.向氢氧化钙溶液中加入几滴紫色石蕊试液,石蕊试液由紫色变成红色
9.某学习小组进行盐酸与氢氧化钠的中和反应实验时,在常温下,向一定量的某溶液中滴加 X 溶液,得到了如图所示的pH变化曲线。下列说法正确的是( )
A.X是盐酸
B.向a点的溶液中加入硫酸铜溶液,产生蓝色沉淀
C.b点表示盐酸和氢氧化钠恰好完全反应
D.c点溶液中的阴离子只有OH-
10.氯气(Cl2)能与水发生如下反应:Cl2+H2O===HCl+HClO,其中HClO是一种酸。将Cl2通入氢氧化钠溶液中,反应的生成物有( )
A.NaCl、H2O B.NaClO、H2O
C.NaCl、NaClO D.NaCl、NaClO、H2O
11.归纳梳理是一种重要的学习方法。以下对知识的归纳正确的是( )
A.CO、CO2都是非金属氧化物,都能与碱溶液反应生成盐和水
B.金刚石和石墨都是碳的单质,都有导电性
C.氢氧化钙溶液与硫酸铜溶液、稀硫酸反应,都体现碱的通性
D.CO2、SO2都能与水反应生成酸,它们都是引起酸雨的重要气体
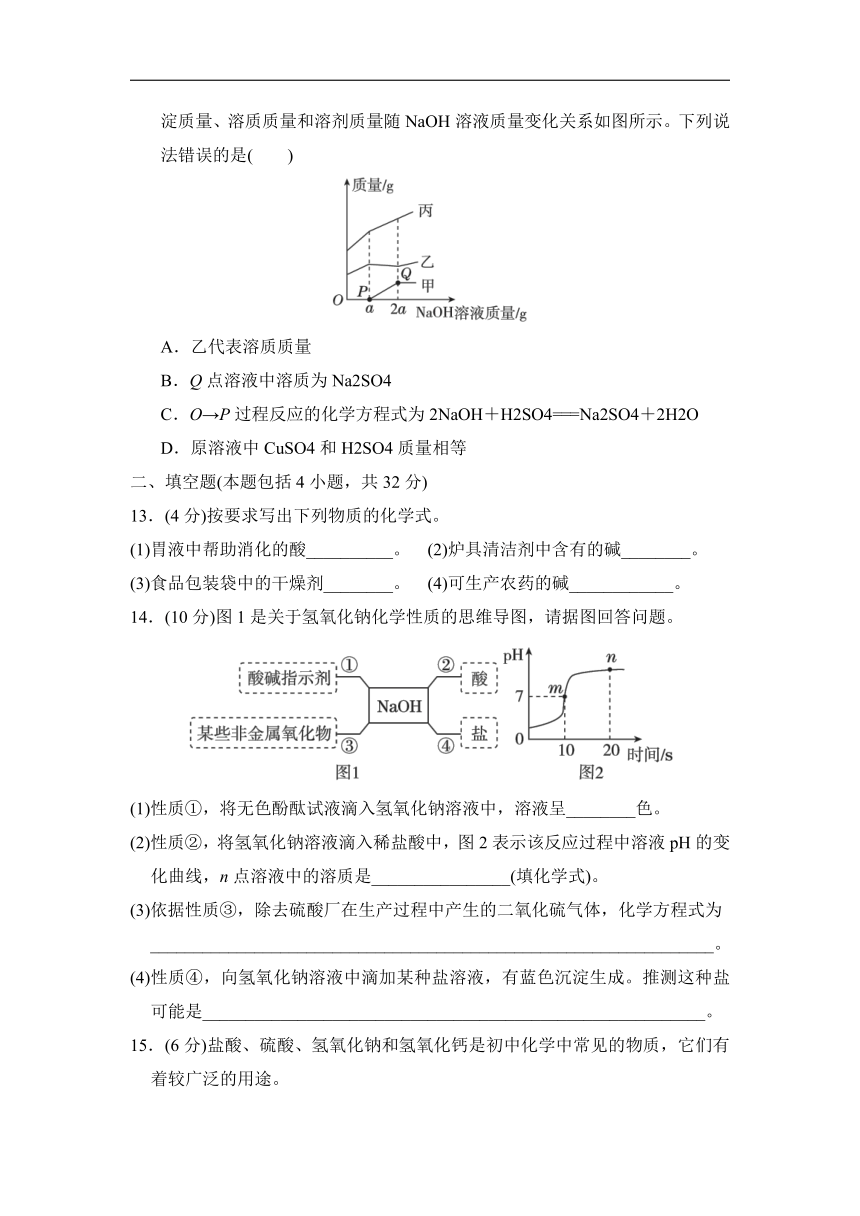
12. 向盛有CuSO4和H2SO4混合溶液的烧杯中,逐滴加入NaOH溶液至过量,沉淀质量、溶质质量和溶剂质量随NaOH溶液质量变化关系如图所示。下列说法错误的是( )
A.乙代表溶质质量
B.Q点溶液中溶质为Na2SO4
C.O→P过程反应的化学方程式为2NaOH+H2SO4===Na2SO4+2H2O
D.原溶液中CuSO4和H2SO4质量相等
二、填空题(本题包括4小题,共32分)
13.(4分)按要求写出下列物质的化学式。
(1)胃液中帮助消化的酸__________。 (2)炉具清洁剂中含有的碱________。
(3)食品包装袋中的干燥剂________。 (4)可生产农药的碱____________。
14.(10分)图1是关于氢氧化钠化学性质的思维导图,请据图回答问题。
(1)性质①,将无色酚酞试液滴入氢氧化钠溶液中,溶液呈________色。
(2)性质②,将氢氧化钠溶液滴入稀盐酸中,图2表示该反应过程中溶液pH的变化曲线,n点溶液中的溶质是________________(填化学式)。
(3)依据性质③,除去硫酸厂在生产过程中产生的二氧化硫气体,化学方程式为
_________________________________________________________________。
(4)性质④,向氢氧化钠溶液中滴加某种盐溶液,有蓝色沉淀生成。推测这种盐可能是__________________________________________________________。
15.(6分)盐酸、硫酸、氢氧化钠和氢氧化钙是初中化学中常见的物质,它们有着较广泛的用途。
(1)酸与碱之间能发生____________反应,写出一个上述四种物质之间能发生反应的化学方程式:_________________________________________________。
(2)氢氧化钙可以用来调节土壤的________性,它的水溶液常用来检验________气体的存在。
(3)将一定量的稀硫酸与氢氧化钠溶液混合,滴入几滴酚酞试液,混合液显红色,可推断该溶液的pH______(填“>”“<”或“=”)7。要准确测定该溶液的pH,需要用到的仪器是________________。
16. (12分)如图所示“天宫号”化学空间站的舱室分别代表初中化学中的常见物质。图中“→”表示转化关系,“—”表示相互能反应,所涉及反应均为初中常见的化学反应。已知A是最常用的溶剂,D的俗名叫烧碱,E是人体胃液中含有的酸,A、B、E、F分别属于四种不同类别的化合物,C是由三种元素组成的化合物。
(1)A的化学式为____________。
(2)C与F反应的基本类型是___________________________________________。
(3)C→D反应的化学方程式为_________________________________________。
(4)空间站迎来了首批访问者,他们搭乘的载人舱X与连接舱C成功对接(如上图所示),则载人舱X代表的物质可能是________(填字母)。
A.C B.CO2 C.Fe2O3 D.CaCO3
三、实验探究题(本题包括2小题,共24分)
17.(9分)某学习小组用黑枸杞提取液做了以下实验:
实验一:室温时,将蒸馏水和不同pH的硫酸、氢氧化钠溶液,放入14支试管中,分别向每支试管中滴加3滴黑枸杞提取液。实验结果如下:
pH 1 2 3 4 5 6 7 8 9 10 11 12 13 14
颜色 粉红 粉红 粉红 浅紫 浅紫 紫 紫 蓝 蓝 深蓝 深蓝 灰绿 黄 黄棕
实验二:室温时,向试管中分别加入相同体积的4种物质,各滴加3滴黑枸杞提取液。实验结果如下:
物质 稀盐酸 牛奶 蒸馏水 炉具清洁剂
颜色 粉红 紫 紫 黄
回答下列问题:
(1)炉具清洁剂的pH约为________。
(2)根据实验现象,不能确定牛奶呈中性的理由是_________________________
_________________________________________________________________。
(3)小苏打溶液的pH为8.3,向小苏打溶液中加3滴黑枸杞提取液,再滴入稀盐酸至过量,观察到的实验现象为_____________________________________。
18.(15分)为加深对酸的主要性质的认识,通过实验解释生活中的一些现象,在学完酸的化学性质后,老师组织同学们完成了以下实验活动。
【实验内容与分析】实验一:按如图1所示完成实验。
实验二:往生锈的铁钉中加入足量的稀盐酸。
实验三:往滴有酚酞的氢氧化钠溶液中加入一定量的稀盐酸。
实验四:往5.3 g Na2CO3粉末中加入足量的稀盐酸。
(1)实验一中,观察到石蕊试液变________色。
(2)实验二中,观察到溶液由无色变成黄色,一段时间后有气泡产生,请解释出现这两个现象的原因______________________________________________。
(3)实验三中,观察到溶液由红色变成无色,由此现象分析,反应后所得溶液中,溶质成分的可能组合有 ________________(不考虑酚酞)(用化学式表示)。
(4)请计算,实验四理论上可以生成二氧化碳的质量为________g。
【应用与拓展】
(5)结合以上实验内容,请设计实验方案除去铜粉中混有的氧化铜,得到纯净的铜_____________________________________________________________
______________________________________________________________。
(6)小明在征得老师的同意后,继续进行了如图2所示实验。
由上述实验可以得出氢氧化钙的性质有______________________。
四、计算题(本题包括1小题,共8分)
19.(8分)小慧称取20 g某氯化铜样品放入烧杯中,加入50 g水使氯化铜完全溶解,逐滴加入一定溶质质量分数的氢氧化钾溶液,反应生成沉淀的质量与所加氢氧化钾溶液质量的关系如图所示。[提示:①CuCl2+2KOH===2KCl+Cu(OH)2↓;②氯化铜样品中所含杂质既不溶于水,也不参与反应。]试计算:
(1)最终生成沉淀的质量为________g。
(2)当恰好完全反应时,所得溶液的溶质质量分数是多少?
答案
一、1.B 2.A 3.C 4.D 5.B 6.A 7.C 8.C
9.C 点拨:由pH的变化可知,是把氢氧化钠溶液滴加到稀盐酸中,X是氢氧化钠溶液,故A错误;a点的溶液的pH小于7,显酸性,说明稀盐酸过量,溶液中的溶质为HCl和NaCl,向a点的溶液中加入硫酸铜溶液,无明显现象,故B错误;b点的溶液的pH等于7,显中性,b点表示盐酸和氢氧化钠恰好完全反应,故C正确;c点的溶液的pH大于7,显碱性,说明氢氧化钠溶液过量,溶液中的溶质为NaOH和NaCl,c点溶液中的阴离子有Cl-、OH-,故D错误。
10.D 点拨:根据信息可知,Cl2能与H2O反应生成HCl和HClO,HCl、HClO与NaOH发生中和反应,最终生成NaCl、NaClO和H2O。
11.C 点拨:CO、CO2都是非金属氧化物,二氧化碳能与碱溶液反应生成盐和水,一氧化碳不能,A不正确;金刚石和石墨都是碳的单质,石墨有导电性,金刚石不能导电,B不正确;氢氧化钙溶液与硫酸铜溶液、稀硫酸反应,都体现碱的通性,C正确;CO2、SO2都能与水反应生成酸,二氧化硫是引起酸雨的主要气体,二氧化碳不是,D不正确。
12.D 点拨:氢氧化钠与稀硫酸反应,溶质质量增加,氢氧化钠与硫酸铜反应,溶质质量减小,继续加氢氧化钠溶液不再发生化学反应,溶质质量增加,所以乙代表溶质质量,A正确;刚开始加入氢氧化钠溶液时没有甲物质,继续滴加氢氧化钠溶液,甲的质量增加,则甲代表沉淀的质量,当沉淀质量达到最大值时,即稀硫酸、硫酸铜与氢氧化钠恰好完全反应,此时溶质只有Na2SO4,所以Q点溶液中溶质为Na2SO4,B正确;O→P过程发生的是氢氧化钠和稀硫酸的反应,反应的化学方程式为2NaOH+H2SO4===Na2SO4+2H2O,C正确;根据图像可知,CuSO4和H2SO4消耗氢氧化钠的质量相等,消耗氢氧化钠的质量相等时,反应的CuSO4和H2SO4的质量比为160:98=80:49,二者质量不相等,D错误。
二、13.(1)HCl (2)NaOH (3)CaO (4)Ca(OH)2
14.(1)红 (2)NaCl、NaOH
(3)2NaOH+SO2===Na2SO3+H2O
(4)硫酸铜(或氯化铜或硝酸铜等)
15.(1)中和;NaOH+HCl===NaCl+H2O(其他合理答案均可) (2)酸;CO2 (3)>;pH计
16.(1)H2O (2)复分解反应
(3)Na2CO3+Ca(OH)2===CaCO3↓+2NaOH
(4)B
点拨:(1)A是最常用的溶剂,故A是水,化学式为H2O。(2)D的俗名叫烧碱,故D是氢氧化钠;E是人体胃液中含有的酸,故E是盐酸;A、B、E、F分别属于四种不同类别的化合物,结合A与B可相互转化,推知B为氢氧化钙,B可与C反应,且C是由三种元素组成的化合物,C可以是碳酸钠;F可以是氯化钙或氯化钡等,经检验,推断合理。C与F反应的基本类型是复分解反应。(3)C→D的反应为氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠。(4)由图可知X代表的物质能与碳酸钠相互转化,故为二氧化碳。
三、17.(1)13 (2)牛奶滴加黑枸杞提取液后,溶液为紫色,而紫色对应的pH为6和7 (3)有气泡生成,溶液颜色由蓝色变为粉红色
18.(1)红 (2)氧化铁与盐酸反应生成氯化铁,此时溶液变为黄色,氧化铁反应完后,内部未生锈的铁与盐酸反应生成氢气,看到气泡产生 (3)NaCl或NaCl和HCl
(4)2.2 (5)向混合固体中加入足量盐酸,然后过滤、洗涤、干燥固体,得到纯净的铜 (6)氢氧化钙微溶于水,形成的溶液显碱性,可使酚酞试液变红色,可与盐酸反应
四、19.(1)9.8
(2)解:设恰好完全反应时,生成氯化钾的质量为x。
CuCl2+2KOH===2KCl+Cu(OH)2↓
149 98
x 9.8 g
=
x=14.9 g
当恰好完全反应时,所得溶液的溶质质量分数是×100%≈14.0%
答:所得溶液的溶质质量分数是14.0%。
可能用到的相对原子质量:H—1 C—12 O—16 Na—23 S—32 Cl—35.5 K—39 Cu—64
一、选择题(本题包括12小题,每题3分,共36分)
1.下列现象中,没有发生化学变化的是( )
A.敞口放置的澄清石灰水中有白色固体析出
B.敞口放置的氯化钠饱和溶液中有白色固体析出
C.浓硫酸溅到木材上,木材变黑
D.长期掩埋于地下的铁器上产生红褐色斑点
2.现有四种无色溶液:①白醋、②盐酸、③氨水、④氢氧化钾溶液,分别测定它们的pH,其中pH<7的是( )
A.①② B.③④ C.①③ D.②③
3.下列物质不需要密封保存的是( )
A.浓盐酸 B.氢氧化钠 C.石灰石 D.浓硫酸
4.稀释浓硫酸并进行硫酸性质实验的下列操作,正确的是( )
5.要除去CaCl2溶液中的稀盐酸得到CaCl2溶液,最好的方法是加入( )
A.生石灰 B.石灰石 C.熟石灰 D.苛性钠
6.下列化学方程式书写正确的是( )
A.2NaOH+CO2===Na2CO3+H2O B.Fe2O3+CO===Fe+CO2
C.2Fe+6HCl===2FeCl3+3H2↑ D.Cu+H2SO4(稀)===CuSO4+H2↑
7.下列关于酸、碱的说法错误的是( )
A.苛性钠、烧碱、火碱都是氢氧化钠
B.氢氧化钙可以用于改良酸性土壤
C.稀盐酸能够使酚酞试液变红
D.生活中许多常见的物质(如柠檬、柑橘)中含有酸
8.通过实验以及对实验现象的观察、记录和分析,可以发现和验证化学原理。下面是小兰同学在完成酸、碱的性质实验时记录的部分实验现象,其中正确的是( )
A.打开盛有浓盐酸的试剂瓶瓶塞,瓶口有白烟产生
B.向氧化铁中加入足量稀硫酸,红棕色固体溶解,溶液由无色变成浅绿色
C.向氯化铜溶液中加入几滴氢氧化钠溶液,产生蓝色沉淀
D.向氢氧化钙溶液中加入几滴紫色石蕊试液,石蕊试液由紫色变成红色
9.某学习小组进行盐酸与氢氧化钠的中和反应实验时,在常温下,向一定量的某溶液中滴加 X 溶液,得到了如图所示的pH变化曲线。下列说法正确的是( )
A.X是盐酸
B.向a点的溶液中加入硫酸铜溶液,产生蓝色沉淀
C.b点表示盐酸和氢氧化钠恰好完全反应
D.c点溶液中的阴离子只有OH-
10.氯气(Cl2)能与水发生如下反应:Cl2+H2O===HCl+HClO,其中HClO是一种酸。将Cl2通入氢氧化钠溶液中,反应的生成物有( )
A.NaCl、H2O B.NaClO、H2O
C.NaCl、NaClO D.NaCl、NaClO、H2O
11.归纳梳理是一种重要的学习方法。以下对知识的归纳正确的是( )
A.CO、CO2都是非金属氧化物,都能与碱溶液反应生成盐和水
B.金刚石和石墨都是碳的单质,都有导电性
C.氢氧化钙溶液与硫酸铜溶液、稀硫酸反应,都体现碱的通性
D.CO2、SO2都能与水反应生成酸,它们都是引起酸雨的重要气体
12. 向盛有CuSO4和H2SO4混合溶液的烧杯中,逐滴加入NaOH溶液至过量,沉淀质量、溶质质量和溶剂质量随NaOH溶液质量变化关系如图所示。下列说法错误的是( )
A.乙代表溶质质量
B.Q点溶液中溶质为Na2SO4
C.O→P过程反应的化学方程式为2NaOH+H2SO4===Na2SO4+2H2O
D.原溶液中CuSO4和H2SO4质量相等
二、填空题(本题包括4小题,共32分)
13.(4分)按要求写出下列物质的化学式。
(1)胃液中帮助消化的酸__________。 (2)炉具清洁剂中含有的碱________。
(3)食品包装袋中的干燥剂________。 (4)可生产农药的碱____________。
14.(10分)图1是关于氢氧化钠化学性质的思维导图,请据图回答问题。
(1)性质①,将无色酚酞试液滴入氢氧化钠溶液中,溶液呈________色。
(2)性质②,将氢氧化钠溶液滴入稀盐酸中,图2表示该反应过程中溶液pH的变化曲线,n点溶液中的溶质是________________(填化学式)。
(3)依据性质③,除去硫酸厂在生产过程中产生的二氧化硫气体,化学方程式为
_________________________________________________________________。
(4)性质④,向氢氧化钠溶液中滴加某种盐溶液,有蓝色沉淀生成。推测这种盐可能是__________________________________________________________。
15.(6分)盐酸、硫酸、氢氧化钠和氢氧化钙是初中化学中常见的物质,它们有着较广泛的用途。
(1)酸与碱之间能发生____________反应,写出一个上述四种物质之间能发生反应的化学方程式:_________________________________________________。
(2)氢氧化钙可以用来调节土壤的________性,它的水溶液常用来检验________气体的存在。
(3)将一定量的稀硫酸与氢氧化钠溶液混合,滴入几滴酚酞试液,混合液显红色,可推断该溶液的pH______(填“>”“<”或“=”)7。要准确测定该溶液的pH,需要用到的仪器是________________。
16. (12分)如图所示“天宫号”化学空间站的舱室分别代表初中化学中的常见物质。图中“→”表示转化关系,“—”表示相互能反应,所涉及反应均为初中常见的化学反应。已知A是最常用的溶剂,D的俗名叫烧碱,E是人体胃液中含有的酸,A、B、E、F分别属于四种不同类别的化合物,C是由三种元素组成的化合物。
(1)A的化学式为____________。
(2)C与F反应的基本类型是___________________________________________。
(3)C→D反应的化学方程式为_________________________________________。
(4)空间站迎来了首批访问者,他们搭乘的载人舱X与连接舱C成功对接(如上图所示),则载人舱X代表的物质可能是________(填字母)。
A.C B.CO2 C.Fe2O3 D.CaCO3
三、实验探究题(本题包括2小题,共24分)
17.(9分)某学习小组用黑枸杞提取液做了以下实验:
实验一:室温时,将蒸馏水和不同pH的硫酸、氢氧化钠溶液,放入14支试管中,分别向每支试管中滴加3滴黑枸杞提取液。实验结果如下:
pH 1 2 3 4 5 6 7 8 9 10 11 12 13 14
颜色 粉红 粉红 粉红 浅紫 浅紫 紫 紫 蓝 蓝 深蓝 深蓝 灰绿 黄 黄棕
实验二:室温时,向试管中分别加入相同体积的4种物质,各滴加3滴黑枸杞提取液。实验结果如下:
物质 稀盐酸 牛奶 蒸馏水 炉具清洁剂
颜色 粉红 紫 紫 黄
回答下列问题:
(1)炉具清洁剂的pH约为________。
(2)根据实验现象,不能确定牛奶呈中性的理由是_________________________
_________________________________________________________________。
(3)小苏打溶液的pH为8.3,向小苏打溶液中加3滴黑枸杞提取液,再滴入稀盐酸至过量,观察到的实验现象为_____________________________________。
18.(15分)为加深对酸的主要性质的认识,通过实验解释生活中的一些现象,在学完酸的化学性质后,老师组织同学们完成了以下实验活动。
【实验内容与分析】实验一:按如图1所示完成实验。
实验二:往生锈的铁钉中加入足量的稀盐酸。
实验三:往滴有酚酞的氢氧化钠溶液中加入一定量的稀盐酸。
实验四:往5.3 g Na2CO3粉末中加入足量的稀盐酸。
(1)实验一中,观察到石蕊试液变________色。
(2)实验二中,观察到溶液由无色变成黄色,一段时间后有气泡产生,请解释出现这两个现象的原因______________________________________________。
(3)实验三中,观察到溶液由红色变成无色,由此现象分析,反应后所得溶液中,溶质成分的可能组合有 ________________(不考虑酚酞)(用化学式表示)。
(4)请计算,实验四理论上可以生成二氧化碳的质量为________g。
【应用与拓展】
(5)结合以上实验内容,请设计实验方案除去铜粉中混有的氧化铜,得到纯净的铜_____________________________________________________________
______________________________________________________________。
(6)小明在征得老师的同意后,继续进行了如图2所示实验。
由上述实验可以得出氢氧化钙的性质有______________________。
四、计算题(本题包括1小题,共8分)
19.(8分)小慧称取20 g某氯化铜样品放入烧杯中,加入50 g水使氯化铜完全溶解,逐滴加入一定溶质质量分数的氢氧化钾溶液,反应生成沉淀的质量与所加氢氧化钾溶液质量的关系如图所示。[提示:①CuCl2+2KOH===2KCl+Cu(OH)2↓;②氯化铜样品中所含杂质既不溶于水,也不参与反应。]试计算:
(1)最终生成沉淀的质量为________g。
(2)当恰好完全反应时,所得溶液的溶质质量分数是多少?
答案
一、1.B 2.A 3.C 4.D 5.B 6.A 7.C 8.C
9.C 点拨:由pH的变化可知,是把氢氧化钠溶液滴加到稀盐酸中,X是氢氧化钠溶液,故A错误;a点的溶液的pH小于7,显酸性,说明稀盐酸过量,溶液中的溶质为HCl和NaCl,向a点的溶液中加入硫酸铜溶液,无明显现象,故B错误;b点的溶液的pH等于7,显中性,b点表示盐酸和氢氧化钠恰好完全反应,故C正确;c点的溶液的pH大于7,显碱性,说明氢氧化钠溶液过量,溶液中的溶质为NaOH和NaCl,c点溶液中的阴离子有Cl-、OH-,故D错误。
10.D 点拨:根据信息可知,Cl2能与H2O反应生成HCl和HClO,HCl、HClO与NaOH发生中和反应,最终生成NaCl、NaClO和H2O。
11.C 点拨:CO、CO2都是非金属氧化物,二氧化碳能与碱溶液反应生成盐和水,一氧化碳不能,A不正确;金刚石和石墨都是碳的单质,石墨有导电性,金刚石不能导电,B不正确;氢氧化钙溶液与硫酸铜溶液、稀硫酸反应,都体现碱的通性,C正确;CO2、SO2都能与水反应生成酸,二氧化硫是引起酸雨的主要气体,二氧化碳不是,D不正确。
12.D 点拨:氢氧化钠与稀硫酸反应,溶质质量增加,氢氧化钠与硫酸铜反应,溶质质量减小,继续加氢氧化钠溶液不再发生化学反应,溶质质量增加,所以乙代表溶质质量,A正确;刚开始加入氢氧化钠溶液时没有甲物质,继续滴加氢氧化钠溶液,甲的质量增加,则甲代表沉淀的质量,当沉淀质量达到最大值时,即稀硫酸、硫酸铜与氢氧化钠恰好完全反应,此时溶质只有Na2SO4,所以Q点溶液中溶质为Na2SO4,B正确;O→P过程发生的是氢氧化钠和稀硫酸的反应,反应的化学方程式为2NaOH+H2SO4===Na2SO4+2H2O,C正确;根据图像可知,CuSO4和H2SO4消耗氢氧化钠的质量相等,消耗氢氧化钠的质量相等时,反应的CuSO4和H2SO4的质量比为160:98=80:49,二者质量不相等,D错误。
二、13.(1)HCl (2)NaOH (3)CaO (4)Ca(OH)2
14.(1)红 (2)NaCl、NaOH
(3)2NaOH+SO2===Na2SO3+H2O
(4)硫酸铜(或氯化铜或硝酸铜等)
15.(1)中和;NaOH+HCl===NaCl+H2O(其他合理答案均可) (2)酸;CO2 (3)>;pH计
16.(1)H2O (2)复分解反应
(3)Na2CO3+Ca(OH)2===CaCO3↓+2NaOH
(4)B
点拨:(1)A是最常用的溶剂,故A是水,化学式为H2O。(2)D的俗名叫烧碱,故D是氢氧化钠;E是人体胃液中含有的酸,故E是盐酸;A、B、E、F分别属于四种不同类别的化合物,结合A与B可相互转化,推知B为氢氧化钙,B可与C反应,且C是由三种元素组成的化合物,C可以是碳酸钠;F可以是氯化钙或氯化钡等,经检验,推断合理。C与F反应的基本类型是复分解反应。(3)C→D的反应为氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠。(4)由图可知X代表的物质能与碳酸钠相互转化,故为二氧化碳。
三、17.(1)13 (2)牛奶滴加黑枸杞提取液后,溶液为紫色,而紫色对应的pH为6和7 (3)有气泡生成,溶液颜色由蓝色变为粉红色
18.(1)红 (2)氧化铁与盐酸反应生成氯化铁,此时溶液变为黄色,氧化铁反应完后,内部未生锈的铁与盐酸反应生成氢气,看到气泡产生 (3)NaCl或NaCl和HCl
(4)2.2 (5)向混合固体中加入足量盐酸,然后过滤、洗涤、干燥固体,得到纯净的铜 (6)氢氧化钙微溶于水,形成的溶液显碱性,可使酚酞试液变红色,可与盐酸反应
四、19.(1)9.8
(2)解:设恰好完全反应时,生成氯化钾的质量为x。
CuCl2+2KOH===2KCl+Cu(OH)2↓
149 98
x 9.8 g
=
x=14.9 g
当恰好完全反应时,所得溶液的溶质质量分数是×100%≈14.0%
答:所得溶液的溶质质量分数是14.0%。
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
