专题8金属和金属材料随堂训练-2021-2022学年九年级化学仁爱版下册(word版 含答案)
文档属性
| 名称 | 专题8金属和金属材料随堂训练-2021-2022学年九年级化学仁爱版下册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 274.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 仁爱科普版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-11 16:17:16 | ||
图片预览



文档简介
专题8金属和金属材料随堂训练2021-2022学年九年级化学仁爱版下册
一、单选题
1.下列金属不能跟稀盐酸反应产生氢气的是( )
A.银 B.锡 C.铝 D.镁
2.下列与金属材料有关的说法中,正确的是( )
A.黄铜片比铜片硬度小
B.钢的性能优良,是很纯的铁
C.沙漠地区的铁制品锈蚀较快
D.为防止钢铁制品生锈,可在其表面刷漆
3.黄铜是铜与锌的合金。下列关于黄铜的说法正确的是( )
A.比纯铜耐腐蚀
B.加热不与空气反应
C.硬度小于纯铜
D.可以完全溶解在稀盐酸中
4.用镍钛合金制成的宇宙飞船自展天线,在低温下被折叠,进入太空后,在阳光照射下可重新展开,恢复成原状。关于此天线制作材料的描述错误的是
A.具有形状记忆功能 B.具有良好的导电性
C.具有良好的延展性 D.具有很低的熔点
5.下列事实能说明铝的金属活动性比铁或铜强的是
A.铝在地壳中含量比铁高 B.铝的熔点低于铜的熔点
C.空气中铁比铝更容易被腐蚀 D.铝丝在硫酸铜溶液中能形成“铜树”
6.下列关于催化剂的说法正确的是
A.化学反应前后催化剂的质量不变 B.化学反应前后催化剂的性质不变
C.催化剂只能加快化学反应速率 D.没有催化剂化学反应不能发生
7.关于金属的说法,不正确的是
A.铁在潮湿的空气中易生锈
B.黄铜合金的硬度比纯铜的硬度大
C.锡制成锡箔是利用锡的延展性
D.铝易氧化,因此抗腐蚀性能较差
8.光亮的铁钉在下列几种情况下,最不容易生锈的是
A. B. C. D.
9.一定质量的锌、铁分别和等量的盐酸反应,产生氢气质量与时间的关系如图所示,下列说法不正确的是
A.t1时,产生氢气的质量锌比铁大
B.t1时,产生氢气的速率锌比铁大
C.t2时,参加反应锌的质量与铁相同
D.t2时,锌、铁消耗的盐酸质量相同
二、简答题
10.小美在蛋糕包装中发现了一包脱氧保鲜剂,打开后发现其中的铁粉已经变为红棕色,铁粉变色的原因是_____。
11.下列物质能否发生反应?写出能发生反应的化学方程式。
(1)银与稀盐酸
(2)锌与硫酸铜溶液
(3)铜与硫酸锌溶液
(4)铝与硝酸银溶液
12.金属在生产生活中有广泛应用。
(1)“共享单车”作为代步工具,既轻便灵活,又环保。
如图是一款自行车的图片,所标材料中,车架主要含有的金属元素是_____,为防止车架生锈,可以采取的防锈措施是_____,铝合金与纯铝相比,其硬度更_____(填“大”或“小”)。
(2)赤铁矿(主要成分Fe2O3)是炼铁的一种矿石,Fe2O3属于_____(填“单质”或“氧化物”),我国是使用“水法冶铜”最早的国家,请写出铁和硫酸铜溶液反应的化学方程式_____。
(3)为了验证Fe、Cu、Ag三种金属的活动性顺序,下列选用的药品可行的是_____。(填序号)
①Fe、CuSO4溶液、Ag ②FeSO4溶液、Cu、Ag
③FeSO4溶液、Cu、AgNO3溶液 ④FeSO4溶液、CuSO4溶液、Ag
三、推断题
13.已知A、B、C、D四种物质之间存在以下转化关系。其中C是密度最小的气体,D是相对分子质量最小的氧化物。试回答:
(1)写出A、C、D三种物质的化学式:A_______、C________、D________。浅绿色溶液B中溶质的化学式____________。
(2)写出C→D的化学方程式___________。
14.已知A、B、C、D、E五种物质均为初中化学中常见的物质,它们相互转化的关系如图所示。A、B均为黑色固体,C是造成温室效应的主要气体,D是一种紫红色固体。回答下列问题:
(1)E的化学式是_______。
(2)写出反应②的化学方程式_______。
(3)反应①中作还原剂的是_______(填化学式)。
(4)写出物质A的一条用途_______。
15.物质组成和变化分析,图中的物质都是初中化学常见的纯净物。
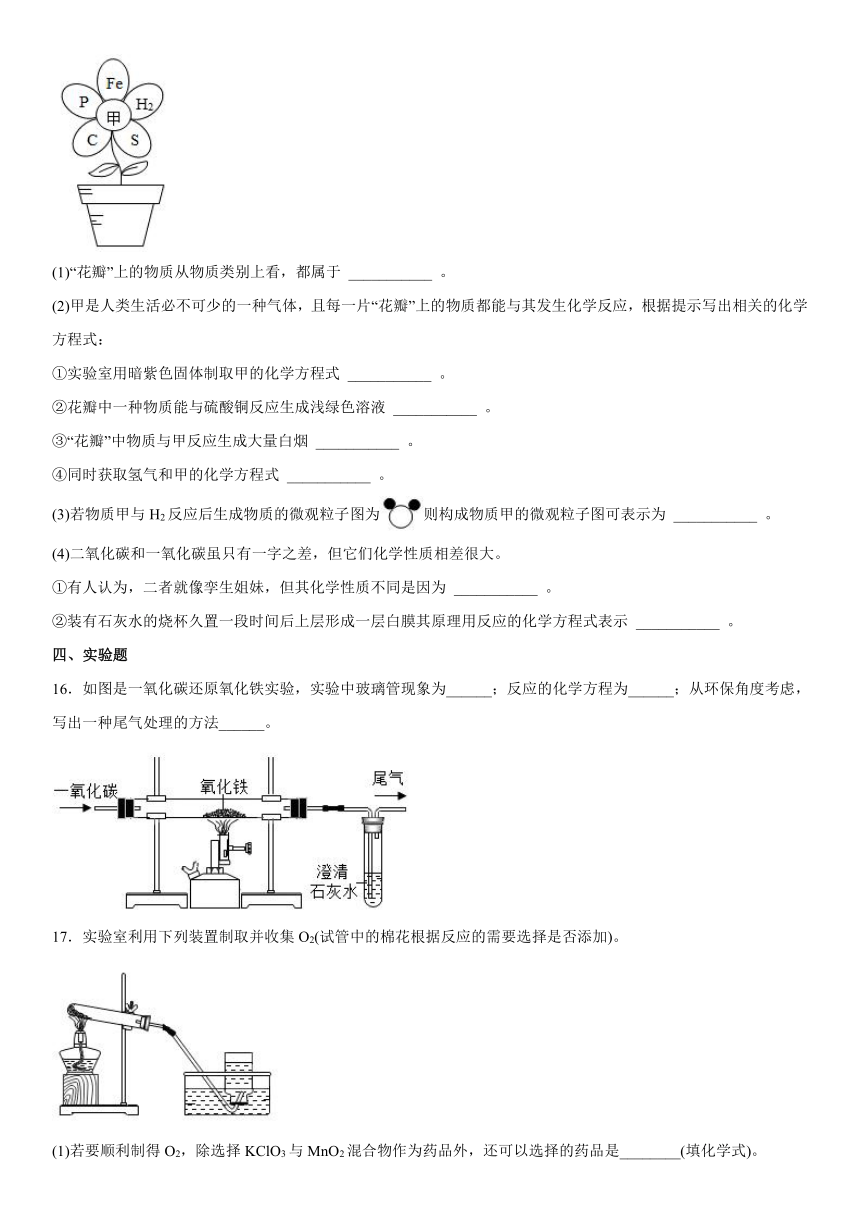
(1)“花瓣”上的物质从物质类别上看,都属于 ___________ 。
(2)甲是人类生活必不可少的一种气体,且每一片“花瓣”上的物质都能与其发生化学反应,根据提示写出相关的化学方程式:
①实验室用暗紫色固体制取甲的化学方程式 ___________ 。
②花瓣中一种物质能与硫酸铜反应生成浅绿色溶液 ___________ 。
③“花瓣”中物质与甲反应生成大量白烟 ___________ 。
④同时获取氢气和甲的化学方程式 ___________ 。
(3)若物质甲与H2反应后生成物质的微观粒子图为则构成物质甲的微观粒子图可表示为 ___________ 。
(4)二氧化碳和一氧化碳虽只有一字之差,但它们化学性质相差很大。
①有人认为,二者就像孪生姐妹,但其化学性质不同是因为 ___________ 。
②装有石灰水的烧杯久置一段时间后上层形成一层白膜其原理用反应的化学方程式表示 ___________ 。
四、实验题
16.如图是一氧化碳还原氧化铁实验,实验中玻璃管现象为______;反应的化学方程为______;从环保角度考虑,写出一种尾气处理的方法______。
17.实验室利用下列装置制取并收集O2(试管中的棉花根据反应的需要选择是否添加)。
(1)若要顺利制得O2,除选择KClO3与MnO2混合物作为药品外,还可以选择的药品是________(填化学式)。
(2)如果选择KClO3与MnO2混合物作为制备O2的药品,则反应后MnO2的质量将______(填“增加” “减小”或“不变”)。
(3)简述检查该装置气密性的方法_____________________________________。
18.金属在日常生活、工农业生产和科学研究方面应用广泛。
(1)铜可用来制作导线,是因为其具有良好的延展性和________。
(2)在空气中,铝表面易生成一层致密的氧化膜,氧化膜的主要成分是________。
(3)某实验小组为了探究影响金属与酸反应快慢的因素,进行以下实验:
实验序号 实验过程 实验现象
a 锌粉和铁粉分别与5%的盐酸反应 锌粉产生气体快
b 铁粉和铁片分别与15%的盐酸反应 铁粉产生气体快
c 铁片分别与5%的盐酸和15%的盐酸反应 15%的盐酸产生气体快
由此得出影响金属与酸反应快慢的因素有:
a.__________________________________;
b.______________________________________;
c.________________________________________。
(4)小明将一小包铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到滤渣和滤液。(提示:金属活动性顺序:锌>铜>银)
①锌和硝酸银溶液反应的化学方程式是______________________________________。
②若滤液为蓝色,则滤液中一定含有的金属离子是______________(写离子符号)。
五、计算题
19.工业上用赤铁矿石(主要成分是)冶炼生铁的化学方程式为()。现有800t含氧化铁80%的赤铁矿石。求:
(1)800t矿石中氧化铁的质量。
(2)该矿石能冶炼出含杂质4%的生铁的质量。(计算结果精确到0.1)
20.铁是一种应用广泛的金属。现用含氧化铁60%的赤铁矿100t冶炼成铁,理论上可得到铁的质量是多少?(反应方程为: )。
21.将一定质量的金属锌投入到63.7g稀硫酸中,恰好完全反应,放出气体的质量与反应时间的关系如图所示。试求:
(1)完全反应后生成氢气的质量为 g。
(2)参加反应的锌的质量是多少?
22.高温下一氧化碳与氧化铁反应最终生成铁和二氧化碳。根据化学方程式计算,16g氧化铁完全反应最多生成铁的质量为______________________。
试卷第1页,共3页
参考答案:
1.A
2.D
3.A
4.D
5.D
6.A
7.D
8.B
9.C
10.铁粉和空气中氧气、水共同作用生成铁锈变为红棕色
11.(1)银活动性弱于氢,不能和稀盐酸反应
(2)
(3)活动性锌大于铜,铜与硫酸锌溶液不反应
(4)
12. 铁 刷漆 大 氧化物 Fe+CuSO4═Cu+FeSO4 ①③
13.(1) Fe H2 H2O FeSO4
(2)
14. O2 C 冶炼金属(合理即可)
15. 单质 分子构成不同
16. 红色固体变黑色 点燃
17. KMnO4 不变 先把导管的一端放入水中,然后两手紧握试管的外壁,观察导管口是否有气泡冒出
18. 导电性 氧化铝(或Al2O3) a.金属活动性(金属活动性越强,反应速率越快) b.金属与酸的接触面积(接触面积越大,反应速率越快) c.酸的浓度(酸的浓度越大,反应速率越快) Zn+2AgNO3===Zn(NO3)2+2Ag Zn2+、Cu2+
19.(1)800t×80%=640t
(2)解:设生成的铁的质量为x.
生铁的质量=≈466.7 t
答:该矿石能冶炼出含杂质4%的生铁的质量为466.7 t.
20.解:设得到铁的质量为x
答:得铁的质量为 42t。
21.(1)0.2
(2)解:设参加反应的锌的质量为x
=
x=6.5g
答:参加反应的锌的质量是6.5g。
22.11.2g
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列金属不能跟稀盐酸反应产生氢气的是( )
A.银 B.锡 C.铝 D.镁
2.下列与金属材料有关的说法中,正确的是( )
A.黄铜片比铜片硬度小
B.钢的性能优良,是很纯的铁
C.沙漠地区的铁制品锈蚀较快
D.为防止钢铁制品生锈,可在其表面刷漆
3.黄铜是铜与锌的合金。下列关于黄铜的说法正确的是( )
A.比纯铜耐腐蚀
B.加热不与空气反应
C.硬度小于纯铜
D.可以完全溶解在稀盐酸中
4.用镍钛合金制成的宇宙飞船自展天线,在低温下被折叠,进入太空后,在阳光照射下可重新展开,恢复成原状。关于此天线制作材料的描述错误的是
A.具有形状记忆功能 B.具有良好的导电性
C.具有良好的延展性 D.具有很低的熔点
5.下列事实能说明铝的金属活动性比铁或铜强的是
A.铝在地壳中含量比铁高 B.铝的熔点低于铜的熔点
C.空气中铁比铝更容易被腐蚀 D.铝丝在硫酸铜溶液中能形成“铜树”
6.下列关于催化剂的说法正确的是
A.化学反应前后催化剂的质量不变 B.化学反应前后催化剂的性质不变
C.催化剂只能加快化学反应速率 D.没有催化剂化学反应不能发生
7.关于金属的说法,不正确的是
A.铁在潮湿的空气中易生锈
B.黄铜合金的硬度比纯铜的硬度大
C.锡制成锡箔是利用锡的延展性
D.铝易氧化,因此抗腐蚀性能较差
8.光亮的铁钉在下列几种情况下,最不容易生锈的是
A. B. C. D.
9.一定质量的锌、铁分别和等量的盐酸反应,产生氢气质量与时间的关系如图所示,下列说法不正确的是
A.t1时,产生氢气的质量锌比铁大
B.t1时,产生氢气的速率锌比铁大
C.t2时,参加反应锌的质量与铁相同
D.t2时,锌、铁消耗的盐酸质量相同
二、简答题
10.小美在蛋糕包装中发现了一包脱氧保鲜剂,打开后发现其中的铁粉已经变为红棕色,铁粉变色的原因是_____。
11.下列物质能否发生反应?写出能发生反应的化学方程式。
(1)银与稀盐酸
(2)锌与硫酸铜溶液
(3)铜与硫酸锌溶液
(4)铝与硝酸银溶液
12.金属在生产生活中有广泛应用。
(1)“共享单车”作为代步工具,既轻便灵活,又环保。
如图是一款自行车的图片,所标材料中,车架主要含有的金属元素是_____,为防止车架生锈,可以采取的防锈措施是_____,铝合金与纯铝相比,其硬度更_____(填“大”或“小”)。
(2)赤铁矿(主要成分Fe2O3)是炼铁的一种矿石,Fe2O3属于_____(填“单质”或“氧化物”),我国是使用“水法冶铜”最早的国家,请写出铁和硫酸铜溶液反应的化学方程式_____。
(3)为了验证Fe、Cu、Ag三种金属的活动性顺序,下列选用的药品可行的是_____。(填序号)
①Fe、CuSO4溶液、Ag ②FeSO4溶液、Cu、Ag
③FeSO4溶液、Cu、AgNO3溶液 ④FeSO4溶液、CuSO4溶液、Ag
三、推断题
13.已知A、B、C、D四种物质之间存在以下转化关系。其中C是密度最小的气体,D是相对分子质量最小的氧化物。试回答:
(1)写出A、C、D三种物质的化学式:A_______、C________、D________。浅绿色溶液B中溶质的化学式____________。
(2)写出C→D的化学方程式___________。
14.已知A、B、C、D、E五种物质均为初中化学中常见的物质,它们相互转化的关系如图所示。A、B均为黑色固体,C是造成温室效应的主要气体,D是一种紫红色固体。回答下列问题:
(1)E的化学式是_______。
(2)写出反应②的化学方程式_______。
(3)反应①中作还原剂的是_______(填化学式)。
(4)写出物质A的一条用途_______。
15.物质组成和变化分析,图中的物质都是初中化学常见的纯净物。
(1)“花瓣”上的物质从物质类别上看,都属于 ___________ 。
(2)甲是人类生活必不可少的一种气体,且每一片“花瓣”上的物质都能与其发生化学反应,根据提示写出相关的化学方程式:
①实验室用暗紫色固体制取甲的化学方程式 ___________ 。
②花瓣中一种物质能与硫酸铜反应生成浅绿色溶液 ___________ 。
③“花瓣”中物质与甲反应生成大量白烟 ___________ 。
④同时获取氢气和甲的化学方程式 ___________ 。
(3)若物质甲与H2反应后生成物质的微观粒子图为则构成物质甲的微观粒子图可表示为 ___________ 。
(4)二氧化碳和一氧化碳虽只有一字之差,但它们化学性质相差很大。
①有人认为,二者就像孪生姐妹,但其化学性质不同是因为 ___________ 。
②装有石灰水的烧杯久置一段时间后上层形成一层白膜其原理用反应的化学方程式表示 ___________ 。
四、实验题
16.如图是一氧化碳还原氧化铁实验,实验中玻璃管现象为______;反应的化学方程为______;从环保角度考虑,写出一种尾气处理的方法______。
17.实验室利用下列装置制取并收集O2(试管中的棉花根据反应的需要选择是否添加)。
(1)若要顺利制得O2,除选择KClO3与MnO2混合物作为药品外,还可以选择的药品是________(填化学式)。
(2)如果选择KClO3与MnO2混合物作为制备O2的药品,则反应后MnO2的质量将______(填“增加” “减小”或“不变”)。
(3)简述检查该装置气密性的方法_____________________________________。
18.金属在日常生活、工农业生产和科学研究方面应用广泛。
(1)铜可用来制作导线,是因为其具有良好的延展性和________。
(2)在空气中,铝表面易生成一层致密的氧化膜,氧化膜的主要成分是________。
(3)某实验小组为了探究影响金属与酸反应快慢的因素,进行以下实验:
实验序号 实验过程 实验现象
a 锌粉和铁粉分别与5%的盐酸反应 锌粉产生气体快
b 铁粉和铁片分别与15%的盐酸反应 铁粉产生气体快
c 铁片分别与5%的盐酸和15%的盐酸反应 15%的盐酸产生气体快
由此得出影响金属与酸反应快慢的因素有:
a.__________________________________;
b.______________________________________;
c.________________________________________。
(4)小明将一小包铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到滤渣和滤液。(提示:金属活动性顺序:锌>铜>银)
①锌和硝酸银溶液反应的化学方程式是______________________________________。
②若滤液为蓝色,则滤液中一定含有的金属离子是______________(写离子符号)。
五、计算题
19.工业上用赤铁矿石(主要成分是)冶炼生铁的化学方程式为()。现有800t含氧化铁80%的赤铁矿石。求:
(1)800t矿石中氧化铁的质量。
(2)该矿石能冶炼出含杂质4%的生铁的质量。(计算结果精确到0.1)
20.铁是一种应用广泛的金属。现用含氧化铁60%的赤铁矿100t冶炼成铁,理论上可得到铁的质量是多少?(反应方程为: )。
21.将一定质量的金属锌投入到63.7g稀硫酸中,恰好完全反应,放出气体的质量与反应时间的关系如图所示。试求:
(1)完全反应后生成氢气的质量为 g。
(2)参加反应的锌的质量是多少?
22.高温下一氧化碳与氧化铁反应最终生成铁和二氧化碳。根据化学方程式计算,16g氧化铁完全反应最多生成铁的质量为______________________。
试卷第1页,共3页
参考答案:
1.A
2.D
3.A
4.D
5.D
6.A
7.D
8.B
9.C
10.铁粉和空气中氧气、水共同作用生成铁锈变为红棕色
11.(1)银活动性弱于氢,不能和稀盐酸反应
(2)
(3)活动性锌大于铜,铜与硫酸锌溶液不反应
(4)
12. 铁 刷漆 大 氧化物 Fe+CuSO4═Cu+FeSO4 ①③
13.(1) Fe H2 H2O FeSO4
(2)
14. O2 C 冶炼金属(合理即可)
15. 单质 分子构成不同
16. 红色固体变黑色 点燃
17. KMnO4 不变 先把导管的一端放入水中,然后两手紧握试管的外壁,观察导管口是否有气泡冒出
18. 导电性 氧化铝(或Al2O3) a.金属活动性(金属活动性越强,反应速率越快) b.金属与酸的接触面积(接触面积越大,反应速率越快) c.酸的浓度(酸的浓度越大,反应速率越快) Zn+2AgNO3===Zn(NO3)2+2Ag Zn2+、Cu2+
19.(1)800t×80%=640t
(2)解:设生成的铁的质量为x.
生铁的质量=≈466.7 t
答:该矿石能冶炼出含杂质4%的生铁的质量为466.7 t.
20.解:设得到铁的质量为x
答:得铁的质量为 42t。
21.(1)0.2
(2)解:设参加反应的锌的质量为x
=
x=6.5g
答:参加反应的锌的质量是6.5g。
22.11.2g
答案第1页,共2页
答案第1页,共2页
