【人教版】化学九年级全一册 8.3.1 铁的冶炼 习题课件
文档属性
| 名称 | 【人教版】化学九年级全一册 8.3.1 铁的冶炼 习题课件 |  | |
| 格式 | pptx | ||
| 文件大小 | 669.3KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-11 14:57:26 | ||
图片预览









文档简介
(共35张PPT)
课题3 金属资源的利用和保护
第1课时 铁的冶炼
第八单元 金属与金属材料
目录
学习目标
课堂导学
例题导学
课堂检测
化学用语天天练
写出下列反应的化学方程式:
铝和硫酸铜溶液反应____________________________
铜和硝酸银溶液反应____________________________
铁和硫酸铜溶液反应____________________________
锌和硝酸铜溶液反应____________________________
2Al+3CuSO4 === Al2(SO4)3+3Cu
Cu+2AgNO3 === Cu(NO3)2+2Ag
Fe+CuSO4 === FeSO4+Cu
Zn+Cu(NO3)2 === Cu+Zn(NO3)2
课程标准:1. 知道一些常见金属(铁、铝等)矿物;2. 知道可用铁矿石炼铁,了解从铁矿石中将铁还原出来的方法;3. 会根据化学方程式对含有某些杂质的反应物或生成物进行有关计算。
核心考点:冶炼铁的原理和方法;含杂质的化学方程式的计算。
学习目标
课堂导学
金属资源在自然界的存在形式及常见金属矿石
金、银
【自主学习】阅读课本P14~15,填写下列空格。
1. 地球上的金属资源除少数很不活泼的金属如______等有 形式存在外,其余都以 的形式存在。在地壳中的含量居前三位的金属元素是
。
单质
化合物
铝、铁、钙(或Al、Fe、Ca)
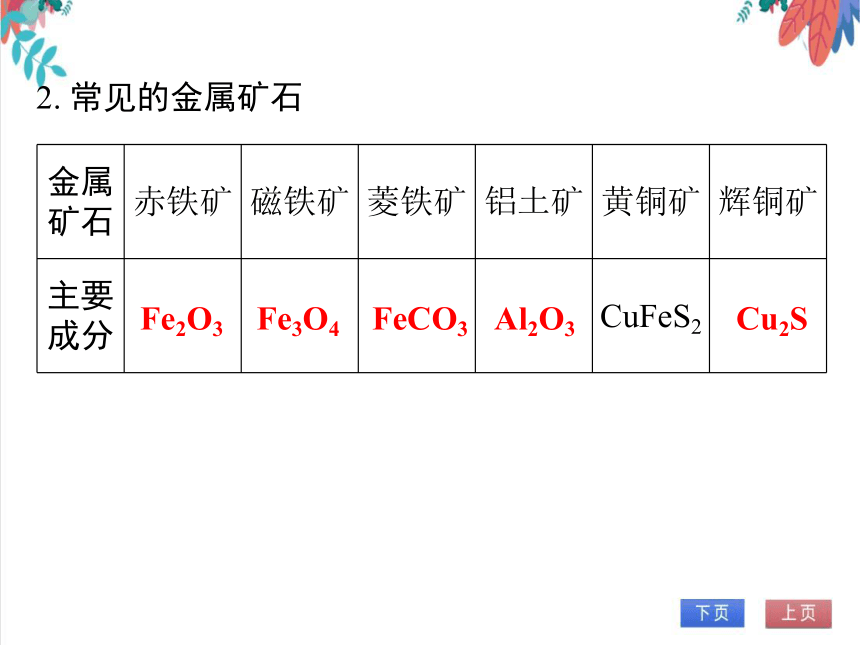
2. 常见的金属矿石
金属矿石 赤铁矿 磁铁矿 菱铁矿 铝土矿 黄铜矿 辉铜矿
主要成分 CuFeS2
Fe2O3
Fe3O4
FeCO3
Al2O3
Cu2S
铁的冶炼
【课堂活动】阅读课本P16,了解一氧化碳还原氧化铁的实验和工业炼铁。
1. 炼铁的原理:利用 与 的反应,将铁从 中还原出来。
一氧化碳
氧化铁
氧化铁
2. 实验室利用一氧化碳还原氧化铁的实验
实验步骤 ①检查装置的________________
②将氧化铁放入硬质玻璃管内并固定
③先点燃装置末端的酒精灯,再通入_________
(目的是__________________________________
______________________________________)
④待装置内空气排尽后点燃酒精喷灯
⑤当玻璃管内 粉末完全变成 色时,熄灭酒精喷灯
气密性
一氧化碳
排尽装置内的空气,防止CO与空气混合加热,发生爆炸
红棕色
黑
实验步骤 ⑥待玻璃管内固体冷却后,停止通入一氧化碳(目的是 )
⑦最后熄灭装置末端的酒精灯
实验装置
防止铁粉在高温条件下重新被氧化
实验现象 ①玻璃管内粉末由 色逐渐变为 色
②试管内澄清石灰水_____________
③酒精灯处尾气燃烧产生 色火焰
化学方程式 ①_____________________________________
②_____________________________________
③_____________________________________
红棕
黑
变浑浊
蓝
CO2 +Ca(OH)2 ==== CaCO3↓+H2O
Fe2O3 + 3CO ==== 2Fe + 3CO2
高温
2CO+O2 ==== 2CO2
点燃
【注意】实验开始时,要先通入CO,后加热,尾部需用酒精灯燃烧或者收集尾气;实验结束时,停止加热,继续通入CO至冷却。CO具有还原性,作还原剂。
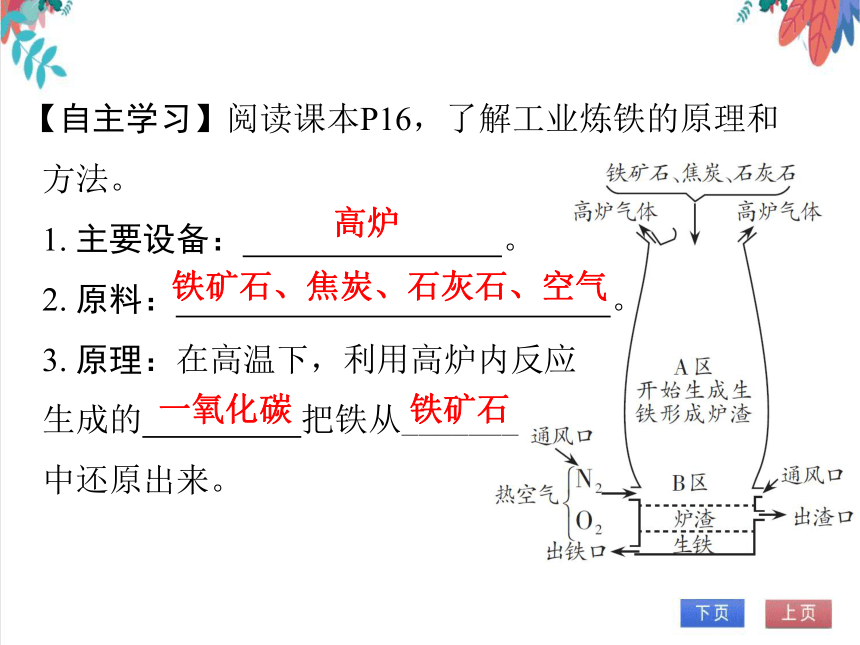
【自主学习】阅读课本P16,了解工业炼铁的原理和方法。
1. 主要设备: 。
2. 原料: 。
3. 原理:在高温下,利用高炉内反应
生成的 把铁从_______
中还原出来。
高炉
铁矿石、焦炭、石灰石、空气
一氧化碳
铁矿石
4. 高炉内发生的有关反应
(1)以赤铁矿为原料: 。
(2)以磁铁矿为原料: Fe3O4 + 4CO==== 3Fe + 4CO2
(3)焦炭的作用:①提供热量:C + O2 ==== CO2;②提供CO:CO2 + C==== 2CO
(4)石灰石的作用:将矿石中的二氧化硅转化为炉渣除去。
5. 产品: 。
高温
点燃
高温
Fe2O3 + 3CO====2Fe + 3CO2
高温
生铁
含杂质物质的化学反应的有关计算
【自主学习】阅读课本P17“例题”,了解含杂质的物质的计算。
1. 不纯物质、纯物质、物质纯度之间的关系
2. 计算的一般步骤
(1)将含杂质物质的质量换算成纯物质的质量。
(2)将纯净物的质量代入化学方程式进行计算。
(3)将计算得到的纯净物质量换算成含杂质物质的质量。
例题导学
【例1】下列有关金属资源的叙述错误的是( )
A. 金属资源广泛地存在于地壳和海洋中,地壳中铁元素含量最高
B. “沙里淘金”说明金在自然界中以单质形式存在
C. 地壳中金属资源大多数以化合物形式存在
D. 地球上金属矿物资源储量有限,不可再生
金属资源在自然界的存在形式及常见金属矿石
A
【点拨】根据地壳中各元素的含量大小来分析。
【变式1】“绿色化学”的理念正深入人心,工业生产更应关注。从效益与环保角度考虑,以下矿石中最不适宜炼铁的是( )
A. 赤铁矿(Fe2O3) B. 磁铁矿(Fe3O4)
C. 黄铁矿(FeS2) D. 菱铁矿(FeCO3)
C
【例2】 (2020·邵阳)如图是实验室模拟工业炼铁的实验装置图。下列说法不正确的是( )
A. B处玻璃管内发生的化学反应是
氧化还原反应,还原剂是CO
B. 在点燃酒精喷灯前,应先通入
CO气体排尽装置中的空气
C. 该实验可以观察到B处固体从黑色逐渐变成红色
D. 该模拟实验缺少尾气处理装置,会污染空气
铁的冶炼
C
【点拨】掌握一氧化碳的化学性质(可燃性、还原性等)、还原氧化铁的实验现象等并能灵活运用是正确解答本题的关键。
【变式2】我国炼铁始于春秋时代,随后炼铁规模和技术不断发展。近年来,我国钢铁工业持续快速发展,建成了门类齐全,独立完整的产业体系。联合钢铁工业的基本生产流程如图。
请回答下列问题:
(1)写出高炉中以赤铁矿(主要成分是 Fe2O3 )为原料炼铁的化学方程式 。
Fe2O3 + 3CO====2Fe + 3CO2
高温
(2)炼铁的固体原料需经过粉碎,其目的是___________
_______________________________;焦炭在炼铁过程中的主要作用是_________________________________。
(3)工业炼钢时,用纯氧的目是_____________________
___________,与纯铁相比,钢坯__________(填字母)。
a. 熔点变高 b. 硬度变大 c. 抗腐蚀性增强
增大反应物接触面积,使反应更快、更充分
提供热量,产生还原剂一氧化碳
与生铁中的碳反应,降低含碳量
bc
有关杂质问题的计算
【例3】 (教材母题:九下人教版)某钢铁厂每天需消耗5 000 t含 Fe2O376%的赤铁矿石,该厂理论上可日产含Fe 98%的生铁的质量是多少
解:由5 000 t含氧化铁76%的赤铁矿,则氧化铁的质量为5 000 t×76%=3 800 t,
设可炼得铁的质量为x。
则可得含铁98%的生铁的质量是
2 660 t÷98%≈2 714.3 t
答:该厂理论上可日产含Fe 98%的生铁的质量约是2 714.3 t。
【点拨】根据氧化铁的质量代入化学方程式来计算铁的质量,进而计算生铁的质量。
【变式3】(教材母题:九下人教版)冶炼2 000 t含杂质3%的生铁,需要含Fe3O490%的磁铁矿石的质量是多少
解:设需要含Fe3O490%的磁铁矿石的质量为x。
答:需要含Fe3O490%的磁铁矿石的质量为2976.7 t。
课堂检测
1. 在化学反应Fe2O3 + 3CO ==== 2Fe + 3CO2 中,下列说法正确的是( )
A. CO在反应中得到了氧,具有氧化性,是氧化剂
B. Fe2O3在反应中失去氧,具有还原性,是还原剂
C. CO发生了还原反应
D. Fe2O3发生了还原反应
高温
D
2. 如图是炼铁高炉示意图。下列说法错误的是( )
A. 焦炭的作用是提供热量、产生还原剂CO
B. 石灰石的作用是与铁矿石中的杂质反应形成炉渣
C. 出铁口位置低于出渣口的原因是
生铁密度大于炉渣
D. 产生的废气无需处理,因为它不
会污染空气
D
3. 如图是一氧化碳还原氧化铁的实验装置图。
(1)通入CO使B装置的液面下降到安全线之前,不能加热氧化铁,这是因为CO和空气混合,加热可能会发生 。
爆炸
(2)A装置(高温),发生反应的化学方程式为
;反应中, 发生了氧化反应。
Fe2O3 + 3CO====2Fe + 3CO2
高温
一氧化碳
(3)B装置,澄清石灰水变浑浊的有关化学方程式为
。
CO2 +Ca(OH)2 ==== CaCO3↓+H2O
(4)反应结束后停止加热,继续通CO;此时B装置的作用是回收CO,防止 。
扩散到空气中污染环境
4. 赤铁矿石的主要成分的化学式是Fe2O3,利用其炼铁的化学反应原理是在高温的条件下,三氧化二铁(Fe2O3)与一氧化碳反应生成铁和二氧化碳。现有150吨含三氧化二铁80 %的赤铁矿石,求:
(1)150吨赤铁矿石里含三氧化二铁的质量为 吨。
(2)利用化学方程式计算,这150吨赤铁矿石最多能炼出多少吨的纯铁?
120
解:设150吨赤铁矿石最多能炼出纯铁的质量为x。
答:炼出纯铁的质量为84 t。
谢谢!
课题3 金属资源的利用和保护
第1课时 铁的冶炼
第八单元 金属与金属材料
目录
学习目标
课堂导学
例题导学
课堂检测
化学用语天天练
写出下列反应的化学方程式:
铝和硫酸铜溶液反应____________________________
铜和硝酸银溶液反应____________________________
铁和硫酸铜溶液反应____________________________
锌和硝酸铜溶液反应____________________________
2Al+3CuSO4 === Al2(SO4)3+3Cu
Cu+2AgNO3 === Cu(NO3)2+2Ag
Fe+CuSO4 === FeSO4+Cu
Zn+Cu(NO3)2 === Cu+Zn(NO3)2
课程标准:1. 知道一些常见金属(铁、铝等)矿物;2. 知道可用铁矿石炼铁,了解从铁矿石中将铁还原出来的方法;3. 会根据化学方程式对含有某些杂质的反应物或生成物进行有关计算。
核心考点:冶炼铁的原理和方法;含杂质的化学方程式的计算。
学习目标
课堂导学
金属资源在自然界的存在形式及常见金属矿石
金、银
【自主学习】阅读课本P14~15,填写下列空格。
1. 地球上的金属资源除少数很不活泼的金属如______等有 形式存在外,其余都以 的形式存在。在地壳中的含量居前三位的金属元素是
。
单质
化合物
铝、铁、钙(或Al、Fe、Ca)
2. 常见的金属矿石
金属矿石 赤铁矿 磁铁矿 菱铁矿 铝土矿 黄铜矿 辉铜矿
主要成分 CuFeS2
Fe2O3
Fe3O4
FeCO3
Al2O3
Cu2S
铁的冶炼
【课堂活动】阅读课本P16,了解一氧化碳还原氧化铁的实验和工业炼铁。
1. 炼铁的原理:利用 与 的反应,将铁从 中还原出来。
一氧化碳
氧化铁
氧化铁
2. 实验室利用一氧化碳还原氧化铁的实验
实验步骤 ①检查装置的________________
②将氧化铁放入硬质玻璃管内并固定
③先点燃装置末端的酒精灯,再通入_________
(目的是__________________________________
______________________________________)
④待装置内空气排尽后点燃酒精喷灯
⑤当玻璃管内 粉末完全变成 色时,熄灭酒精喷灯
气密性
一氧化碳
排尽装置内的空气,防止CO与空气混合加热,发生爆炸
红棕色
黑
实验步骤 ⑥待玻璃管内固体冷却后,停止通入一氧化碳(目的是 )
⑦最后熄灭装置末端的酒精灯
实验装置
防止铁粉在高温条件下重新被氧化
实验现象 ①玻璃管内粉末由 色逐渐变为 色
②试管内澄清石灰水_____________
③酒精灯处尾气燃烧产生 色火焰
化学方程式 ①_____________________________________
②_____________________________________
③_____________________________________
红棕
黑
变浑浊
蓝
CO2 +Ca(OH)2 ==== CaCO3↓+H2O
Fe2O3 + 3CO ==== 2Fe + 3CO2
高温
2CO+O2 ==== 2CO2
点燃
【注意】实验开始时,要先通入CO,后加热,尾部需用酒精灯燃烧或者收集尾气;实验结束时,停止加热,继续通入CO至冷却。CO具有还原性,作还原剂。
【自主学习】阅读课本P16,了解工业炼铁的原理和方法。
1. 主要设备: 。
2. 原料: 。
3. 原理:在高温下,利用高炉内反应
生成的 把铁从_______
中还原出来。
高炉
铁矿石、焦炭、石灰石、空气
一氧化碳
铁矿石
4. 高炉内发生的有关反应
(1)以赤铁矿为原料: 。
(2)以磁铁矿为原料: Fe3O4 + 4CO==== 3Fe + 4CO2
(3)焦炭的作用:①提供热量:C + O2 ==== CO2;②提供CO:CO2 + C==== 2CO
(4)石灰石的作用:将矿石中的二氧化硅转化为炉渣除去。
5. 产品: 。
高温
点燃
高温
Fe2O3 + 3CO====2Fe + 3CO2
高温
生铁
含杂质物质的化学反应的有关计算
【自主学习】阅读课本P17“例题”,了解含杂质的物质的计算。
1. 不纯物质、纯物质、物质纯度之间的关系
2. 计算的一般步骤
(1)将含杂质物质的质量换算成纯物质的质量。
(2)将纯净物的质量代入化学方程式进行计算。
(3)将计算得到的纯净物质量换算成含杂质物质的质量。
例题导学
【例1】下列有关金属资源的叙述错误的是( )
A. 金属资源广泛地存在于地壳和海洋中,地壳中铁元素含量最高
B. “沙里淘金”说明金在自然界中以单质形式存在
C. 地壳中金属资源大多数以化合物形式存在
D. 地球上金属矿物资源储量有限,不可再生
金属资源在自然界的存在形式及常见金属矿石
A
【点拨】根据地壳中各元素的含量大小来分析。
【变式1】“绿色化学”的理念正深入人心,工业生产更应关注。从效益与环保角度考虑,以下矿石中最不适宜炼铁的是( )
A. 赤铁矿(Fe2O3) B. 磁铁矿(Fe3O4)
C. 黄铁矿(FeS2) D. 菱铁矿(FeCO3)
C
【例2】 (2020·邵阳)如图是实验室模拟工业炼铁的实验装置图。下列说法不正确的是( )
A. B处玻璃管内发生的化学反应是
氧化还原反应,还原剂是CO
B. 在点燃酒精喷灯前,应先通入
CO气体排尽装置中的空气
C. 该实验可以观察到B处固体从黑色逐渐变成红色
D. 该模拟实验缺少尾气处理装置,会污染空气
铁的冶炼
C
【点拨】掌握一氧化碳的化学性质(可燃性、还原性等)、还原氧化铁的实验现象等并能灵活运用是正确解答本题的关键。
【变式2】我国炼铁始于春秋时代,随后炼铁规模和技术不断发展。近年来,我国钢铁工业持续快速发展,建成了门类齐全,独立完整的产业体系。联合钢铁工业的基本生产流程如图。
请回答下列问题:
(1)写出高炉中以赤铁矿(主要成分是 Fe2O3 )为原料炼铁的化学方程式 。
Fe2O3 + 3CO====2Fe + 3CO2
高温
(2)炼铁的固体原料需经过粉碎,其目的是___________
_______________________________;焦炭在炼铁过程中的主要作用是_________________________________。
(3)工业炼钢时,用纯氧的目是_____________________
___________,与纯铁相比,钢坯__________(填字母)。
a. 熔点变高 b. 硬度变大 c. 抗腐蚀性增强
增大反应物接触面积,使反应更快、更充分
提供热量,产生还原剂一氧化碳
与生铁中的碳反应,降低含碳量
bc
有关杂质问题的计算
【例3】 (教材母题:九下人教版)某钢铁厂每天需消耗5 000 t含 Fe2O376%的赤铁矿石,该厂理论上可日产含Fe 98%的生铁的质量是多少
解:由5 000 t含氧化铁76%的赤铁矿,则氧化铁的质量为5 000 t×76%=3 800 t,
设可炼得铁的质量为x。
则可得含铁98%的生铁的质量是
2 660 t÷98%≈2 714.3 t
答:该厂理论上可日产含Fe 98%的生铁的质量约是2 714.3 t。
【点拨】根据氧化铁的质量代入化学方程式来计算铁的质量,进而计算生铁的质量。
【变式3】(教材母题:九下人教版)冶炼2 000 t含杂质3%的生铁,需要含Fe3O490%的磁铁矿石的质量是多少
解:设需要含Fe3O490%的磁铁矿石的质量为x。
答:需要含Fe3O490%的磁铁矿石的质量为2976.7 t。
课堂检测
1. 在化学反应Fe2O3 + 3CO ==== 2Fe + 3CO2 中,下列说法正确的是( )
A. CO在反应中得到了氧,具有氧化性,是氧化剂
B. Fe2O3在反应中失去氧,具有还原性,是还原剂
C. CO发生了还原反应
D. Fe2O3发生了还原反应
高温
D
2. 如图是炼铁高炉示意图。下列说法错误的是( )
A. 焦炭的作用是提供热量、产生还原剂CO
B. 石灰石的作用是与铁矿石中的杂质反应形成炉渣
C. 出铁口位置低于出渣口的原因是
生铁密度大于炉渣
D. 产生的废气无需处理,因为它不
会污染空气
D
3. 如图是一氧化碳还原氧化铁的实验装置图。
(1)通入CO使B装置的液面下降到安全线之前,不能加热氧化铁,这是因为CO和空气混合,加热可能会发生 。
爆炸
(2)A装置(高温),发生反应的化学方程式为
;反应中, 发生了氧化反应。
Fe2O3 + 3CO====2Fe + 3CO2
高温
一氧化碳
(3)B装置,澄清石灰水变浑浊的有关化学方程式为
。
CO2 +Ca(OH)2 ==== CaCO3↓+H2O
(4)反应结束后停止加热,继续通CO;此时B装置的作用是回收CO,防止 。
扩散到空气中污染环境
4. 赤铁矿石的主要成分的化学式是Fe2O3,利用其炼铁的化学反应原理是在高温的条件下,三氧化二铁(Fe2O3)与一氧化碳反应生成铁和二氧化碳。现有150吨含三氧化二铁80 %的赤铁矿石,求:
(1)150吨赤铁矿石里含三氧化二铁的质量为 吨。
(2)利用化学方程式计算,这150吨赤铁矿石最多能炼出多少吨的纯铁?
120
解:设150吨赤铁矿石最多能炼出纯铁的质量为x。
答:炼出纯铁的质量为84 t。
谢谢!
同课章节目录
