【人教版】化学九年级全一册 11.1.3 盐的化学性质 习题课件
文档属性
| 名称 | 【人教版】化学九年级全一册 11.1.3 盐的化学性质 习题课件 |

|
|
| 格式 | pptx | ||
| 文件大小 | 292.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-11 14:57:36 | ||
图片预览





文档简介
(共23张PPT)
课题1 生活中常见的盐
第3课时 盐的化学性质
第十一单元 盐 化肥
目录
学习目标
课堂导学
例题导学
课堂检测
化学用语天天练
请写出下列反应的化学方程式:
硫酸铜与氢氧化钠的反应
______________________________________________
硫酸铜与氯化钡的反应
______________________________________________
2NaOH+CuSO4 === Cu(OH)2↓+Na2SO4
CuSO4+BaCl2 === CuCl2+BaSO4↓
课程标准:1. 掌握盐的化学性质和化学方程式的书写规律;2. 掌握酸、碱、盐之间的反应。
核心考点:盐的化学性质。
学习目标
1. 盐的化学性质
课堂导学
盐的化学性质
盐的化学性质 化学方程式 实验现象
盐(溶液)与金属反应生成_____和_____ CuSO4 + Fe _________________ 铁表面有 ,溶液由 色变 色
Cu + AgNO3 _______________ 铜片表面有 ,溶液由 色变 色
新盐
新金属
===Cu+FeSO4
红色固体析出
蓝
浅绿
2
2Ag+Cu(NO3)2
银白色固体析出
无
蓝
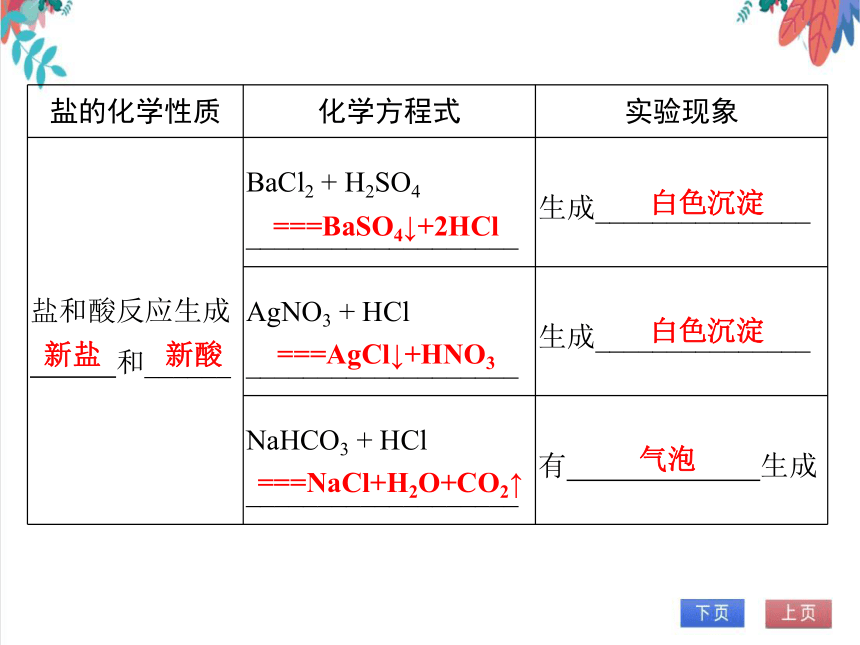
盐的化学性质 化学方程式 实验现象
盐和酸反应生成 和______ BaCl2 + H2SO4 ___________________ 生成_______________
AgNO3 + HCl ___________________ 生成_______________
NaHCO3 + HCl ___________________ 有 生成
新盐
新酸
===BaSO4↓+2HCl
白色沉淀
===AgCl↓+HNO3
白色沉淀
===NaCl+H2O+CO2↑
气泡
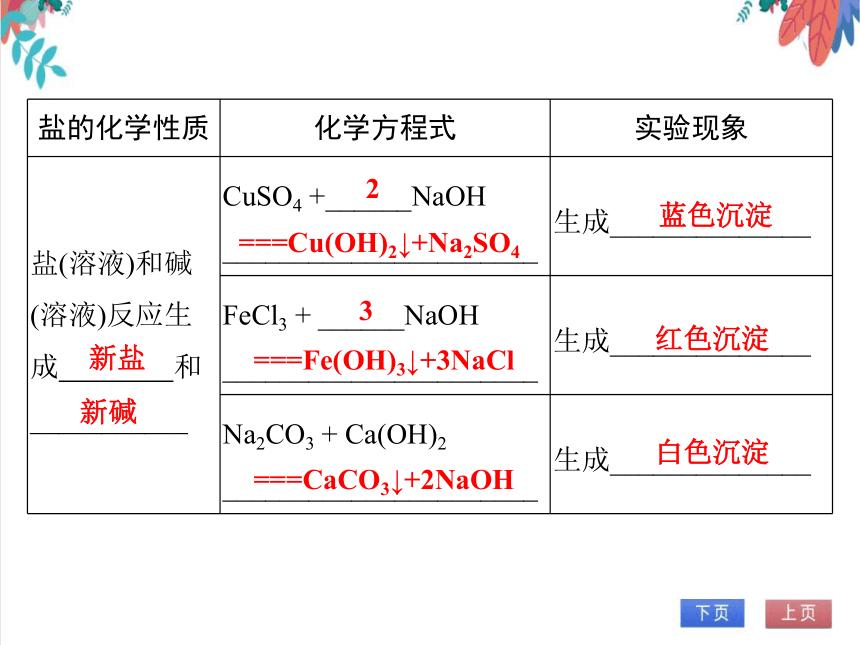
盐的化学性质 化学方程式 实验现象
盐(溶液)和碱(溶液)反应生成 和___________ CuSO4 +______NaOH ______________________ 生成______________
FeCl3 + ______NaOH ______________________ 生成______________
Na2CO3 + Ca(OH)2 ______________________ 生成______________
新盐
新碱
2
===Cu(OH)2↓+Na2SO4
蓝色沉淀
3
===Fe(OH)3↓+3NaCl
红色沉淀
===CaCO3↓+2NaOH
白色沉淀
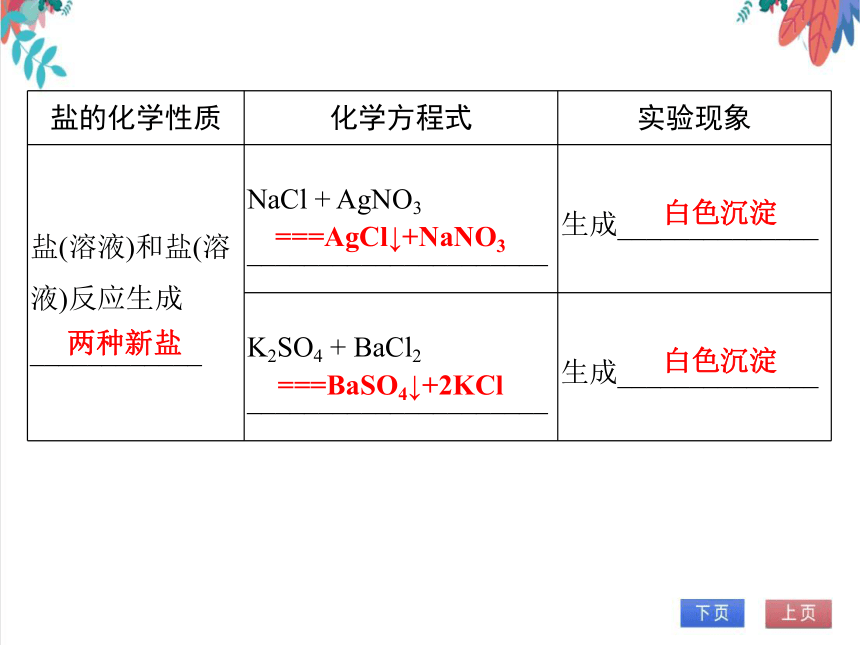
盐的化学性质 化学方程式 实验现象
盐(溶液)和盐(溶液)反应生成____________ NaCl + AgNO3 _____________________ 生成______________
K2SO4 + BaCl2 _____________________ 生成______________
两种新盐
===AgCl↓+NaNO3
白色沉淀
===BaSO4↓+2KCl
白色沉淀
2. SO42-和Cl-的检验
(1)SO42-的检验方法:先取少量待测液于试管中,加入 ,若无明显现象,再加入 溶液,生成 ,证明原溶液中含有SO42-。
(2)Cl-的检验方法:先取少量待测液于试管中,加入
,若无明显现象,再加入 溶液,生成白色沉淀,证明原溶液中含有Cl-。
稀盐酸
硝酸钡
白色沉淀
稀硝酸
硝酸银
3. 除杂:所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变。除杂质题至少要满足两个条件:①加入的试剂只能与 反应,不能与原物质反应;②反应后不能引入 。
杂质
新的杂质
例题导学
盐的化学性质
【例题】下列物质能跟镁、氯化钡溶液、氢氧化钠溶液都发生反应的是( )
A. K2CO3溶液 B. CuSO4溶液
C. Ca(OH)2溶液 D. HNO3溶液
B
【点拨】抓住物质间的反应及置换反应和复分解反应的条件。置换反应:金属和酸反应(条件:金属必须是在金属活动性顺序表中氢前的,酸一般指稀盐酸和稀硫酸),金属和盐溶液反应(条件:金属必须是前面的金属可以把排在它后面的金属从盐溶液中置换出来,钾、钙、钠除外);复分解反应的条件:必须有水或沉淀或气体生成。
【变式】(2020·安徽)某实验小组用如图装置进行微型实验。按下列表中选项加入试剂,实验时滴入甲,浸有丙的棉花不变红的是( )
选项 甲 乙 丙
A 浓氨水 \ 无色酚酞溶液
B 石灰水 碳酸钠 无色酚酞溶液
C 稀盐酸 石灰石 紫色石蕊溶液
D 浓盐酸 浓盐酸 紫色石蕊溶液
B
课堂检测
1. 下列关于CaCO3的说法中,正确的是( )
A. 组成:由一个钙元素、一个碳元素和三个氧元素组成B. 性质:能与稀硫酸反应
C. 用途:煅烧可制得氢氧化钙
D. 制取:用生石灰与水反应
B
2. (2021·渝中区模拟)除去下列物质中的少量杂质,所选用的试剂及操作方法均正确的是( )
选 项 物质(括号内为杂质) 试 剂 操作方法
A CaO(CaCO3) 水 溶解、过滤、结晶
B CO2(CO) 足量的O2 点燃
C HCl(H2SO4) 适量的氯化钡溶液 过滤
D NaCl(NaOH) 适量的硫酸 蒸发结晶
C
3. 金属在生活生产中有着非常广泛的应用,盐中含有金属离子(或铵根离子)和酸根离子,组成相似的盐具有一些相似的化学性质,请完成下列问题。
(1)向Cu(NO3)2溶液中加入NaOH溶液,充分振荡,反应的化学方程式为
。
(2)在溶液中能与CuSO4反应而不与Cu(NO3)2反应的物质有 。(任举一例)
Cu(NO3)2+2NaOH ===Cu(OH)2↓+2NaNO3
硝酸钡(或氯化钡等)
(3)向CuSO4溶液中加入某种纯净物的溶液,能同时将铜离子和硫酸根离子转变成沉淀,该纯净物的化学式为 。
(4)FeCl3和FeCl2虽然组成元素完全相同,但它们有相似也有截然不同的化学性质,在实验室里通常可以用FeCl3与铁反应来制取FeCl2,写出反应的化学方程式: 。
Ba(OH)2
2FeCl3+Fe===3FeCl2
4. 学习了单质、氧化物、酸、碱、盐的性质后,发现有很多不同类别的物质在发生反应时都有盐生成(其他物质省略),如图所示。请回答:
(1)若盐是硫酸钾,则①中发生反应的化学方程式为
。
H2SO4+2KOH===K2SO4+2H2O
(2)若盐是氯化亚铁,则在已显示的变化中可以通过置换反应来实现的有 (填序号)。
④⑥
(3)若盐是硝酸铜,则由⑦来实现的化学方程式为
___________________________________________,属于 (填基本反应类型)反应。
CuSO4+Ba(NO3)2 === BaSO4↓+Cu(NO3)2
复分解
(4)图中⑤处应补充的文字是______________________ (写一种,不能与图中已有信息重复)。
金属氧化物+酸
谢谢!
课题1 生活中常见的盐
第3课时 盐的化学性质
第十一单元 盐 化肥
目录
学习目标
课堂导学
例题导学
课堂检测
化学用语天天练
请写出下列反应的化学方程式:
硫酸铜与氢氧化钠的反应
______________________________________________
硫酸铜与氯化钡的反应
______________________________________________
2NaOH+CuSO4 === Cu(OH)2↓+Na2SO4
CuSO4+BaCl2 === CuCl2+BaSO4↓
课程标准:1. 掌握盐的化学性质和化学方程式的书写规律;2. 掌握酸、碱、盐之间的反应。
核心考点:盐的化学性质。
学习目标
1. 盐的化学性质
课堂导学
盐的化学性质
盐的化学性质 化学方程式 实验现象
盐(溶液)与金属反应生成_____和_____ CuSO4 + Fe _________________ 铁表面有 ,溶液由 色变 色
Cu + AgNO3 _______________ 铜片表面有 ,溶液由 色变 色
新盐
新金属
===Cu+FeSO4
红色固体析出
蓝
浅绿
2
2Ag+Cu(NO3)2
银白色固体析出
无
蓝
盐的化学性质 化学方程式 实验现象
盐和酸反应生成 和______ BaCl2 + H2SO4 ___________________ 生成_______________
AgNO3 + HCl ___________________ 生成_______________
NaHCO3 + HCl ___________________ 有 生成
新盐
新酸
===BaSO4↓+2HCl
白色沉淀
===AgCl↓+HNO3
白色沉淀
===NaCl+H2O+CO2↑
气泡
盐的化学性质 化学方程式 实验现象
盐(溶液)和碱(溶液)反应生成 和___________ CuSO4 +______NaOH ______________________ 生成______________
FeCl3 + ______NaOH ______________________ 生成______________
Na2CO3 + Ca(OH)2 ______________________ 生成______________
新盐
新碱
2
===Cu(OH)2↓+Na2SO4
蓝色沉淀
3
===Fe(OH)3↓+3NaCl
红色沉淀
===CaCO3↓+2NaOH
白色沉淀
盐的化学性质 化学方程式 实验现象
盐(溶液)和盐(溶液)反应生成____________ NaCl + AgNO3 _____________________ 生成______________
K2SO4 + BaCl2 _____________________ 生成______________
两种新盐
===AgCl↓+NaNO3
白色沉淀
===BaSO4↓+2KCl
白色沉淀
2. SO42-和Cl-的检验
(1)SO42-的检验方法:先取少量待测液于试管中,加入 ,若无明显现象,再加入 溶液,生成 ,证明原溶液中含有SO42-。
(2)Cl-的检验方法:先取少量待测液于试管中,加入
,若无明显现象,再加入 溶液,生成白色沉淀,证明原溶液中含有Cl-。
稀盐酸
硝酸钡
白色沉淀
稀硝酸
硝酸银
3. 除杂:所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变。除杂质题至少要满足两个条件:①加入的试剂只能与 反应,不能与原物质反应;②反应后不能引入 。
杂质
新的杂质
例题导学
盐的化学性质
【例题】下列物质能跟镁、氯化钡溶液、氢氧化钠溶液都发生反应的是( )
A. K2CO3溶液 B. CuSO4溶液
C. Ca(OH)2溶液 D. HNO3溶液
B
【点拨】抓住物质间的反应及置换反应和复分解反应的条件。置换反应:金属和酸反应(条件:金属必须是在金属活动性顺序表中氢前的,酸一般指稀盐酸和稀硫酸),金属和盐溶液反应(条件:金属必须是前面的金属可以把排在它后面的金属从盐溶液中置换出来,钾、钙、钠除外);复分解反应的条件:必须有水或沉淀或气体生成。
【变式】(2020·安徽)某实验小组用如图装置进行微型实验。按下列表中选项加入试剂,实验时滴入甲,浸有丙的棉花不变红的是( )
选项 甲 乙 丙
A 浓氨水 \ 无色酚酞溶液
B 石灰水 碳酸钠 无色酚酞溶液
C 稀盐酸 石灰石 紫色石蕊溶液
D 浓盐酸 浓盐酸 紫色石蕊溶液
B
课堂检测
1. 下列关于CaCO3的说法中,正确的是( )
A. 组成:由一个钙元素、一个碳元素和三个氧元素组成B. 性质:能与稀硫酸反应
C. 用途:煅烧可制得氢氧化钙
D. 制取:用生石灰与水反应
B
2. (2021·渝中区模拟)除去下列物质中的少量杂质,所选用的试剂及操作方法均正确的是( )
选 项 物质(括号内为杂质) 试 剂 操作方法
A CaO(CaCO3) 水 溶解、过滤、结晶
B CO2(CO) 足量的O2 点燃
C HCl(H2SO4) 适量的氯化钡溶液 过滤
D NaCl(NaOH) 适量的硫酸 蒸发结晶
C
3. 金属在生活生产中有着非常广泛的应用,盐中含有金属离子(或铵根离子)和酸根离子,组成相似的盐具有一些相似的化学性质,请完成下列问题。
(1)向Cu(NO3)2溶液中加入NaOH溶液,充分振荡,反应的化学方程式为
。
(2)在溶液中能与CuSO4反应而不与Cu(NO3)2反应的物质有 。(任举一例)
Cu(NO3)2+2NaOH ===Cu(OH)2↓+2NaNO3
硝酸钡(或氯化钡等)
(3)向CuSO4溶液中加入某种纯净物的溶液,能同时将铜离子和硫酸根离子转变成沉淀,该纯净物的化学式为 。
(4)FeCl3和FeCl2虽然组成元素完全相同,但它们有相似也有截然不同的化学性质,在实验室里通常可以用FeCl3与铁反应来制取FeCl2,写出反应的化学方程式: 。
Ba(OH)2
2FeCl3+Fe===3FeCl2
4. 学习了单质、氧化物、酸、碱、盐的性质后,发现有很多不同类别的物质在发生反应时都有盐生成(其他物质省略),如图所示。请回答:
(1)若盐是硫酸钾,则①中发生反应的化学方程式为
。
H2SO4+2KOH===K2SO4+2H2O
(2)若盐是氯化亚铁,则在已显示的变化中可以通过置换反应来实现的有 (填序号)。
④⑥
(3)若盐是硝酸铜,则由⑦来实现的化学方程式为
___________________________________________,属于 (填基本反应类型)反应。
CuSO4+Ba(NO3)2 === BaSO4↓+Cu(NO3)2
复分解
(4)图中⑤处应补充的文字是______________________ (写一种,不能与图中已有信息重复)。
金属氧化物+酸
谢谢!
同课章节目录
