第6章常用的金属和盐单元巩固练习---2021-2022学年九年级化学沪教版(上海)下册(word版 含答案)
文档属性
| 名称 | 第6章常用的金属和盐单元巩固练习---2021-2022学年九年级化学沪教版(上海)下册(word版 含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 164.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-11 16:33:35 | ||
图片预览



文档简介
第6章常用的金属和盐单元巩固2021-2022学年九年级化学沪教版(上海)
一、单选题
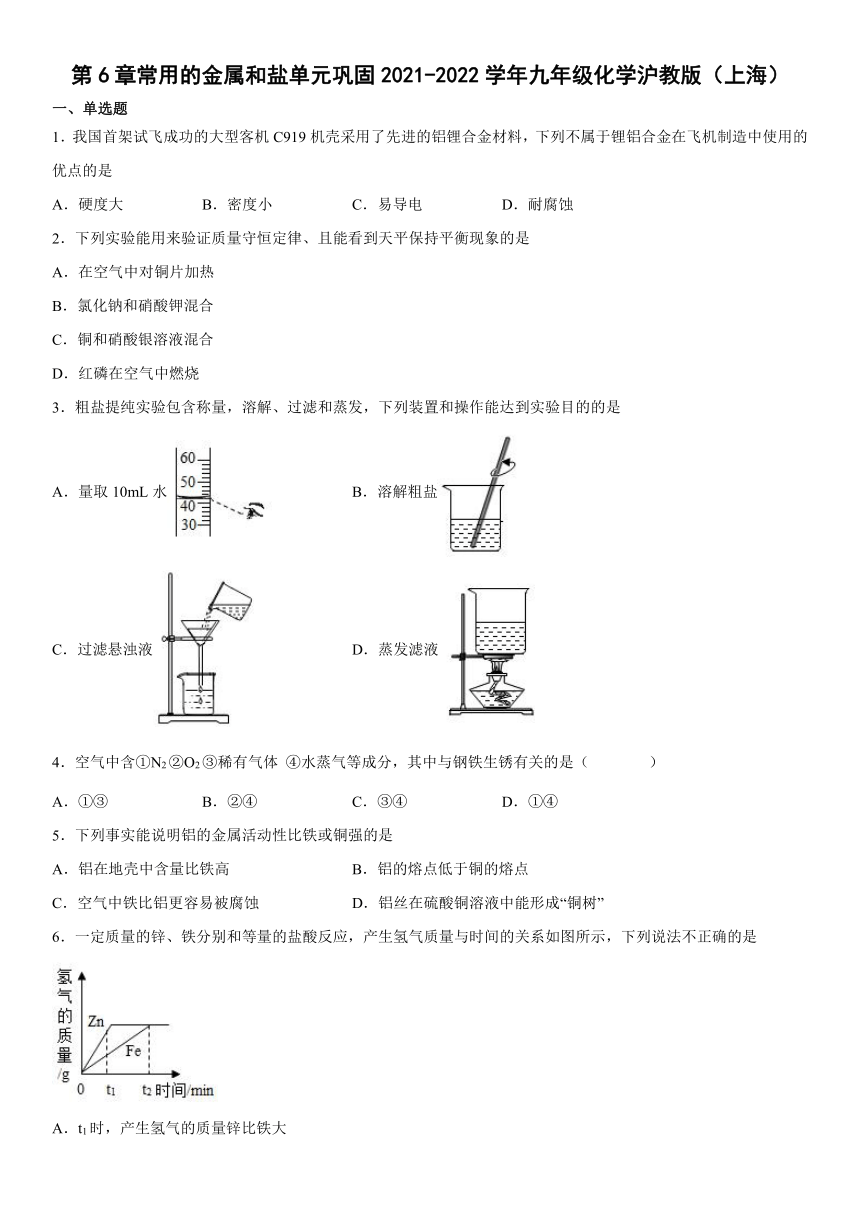
1.我国首架试飞成功的大型客机C919机壳采用了先进的铝锂合金材料,下列不属于锂铝合金在飞机制造中使用的优点的是
A.硬度大 B.密度小 C.易导电 D.耐腐蚀
2.下列实验能用来验证质量守恒定律、且能看到天平保持平衡现象的是
A.在空气中对铜片加热
B.氯化钠和硝酸钾混合
C.铜和硝酸银溶液混合
D.红磷在空气中燃烧
3.粗盐提纯实验包含称量,溶解、过滤和蒸发,下列装置和操作能达到实验目的的是
A.量取10mL水 B.溶解粗盐
C.过滤悬浊液 D.蒸发滤液
4.空气中含①N2 ②O2 ③稀有气体 ④水蒸气等成分,其中与钢铁生锈有关的是( )
A.①③ B.②④ C.③④ D.①④
5.下列事实能说明铝的金属活动性比铁或铜强的是
A.铝在地壳中含量比铁高 B.铝的熔点低于铜的熔点
C.空气中铁比铝更容易被腐蚀 D.铝丝在硫酸铜溶液中能形成“铜树”
6.一定质量的锌、铁分别和等量的盐酸反应,产生氢气质量与时间的关系如图所示,下列说法不正确的是
A.t1时,产生氢气的质量锌比铁大
B.t1时,产生氢气的速率锌比铁大
C.t2时,参加反应锌的质量与铁相同
D.t2时,锌、铁消耗的盐酸质量相同
7.“珍惜资源,保护环境”是每位公民应尽的义务,下列相关做法错误的是
A.我国稀土储量世界第一,可以任意开发利用
B.研发秸秆综合利用技术,避免因直接焚烧造成大气污染
C.利用二氧化碳捕捉技术,减少我国二氧化碳引起的“温室效应”
D.改造城市排水管网,实现雨水和生活用水的分流与处理
8.“愚人金”实为铜锌合金,外观与黄金极为相似,常被不法商贩冒充黄金牟取暴利,下列关于鉴别“愚人金”与黄金的实验方案,合理的是
比较硬度,硬度小的是“愚人金”
灼烧,表面变色的是“愚人金”
浸没在稀硫酸中,表面有气泡产生的是“愚人金”
浸没在硫酸锌溶液中,表面附着白色物质的是“愚人金”
A. B. C. D.
9.有X、Y、Z三种金属,X在常温下就能与氧气反应,Y、Z在常温下几乎不与氧气反应;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Z表面有银析出,而Y没有变化。根据以上实验事实,判断X、Y、Z三种金属的活动性由强到弱的顺序正确的是
A.X、Y、Z B.X、Z、Y
C.Y、Z、X D.Z、Y、X
10.在Ca(OH)2的饱和溶液中加入下列物质,冷却至室温,溶液的pH没有改变的是
A.CO2 B.CaO C.Cu(NO3)2 D.HCl
11.为了探究影响锌与盐酸反应剧烈程度的因素,某学习小组设计了下列实验
下列说法正确的是
实验① 实验② 实验③
A.对比实验①和②,可研究盐酸的浓度对反应剧烈程度的影响
B.对比实验②和③,可研究盐酸的浓度对反应剧烈程度的影响
C.对比实验②和③,可研究温度对反应剧烈程度的影响
D.对比实验①和②,可研究温度对反应剧烈程度的影响
二、简答题
12.铝、铁、铜是我们生活中常见的金属。
(1)下列生活用品中,主要利用金属具有良好导热性的是____________(填序号)。
A.铁锅 B.铜导线 C.铝制易拉罐
(2)铝具有很好的抗腐蚀性能,原因是_______________。
(3)在高温下,利用焦炭与氧气反应生成的一氧化碳可把铁从铁矿石里还原出来。其反应原理是:__________________。
(4)工人师傅切割铁板时,用硫酸铜溶液在铁板上画线可留下红色的印迹。其反应的化学方程式为_________。
13.《天工开物》中介绍了锌的冶炼方法:“炉甘石(ZnCO3)、煤炭饼装罐泥封”“其底铺薪,发火煅红”“冷淀毁罐取出”。反应区中发生的主要反应有:ZnCO3分解生成 ZnO 和另一种氧化物;ZnO与C反应生成Zn。
(1)反应区中ZnCO3分解的化学方程式为____________。
(2)“冷淀”后方能“毁罐”取锌,从化学变化的角度分析其原因_________。
14.金属钛因为神奇的性能越来越引起人们关注,常温下钛不与非金属及强酸反应。加热时却可以和常见的非金属单质反应,地壳中的含钛矿石之一是金红石(TiO2),目前大规模生产钛的方法是:
(1)使金红石与炭粉混合,在高温条件下反应,再通入氯气,制得TiCl4和一种可燃气体,该反应的化学方程式为________________________________________________________________________。
(2)在氩的气流中,高温下用过量的镁跟TiCl4反应制得金属钛,写出此反应的化学方程式:________________________________________________________________________。
三、推断题
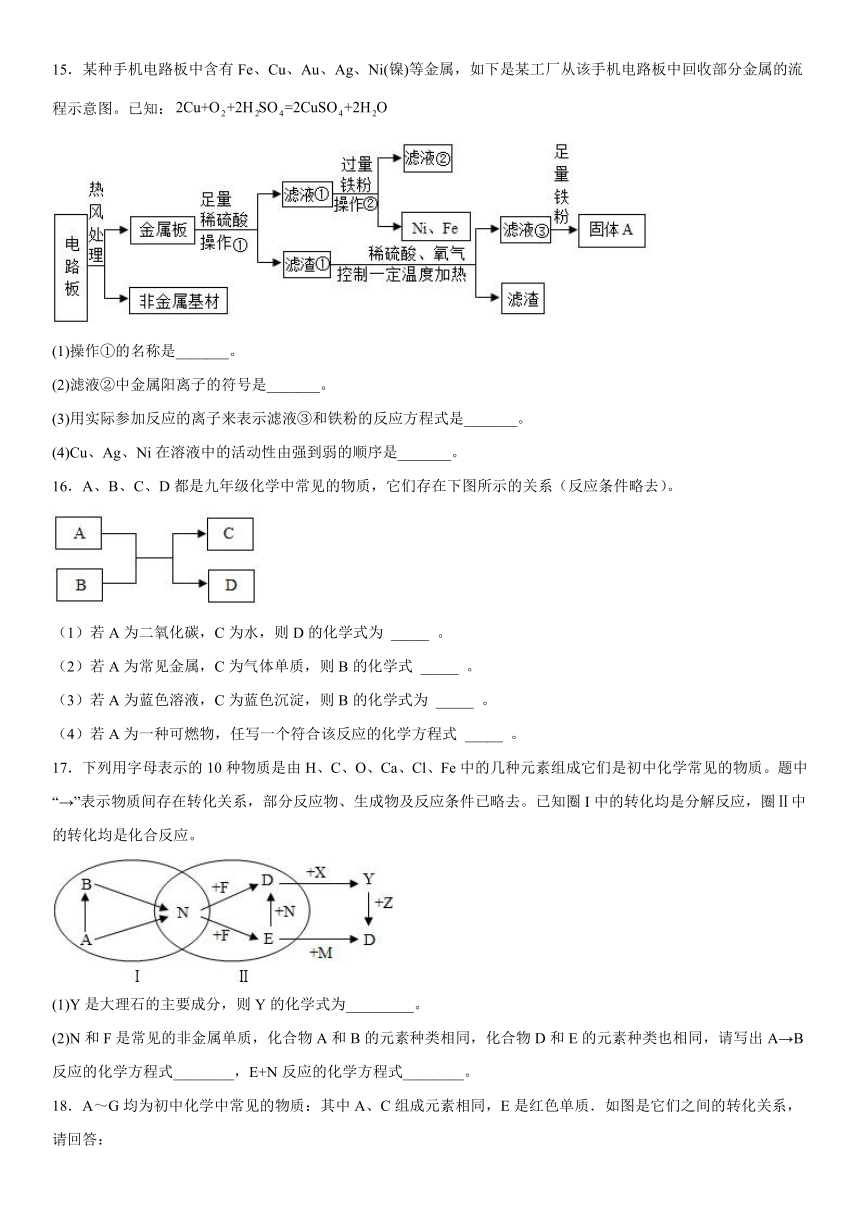
15.某种手机电路板中含有Fe、Cu、Au、Ag、Ni(镍)等金属,如下是某工厂从该手机电路板中回收部分金属的流程示意图。已知:
(1)操作①的名称是_______。
(2)滤液②中金属阳离子的符号是_______。
(3)用实际参加反应的离子来表示滤液③和铁粉的反应方程式是_______。
(4)Cu、Ag、Ni在溶液中的活动性由强到弱的顺序是_______。
16.A、B、C、D都是九年级化学中常见的物质,它们存在下图所示的关系(反应条件略去)。
(1)若A为二氧化碳,C为水,则D的化学式为 _____ 。
(2)若A为常见金属,C为气体单质,则B的化学式 _____ 。
(3)若A为蓝色溶液,C为蓝色沉淀,则B的化学式为 _____ 。
(4)若A为一种可燃物,任写一个符合该反应的化学方程式 _____ 。
17.下列用字母表示的10种物质是由H、C、O、Ca、Cl、Fe中的几种元素组成它们是初中化学常见的物质。题中“→”表示物质间存在转化关系,部分反应物、生成物及反应条件已略去。已知圈I中的转化均是分解反应,圈Ⅱ中的转化均是化合反应。
(1)Y是大理石的主要成分,则Y的化学式为_________。
(2)N和F是常见的非金属单质,化合物A和B的元素种类相同,化合物D和E的元素种类也相同,请写出A→B反应的化学方程式________,E+N反应的化学方程式________。
18.A~G均为初中化学中常见的物质:其中A、C组成元素相同,E是红色单质.如图是它们之间的转化关系,请回答:
(1)写出反应①的化学方程式_______________,其中B物质在该反应中起_______作用.
(2)反应②中的现象为_________________.
(3)反应③的基本类型是____________反应.
四、实验题
19.化学兴趣小组的同学把铁钉和铁粉放在潮湿的环境中一段时间后,发现银白色的铁钉表面出现了一层黄色的物质。小组同学经查阅资料得知是铁锈。
(1)铁锈的主要成分是氧化铁___________(写化学式),铁锈属于___________(填“纯净物”或“混合物”)。在此过程中,铁粉温度明显升高,___________能变成___________能。
(2)小明将生锈的铁钉放入稀盐酸中。表面的铁锈很快消失,反应生成氯化铁和水,溶液变成黄色。铁离子___________(写出符号)使溶液显黄色。铁钉放在黄色的溶液中一段时间后溶液又变成了浅绿色:氯化铁和铁反应生成了氯化亚铁,该反应的符号表达式___________。基本反应类型是___________。
(3)小芳发现:等质量的铁钉和铁粉放入相同的稀盐酸中,都有气泡产生,但铁粉与稀盐酸产生气泡的速率明显更快,由此现象可得出反应速率与___________有关。
(4)铁元素是人体必须的___________(填“微量”或“常量”)元素。如果缺少铁元素,会导致___________。
20.下图为化学小组探究金属的化学性质所做的三个实验。回答下列问题:
(1)B中发生的化学反应方程式是________。
(2)指出无明显现象的实验(填序号),并解释原因_______
(3)综合三个实验,得出三种金属活动性是______。
21.某兴趣小组的同学设计了如图所示实验,探究铁、镁、铜的金属活动性。
(1)请你写出试管B中反应的化学方程式:______。
(2)张昕同学认为该实验能得出这三种金属的活动性由强到弱依次为镁、铁、铜;晓梅同学认为该实验设计不合理,她的理由是______。
(3)某兴趣小组的同学又设计了以下实验方案,你认为可行的是______(填编号)。
①将镁片、铁片分别浸入到硫酸铜溶液中
②将镁片、铜片分别浸入到硫酸亚铁溶液中
③将铁片分别浸入到硫酸镁、硫酸铜溶液中
④将铜片分别浸入到硫酸亚铁、硫酸镁溶液中
五、计算题
22.实验室用20g含氧化铁80%的赤铁矿石进行炼铁,理论上可炼出纯铁的质量是多少?
23.烧杯中现有20gCu-Zn合金,向其中加入50g稀硫酸,恰好完全反应,测得烧杯内剩余物质的质量为69.8g。求:
(1)产生氢气的质量是_____g。
(2)该合金中锌的质量分数。
24.实验室用含杂质的锌(也称粗锌)与盐酸反应制取氢气,取8.0g含杂质的锌粒于烧杯中(所含杂质不溶于水,也不与酸反应),向其中加入73.0g稀盐酸,恰好完全反应后烧杯内剩余物质的质量为80.8g。计算:
(1)生成氢气的质量 g。
(2)求稀盐酸的溶质质量分数(请写出计算过程)。
试卷第1页,共3页
参考答案:
1.C
2.C
3.B
4.B
5.D
6.C
7.A
8.D
9.B
10.B
11.A
12. A 铝易与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化 Fe2O3+3CO2Fe+3CO2 Fe+CuSO4═FeSO4+Cu
13. 防止生成的锌在较高温度下又被氧化成氧化锌
14.
15. 过滤 Fe2+ Ni、Cu、Ag
16. CaCO3或Na2CO3 H2SO4或HCl NaOH或Ca(OH)2 (其他合理答案也可以)
17.(1)CaCO3
(2)
18. 2H2O22H2O+O2↑ 催化 红色固体变黑 复分解
19.(1) Fe2O3 混合物 化学 热
(2) Fe3+
化合反应
(3)反应物的接触面积
(4) 微量 贫血##缺铁性贫血
20. D,原因是:铜是“氢后”金属与稀盐酸不能反应 铁>铜>银
21. A、B两支试管所用酸的种类不同 ②③
22.解:样品为20g,赤铁矿含80%氧化铁,则其中铁元素质量=
所以理论上20g赤铁矿可提炼出11.2g铁。
答:理论上可炼出纯铁的质量是11.2g。
23.(1)0.2g
(2)设该合金中锌的质量为x
x=6.5g
该合金中锌的质量分数=
答:该合金中锌的质量分数为32.5%。
24.(1)0.2g;(2)10%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.我国首架试飞成功的大型客机C919机壳采用了先进的铝锂合金材料,下列不属于锂铝合金在飞机制造中使用的优点的是
A.硬度大 B.密度小 C.易导电 D.耐腐蚀
2.下列实验能用来验证质量守恒定律、且能看到天平保持平衡现象的是
A.在空气中对铜片加热
B.氯化钠和硝酸钾混合
C.铜和硝酸银溶液混合
D.红磷在空气中燃烧
3.粗盐提纯实验包含称量,溶解、过滤和蒸发,下列装置和操作能达到实验目的的是
A.量取10mL水 B.溶解粗盐
C.过滤悬浊液 D.蒸发滤液
4.空气中含①N2 ②O2 ③稀有气体 ④水蒸气等成分,其中与钢铁生锈有关的是( )
A.①③ B.②④ C.③④ D.①④
5.下列事实能说明铝的金属活动性比铁或铜强的是
A.铝在地壳中含量比铁高 B.铝的熔点低于铜的熔点
C.空气中铁比铝更容易被腐蚀 D.铝丝在硫酸铜溶液中能形成“铜树”
6.一定质量的锌、铁分别和等量的盐酸反应,产生氢气质量与时间的关系如图所示,下列说法不正确的是
A.t1时,产生氢气的质量锌比铁大
B.t1时,产生氢气的速率锌比铁大
C.t2时,参加反应锌的质量与铁相同
D.t2时,锌、铁消耗的盐酸质量相同
7.“珍惜资源,保护环境”是每位公民应尽的义务,下列相关做法错误的是
A.我国稀土储量世界第一,可以任意开发利用
B.研发秸秆综合利用技术,避免因直接焚烧造成大气污染
C.利用二氧化碳捕捉技术,减少我国二氧化碳引起的“温室效应”
D.改造城市排水管网,实现雨水和生活用水的分流与处理
8.“愚人金”实为铜锌合金,外观与黄金极为相似,常被不法商贩冒充黄金牟取暴利,下列关于鉴别“愚人金”与黄金的实验方案,合理的是
比较硬度,硬度小的是“愚人金”
灼烧,表面变色的是“愚人金”
浸没在稀硫酸中,表面有气泡产生的是“愚人金”
浸没在硫酸锌溶液中,表面附着白色物质的是“愚人金”
A. B. C. D.
9.有X、Y、Z三种金属,X在常温下就能与氧气反应,Y、Z在常温下几乎不与氧气反应;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Z表面有银析出,而Y没有变化。根据以上实验事实,判断X、Y、Z三种金属的活动性由强到弱的顺序正确的是
A.X、Y、Z B.X、Z、Y
C.Y、Z、X D.Z、Y、X
10.在Ca(OH)2的饱和溶液中加入下列物质,冷却至室温,溶液的pH没有改变的是
A.CO2 B.CaO C.Cu(NO3)2 D.HCl
11.为了探究影响锌与盐酸反应剧烈程度的因素,某学习小组设计了下列实验
下列说法正确的是
实验① 实验② 实验③
A.对比实验①和②,可研究盐酸的浓度对反应剧烈程度的影响
B.对比实验②和③,可研究盐酸的浓度对反应剧烈程度的影响
C.对比实验②和③,可研究温度对反应剧烈程度的影响
D.对比实验①和②,可研究温度对反应剧烈程度的影响
二、简答题
12.铝、铁、铜是我们生活中常见的金属。
(1)下列生活用品中,主要利用金属具有良好导热性的是____________(填序号)。
A.铁锅 B.铜导线 C.铝制易拉罐
(2)铝具有很好的抗腐蚀性能,原因是_______________。
(3)在高温下,利用焦炭与氧气反应生成的一氧化碳可把铁从铁矿石里还原出来。其反应原理是:__________________。
(4)工人师傅切割铁板时,用硫酸铜溶液在铁板上画线可留下红色的印迹。其反应的化学方程式为_________。
13.《天工开物》中介绍了锌的冶炼方法:“炉甘石(ZnCO3)、煤炭饼装罐泥封”“其底铺薪,发火煅红”“冷淀毁罐取出”。反应区中发生的主要反应有:ZnCO3分解生成 ZnO 和另一种氧化物;ZnO与C反应生成Zn。
(1)反应区中ZnCO3分解的化学方程式为____________。
(2)“冷淀”后方能“毁罐”取锌,从化学变化的角度分析其原因_________。
14.金属钛因为神奇的性能越来越引起人们关注,常温下钛不与非金属及强酸反应。加热时却可以和常见的非金属单质反应,地壳中的含钛矿石之一是金红石(TiO2),目前大规模生产钛的方法是:
(1)使金红石与炭粉混合,在高温条件下反应,再通入氯气,制得TiCl4和一种可燃气体,该反应的化学方程式为________________________________________________________________________。
(2)在氩的气流中,高温下用过量的镁跟TiCl4反应制得金属钛,写出此反应的化学方程式:________________________________________________________________________。
三、推断题
15.某种手机电路板中含有Fe、Cu、Au、Ag、Ni(镍)等金属,如下是某工厂从该手机电路板中回收部分金属的流程示意图。已知:
(1)操作①的名称是_______。
(2)滤液②中金属阳离子的符号是_______。
(3)用实际参加反应的离子来表示滤液③和铁粉的反应方程式是_______。
(4)Cu、Ag、Ni在溶液中的活动性由强到弱的顺序是_______。
16.A、B、C、D都是九年级化学中常见的物质,它们存在下图所示的关系(反应条件略去)。
(1)若A为二氧化碳,C为水,则D的化学式为 _____ 。
(2)若A为常见金属,C为气体单质,则B的化学式 _____ 。
(3)若A为蓝色溶液,C为蓝色沉淀,则B的化学式为 _____ 。
(4)若A为一种可燃物,任写一个符合该反应的化学方程式 _____ 。
17.下列用字母表示的10种物质是由H、C、O、Ca、Cl、Fe中的几种元素组成它们是初中化学常见的物质。题中“→”表示物质间存在转化关系,部分反应物、生成物及反应条件已略去。已知圈I中的转化均是分解反应,圈Ⅱ中的转化均是化合反应。
(1)Y是大理石的主要成分,则Y的化学式为_________。
(2)N和F是常见的非金属单质,化合物A和B的元素种类相同,化合物D和E的元素种类也相同,请写出A→B反应的化学方程式________,E+N反应的化学方程式________。
18.A~G均为初中化学中常见的物质:其中A、C组成元素相同,E是红色单质.如图是它们之间的转化关系,请回答:
(1)写出反应①的化学方程式_______________,其中B物质在该反应中起_______作用.
(2)反应②中的现象为_________________.
(3)反应③的基本类型是____________反应.
四、实验题
19.化学兴趣小组的同学把铁钉和铁粉放在潮湿的环境中一段时间后,发现银白色的铁钉表面出现了一层黄色的物质。小组同学经查阅资料得知是铁锈。
(1)铁锈的主要成分是氧化铁___________(写化学式),铁锈属于___________(填“纯净物”或“混合物”)。在此过程中,铁粉温度明显升高,___________能变成___________能。
(2)小明将生锈的铁钉放入稀盐酸中。表面的铁锈很快消失,反应生成氯化铁和水,溶液变成黄色。铁离子___________(写出符号)使溶液显黄色。铁钉放在黄色的溶液中一段时间后溶液又变成了浅绿色:氯化铁和铁反应生成了氯化亚铁,该反应的符号表达式___________。基本反应类型是___________。
(3)小芳发现:等质量的铁钉和铁粉放入相同的稀盐酸中,都有气泡产生,但铁粉与稀盐酸产生气泡的速率明显更快,由此现象可得出反应速率与___________有关。
(4)铁元素是人体必须的___________(填“微量”或“常量”)元素。如果缺少铁元素,会导致___________。
20.下图为化学小组探究金属的化学性质所做的三个实验。回答下列问题:
(1)B中发生的化学反应方程式是________。
(2)指出无明显现象的实验(填序号),并解释原因_______
(3)综合三个实验,得出三种金属活动性是______。
21.某兴趣小组的同学设计了如图所示实验,探究铁、镁、铜的金属活动性。
(1)请你写出试管B中反应的化学方程式:______。
(2)张昕同学认为该实验能得出这三种金属的活动性由强到弱依次为镁、铁、铜;晓梅同学认为该实验设计不合理,她的理由是______。
(3)某兴趣小组的同学又设计了以下实验方案,你认为可行的是______(填编号)。
①将镁片、铁片分别浸入到硫酸铜溶液中
②将镁片、铜片分别浸入到硫酸亚铁溶液中
③将铁片分别浸入到硫酸镁、硫酸铜溶液中
④将铜片分别浸入到硫酸亚铁、硫酸镁溶液中
五、计算题
22.实验室用20g含氧化铁80%的赤铁矿石进行炼铁,理论上可炼出纯铁的质量是多少?
23.烧杯中现有20gCu-Zn合金,向其中加入50g稀硫酸,恰好完全反应,测得烧杯内剩余物质的质量为69.8g。求:
(1)产生氢气的质量是_____g。
(2)该合金中锌的质量分数。
24.实验室用含杂质的锌(也称粗锌)与盐酸反应制取氢气,取8.0g含杂质的锌粒于烧杯中(所含杂质不溶于水,也不与酸反应),向其中加入73.0g稀盐酸,恰好完全反应后烧杯内剩余物质的质量为80.8g。计算:
(1)生成氢气的质量 g。
(2)求稀盐酸的溶质质量分数(请写出计算过程)。
试卷第1页,共3页
参考答案:
1.C
2.C
3.B
4.B
5.D
6.C
7.A
8.D
9.B
10.B
11.A
12. A 铝易与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化 Fe2O3+3CO2Fe+3CO2 Fe+CuSO4═FeSO4+Cu
13. 防止生成的锌在较高温度下又被氧化成氧化锌
14.
15. 过滤 Fe2+ Ni、Cu、Ag
16. CaCO3或Na2CO3 H2SO4或HCl NaOH或Ca(OH)2 (其他合理答案也可以)
17.(1)CaCO3
(2)
18. 2H2O22H2O+O2↑ 催化 红色固体变黑 复分解
19.(1) Fe2O3 混合物 化学 热
(2) Fe3+
化合反应
(3)反应物的接触面积
(4) 微量 贫血##缺铁性贫血
20. D,原因是:铜是“氢后”金属与稀盐酸不能反应 铁>铜>银
21. A、B两支试管所用酸的种类不同 ②③
22.解:样品为20g,赤铁矿含80%氧化铁,则其中铁元素质量=
所以理论上20g赤铁矿可提炼出11.2g铁。
答:理论上可炼出纯铁的质量是11.2g。
23.(1)0.2g
(2)设该合金中锌的质量为x
x=6.5g
该合金中锌的质量分数=
答:该合金中锌的质量分数为32.5%。
24.(1)0.2g;(2)10%
答案第1页,共2页
答案第1页,共2页
