第6章常用的金属和盐章末复习-2021-2022学年九年级化学沪教版(上海)第二学期 (word版有答案)
文档属性
| 名称 | 第6章常用的金属和盐章末复习-2021-2022学年九年级化学沪教版(上海)第二学期 (word版有答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 279.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-11 21:44:47 | ||
图片预览


文档简介
第6章常用的金属和盐章末复习2021-2022学年九年级化学沪教版(上海)
一、单选题
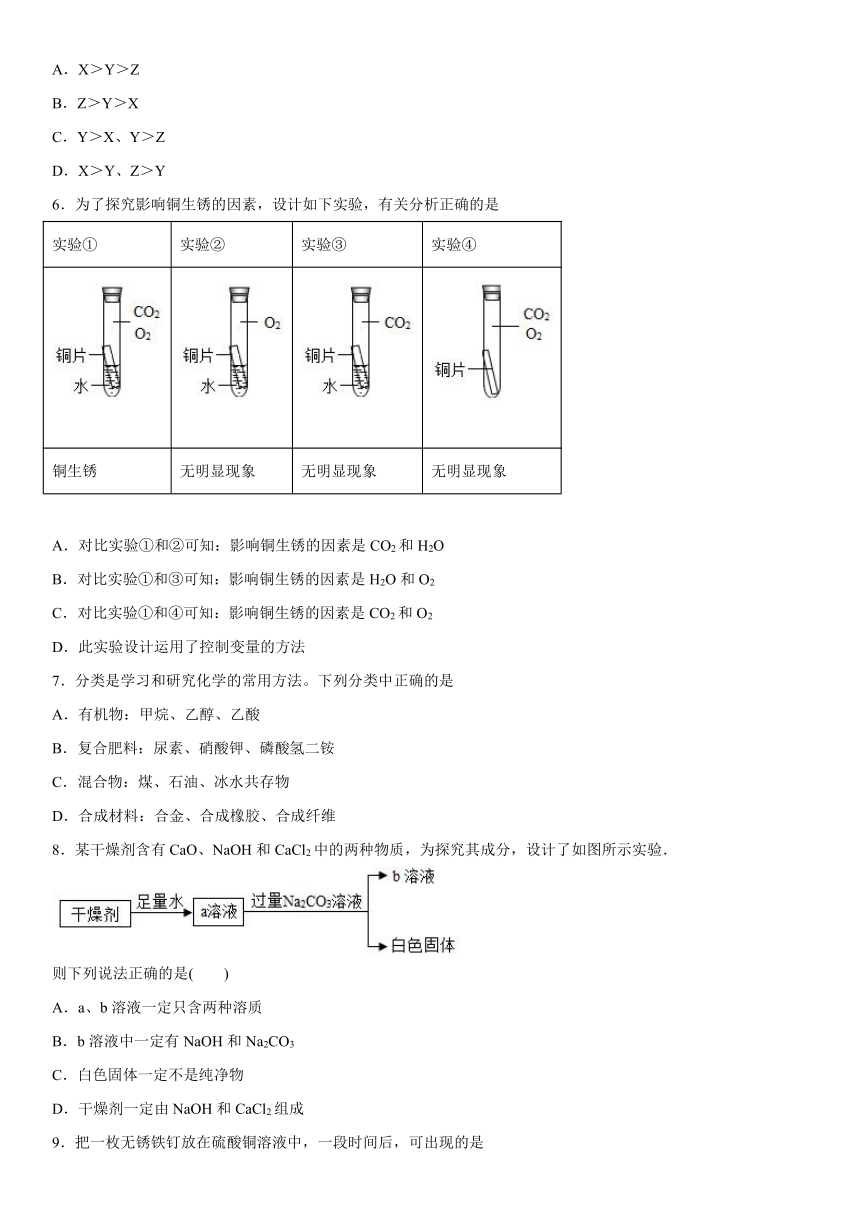
1.我国第一艘国产航母“山东舰”在制造的过程中使用了大量的金属材料。下列有关金属材料的说法错误的是
A.合金的硬度一般比组成它们的纯金属更高
B.钢铁是使用最多的金属材料
C.金属在常温下都是固体
D.大多数金属为电和热的优良导体
2.某同学总结的Ca(OH)2的化学性质如图,下列说法错误的是
A.甲一定是碳酸盐
B.反应②为放热反应
C.反应③可用于检验某种温室气体
D.向澄清石灰水中加入紫色石蕊试液,试液由紫色变为蓝色
3.下列属于置换反应的是
A.
B.
C.NaOH+HCl=NaCl+H2O
D.2Al+6HCl=2AlCl3+3H2↑
4.某pH=12的无色溶液中大量存在的离子有Na+、Ba2+、NO、X,则X可能是
A.Cu2+ B.Cl- C.H+ D.SO
5.为比较X、Y、Z三种金属活动性大小,进行如图所示的实验。下列实验结论正确的是( )
A.X>Y>Z
B.Z>Y>X
C.Y>X、Y>Z
D.X>Y、Z>Y
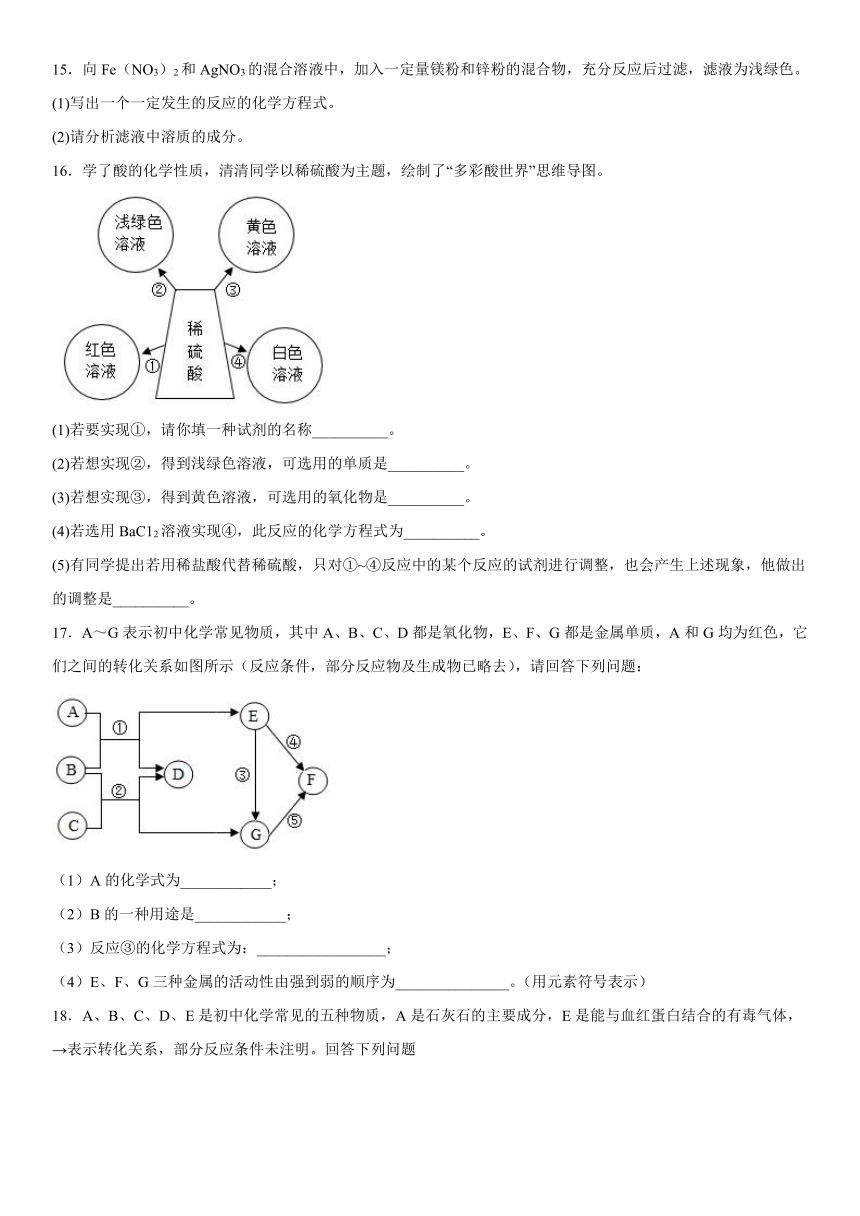
6.为了探究影响铜生锈的因素,设计如下实验,有关分析正确的是
实验① 实验② 实验③ 实验④
铜生锈 无明显现象 无明显现象 无明显现象
A.对比实验①和②可知:影响铜生锈的因素是CO2和H2O
B.对比实验①和③可知:影响铜生锈的因素是H2O和O2
C.对比实验①和④可知:影响铜生锈的因素是CO2和O2
D.此实验设计运用了控制变量的方法
7.分类是学习和研究化学的常用方法。下列分类中正确的是
A.有机物:甲烷、乙醇、乙酸
B.复合肥料:尿素、硝酸钾、磷酸氢二铵
C.混合物:煤、石油、冰水共存物
D.合成材料:合金、合成橡胶、合成纤维
8.某干燥剂含有CaO、NaOH和CaCl2中的两种物质,为探究其成分,设计了如图所示实验.
则下列说法正确的是( )
A.a、b溶液一定只含两种溶质
B.b溶液中一定有NaOH和Na2CO3
C.白色固体一定不是纯净物
D.干燥剂一定由NaOH和CaCl2组成
9.把一枚无锈铁钉放在硫酸铜溶液中,一段时间后,可出现的是
A.溶液蓝色变浅直至无色 B.铁钉表面析出红色物质
C.产生大量气泡 D.溶液质量增加
10.已知金属锰在金属活动性顺序中位于铝和锌之间.下列化学反应不能发生的是( )
A.Mn+2HCl=MnCl2+H2↑ B.Mg+MnSO4=MgSO4+Mn
C.Fe+MnSO4=FeSO4+Mn D.Mn+CuSO4=MnSO4+Cu
11.某化学兴趣小组为验证Ag、Fe、Cu三种金属的活动性顺序,设计了如下图所示的实验操作.其中可以达到实验目的的组合是
A.①③ B.②④ C.④⑤ D.②③
二、简答题
12.生活中处处是化学,请用所学过的化学知识回答下列问题。
(1)在铁制品表面涂油刷漆等都能防止铁生锈,其原理是什么?
(2)金刚石和石墨都是碳元素组成的单质,但二者的物理性质差异却非常大,其原因是什么?
13.广东“南海一号”南宋沉船出土的金叶子和金缨络胸佩(如图)。在海底沉睡800年至今仍光彩照人,从物质性质的角度解释其原因:______。
14.冬季,道路结冰给交通带来极大不便.为了快速消除道路上的冰雪,交通部门使用了大量的融雪剂(主要成分为,,,等).一年过后,小仪和同学们对桥梁、道路设施及周边植被进行了考察.
(1)使用工业盐做融雪剂对环境有无影响?______(填“有”或“无”).
(2)如果有影响,主要表现在哪些方面(至少答两点)?______.
(3)你对使用融雪剂有什么建议?______.
三、推断题
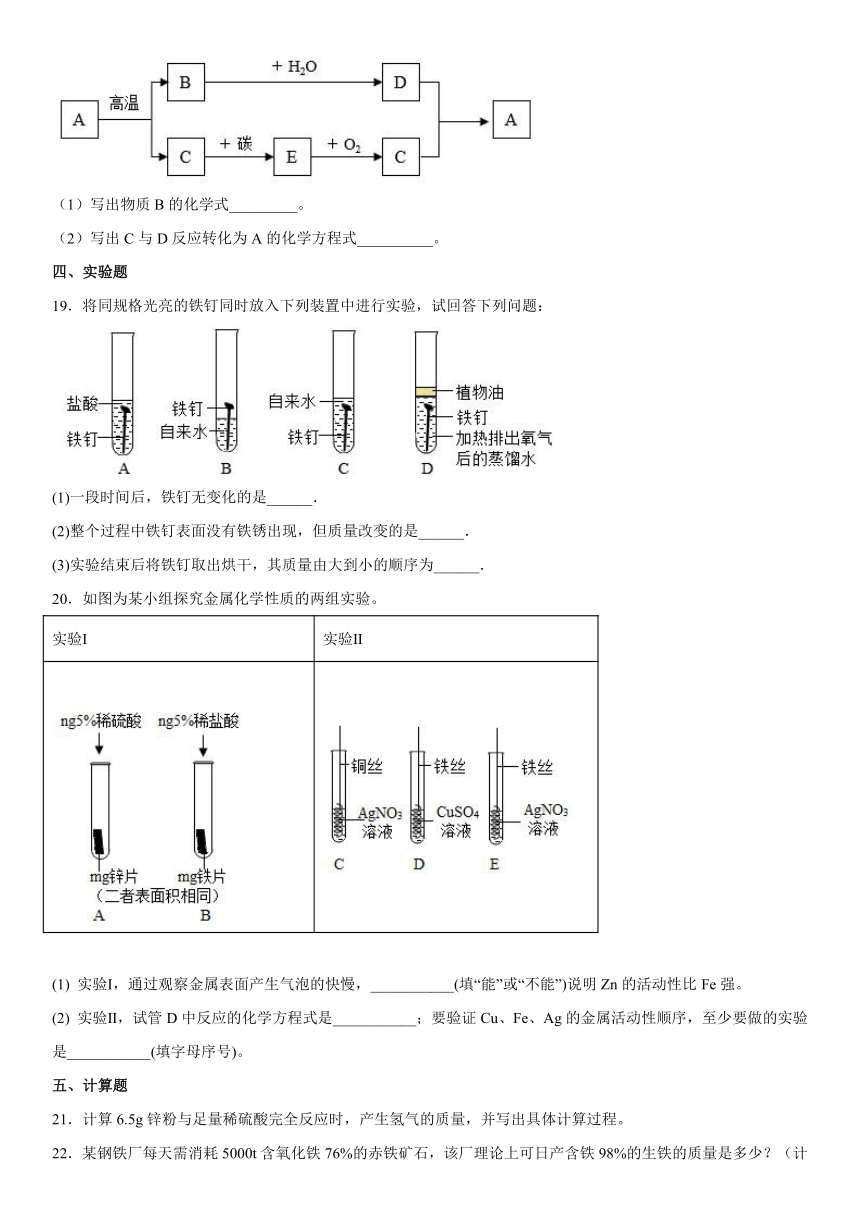
15.向Fe(NO3)2和AgNO3的混合溶液中,加入一定量镁粉和锌粉的混合物,充分反应后过滤,滤液为浅绿色。
(1)写出一个一定发生的反应的化学方程式。
(2)请分析滤液中溶质的成分。
16.学了酸的化学性质,清清同学以稀硫酸为主题,绘制了“多彩酸世界”思维导图。
(1)若要实现①,请你填一种试剂的名称__________。
(2)若想实现②,得到浅绿色溶液,可选用的单质是__________。
(3)若想实现③,得到黄色溶液,可选用的氧化物是__________。
(4)若选用BaC12溶液实现④,此反应的化学方程式为__________。
(5)有同学提出若用稀盐酸代替稀硫酸,只对①~④反应中的某个反应的试剂进行调整,也会产生上述现象,他做出的调整是__________。
17.A~G表示初中化学常见物质,其中A、B、C、D都是氧化物,E、F、G都是金属单质,A和G均为红色,它们之间的转化关系如图所示(反应条件,部分反应物及生成物已略去),请回答下列问题:
(1)A的化学式为____________;
(2)B的一种用途是____________;
(3)反应③的化学方程式为:_________________;
(4)E、F、G三种金属的活动性由强到弱的顺序为_______________。(用元素符号表示)
18.A、B、C、D、E是初中化学常见的五种物质,A是石灰石的主要成分,E是能与血红蛋白结合的有毒气体,→表示转化关系,部分反应条件未注明。回答下列问题
(1)写出物质B的化学式_________。
(2)写出C与D反应转化为A的化学方程式__________。
四、实验题
19.将同规格光亮的铁钉同时放入下列装置中进行实验,试回答下列问题:
(1)一段时间后,铁钉无变化的是______.
(2)整个过程中铁钉表面没有铁锈出现,但质量改变的是______.
(3)实验结束后将铁钉取出烘干,其质量由大到小的顺序为______.
20.如图为某小组探究金属化学性质的两组实验。
实验Ⅰ 实验Ⅱ
(1) 实验Ⅰ,通过观察金属表面产生气泡的快慢,___________(填“能”或“不能”)说明Zn的活动性比Fe强。
(2) 实验Ⅱ,试管D中反应的化学方程式是___________;要验证Cu、Fe、Ag的金属活动性顺序,至少要做的实验是___________(填字母序号)。
五、计算题
21.计算6.5g锌粉与足量稀硫酸完全反应时,产生氢气的质量,并写出具体计算过程。
22.某钢铁厂每天需消耗5000t含氧化铁76%的赤铁矿石,该厂理论上可日产含铁98%的生铁的质量是多少?(计算结果保留整数)
23.实验室中有一瓶已变质的氢氧化钠固体,化学兴趣小组为了检验该固体中氢氧化钠的纯度,取14.6g固体于烧杯中进行实验,分四次加入某浓度的盐酸,所得数据如表:
次数 1 2 3 4
加入盐酸的质量/g 14.6 14.6 14.6 14.6
烧杯中物质的质量/g 29.2 41.6 54.0 68.6
根据上表数据分析,回答下列问题:
(1)反应生成CO2的质量为______g。
(2)计算该瓶固体中氢氧化钠的质量分数(写出计算过程,结果保留到0.1%)。
(3)请你帮化学兴趣小组将表格中的数据转化为曲线。
24.市售的食用纯碱往往含有少量氯化钠,探究小组以某品牌食用纯碱为样品测定其中Na2CO3的质量分数,实验过程如图:
请分析实验过程,回答:
(1)写出相关反应的化学方程式______。
(2)实验中加入“过量”CaCl2溶液,目的是______。
(3)若取用样品的质量为2.2g,且实验过程中无质量损失,最终得到沉淀的质量为2g。则2.2g纯碱样品中Na2CO3的质量为______克,该品牌食用纯碱中Na2CO3的质量分数为______。
试卷第1页,共3页
参考答案:
1.C
2.A
3.D
4.B
5.A
6.D
7.A
8.B
9.B
10.C
11.D
12.(1)隔绝水和氧气
(2)碳原子的排序不同
13.金的化学性质稳定,很难与其它物质反应
14. 有 水质污染、铁制品腐蚀、土壤污染等 铲除部分冰雪再使用少量融雪剂或用化肥做融雪剂等
15.(1)Mg + 2AgNO3=Mg(NO3)2+2Ag
(2)一定有硝酸镁、硝酸锌、硝酸亚铁,可能有硝酸银
16.(1)紫色石蕊试液
(2)Fe##铁
(3)Fe2O3##氧化铁
(4)
(5)将第④试剂调换为硝酸银(AgNO3)
17. Fe2O3 冶炼金属 Fe+CuSO4=FeSO4+Cu 铁>铜>银
18. CaO CO2 + Ca(OH)2 = CaCO3↓+ H2O
19. D A B C D A
20. 不能 Fe+CuSO4=Cu+FeSO4 CD
21.解:设产生氢气的质量为x
x=0.2g
答:产生氢气的质量为0.2g。
22.设生铁质量为x
答:该厂理论上可日产含铁98%的生铁的质量为2714t。
23.(1)4.4;
(2)解:设碳酸钠质量为x
,
x=10.6g
该瓶固体中氢氧化钠的质量分数是:,
答:该瓶固体中氢氧化钠的质量分数是27.4%。
(3)。
24.(1)
(2)碳酸钠完全反应,使实验结果更准确
(3)解:设2.2g纯碱样品中碳酸钠的质量为x。
x=2.12g
该品牌食用纯碱中碳酸钠的质量分数=
答:2.2g纯碱样品中碳酸钠的质量是21.2g。该品牌食用纯碱中Na2CO3的质量分数是96.4%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.我国第一艘国产航母“山东舰”在制造的过程中使用了大量的金属材料。下列有关金属材料的说法错误的是
A.合金的硬度一般比组成它们的纯金属更高
B.钢铁是使用最多的金属材料
C.金属在常温下都是固体
D.大多数金属为电和热的优良导体
2.某同学总结的Ca(OH)2的化学性质如图,下列说法错误的是
A.甲一定是碳酸盐
B.反应②为放热反应
C.反应③可用于检验某种温室气体
D.向澄清石灰水中加入紫色石蕊试液,试液由紫色变为蓝色
3.下列属于置换反应的是
A.
B.
C.NaOH+HCl=NaCl+H2O
D.2Al+6HCl=2AlCl3+3H2↑
4.某pH=12的无色溶液中大量存在的离子有Na+、Ba2+、NO、X,则X可能是
A.Cu2+ B.Cl- C.H+ D.SO
5.为比较X、Y、Z三种金属活动性大小,进行如图所示的实验。下列实验结论正确的是( )
A.X>Y>Z
B.Z>Y>X
C.Y>X、Y>Z
D.X>Y、Z>Y
6.为了探究影响铜生锈的因素,设计如下实验,有关分析正确的是
实验① 实验② 实验③ 实验④
铜生锈 无明显现象 无明显现象 无明显现象
A.对比实验①和②可知:影响铜生锈的因素是CO2和H2O
B.对比实验①和③可知:影响铜生锈的因素是H2O和O2
C.对比实验①和④可知:影响铜生锈的因素是CO2和O2
D.此实验设计运用了控制变量的方法
7.分类是学习和研究化学的常用方法。下列分类中正确的是
A.有机物:甲烷、乙醇、乙酸
B.复合肥料:尿素、硝酸钾、磷酸氢二铵
C.混合物:煤、石油、冰水共存物
D.合成材料:合金、合成橡胶、合成纤维
8.某干燥剂含有CaO、NaOH和CaCl2中的两种物质,为探究其成分,设计了如图所示实验.
则下列说法正确的是( )
A.a、b溶液一定只含两种溶质
B.b溶液中一定有NaOH和Na2CO3
C.白色固体一定不是纯净物
D.干燥剂一定由NaOH和CaCl2组成
9.把一枚无锈铁钉放在硫酸铜溶液中,一段时间后,可出现的是
A.溶液蓝色变浅直至无色 B.铁钉表面析出红色物质
C.产生大量气泡 D.溶液质量增加
10.已知金属锰在金属活动性顺序中位于铝和锌之间.下列化学反应不能发生的是( )
A.Mn+2HCl=MnCl2+H2↑ B.Mg+MnSO4=MgSO4+Mn
C.Fe+MnSO4=FeSO4+Mn D.Mn+CuSO4=MnSO4+Cu
11.某化学兴趣小组为验证Ag、Fe、Cu三种金属的活动性顺序,设计了如下图所示的实验操作.其中可以达到实验目的的组合是
A.①③ B.②④ C.④⑤ D.②③
二、简答题
12.生活中处处是化学,请用所学过的化学知识回答下列问题。
(1)在铁制品表面涂油刷漆等都能防止铁生锈,其原理是什么?
(2)金刚石和石墨都是碳元素组成的单质,但二者的物理性质差异却非常大,其原因是什么?
13.广东“南海一号”南宋沉船出土的金叶子和金缨络胸佩(如图)。在海底沉睡800年至今仍光彩照人,从物质性质的角度解释其原因:______。
14.冬季,道路结冰给交通带来极大不便.为了快速消除道路上的冰雪,交通部门使用了大量的融雪剂(主要成分为,,,等).一年过后,小仪和同学们对桥梁、道路设施及周边植被进行了考察.
(1)使用工业盐做融雪剂对环境有无影响?______(填“有”或“无”).
(2)如果有影响,主要表现在哪些方面(至少答两点)?______.
(3)你对使用融雪剂有什么建议?______.
三、推断题
15.向Fe(NO3)2和AgNO3的混合溶液中,加入一定量镁粉和锌粉的混合物,充分反应后过滤,滤液为浅绿色。
(1)写出一个一定发生的反应的化学方程式。
(2)请分析滤液中溶质的成分。
16.学了酸的化学性质,清清同学以稀硫酸为主题,绘制了“多彩酸世界”思维导图。
(1)若要实现①,请你填一种试剂的名称__________。
(2)若想实现②,得到浅绿色溶液,可选用的单质是__________。
(3)若想实现③,得到黄色溶液,可选用的氧化物是__________。
(4)若选用BaC12溶液实现④,此反应的化学方程式为__________。
(5)有同学提出若用稀盐酸代替稀硫酸,只对①~④反应中的某个反应的试剂进行调整,也会产生上述现象,他做出的调整是__________。
17.A~G表示初中化学常见物质,其中A、B、C、D都是氧化物,E、F、G都是金属单质,A和G均为红色,它们之间的转化关系如图所示(反应条件,部分反应物及生成物已略去),请回答下列问题:
(1)A的化学式为____________;
(2)B的一种用途是____________;
(3)反应③的化学方程式为:_________________;
(4)E、F、G三种金属的活动性由强到弱的顺序为_______________。(用元素符号表示)
18.A、B、C、D、E是初中化学常见的五种物质,A是石灰石的主要成分,E是能与血红蛋白结合的有毒气体,→表示转化关系,部分反应条件未注明。回答下列问题
(1)写出物质B的化学式_________。
(2)写出C与D反应转化为A的化学方程式__________。
四、实验题
19.将同规格光亮的铁钉同时放入下列装置中进行实验,试回答下列问题:
(1)一段时间后,铁钉无变化的是______.
(2)整个过程中铁钉表面没有铁锈出现,但质量改变的是______.
(3)实验结束后将铁钉取出烘干,其质量由大到小的顺序为______.
20.如图为某小组探究金属化学性质的两组实验。
实验Ⅰ 实验Ⅱ
(1) 实验Ⅰ,通过观察金属表面产生气泡的快慢,___________(填“能”或“不能”)说明Zn的活动性比Fe强。
(2) 实验Ⅱ,试管D中反应的化学方程式是___________;要验证Cu、Fe、Ag的金属活动性顺序,至少要做的实验是___________(填字母序号)。
五、计算题
21.计算6.5g锌粉与足量稀硫酸完全反应时,产生氢气的质量,并写出具体计算过程。
22.某钢铁厂每天需消耗5000t含氧化铁76%的赤铁矿石,该厂理论上可日产含铁98%的生铁的质量是多少?(计算结果保留整数)
23.实验室中有一瓶已变质的氢氧化钠固体,化学兴趣小组为了检验该固体中氢氧化钠的纯度,取14.6g固体于烧杯中进行实验,分四次加入某浓度的盐酸,所得数据如表:
次数 1 2 3 4
加入盐酸的质量/g 14.6 14.6 14.6 14.6
烧杯中物质的质量/g 29.2 41.6 54.0 68.6
根据上表数据分析,回答下列问题:
(1)反应生成CO2的质量为______g。
(2)计算该瓶固体中氢氧化钠的质量分数(写出计算过程,结果保留到0.1%)。
(3)请你帮化学兴趣小组将表格中的数据转化为曲线。
24.市售的食用纯碱往往含有少量氯化钠,探究小组以某品牌食用纯碱为样品测定其中Na2CO3的质量分数,实验过程如图:
请分析实验过程,回答:
(1)写出相关反应的化学方程式______。
(2)实验中加入“过量”CaCl2溶液,目的是______。
(3)若取用样品的质量为2.2g,且实验过程中无质量损失,最终得到沉淀的质量为2g。则2.2g纯碱样品中Na2CO3的质量为______克,该品牌食用纯碱中Na2CO3的质量分数为______。
试卷第1页,共3页
参考答案:
1.C
2.A
3.D
4.B
5.A
6.D
7.A
8.B
9.B
10.C
11.D
12.(1)隔绝水和氧气
(2)碳原子的排序不同
13.金的化学性质稳定,很难与其它物质反应
14. 有 水质污染、铁制品腐蚀、土壤污染等 铲除部分冰雪再使用少量融雪剂或用化肥做融雪剂等
15.(1)Mg + 2AgNO3=Mg(NO3)2+2Ag
(2)一定有硝酸镁、硝酸锌、硝酸亚铁,可能有硝酸银
16.(1)紫色石蕊试液
(2)Fe##铁
(3)Fe2O3##氧化铁
(4)
(5)将第④试剂调换为硝酸银(AgNO3)
17. Fe2O3 冶炼金属 Fe+CuSO4=FeSO4+Cu 铁>铜>银
18. CaO CO2 + Ca(OH)2 = CaCO3↓+ H2O
19. D A B C D A
20. 不能 Fe+CuSO4=Cu+FeSO4 CD
21.解:设产生氢气的质量为x
x=0.2g
答:产生氢气的质量为0.2g。
22.设生铁质量为x
答:该厂理论上可日产含铁98%的生铁的质量为2714t。
23.(1)4.4;
(2)解:设碳酸钠质量为x
,
x=10.6g
该瓶固体中氢氧化钠的质量分数是:,
答:该瓶固体中氢氧化钠的质量分数是27.4%。
(3)。
24.(1)
(2)碳酸钠完全反应,使实验结果更准确
(3)解:设2.2g纯碱样品中碳酸钠的质量为x。
x=2.12g
该品牌食用纯碱中碳酸钠的质量分数=
答:2.2g纯碱样品中碳酸钠的质量是21.2g。该品牌食用纯碱中Na2CO3的质量分数是96.4%。
答案第1页,共2页
答案第1页,共2页
