高中化学苏教版(2019)选择性必修1 专题1 化学反应与能量变化 专题检测试卷(word版含解析)
文档属性
| 名称 | 高中化学苏教版(2019)选择性必修1 专题1 化学反应与能量变化 专题检测试卷(word版含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-12 23:14:41 | ||
图片预览



文档简介
专题1 化学反应与能量变化 专题检测试卷
(时间:90分钟 满分:100分)
一、选择题(本题包括18小题,每小题3分,共54分;每小题只有一个选项符合题意)
1.下列关于能量变化的说法正确的是( )
A.“冰,水为之,而寒于水”说明相同质量的水和冰相比较,冰的能量高
B.化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种
C.已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定
D.化学反应遵循质量守恒的同时,也遵循能量守恒
2.C和H2在生产、生活、科技中是非常重要的燃料。已知:
①2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1
②
下列推断正确的是( )
A.C(s)的标准燃烧热为-110.5 kJ·mol-1
B.2H2(g)+O2(g)===2H2O(g) ΔH=484 kJ·mol-1
C.C(s)+H2O(g)===CO(g)+H2(g)
ΔH=131.5 kJ·mol-1
D.将2 mol H2O(g)分解成H2(g)和O2(g),至少需要提供4×463 kJ的热量
3.下列关于反应热的叙述正确的是( )
A.当ΔH<0时,表示该反应为吸热反应
B.1 mol H2与0.5 mol O2反应放出的热量就是H2的标准燃烧热
C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D.1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应放出的热量:CH3COOH4.某同学设计如图所示实验,探究反应中的能量变化。
下列判断正确的是( )
A.由实验可知,(a)、(b)、(c)所涉及的反应都是放热反应
B.将实验(a)中的铝片更换为等质量的铝粉后释放出的热量有所增加
C.实验(c)中将环形玻璃搅拌棒改为铁质搅拌器对实验结果没有影响
D.若用NaOH固体代替NaOH溶液与盐酸反应测定中和反应的反应热,则测定数值偏高
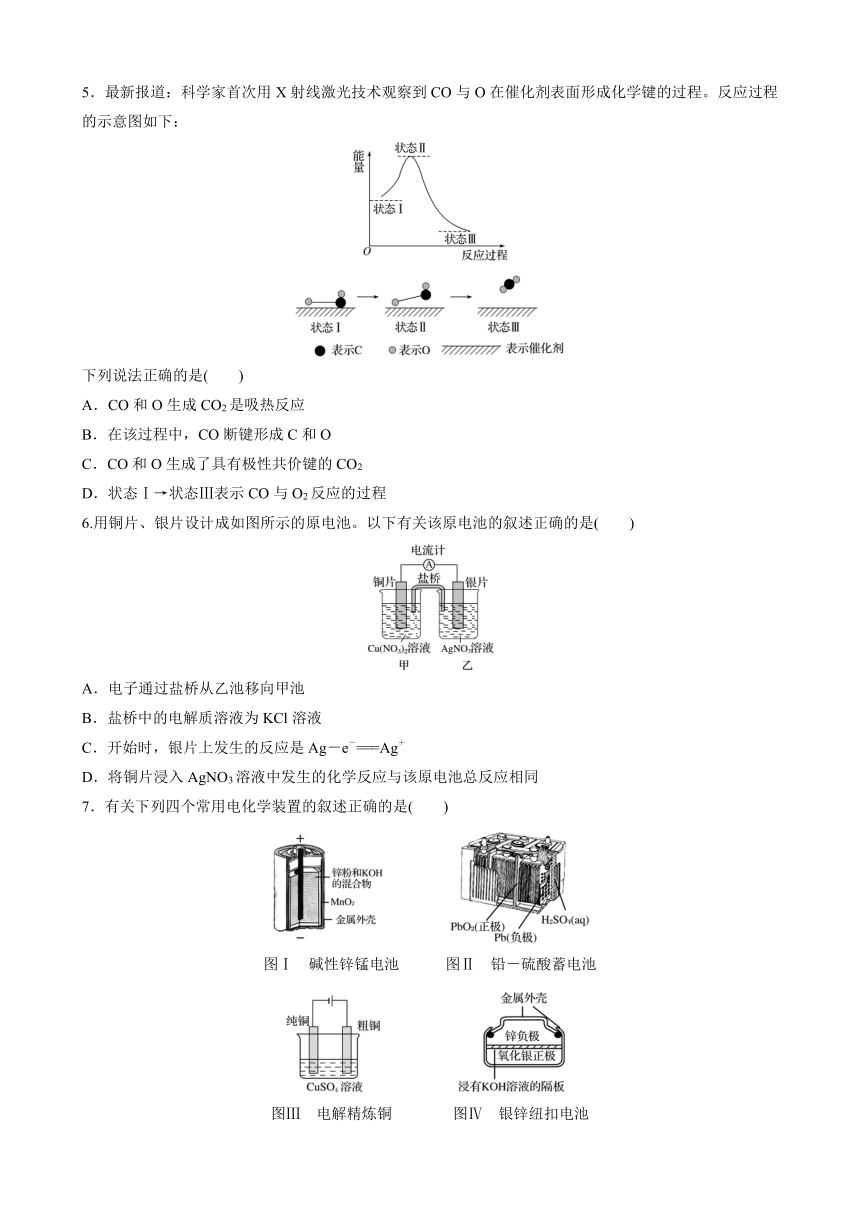
5.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
下列说法正确的是( )
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
6.用铜片、银片设计成如图所示的原电池。以下有关该原电池的叙述正确的是( )
A.电子通过盐桥从乙池移向甲池
B.盐桥中的电解质溶液为KCl溶液
C.开始时,银片上发生的反应是Ag-e-===Ag+
D.将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同
7.有关下列四个常用电化学装置的叙述正确的是( )
图Ⅰ 碱性锌锰电池 图Ⅱ 铅-硫酸蓄电池
图Ⅲ 电解精炼铜 图Ⅳ 银锌纽扣电池
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液浓度始终不变
D.图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中被还原为Ag
8.下列关于如图装置说法正确的是( )
A.装置中电子移动的途径是:负极→Fe→M溶液→石墨→正极
B.若M为NaCl溶液,通电一段时间后,溶液中可能有NaClO
C.若M为FeCl2溶液,可以实现石墨上镀铁
D.若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
9.用铂(惰性)电极进行电解,下列说法正确的是( )
A.电解NaOH溶液时,溶液的pH减小
B.电解H2SO4溶液时,在阳极和阴极析出产物的物质的量之比为2∶1
C.电解饱和Na2SO4溶液时,溶液浓度将增大,pH不变
D.电解CuCl2溶液时,溶液浓度将减小
10.通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是( )
①C(s)+H2O(g)===CO(g)+H2(g) ΔH1=a kJ·mol-1
②CO(g)+H2O(g)===CO2(g)+H2(g)
ΔH2=b kJ·mol-1
③CO2(g)+3H2(g)===CH3OH(g)+H2O(g)
ΔH3=c kJ·mol-1
④2CH3OH(g)===CH3OCH3(g)+H2O(g)
ΔH4=d kJ·mol-1
A.反应①、②为反应③提供原料气
B.反应③也是CO2资源化利用的方法之一
C.反应CH3OH(g)===CH3OCH3(g)+H2O(l)的ΔH= kJ·mol-1
D.反应2CO(g)+4H2(g)===CH3OCH3(g)+H2O(g)的ΔH=(2b+2c+d) kJ·mol-1
11.已知下列热化学方程式:
Zn(s)+O2(g)===ZnO(s)
ΔH1=-351.1 kJ·mol-1
Hg(l)+O2(g)===HgO(s)
ΔH2=-90.7 kJ·mol-1
由此可知Zn(s)+HgO(s)===ZnO(s)+Hg(l) ΔH3,其中ΔH3是( )
A.-441.8 kJ·mol-1 B.-254.6 kJ·mol-1
C.-438.9 kJ·mol-1 D.-260.4 kJ·mol-1
12.如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700~900 ℃时,O2-可在该固体氧化物电解质中自由移动,反应物、生成物均为无毒无害的物质。下列说法正确的是( )
A.电池内的O2-由电极乙移向电极甲
B.电池总反应为N2H4+2O2===2NO+2H2O
C.当电极甲上消耗1 mol N2H4时,电极乙上有22.4 L O2参与反应
D.电池外电路的电子由电极乙移向电极甲
13.某学术刊物介绍了一种新型中温全瓷铁—空气电池,其结构如图所示。
下列有关该电池放电时的说法正确的是( )
A.O2-由b极移向a极
B.正极的电极反应式为FeOx+2xe-===Fe+xO2-
C.铁表面发生的反应为xH2O(g)+Fe===FeOx+xH2
D.若有22.4 L(标准状况)空气参与反应,则电路中有4 mol电子转移
14.2018年我国科学家成功研制出铝—石墨烯电池。若手机使用该电池,1.1 s即充满电并可连续使用半个月。电池的电解质为铝基离子液体(BMIM和AlCl3按一定比例配制而成),主要阴离子为AlCl、Al2Cl,其电池如图所示。下列说法正确的是( )
A.放电时,石墨烯作电池正极,发生氧化反应
B.放电时,铝电极的电极反应式为Al-3e-+7AlCl===4Al2Cl
C.充电时,Al与电源正极相连
D.放电时,AlCl、Al2Cl向石墨烯移动
15.关于下列各装置图的叙述不正确的是( )
A.用图①装置实现铁上镀铜,a极为铜,电解质溶液可以是CuSO4溶液
B.图②装置盐桥中KCl的Cl-移向右烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
16.由于具有超低耗电量、寿命长的特点,LED产品越来越受欢迎,下图是氢氧燃料电池驱动LED发光的装置。下列有关叙述正确的是( )
A.电池负极电极反应式为H2-2e-+2OH-===2H2O
B.a处通入氧气,b处通入氢气
C.该装置中能量转化只涉及两种形式的能量转化
D.P型半导体连接的是电池负极
17.在K2Cr2O7存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如图所示,下列说法错误的是( )
A.负极的电极反应式为C6H5OH-28e-+11H2O===6CO2↑+28H+
B.电路中每转移3 mol电子,正极生成103 g Cr(OH)3
C.装置工作一段时间后,中间室中NaCl溶液的浓度将减小
D.反应温度越高,该装置处理含苯酚废水的效率越高
18.工业上电解NaHSO4溶液制备Na2S2O8。电解时,阴极材料为Pb;阳极(铂电极)电极反应式为2HSO-2e-===S2O+2H+。下列说法正确的是( )
A.阴极电极反应式为Pb+HSO-2e-===PbSO4+H+
B.阳极反应中S的化合价升高
C.S2O中既存在非极性键又存在极性键
D.可以用铜电极作阳极
二、非选择题(本题包括4小题,共46分)
19.(10分)(1)S8分子可形成单斜硫和斜方硫,转化过程如下:S(单斜,s)S(斜方,s) ΔH=-0.398 kJ·mol-1,则S(单斜,s)、S(斜方,s)相比,较稳定的是______[填“S(单斜,s)”或“S(斜方,s)”]。
(2)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1)
化学键 H—H H—Cl
键能 436 431
热化学方程式:H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ·mol-1,则Cl—Cl的键能为________kJ·mol-1。
(3)标准状况下,6.72 L C2H2(g)在O2(g)中完全燃烧生成CO2(g)和H2O(l),放出389.7 kJ热量,请写出表示C2H2标准燃烧热的热化学方程式:_________________________________
________________________________________________________________________。
(4)已知:C(石墨,s)+ O2(g)===CO2(g)
ΔH1=-a kJ·mol-1
H2(g)+O2(g)===H2O(l) ΔH2=-b kJ·mol-1
CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH3=-c kJ·mol-1
计算C(石墨,s)与H2(g)反应生成1 mol CH4(g)的ΔH为________kJ·mol-1 (用含a、b、c的式子表示)。
(5)由N2O和NO反应生成N2和NO2的能量变化如图所示。则反应过程中,每生成2 mol N2理论上放出的热量为________。
20.(10分)铅酸蓄电池是典型的可充电电池,电池总反应式为Pb+PbO2+2H2SO42PbSO4+2H2O。
请回答下列问题:
(1)放电时,正极的电极反应式是__________________。电解液中H2SO4的浓度将变________,当外电路通过1 mol电子时,理论上负极板的质量增加________ g,电池中消耗的硫酸物质的量为________。
(2)在完全放电耗尽PbO2和Pb时,若按图示连接,外加电源充电一段时间后,则在A电极上生成________。B电极上生成________,充电完成后,重新放电,A电极为________极。
21.(12分)铁、铝及其化合物在生产和生活中有着广泛的应用。
(1)某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护。
为防止金属Fe被腐蚀,可以采用上述________(填装置序号)装置原理进行防护;装置③中总反应的离子方程式为__________________________________________________________。
(2)用甲烷或其他有机物、氧气为原料可设计成原电池,以CnH2nOn、O2为原料,硫酸溶液为电解质设计成燃料电池,则负极的电极反应式为__________________________________。
(3)图1是在金属锌板上贴上一张用某溶液浸湿的滤纸,图2是NaBH4/H2O2燃料电池。
图2电池负极区的电极反应为________________________________________________
__________________________________________________________________________;
若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则滤纸出现________色,c位置的电极反应式为______________________________________________________,
若用KI 淀粉溶液浸湿滤纸,用导线将a、b与A、B电极相连,铅笔芯c点处出现蓝色,则b接的是________(填“A”或“B”)电极。
22.(14分)(1)绿色电源“直接二甲醚燃料电池”的工作原理示意图如图所示:
正极为________(填“A电极”或“B电极”),H+移动方向为由________到________(填“A”或“B”),写出A电极的电极反应式:____________________________________。
(2)SO2和NOx是主要大气污染物,利用如图装置可同时吸收SO2和NO。
①a是直流电源的________极。
②已知电解池的阴极室中溶液的pH在4~7之间,阴极的电极反应为________________________________________________________________________。
③用离子方程式表示吸收NO的原理__________________________________________
________________________________________________________________________。
(3)结合如图所示的电解装置可去除废水中的氨氮。
①a极为________。
②d极反应式为___________________________________________________________。
(4)VB2-空气电池是目前储电能力最高的电池。以VB2-空气电池为电源,用惰性电极电解硫酸铜溶液如图所示,该电池工作时的反应为4VB2+11O2===4B2O3+2V2O5,VB2极发生的电极反应为_______________________________________________________________。
当外电路中通过0.04 mol电子时,B装置内共收集到0.448 L气体(标准状况),若B装置内的液体体积为200 mL(电解前后溶液体积不变),则电解前CuSO4溶液的物质的量浓度为________ mol·L-1。
答案与解析
专题1 化学反应与能量变化 专题检测试卷
(时间:90分钟 满分:100分)
一、选择题(本题包括18小题,每小题3分,共54分;每小题只有一个选项符合题意)
1.下列关于能量变化的说法正确的是( )
A.“冰,水为之,而寒于水”说明相同质量的水和冰相比较,冰的能量高
B.化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种
C.已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定
D.化学反应遵循质量守恒的同时,也遵循能量守恒
答案 D
解析 水和冰相比较,冰的能量低,故A错误;发生化学反应时能量的变化有多种形式,可以表现为热量的变化,还可以表现为光能等,故B错误;ΔH>0说明反应吸热,所以石墨的能量较低,能量越低物质越稳定,故石墨更稳定,故C错误;化学反应遵循质量守恒的同时,也遵循能量守恒,故D正确。
2.C和H2在生产、生活、科技中是非常重要的燃料。已知:
①2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1
②
下列推断正确的是( )
A.C(s)的标准燃烧热为-110.5 kJ·mol-1
B.2H2(g)+O2(g)===2H2O(g) ΔH=484 kJ·mol-1
C.C(s)+H2O(g)===CO(g)+H2(g)
ΔH=131.5 kJ·mol-1
D.将2 mol H2O(g)分解成H2(g)和O2(g),至少需要提供4×463 kJ的热量
答案 C
解析 A项,由题意可得反应③C(s)+O2(g)===CO(g)ΔH=-110.5 kJ·mol-1,但表达C(s)的标准燃烧热时必须生成稳定的氧化物二氧化碳,故标准燃烧热不是-110.5 kJ·mol-1,错误;B项,2 mol水分子中含有4 mol H—O键,反应2H2(g)+O2(g)===2H2O(g)的ΔH=反应物的总键能-生成物的总键能=436 kJ·mol-1×2+496 kJ·mol-1-4×463 kJ·mol-1=-484 kJ·mol-1,错误;C项,③C(s)+O2(g)===CO(g) ΔH=-110.5 kJ·mol-1,④2H2(g)+O2(g)===2H2O(g) ΔH=-484 kJ·mol-1,由③-×④得:C(s)+H2O(g)===CO(g)+H2(g) ΔH=-110.5 kJ·mol-1-×(-484 kJ·mol-1)=131.5 kJ·mol-1,正确;D项,由2H2(g)+O2(g)===2H2O(g) ΔH=-484 kJ·mol-1可知,分解2 mol H2O(g),至少需要提供484 kJ的热量,错误。
3.下列关于反应热的叙述正确的是( )
A.当ΔH<0时,表示该反应为吸热反应
B.1 mol H2与0.5 mol O2反应放出的热量就是H2的标准燃烧热
C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D.1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应放出的热量:CH3COOH答案 D
解析 A项,ΔH<0表示反应为放热反应;C项,反应热等于反应物总能量与生成物总能量的差值,故与二者的能量有关;D项,CH3COOH电离时吸热。
4.某同学设计如图所示实验,探究反应中的能量变化。
下列判断正确的是( )
A.由实验可知,(a)、(b)、(c)所涉及的反应都是放热反应
B.将实验(a)中的铝片更换为等质量的铝粉后释放出的热量有所增加
C.实验(c)中将环形玻璃搅拌棒改为铁质搅拌器对实验结果没有影响
D.若用NaOH固体代替NaOH溶液与盐酸反应测定中和反应的反应热,则测定数值偏高
答案 D
解析 A项,Ba(OH)2·8H2O与NH4Cl的反应属于吸热反应,错误;B项,改为铝粉,没有改变反应的本质,放出的热量不变,错误;C项,铁质搅拌器导热性好,热量损失较大,错误;D项,NaOH固体溶于水时放热,正确。
5.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
下列说法正确的是( )
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
答案 C
解析 A项,由能量—反应过程图像中状态Ⅰ和状态Ⅲ知,CO和O生成CO2是放热反应,错误;B项,由状态Ⅱ知,在CO与O生成CO2的过程中CO没有断键形成C和O,错误;C项,由状态Ⅲ及CO2的结构式O==C==O知,CO2分子中存在碳氧极性共价键,正确;D项,由能量—反应过程图像中状态Ⅰ(CO和O)和状态Ⅲ(CO2)分析,状态Ⅰ→状态Ⅲ表示CO和O原子反应生成CO2的过程,错误。
6.用铜片、银片设计成如图所示的原电池。以下有关该原电池的叙述正确的是( )
A.电子通过盐桥从乙池移向甲池
B.盐桥中的电解质溶液为KCl溶液
C.开始时,银片上发生的反应是Ag-e-===Ag+
D.将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同
答案 D
解析 电子不能通过电解质溶液,故A错误;乙烧杯中的电解质溶液为AgNO3溶液,能和KCl反应生成AgCl沉淀,堵塞盐桥,故B错误;铜片是负极,银片是正极,在银片上发生的反应式是Ag++e-===Ag,故C错误;该原电池的负极是铜,电极反应式为Cu-2e-===Cu2+,正极是银,电极反应式为2Ag++2e-===2Ag,两极的反应式相加得到总反应式:Cu+2Ag+===Cu2++2Ag,将铜片浸入AgNO3溶液中发生的化学反应也是铜置换银,故D正确。
7.(2020·福建平和中学高二月考)有关下列四个常用电化学装置的叙述正确的是( )
图Ⅰ 碱性锌锰电池 图Ⅱ 铅-硫酸蓄电池
图Ⅲ 电解精炼铜 图Ⅳ 银锌纽扣电池
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液浓度始终不变
D.图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中被还原为Ag
答案 D
解析 该电池反应中MnO2得到电子被还原,为原电池的正极,故A错误;铅蓄电池放电时电池反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O, 该反应中有H2SO4参加反应,导致硫酸的浓度降低,故B错误;粗铜中不仅含有铜,还含有其他金属,电解时,粗铜中有铜和其他金属失电子,纯铜上只有Cu2+得电子,所以阴极上析出的铜大于阳极上减少的铜,溶液中Cu2+浓度减小,故C错误。
8.下列关于如图装置说法正确的是( )
A.装置中电子移动的途径是:负极→Fe→M溶液→石墨→正极
B.若M为NaCl溶液,通电一段时间后,溶液中可能有NaClO
C.若M为FeCl2溶液,可以实现石墨上镀铁
D.若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
答案 B
9.(2020·南昌市第一中学高二期末)用铂(惰性)电极进行电解,下列说法正确的是( )
A.电解NaOH溶液时,溶液的pH减小
B.电解H2SO4溶液时,在阳极和阴极析出产物的物质的量之比为2∶1
C.电解饱和Na2SO4溶液时,溶液浓度将增大,pH不变
D.电解CuCl2溶液时,溶液浓度将减小
答案 D
解析 电解氢氧化钠溶液时,实质上是电解水,溶剂的质量减少,溶质的质量不变,所以溶液的浓度增大,氢氧根离子的浓度增大,溶液的pH增大,选项A错误;电解H2SO4溶液,实质是电解水,阳极生成氧气,阴极生成氢气,根据得失电子守恒,阳极和阴极析出产物的物质的量之比为1∶2,选项B错误;电解饱和硫酸钠溶液时,阴极上氢离子放电、阳极上氢氧根离子放电,相当于电解水,溶液过饱和析出晶体,浓度不变,硫酸钠是强酸强碱盐,其溶液呈中性,pH不变,选项C错误;电解CuCl2 溶液的实质是电解电解质本身,CuCl2溶液浓度将减小,选项D正确。
10.通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是( )
①C(s)+H2O(g)===CO(g)+H2(g) ΔH1=a kJ·mol-1
②CO(g)+H2O(g)===CO2(g)+H2(g)
ΔH2=b kJ·mol-1
③CO2(g)+3H2(g)===CH3OH(g)+H2O(g)
ΔH3=c kJ·mol-1
④2CH3OH(g)===CH3OCH3(g)+H2O(g)
ΔH4=d kJ·mol-1
A.反应①、②为反应③提供原料气
B.反应③也是CO2资源化利用的方法之一
C.反应CH3OH(g)===CH3OCH3(g)+H2O(l)的ΔH= kJ·mol-1
D.反应2CO(g)+4H2(g)===CH3OCH3(g)+H2O(g)的ΔH=(2b+2c+d) kJ·mol-1
答案 C
解析 反应③中的反应物为CO2、H2,由反应可知,反应①、②为反应③提供原料气,故A正确;反应③中的反应物为CO2,转化为甲醇,则反应③也是CO2资源化利用的方法之一,故B正确;由反应④可知,物质的量与热量成正比,且气态水的能量比液态水的能量高,则反应CH3OH(g)===CH3OCH3(g)+H2O(l)的ΔH≠ kJ·mol-1,故C错误;由盖斯定律可知,②×2+③×2+④得到2CO(g)+4H2(g)===CH3OCH3(g)+H2O(g),则ΔH=(2b+2c+d) kJ·mol-1,故D正确。
11.已知下列热化学方程式:
Zn(s)+O2(g)===ZnO(s)
ΔH1=-351.1 kJ·mol-1
Hg(l)+O2(g)===HgO(s)
ΔH2=-90.7 kJ·mol-1
由此可知Zn(s)+HgO(s)===ZnO(s)+Hg(l) ΔH3,其中ΔH3是( )
A.-441.8 kJ·mol-1 B.-254.6 kJ·mol-1
C.-438.9 kJ·mol-1 D.-260.4 kJ·mol-1
答案 D
解析 将两个已知反应自上而下分别标作①和②,根据盖斯定律①-②得Zn(s)+HgO(s)===ZnO(s)+Hg(l)ΔH3=-351.1 kJ·mol-1+90.7 kJ·mol-1=-260.4 kJ·mol-1。即D项正确。
12.如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700~900 ℃时,O2-可在该固体氧化物电解质中自由移动,反应物、生成物均为无毒无害的物质。下列说法正确的是( )
A.电池内的O2-由电极乙移向电极甲
B.电池总反应为N2H4+2O2===2NO+2H2O
C.当电极甲上消耗1 mol N2H4时,电极乙上有22.4 L O2参与反应
D.电池外电路的电子由电极乙移向电极甲
答案 A
解析 A项,在原电池内部,阴离子向负极移动,阳离子向正极移动,该装置中电极甲为负极,电极乙为正极,所以O2-由电极乙移向电极甲,正确;B项,电池的总反应为N2H4+O2===N2+2H2O,错误;C项,当电极甲上有1 mol N2H4消耗时,转移4 mol电子,根据得失电子守恒知,电极乙上有1 mol O2参与反应,在标准状况下O2的体积为22.4 L,题目中没有指明标准状况,错误;D项,在外电路中,电子由负极(甲)移向正极(乙),错误。
13.某学术刊物介绍了一种新型中温全瓷铁—空气电池,其结构如图所示。
下列有关该电池放电时的说法正确的是( )
A.O2-由b极移向a极
B.正极的电极反应式为FeOx+2xe-===Fe+xO2-
C.铁表面发生的反应为xH2O(g)+Fe===FeOx+xH2
D.若有22.4 L(标准状况)空气参与反应,则电路中有4 mol电子转移
答案 C
解析 由新型中温全瓷铁—空气电池的装置图可知,a极空气中氧气得电子发生还原反应为正极,铁与水反应生成氢气,氢气在b极失电子发生氧化反应为负极。在原电池中,阴离子向负极移动,O2-由a极移向b极,A项错误;a极空气中的氧气得电子发生还原反应,为正极,电极反应式为O2+4e-===2O2-,B项错误;由新型中温全瓷铁—空气电池的装置图可知,铁表面发生的反应为xH2O(g)+Fe===FeOx+xH2,C项正确;有22.4 L(标准状况)空气参与反应,则氧气为×=0.2 mol,则电路中转移0.8 mol电子,D项错误。
14.(2020·济南期末)2018年我国科学家成功研制出铝—石墨烯电池。若手机使用该电池,1.1 s即充满电并可连续使用半个月。电池的电解质为铝基离子液体(BMIM和AlCl3按一定比例配制而成),主要阴离子为AlCl、Al2Cl,其电池如图所示。下列说法正确的是( )
A.放电时,石墨烯作电池正极,发生氧化反应
B.放电时,铝电极的电极反应式为Al-3e-+7AlCl===4Al2Cl
C.充电时,Al与电源正极相连
D.放电时,AlCl、Al2Cl向石墨烯移动
答案 B
解析 放电时是原电池,Al作负极,发生氧化反应,石墨烯作正极,发生还原反应,故A错误;根据题意可知,电池中主要阴离子为AlCl、Al2Cl,且Al作负极,失去电子,电极反应式为Al-3e-+7AlCl===4Al2Cl,故B正确;充电时,阴极得电子生成Al,所以Al应该连接电源负极,故C错误;放电时,阳离子向正极移动,阴离子向负极移动,即阴离子(AlCl、Al2Cl)向Al移动,故D错误。
15.(2020·重庆期末)关于下列各装置图的叙述不正确的是( )
A.用图①装置实现铁上镀铜,a极为铜,电解质溶液可以是CuSO4溶液
B.图②装置盐桥中KCl的Cl-移向右烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
答案 B
解析 根据电流方向知a为电解池的阳极,要实现铁上镀铜,则铜为阳极,电解质溶液可以是CuSO4溶液,故A项正确;图②装置是原电池,Zn为负极,Cu为正极,在原电池内,阴离子移向负极,故B项错误;要保护钢闸门不受腐蚀,钢闸门应该连在电源的负极上,故C项正确;左边装置的负极反应式为Al-3e-===Al3+,右边装置的负极反应式为Zn-2e-===Zn2+,这两个装置中通过相同数目的电子时,消耗的负极材料的物质的量之比应该为2∶3,故D项正确。
16.(2020·合肥高二期末)由于具有超低耗电量、寿命长的特点,LED产品越来越受欢迎,下图是氢氧燃料电池驱动LED发光的装置。下列有关叙述正确的是( )
A.电池负极电极反应式为H2-2e-+2OH-===2H2O
B.a处通入氧气,b处通入氢气
C.该装置中能量转化只涉及两种形式的能量转化
D.P型半导体连接的是电池负极
答案 A
解析 根据LED发光二极管中电子移动方向可判断N型半导体与电池负极相连,H2在负极反应,电解质溶液为KOH溶液,负极电极反应式为H2-2e-+2OH-===2H2O,A正确;a处为负极,应该通入氢气,b处通入氧气,B错误;该装置主要涉及化学能、电能、光能三种形式的能量转化,C错误;P型半导体与电池正极相连,D错误。
17.(2021·百师联盟复习联考)在K2Cr2O7存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如图所示,下列说法错误的是( )
A.负极的电极反应式为C6H5OH-28e-+11H2O===6CO2↑+28H+
B.电路中每转移3 mol电子,正极生成103 g Cr(OH)3
C.装置工作一段时间后,中间室中NaCl溶液的浓度将减小
D.反应温度越高,该装置处理含苯酚废水的效率越高
答案 D
解析 由图可知,负极发生氧化反应,C6H5OH失电子生成CO2,电极反应式为C6H5OH-28e-+11H2O===6CO2↑+28H+,A项正确;正极K2Cr2O7被还原为Cr(OH)3,生成1 mol Cr(OH)3转移3 mol电子,1 mol Cr(OH)3的质量为103 g,B项正确;负极产生的H+通过阳离子交换膜进入中间室,正极产生的OH-通过阴离子交换膜也进入中间室,H+和OH-反应生成水,溶液体积增大,NaCl溶液的浓度将减小,C项正确;负极利用微生物实现将苯酚氧化为CO2,温度过高,则微生物失去活性,处理废水效率下降,D项错误。
18.(2020·山东等级模拟考,11)工业上电解NaHSO4溶液制备Na2S2O8。电解时,阴极材料为Pb;阳极(铂电极)电极反应式为2HSO-2e-===S2O+2H+。下列说法正确的是( )
A.阴极电极反应式为Pb+HSO-2e-===PbSO4+H+
B.阳极反应中S的化合价升高
C.S2O中既存在非极性键又存在极性键
D.可以用铜电极作阳极
答案 C
解析 Na2S2O8的结构式为,由此结构可以判断出以下信息:S2O中含硫氧极性键和氧氧非极性键;S的化合价仍为+6价,中间的两个O原子均为-1价,其他的O原子均为-2价;电解时阳极的HSO中O失去电子,S未变价;阴极电极反应式为2H++2e-===H2↑;若用铜作阳极,则阳极反应为Cu-2e-===Cu2+,综上所述,故选C。
二、非选择题(本题包括4小题,共46分)
19.(10分)(1)S8分子可形成单斜硫和斜方硫,转化过程如下:S(单斜,s)S(斜方,s) ΔH=-0.398 kJ·mol-1,则S(单斜,s)、S(斜方,s)相比,较稳定的是______[填“S(单斜,s)”或“S(斜方,s)”]。
(2)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1)
化学键 H—H H—Cl
键能 436 431
热化学方程式:H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ·mol-1,则Cl—Cl的键能为________kJ·mol-1。
(3)标准状况下,6.72 L C2H2(g)在O2(g)中完全燃烧生成CO2(g)和H2O(l),放出389.7 kJ热量,请写出表示C2H2标准燃烧热的热化学方程式:_________________________________
________________________________________________________________________。
(4)已知:C(石墨,s)+ O2(g)===CO2(g)
ΔH1=-a kJ·mol-1
H2(g)+O2(g)===H2O(l) ΔH2=-b kJ·mol-1
CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH3=-c kJ·mol-1
计算C(石墨,s)与H2(g)反应生成1 mol CH4(g)的ΔH为________kJ·mol-1 (用含a、b、c的式子表示)。
(5)由N2O和NO反应生成N2和NO2的能量变化如图所示。则反应过程中,每生成2 mol N2理论上放出的热量为________。
答案 (1)S(斜方,s) (2)243 (3)C2H2(g)+O2(g)===2CO2(g)+H2O(l) ΔH=-1 299.0 kJ·mol-1 (4)c-2b-a (5)278 kJ
解析 (1)能量越高越不稳定,根据热化学方程式可知,S(单斜,s)S(斜方,s) ΔH=-0.398 kJ·mol-1,S(单斜,s)能量高于S(斜方,s),所以S(斜方,s)较稳定。
(2)根据已知条件可知,(431×2) kJ·mol-1-[436 kJ·mol-1+E(Cl—Cl)]=183 kJ·mol-1,计算可得到Cl—Cl的键能为243 kJ·mol-1。
(3)标准状况下,6.72 L C2H2(g)的物质的量为0.3 mol,则C2H2标准燃烧热的热化学方程式:C2H2(g)+O2(g)===2CO2(g)+H2O(l) ΔH=-=-1 299.0 kJ·mol-1。
(4)根据盖斯定律,C(石墨,s)与H2(g)反应生成1 mol CH4(g)的热化学方程式为C(石墨,s)+2H2(g)===CH4(g) ΔH=ΔH1+2ΔH2-ΔH3=[-a+2×(-b)-(-c)]kJ·mol-1=(c-2b-a)kJ·mol-1。
(5)根据能量变化图可知,热化学方程式为N2O(g)+NO(g)===N2(g)+NO2(g) ΔH=(209-348)kJ·mol-1= -139 kJ·mol-1,则反应过程中,每生成2 mol N2理论上放出的热量为278 kJ。
20.(10分)铅酸蓄电池是典型的可充电电池,电池总反应式为Pb+PbO2+2H2SO42PbSO4+2H2O。
请回答下列问题:
(1)放电时,正极的电极反应式是__________________。电解液中H2SO4的浓度将变________,当外电路通过1 mol电子时,理论上负极板的质量增加________ g,电池中消耗的硫酸物质的量为________。
(2)在完全放电耗尽PbO2和Pb时,若按图示连接,外加电源充电一段时间后,则在A电极上生成________。B电极上生成________,充电完成后,重新放电,A电极为________极。
答案 (1)PbO2+2e-+4H++SO===PbSO4+2H2O
小 48 1 mol (2)Pb PbO2 负
解析 (1)电池总反应式:Pb+PbO2+2H2SO42PbSO4+2H2O,负极:Pb-2e-+SO===PbSO4,正极:PbO2+2e-+4H++SO===PbSO4+2H2O;电解液中H2SO4的浓度将减小;当外电路通过1 mol电子时,依据电子守恒计算理论上负极板的质量增加0.5 mol×303 g·mol-1-0.5 mol×207 g·mol-1=48 g。
(2)在完全放电耗尽PbO2和Pb时,电极上析出的是PbSO4,若按题图连接电源,B为阳极应是失去电子发生氧化反应,A为阴极是得到电子发生还原反应,实质是电解反应,B电极上发生反应为PbSO4+2H2O-2e-===PbO2+4H++SO,A电极发生反应为PbSO4+2e-===Pb+SO,所以A电极上生成Pb,B电极上生成PbO2。
21.(12分)铁、铝及其化合物在生产和生活中有着广泛的应用。
(1)某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护。
为防止金属Fe被腐蚀,可以采用上述________(填装置序号)装置原理进行防护;装置③中总反应的离子方程式为__________________________________________________________。
(2)用甲烷或其他有机物、氧气为原料可设计成原电池,以CnH2nOn、O2为原料,硫酸溶液为电解质设计成燃料电池,则负极的电极反应式为__________________________________。
(3)图1是在金属锌板上贴上一张用某溶液浸湿的滤纸,图2是NaBH4/H2O2燃料电池。
图2电池负极区的电极反应为________________________________________________
__________________________________________________________________________;
若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则滤纸出现________色,c位置的电极反应式为______________________________________________________,
若用KI 淀粉溶液浸湿滤纸,用导线将a、b与A、B电极相连,铅笔芯c点处出现蓝色,则b接的是________(填“A”或“B”)电极。
答案 (1)②③ 2Cl-+2H2O2OH-+Cl2↑+H2↑
(2)CnH2nOn-4ne-+nH2O===nCO2+4nH+
(3)BH-8e-+8OH-===BO+6H2O 红
O2+2H2O+4e-===4OH- B
解析 (1)①装置为原电池,铁为负极,被腐蚀;②装置为原电池,锌为负极被腐蚀,铁作正极被保护;③装置为电解池,铁作阴极被保护。装置③中铁被保护,实际是电解饱和食盐水,生成氢氧化钠、氢气和氯气,离子方程式为2Cl-+2H2O2OH-+Cl2↑+H2↑。
(2)燃料电池中燃料作负极,反应失去电子,在酸性条件下生成二氧化碳,电极反应式为CnH2nOn-4ne-+nH2O=== nCO2+4nH+。
(3)NaBH4/H2O2燃料电池中负极为BH发生氧化反应,电极反应式为BH-8e-+8OH-===BO+6H2O,即A为负极,B为正极。若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,形成原电池,锌失去电子,铅笔芯为正极,氧气得到电子,在该电极生成氢氧化钠,使酚酞变红色;c点的电极反应式是O2+2H2O+4e-===4OH-;若用KI 淀粉溶液浸湿滤纸,c处出现蓝色,则c处发生反应2I--2e-===I2,c为阳极,则b接电池正极,因为A是负极,B是正极,所以b连接B电极。
22.(14分)(1)绿色电源“直接二甲醚燃料电池”的工作原理示意图如图所示:
正极为________(填“A电极”或“B电极”),H+移动方向为由________到________(填“A”或“B”),写出A电极的电极反应式:____________________________________。
(2)SO2和NOx是主要大气污染物,利用如图装置可同时吸收SO2和NO。
①a是直流电源的________极。
②已知电解池的阴极室中溶液的pH在4~7之间,阴极的电极反应为________________________________________________________________________。
③用离子方程式表示吸收NO的原理__________________________________________
________________________________________________________________________。
(3)结合如图所示的电解装置可去除废水中的氨氮。
①a极为________。
②d极反应式为___________________________________________________________。
(4)VB2-空气电池是目前储电能力最高的电池。以VB2-空气电池为电源,用惰性电极电解硫酸铜溶液如图所示,该电池工作时的反应为4VB2+11O2===4B2O3+2V2O5,VB2极发生的电极反应为_______________________________________________________________。
当外电路中通过0.04 mol电子时,B装置内共收集到0.448 L气体(标准状况),若B装置内的液体体积为200 mL(电解前后溶液体积不变),则电解前CuSO4溶液的物质的量浓度为________ mol·L-1。
答案 (1)B电极 A B CH3OCH3+3H2O-12e-===2CO2+12H+
(2)①负 ②2HSO+2H++2e-===S2O+2H2O ③2NO+2S2O+2H2O===N2+4HSO
(3)①负极 ②Cl--2e-+H2O===H++HClO
(4)2VB2+22OH--22e-===V2O5+2B2O3+11H2O 0.05
解析 (1)燃料电池中通入燃料的一极为负极,即A为负极,负极上二甲醚失电子生成二氧化碳和氢离子,则负极的电极反应式为CH3OCH3+3H2O-12e-===2CO2+12H+,通入氧气的一极为正极,即B电极为正极;溶液中阳离子向正极移动,即H+从A移向B。(2)由图中信息可知,与a相连的电极上,HSO被还原为S2O,所以a电极为电源的负极,b为正极。②已知电解池的阴极室中溶液的pH在4~7之间,溶液显酸性,所以阴极的电极反应式为2HSO+2H++2e-===S2O+2H2O。③吸收NO的原理是NO与S2O反应生成氮气和HSO,离子方程式为2NO+2S2O+2H2O===N2+4HSO。
(3)由图可知,电解时Cl-失去电子转化为HClO,HClO可氧化NH3生成N2,则d连接电源正极为阳极,a为负极,阳极反应式为Cl--2e-+H2O===H++HClO。(4)该电池工作时的反应为4VB2+11O2===4B2O3+2V2O5,碱性条件下,VB2极发生氧化反应,反应得到B2O3、V2O5,有OH-参与反应,同时有H2O生成,电极反应式为2VB2+22OH--22e-===V2O5+2B2O3+11H2O;B装置为电解池,阳极生成氧气,根据电子转移守恒可知生成氧气的物质的量为=0.01 mol,生成气体总物质的量为=0.02 mol,故生成氢气的物质的量为0.01 mol,由电子转移守恒知,电解前CuSO4的物质的量为=0.01 mol,故电解前CuSO4溶液的物质的量浓度为=0.05 mol·L-1。
(时间:90分钟 满分:100分)
一、选择题(本题包括18小题,每小题3分,共54分;每小题只有一个选项符合题意)
1.下列关于能量变化的说法正确的是( )
A.“冰,水为之,而寒于水”说明相同质量的水和冰相比较,冰的能量高
B.化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种
C.已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定
D.化学反应遵循质量守恒的同时,也遵循能量守恒
2.C和H2在生产、生活、科技中是非常重要的燃料。已知:
①2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1
②
下列推断正确的是( )
A.C(s)的标准燃烧热为-110.5 kJ·mol-1
B.2H2(g)+O2(g)===2H2O(g) ΔH=484 kJ·mol-1
C.C(s)+H2O(g)===CO(g)+H2(g)
ΔH=131.5 kJ·mol-1
D.将2 mol H2O(g)分解成H2(g)和O2(g),至少需要提供4×463 kJ的热量
3.下列关于反应热的叙述正确的是( )
A.当ΔH<0时,表示该反应为吸热反应
B.1 mol H2与0.5 mol O2反应放出的热量就是H2的标准燃烧热
C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D.1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应放出的热量:CH3COOH
下列判断正确的是( )
A.由实验可知,(a)、(b)、(c)所涉及的反应都是放热反应
B.将实验(a)中的铝片更换为等质量的铝粉后释放出的热量有所增加
C.实验(c)中将环形玻璃搅拌棒改为铁质搅拌器对实验结果没有影响
D.若用NaOH固体代替NaOH溶液与盐酸反应测定中和反应的反应热,则测定数值偏高
5.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
下列说法正确的是( )
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
6.用铜片、银片设计成如图所示的原电池。以下有关该原电池的叙述正确的是( )
A.电子通过盐桥从乙池移向甲池
B.盐桥中的电解质溶液为KCl溶液
C.开始时,银片上发生的反应是Ag-e-===Ag+
D.将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同
7.有关下列四个常用电化学装置的叙述正确的是( )
图Ⅰ 碱性锌锰电池 图Ⅱ 铅-硫酸蓄电池
图Ⅲ 电解精炼铜 图Ⅳ 银锌纽扣电池
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液浓度始终不变
D.图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中被还原为Ag
8.下列关于如图装置说法正确的是( )
A.装置中电子移动的途径是:负极→Fe→M溶液→石墨→正极
B.若M为NaCl溶液,通电一段时间后,溶液中可能有NaClO
C.若M为FeCl2溶液,可以实现石墨上镀铁
D.若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
9.用铂(惰性)电极进行电解,下列说法正确的是( )
A.电解NaOH溶液时,溶液的pH减小
B.电解H2SO4溶液时,在阳极和阴极析出产物的物质的量之比为2∶1
C.电解饱和Na2SO4溶液时,溶液浓度将增大,pH不变
D.电解CuCl2溶液时,溶液浓度将减小
10.通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是( )
①C(s)+H2O(g)===CO(g)+H2(g) ΔH1=a kJ·mol-1
②CO(g)+H2O(g)===CO2(g)+H2(g)
ΔH2=b kJ·mol-1
③CO2(g)+3H2(g)===CH3OH(g)+H2O(g)
ΔH3=c kJ·mol-1
④2CH3OH(g)===CH3OCH3(g)+H2O(g)
ΔH4=d kJ·mol-1
A.反应①、②为反应③提供原料气
B.反应③也是CO2资源化利用的方法之一
C.反应CH3OH(g)===CH3OCH3(g)+H2O(l)的ΔH= kJ·mol-1
D.反应2CO(g)+4H2(g)===CH3OCH3(g)+H2O(g)的ΔH=(2b+2c+d) kJ·mol-1
11.已知下列热化学方程式:
Zn(s)+O2(g)===ZnO(s)
ΔH1=-351.1 kJ·mol-1
Hg(l)+O2(g)===HgO(s)
ΔH2=-90.7 kJ·mol-1
由此可知Zn(s)+HgO(s)===ZnO(s)+Hg(l) ΔH3,其中ΔH3是( )
A.-441.8 kJ·mol-1 B.-254.6 kJ·mol-1
C.-438.9 kJ·mol-1 D.-260.4 kJ·mol-1
12.如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700~900 ℃时,O2-可在该固体氧化物电解质中自由移动,反应物、生成物均为无毒无害的物质。下列说法正确的是( )
A.电池内的O2-由电极乙移向电极甲
B.电池总反应为N2H4+2O2===2NO+2H2O
C.当电极甲上消耗1 mol N2H4时,电极乙上有22.4 L O2参与反应
D.电池外电路的电子由电极乙移向电极甲
13.某学术刊物介绍了一种新型中温全瓷铁—空气电池,其结构如图所示。
下列有关该电池放电时的说法正确的是( )
A.O2-由b极移向a极
B.正极的电极反应式为FeOx+2xe-===Fe+xO2-
C.铁表面发生的反应为xH2O(g)+Fe===FeOx+xH2
D.若有22.4 L(标准状况)空气参与反应,则电路中有4 mol电子转移
14.2018年我国科学家成功研制出铝—石墨烯电池。若手机使用该电池,1.1 s即充满电并可连续使用半个月。电池的电解质为铝基离子液体(BMIM和AlCl3按一定比例配制而成),主要阴离子为AlCl、Al2Cl,其电池如图所示。下列说法正确的是( )
A.放电时,石墨烯作电池正极,发生氧化反应
B.放电时,铝电极的电极反应式为Al-3e-+7AlCl===4Al2Cl
C.充电时,Al与电源正极相连
D.放电时,AlCl、Al2Cl向石墨烯移动
15.关于下列各装置图的叙述不正确的是( )
A.用图①装置实现铁上镀铜,a极为铜,电解质溶液可以是CuSO4溶液
B.图②装置盐桥中KCl的Cl-移向右烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
16.由于具有超低耗电量、寿命长的特点,LED产品越来越受欢迎,下图是氢氧燃料电池驱动LED发光的装置。下列有关叙述正确的是( )
A.电池负极电极反应式为H2-2e-+2OH-===2H2O
B.a处通入氧气,b处通入氢气
C.该装置中能量转化只涉及两种形式的能量转化
D.P型半导体连接的是电池负极
17.在K2Cr2O7存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如图所示,下列说法错误的是( )
A.负极的电极反应式为C6H5OH-28e-+11H2O===6CO2↑+28H+
B.电路中每转移3 mol电子,正极生成103 g Cr(OH)3
C.装置工作一段时间后,中间室中NaCl溶液的浓度将减小
D.反应温度越高,该装置处理含苯酚废水的效率越高
18.工业上电解NaHSO4溶液制备Na2S2O8。电解时,阴极材料为Pb;阳极(铂电极)电极反应式为2HSO-2e-===S2O+2H+。下列说法正确的是( )
A.阴极电极反应式为Pb+HSO-2e-===PbSO4+H+
B.阳极反应中S的化合价升高
C.S2O中既存在非极性键又存在极性键
D.可以用铜电极作阳极
二、非选择题(本题包括4小题,共46分)
19.(10分)(1)S8分子可形成单斜硫和斜方硫,转化过程如下:S(单斜,s)S(斜方,s) ΔH=-0.398 kJ·mol-1,则S(单斜,s)、S(斜方,s)相比,较稳定的是______[填“S(单斜,s)”或“S(斜方,s)”]。
(2)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1)
化学键 H—H H—Cl
键能 436 431
热化学方程式:H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ·mol-1,则Cl—Cl的键能为________kJ·mol-1。
(3)标准状况下,6.72 L C2H2(g)在O2(g)中完全燃烧生成CO2(g)和H2O(l),放出389.7 kJ热量,请写出表示C2H2标准燃烧热的热化学方程式:_________________________________
________________________________________________________________________。
(4)已知:C(石墨,s)+ O2(g)===CO2(g)
ΔH1=-a kJ·mol-1
H2(g)+O2(g)===H2O(l) ΔH2=-b kJ·mol-1
CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH3=-c kJ·mol-1
计算C(石墨,s)与H2(g)反应生成1 mol CH4(g)的ΔH为________kJ·mol-1 (用含a、b、c的式子表示)。
(5)由N2O和NO反应生成N2和NO2的能量变化如图所示。则反应过程中,每生成2 mol N2理论上放出的热量为________。
20.(10分)铅酸蓄电池是典型的可充电电池,电池总反应式为Pb+PbO2+2H2SO42PbSO4+2H2O。
请回答下列问题:
(1)放电时,正极的电极反应式是__________________。电解液中H2SO4的浓度将变________,当外电路通过1 mol电子时,理论上负极板的质量增加________ g,电池中消耗的硫酸物质的量为________。
(2)在完全放电耗尽PbO2和Pb时,若按图示连接,外加电源充电一段时间后,则在A电极上生成________。B电极上生成________,充电完成后,重新放电,A电极为________极。
21.(12分)铁、铝及其化合物在生产和生活中有着广泛的应用。
(1)某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护。
为防止金属Fe被腐蚀,可以采用上述________(填装置序号)装置原理进行防护;装置③中总反应的离子方程式为__________________________________________________________。
(2)用甲烷或其他有机物、氧气为原料可设计成原电池,以CnH2nOn、O2为原料,硫酸溶液为电解质设计成燃料电池,则负极的电极反应式为__________________________________。
(3)图1是在金属锌板上贴上一张用某溶液浸湿的滤纸,图2是NaBH4/H2O2燃料电池。
图2电池负极区的电极反应为________________________________________________
__________________________________________________________________________;
若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则滤纸出现________色,c位置的电极反应式为______________________________________________________,
若用KI 淀粉溶液浸湿滤纸,用导线将a、b与A、B电极相连,铅笔芯c点处出现蓝色,则b接的是________(填“A”或“B”)电极。
22.(14分)(1)绿色电源“直接二甲醚燃料电池”的工作原理示意图如图所示:
正极为________(填“A电极”或“B电极”),H+移动方向为由________到________(填“A”或“B”),写出A电极的电极反应式:____________________________________。
(2)SO2和NOx是主要大气污染物,利用如图装置可同时吸收SO2和NO。
①a是直流电源的________极。
②已知电解池的阴极室中溶液的pH在4~7之间,阴极的电极反应为________________________________________________________________________。
③用离子方程式表示吸收NO的原理__________________________________________
________________________________________________________________________。
(3)结合如图所示的电解装置可去除废水中的氨氮。
①a极为________。
②d极反应式为___________________________________________________________。
(4)VB2-空气电池是目前储电能力最高的电池。以VB2-空气电池为电源,用惰性电极电解硫酸铜溶液如图所示,该电池工作时的反应为4VB2+11O2===4B2O3+2V2O5,VB2极发生的电极反应为_______________________________________________________________。
当外电路中通过0.04 mol电子时,B装置内共收集到0.448 L气体(标准状况),若B装置内的液体体积为200 mL(电解前后溶液体积不变),则电解前CuSO4溶液的物质的量浓度为________ mol·L-1。
答案与解析
专题1 化学反应与能量变化 专题检测试卷
(时间:90分钟 满分:100分)
一、选择题(本题包括18小题,每小题3分,共54分;每小题只有一个选项符合题意)
1.下列关于能量变化的说法正确的是( )
A.“冰,水为之,而寒于水”说明相同质量的水和冰相比较,冰的能量高
B.化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种
C.已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定
D.化学反应遵循质量守恒的同时,也遵循能量守恒
答案 D
解析 水和冰相比较,冰的能量低,故A错误;发生化学反应时能量的变化有多种形式,可以表现为热量的变化,还可以表现为光能等,故B错误;ΔH>0说明反应吸热,所以石墨的能量较低,能量越低物质越稳定,故石墨更稳定,故C错误;化学反应遵循质量守恒的同时,也遵循能量守恒,故D正确。
2.C和H2在生产、生活、科技中是非常重要的燃料。已知:
①2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1
②
下列推断正确的是( )
A.C(s)的标准燃烧热为-110.5 kJ·mol-1
B.2H2(g)+O2(g)===2H2O(g) ΔH=484 kJ·mol-1
C.C(s)+H2O(g)===CO(g)+H2(g)
ΔH=131.5 kJ·mol-1
D.将2 mol H2O(g)分解成H2(g)和O2(g),至少需要提供4×463 kJ的热量
答案 C
解析 A项,由题意可得反应③C(s)+O2(g)===CO(g)ΔH=-110.5 kJ·mol-1,但表达C(s)的标准燃烧热时必须生成稳定的氧化物二氧化碳,故标准燃烧热不是-110.5 kJ·mol-1,错误;B项,2 mol水分子中含有4 mol H—O键,反应2H2(g)+O2(g)===2H2O(g)的ΔH=反应物的总键能-生成物的总键能=436 kJ·mol-1×2+496 kJ·mol-1-4×463 kJ·mol-1=-484 kJ·mol-1,错误;C项,③C(s)+O2(g)===CO(g) ΔH=-110.5 kJ·mol-1,④2H2(g)+O2(g)===2H2O(g) ΔH=-484 kJ·mol-1,由③-×④得:C(s)+H2O(g)===CO(g)+H2(g) ΔH=-110.5 kJ·mol-1-×(-484 kJ·mol-1)=131.5 kJ·mol-1,正确;D项,由2H2(g)+O2(g)===2H2O(g) ΔH=-484 kJ·mol-1可知,分解2 mol H2O(g),至少需要提供484 kJ的热量,错误。
3.下列关于反应热的叙述正确的是( )
A.当ΔH<0时,表示该反应为吸热反应
B.1 mol H2与0.5 mol O2反应放出的热量就是H2的标准燃烧热
C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D.1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应放出的热量:CH3COOH
解析 A项,ΔH<0表示反应为放热反应;C项,反应热等于反应物总能量与生成物总能量的差值,故与二者的能量有关;D项,CH3COOH电离时吸热。
4.某同学设计如图所示实验,探究反应中的能量变化。
下列判断正确的是( )
A.由实验可知,(a)、(b)、(c)所涉及的反应都是放热反应
B.将实验(a)中的铝片更换为等质量的铝粉后释放出的热量有所增加
C.实验(c)中将环形玻璃搅拌棒改为铁质搅拌器对实验结果没有影响
D.若用NaOH固体代替NaOH溶液与盐酸反应测定中和反应的反应热,则测定数值偏高
答案 D
解析 A项,Ba(OH)2·8H2O与NH4Cl的反应属于吸热反应,错误;B项,改为铝粉,没有改变反应的本质,放出的热量不变,错误;C项,铁质搅拌器导热性好,热量损失较大,错误;D项,NaOH固体溶于水时放热,正确。
5.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
下列说法正确的是( )
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
答案 C
解析 A项,由能量—反应过程图像中状态Ⅰ和状态Ⅲ知,CO和O生成CO2是放热反应,错误;B项,由状态Ⅱ知,在CO与O生成CO2的过程中CO没有断键形成C和O,错误;C项,由状态Ⅲ及CO2的结构式O==C==O知,CO2分子中存在碳氧极性共价键,正确;D项,由能量—反应过程图像中状态Ⅰ(CO和O)和状态Ⅲ(CO2)分析,状态Ⅰ→状态Ⅲ表示CO和O原子反应生成CO2的过程,错误。
6.用铜片、银片设计成如图所示的原电池。以下有关该原电池的叙述正确的是( )
A.电子通过盐桥从乙池移向甲池
B.盐桥中的电解质溶液为KCl溶液
C.开始时,银片上发生的反应是Ag-e-===Ag+
D.将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同
答案 D
解析 电子不能通过电解质溶液,故A错误;乙烧杯中的电解质溶液为AgNO3溶液,能和KCl反应生成AgCl沉淀,堵塞盐桥,故B错误;铜片是负极,银片是正极,在银片上发生的反应式是Ag++e-===Ag,故C错误;该原电池的负极是铜,电极反应式为Cu-2e-===Cu2+,正极是银,电极反应式为2Ag++2e-===2Ag,两极的反应式相加得到总反应式:Cu+2Ag+===Cu2++2Ag,将铜片浸入AgNO3溶液中发生的化学反应也是铜置换银,故D正确。
7.(2020·福建平和中学高二月考)有关下列四个常用电化学装置的叙述正确的是( )
图Ⅰ 碱性锌锰电池 图Ⅱ 铅-硫酸蓄电池
图Ⅲ 电解精炼铜 图Ⅳ 银锌纽扣电池
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液浓度始终不变
D.图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中被还原为Ag
答案 D
解析 该电池反应中MnO2得到电子被还原,为原电池的正极,故A错误;铅蓄电池放电时电池反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O, 该反应中有H2SO4参加反应,导致硫酸的浓度降低,故B错误;粗铜中不仅含有铜,还含有其他金属,电解时,粗铜中有铜和其他金属失电子,纯铜上只有Cu2+得电子,所以阴极上析出的铜大于阳极上减少的铜,溶液中Cu2+浓度减小,故C错误。
8.下列关于如图装置说法正确的是( )
A.装置中电子移动的途径是:负极→Fe→M溶液→石墨→正极
B.若M为NaCl溶液,通电一段时间后,溶液中可能有NaClO
C.若M为FeCl2溶液,可以实现石墨上镀铁
D.若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
答案 B
9.(2020·南昌市第一中学高二期末)用铂(惰性)电极进行电解,下列说法正确的是( )
A.电解NaOH溶液时,溶液的pH减小
B.电解H2SO4溶液时,在阳极和阴极析出产物的物质的量之比为2∶1
C.电解饱和Na2SO4溶液时,溶液浓度将增大,pH不变
D.电解CuCl2溶液时,溶液浓度将减小
答案 D
解析 电解氢氧化钠溶液时,实质上是电解水,溶剂的质量减少,溶质的质量不变,所以溶液的浓度增大,氢氧根离子的浓度增大,溶液的pH增大,选项A错误;电解H2SO4溶液,实质是电解水,阳极生成氧气,阴极生成氢气,根据得失电子守恒,阳极和阴极析出产物的物质的量之比为1∶2,选项B错误;电解饱和硫酸钠溶液时,阴极上氢离子放电、阳极上氢氧根离子放电,相当于电解水,溶液过饱和析出晶体,浓度不变,硫酸钠是强酸强碱盐,其溶液呈中性,pH不变,选项C错误;电解CuCl2 溶液的实质是电解电解质本身,CuCl2溶液浓度将减小,选项D正确。
10.通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是( )
①C(s)+H2O(g)===CO(g)+H2(g) ΔH1=a kJ·mol-1
②CO(g)+H2O(g)===CO2(g)+H2(g)
ΔH2=b kJ·mol-1
③CO2(g)+3H2(g)===CH3OH(g)+H2O(g)
ΔH3=c kJ·mol-1
④2CH3OH(g)===CH3OCH3(g)+H2O(g)
ΔH4=d kJ·mol-1
A.反应①、②为反应③提供原料气
B.反应③也是CO2资源化利用的方法之一
C.反应CH3OH(g)===CH3OCH3(g)+H2O(l)的ΔH= kJ·mol-1
D.反应2CO(g)+4H2(g)===CH3OCH3(g)+H2O(g)的ΔH=(2b+2c+d) kJ·mol-1
答案 C
解析 反应③中的反应物为CO2、H2,由反应可知,反应①、②为反应③提供原料气,故A正确;反应③中的反应物为CO2,转化为甲醇,则反应③也是CO2资源化利用的方法之一,故B正确;由反应④可知,物质的量与热量成正比,且气态水的能量比液态水的能量高,则反应CH3OH(g)===CH3OCH3(g)+H2O(l)的ΔH≠ kJ·mol-1,故C错误;由盖斯定律可知,②×2+③×2+④得到2CO(g)+4H2(g)===CH3OCH3(g)+H2O(g),则ΔH=(2b+2c+d) kJ·mol-1,故D正确。
11.已知下列热化学方程式:
Zn(s)+O2(g)===ZnO(s)
ΔH1=-351.1 kJ·mol-1
Hg(l)+O2(g)===HgO(s)
ΔH2=-90.7 kJ·mol-1
由此可知Zn(s)+HgO(s)===ZnO(s)+Hg(l) ΔH3,其中ΔH3是( )
A.-441.8 kJ·mol-1 B.-254.6 kJ·mol-1
C.-438.9 kJ·mol-1 D.-260.4 kJ·mol-1
答案 D
解析 将两个已知反应自上而下分别标作①和②,根据盖斯定律①-②得Zn(s)+HgO(s)===ZnO(s)+Hg(l)ΔH3=-351.1 kJ·mol-1+90.7 kJ·mol-1=-260.4 kJ·mol-1。即D项正确。
12.如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700~900 ℃时,O2-可在该固体氧化物电解质中自由移动,反应物、生成物均为无毒无害的物质。下列说法正确的是( )
A.电池内的O2-由电极乙移向电极甲
B.电池总反应为N2H4+2O2===2NO+2H2O
C.当电极甲上消耗1 mol N2H4时,电极乙上有22.4 L O2参与反应
D.电池外电路的电子由电极乙移向电极甲
答案 A
解析 A项,在原电池内部,阴离子向负极移动,阳离子向正极移动,该装置中电极甲为负极,电极乙为正极,所以O2-由电极乙移向电极甲,正确;B项,电池的总反应为N2H4+O2===N2+2H2O,错误;C项,当电极甲上有1 mol N2H4消耗时,转移4 mol电子,根据得失电子守恒知,电极乙上有1 mol O2参与反应,在标准状况下O2的体积为22.4 L,题目中没有指明标准状况,错误;D项,在外电路中,电子由负极(甲)移向正极(乙),错误。
13.某学术刊物介绍了一种新型中温全瓷铁—空气电池,其结构如图所示。
下列有关该电池放电时的说法正确的是( )
A.O2-由b极移向a极
B.正极的电极反应式为FeOx+2xe-===Fe+xO2-
C.铁表面发生的反应为xH2O(g)+Fe===FeOx+xH2
D.若有22.4 L(标准状况)空气参与反应,则电路中有4 mol电子转移
答案 C
解析 由新型中温全瓷铁—空气电池的装置图可知,a极空气中氧气得电子发生还原反应为正极,铁与水反应生成氢气,氢气在b极失电子发生氧化反应为负极。在原电池中,阴离子向负极移动,O2-由a极移向b极,A项错误;a极空气中的氧气得电子发生还原反应,为正极,电极反应式为O2+4e-===2O2-,B项错误;由新型中温全瓷铁—空气电池的装置图可知,铁表面发生的反应为xH2O(g)+Fe===FeOx+xH2,C项正确;有22.4 L(标准状况)空气参与反应,则氧气为×=0.2 mol,则电路中转移0.8 mol电子,D项错误。
14.(2020·济南期末)2018年我国科学家成功研制出铝—石墨烯电池。若手机使用该电池,1.1 s即充满电并可连续使用半个月。电池的电解质为铝基离子液体(BMIM和AlCl3按一定比例配制而成),主要阴离子为AlCl、Al2Cl,其电池如图所示。下列说法正确的是( )
A.放电时,石墨烯作电池正极,发生氧化反应
B.放电时,铝电极的电极反应式为Al-3e-+7AlCl===4Al2Cl
C.充电时,Al与电源正极相连
D.放电时,AlCl、Al2Cl向石墨烯移动
答案 B
解析 放电时是原电池,Al作负极,发生氧化反应,石墨烯作正极,发生还原反应,故A错误;根据题意可知,电池中主要阴离子为AlCl、Al2Cl,且Al作负极,失去电子,电极反应式为Al-3e-+7AlCl===4Al2Cl,故B正确;充电时,阴极得电子生成Al,所以Al应该连接电源负极,故C错误;放电时,阳离子向正极移动,阴离子向负极移动,即阴离子(AlCl、Al2Cl)向Al移动,故D错误。
15.(2020·重庆期末)关于下列各装置图的叙述不正确的是( )
A.用图①装置实现铁上镀铜,a极为铜,电解质溶液可以是CuSO4溶液
B.图②装置盐桥中KCl的Cl-移向右烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
答案 B
解析 根据电流方向知a为电解池的阳极,要实现铁上镀铜,则铜为阳极,电解质溶液可以是CuSO4溶液,故A项正确;图②装置是原电池,Zn为负极,Cu为正极,在原电池内,阴离子移向负极,故B项错误;要保护钢闸门不受腐蚀,钢闸门应该连在电源的负极上,故C项正确;左边装置的负极反应式为Al-3e-===Al3+,右边装置的负极反应式为Zn-2e-===Zn2+,这两个装置中通过相同数目的电子时,消耗的负极材料的物质的量之比应该为2∶3,故D项正确。
16.(2020·合肥高二期末)由于具有超低耗电量、寿命长的特点,LED产品越来越受欢迎,下图是氢氧燃料电池驱动LED发光的装置。下列有关叙述正确的是( )
A.电池负极电极反应式为H2-2e-+2OH-===2H2O
B.a处通入氧气,b处通入氢气
C.该装置中能量转化只涉及两种形式的能量转化
D.P型半导体连接的是电池负极
答案 A
解析 根据LED发光二极管中电子移动方向可判断N型半导体与电池负极相连,H2在负极反应,电解质溶液为KOH溶液,负极电极反应式为H2-2e-+2OH-===2H2O,A正确;a处为负极,应该通入氢气,b处通入氧气,B错误;该装置主要涉及化学能、电能、光能三种形式的能量转化,C错误;P型半导体与电池正极相连,D错误。
17.(2021·百师联盟复习联考)在K2Cr2O7存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如图所示,下列说法错误的是( )
A.负极的电极反应式为C6H5OH-28e-+11H2O===6CO2↑+28H+
B.电路中每转移3 mol电子,正极生成103 g Cr(OH)3
C.装置工作一段时间后,中间室中NaCl溶液的浓度将减小
D.反应温度越高,该装置处理含苯酚废水的效率越高
答案 D
解析 由图可知,负极发生氧化反应,C6H5OH失电子生成CO2,电极反应式为C6H5OH-28e-+11H2O===6CO2↑+28H+,A项正确;正极K2Cr2O7被还原为Cr(OH)3,生成1 mol Cr(OH)3转移3 mol电子,1 mol Cr(OH)3的质量为103 g,B项正确;负极产生的H+通过阳离子交换膜进入中间室,正极产生的OH-通过阴离子交换膜也进入中间室,H+和OH-反应生成水,溶液体积增大,NaCl溶液的浓度将减小,C项正确;负极利用微生物实现将苯酚氧化为CO2,温度过高,则微生物失去活性,处理废水效率下降,D项错误。
18.(2020·山东等级模拟考,11)工业上电解NaHSO4溶液制备Na2S2O8。电解时,阴极材料为Pb;阳极(铂电极)电极反应式为2HSO-2e-===S2O+2H+。下列说法正确的是( )
A.阴极电极反应式为Pb+HSO-2e-===PbSO4+H+
B.阳极反应中S的化合价升高
C.S2O中既存在非极性键又存在极性键
D.可以用铜电极作阳极
答案 C
解析 Na2S2O8的结构式为,由此结构可以判断出以下信息:S2O中含硫氧极性键和氧氧非极性键;S的化合价仍为+6价,中间的两个O原子均为-1价,其他的O原子均为-2价;电解时阳极的HSO中O失去电子,S未变价;阴极电极反应式为2H++2e-===H2↑;若用铜作阳极,则阳极反应为Cu-2e-===Cu2+,综上所述,故选C。
二、非选择题(本题包括4小题,共46分)
19.(10分)(1)S8分子可形成单斜硫和斜方硫,转化过程如下:S(单斜,s)S(斜方,s) ΔH=-0.398 kJ·mol-1,则S(单斜,s)、S(斜方,s)相比,较稳定的是______[填“S(单斜,s)”或“S(斜方,s)”]。
(2)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1)
化学键 H—H H—Cl
键能 436 431
热化学方程式:H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ·mol-1,则Cl—Cl的键能为________kJ·mol-1。
(3)标准状况下,6.72 L C2H2(g)在O2(g)中完全燃烧生成CO2(g)和H2O(l),放出389.7 kJ热量,请写出表示C2H2标准燃烧热的热化学方程式:_________________________________
________________________________________________________________________。
(4)已知:C(石墨,s)+ O2(g)===CO2(g)
ΔH1=-a kJ·mol-1
H2(g)+O2(g)===H2O(l) ΔH2=-b kJ·mol-1
CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH3=-c kJ·mol-1
计算C(石墨,s)与H2(g)反应生成1 mol CH4(g)的ΔH为________kJ·mol-1 (用含a、b、c的式子表示)。
(5)由N2O和NO反应生成N2和NO2的能量变化如图所示。则反应过程中,每生成2 mol N2理论上放出的热量为________。
答案 (1)S(斜方,s) (2)243 (3)C2H2(g)+O2(g)===2CO2(g)+H2O(l) ΔH=-1 299.0 kJ·mol-1 (4)c-2b-a (5)278 kJ
解析 (1)能量越高越不稳定,根据热化学方程式可知,S(单斜,s)S(斜方,s) ΔH=-0.398 kJ·mol-1,S(单斜,s)能量高于S(斜方,s),所以S(斜方,s)较稳定。
(2)根据已知条件可知,(431×2) kJ·mol-1-[436 kJ·mol-1+E(Cl—Cl)]=183 kJ·mol-1,计算可得到Cl—Cl的键能为243 kJ·mol-1。
(3)标准状况下,6.72 L C2H2(g)的物质的量为0.3 mol,则C2H2标准燃烧热的热化学方程式:C2H2(g)+O2(g)===2CO2(g)+H2O(l) ΔH=-=-1 299.0 kJ·mol-1。
(4)根据盖斯定律,C(石墨,s)与H2(g)反应生成1 mol CH4(g)的热化学方程式为C(石墨,s)+2H2(g)===CH4(g) ΔH=ΔH1+2ΔH2-ΔH3=[-a+2×(-b)-(-c)]kJ·mol-1=(c-2b-a)kJ·mol-1。
(5)根据能量变化图可知,热化学方程式为N2O(g)+NO(g)===N2(g)+NO2(g) ΔH=(209-348)kJ·mol-1= -139 kJ·mol-1,则反应过程中,每生成2 mol N2理论上放出的热量为278 kJ。
20.(10分)铅酸蓄电池是典型的可充电电池,电池总反应式为Pb+PbO2+2H2SO42PbSO4+2H2O。
请回答下列问题:
(1)放电时,正极的电极反应式是__________________。电解液中H2SO4的浓度将变________,当外电路通过1 mol电子时,理论上负极板的质量增加________ g,电池中消耗的硫酸物质的量为________。
(2)在完全放电耗尽PbO2和Pb时,若按图示连接,外加电源充电一段时间后,则在A电极上生成________。B电极上生成________,充电完成后,重新放电,A电极为________极。
答案 (1)PbO2+2e-+4H++SO===PbSO4+2H2O
小 48 1 mol (2)Pb PbO2 负
解析 (1)电池总反应式:Pb+PbO2+2H2SO42PbSO4+2H2O,负极:Pb-2e-+SO===PbSO4,正极:PbO2+2e-+4H++SO===PbSO4+2H2O;电解液中H2SO4的浓度将减小;当外电路通过1 mol电子时,依据电子守恒计算理论上负极板的质量增加0.5 mol×303 g·mol-1-0.5 mol×207 g·mol-1=48 g。
(2)在完全放电耗尽PbO2和Pb时,电极上析出的是PbSO4,若按题图连接电源,B为阳极应是失去电子发生氧化反应,A为阴极是得到电子发生还原反应,实质是电解反应,B电极上发生反应为PbSO4+2H2O-2e-===PbO2+4H++SO,A电极发生反应为PbSO4+2e-===Pb+SO,所以A电极上生成Pb,B电极上生成PbO2。
21.(12分)铁、铝及其化合物在生产和生活中有着广泛的应用。
(1)某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护。
为防止金属Fe被腐蚀,可以采用上述________(填装置序号)装置原理进行防护;装置③中总反应的离子方程式为__________________________________________________________。
(2)用甲烷或其他有机物、氧气为原料可设计成原电池,以CnH2nOn、O2为原料,硫酸溶液为电解质设计成燃料电池,则负极的电极反应式为__________________________________。
(3)图1是在金属锌板上贴上一张用某溶液浸湿的滤纸,图2是NaBH4/H2O2燃料电池。
图2电池负极区的电极反应为________________________________________________
__________________________________________________________________________;
若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则滤纸出现________色,c位置的电极反应式为______________________________________________________,
若用KI 淀粉溶液浸湿滤纸,用导线将a、b与A、B电极相连,铅笔芯c点处出现蓝色,则b接的是________(填“A”或“B”)电极。
答案 (1)②③ 2Cl-+2H2O2OH-+Cl2↑+H2↑
(2)CnH2nOn-4ne-+nH2O===nCO2+4nH+
(3)BH-8e-+8OH-===BO+6H2O 红
O2+2H2O+4e-===4OH- B
解析 (1)①装置为原电池,铁为负极,被腐蚀;②装置为原电池,锌为负极被腐蚀,铁作正极被保护;③装置为电解池,铁作阴极被保护。装置③中铁被保护,实际是电解饱和食盐水,生成氢氧化钠、氢气和氯气,离子方程式为2Cl-+2H2O2OH-+Cl2↑+H2↑。
(2)燃料电池中燃料作负极,反应失去电子,在酸性条件下生成二氧化碳,电极反应式为CnH2nOn-4ne-+nH2O=== nCO2+4nH+。
(3)NaBH4/H2O2燃料电池中负极为BH发生氧化反应,电极反应式为BH-8e-+8OH-===BO+6H2O,即A为负极,B为正极。若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,形成原电池,锌失去电子,铅笔芯为正极,氧气得到电子,在该电极生成氢氧化钠,使酚酞变红色;c点的电极反应式是O2+2H2O+4e-===4OH-;若用KI 淀粉溶液浸湿滤纸,c处出现蓝色,则c处发生反应2I--2e-===I2,c为阳极,则b接电池正极,因为A是负极,B是正极,所以b连接B电极。
22.(14分)(1)绿色电源“直接二甲醚燃料电池”的工作原理示意图如图所示:
正极为________(填“A电极”或“B电极”),H+移动方向为由________到________(填“A”或“B”),写出A电极的电极反应式:____________________________________。
(2)SO2和NOx是主要大气污染物,利用如图装置可同时吸收SO2和NO。
①a是直流电源的________极。
②已知电解池的阴极室中溶液的pH在4~7之间,阴极的电极反应为________________________________________________________________________。
③用离子方程式表示吸收NO的原理__________________________________________
________________________________________________________________________。
(3)结合如图所示的电解装置可去除废水中的氨氮。
①a极为________。
②d极反应式为___________________________________________________________。
(4)VB2-空气电池是目前储电能力最高的电池。以VB2-空气电池为电源,用惰性电极电解硫酸铜溶液如图所示,该电池工作时的反应为4VB2+11O2===4B2O3+2V2O5,VB2极发生的电极反应为_______________________________________________________________。
当外电路中通过0.04 mol电子时,B装置内共收集到0.448 L气体(标准状况),若B装置内的液体体积为200 mL(电解前后溶液体积不变),则电解前CuSO4溶液的物质的量浓度为________ mol·L-1。
答案 (1)B电极 A B CH3OCH3+3H2O-12e-===2CO2+12H+
(2)①负 ②2HSO+2H++2e-===S2O+2H2O ③2NO+2S2O+2H2O===N2+4HSO
(3)①负极 ②Cl--2e-+H2O===H++HClO
(4)2VB2+22OH--22e-===V2O5+2B2O3+11H2O 0.05
解析 (1)燃料电池中通入燃料的一极为负极,即A为负极,负极上二甲醚失电子生成二氧化碳和氢离子,则负极的电极反应式为CH3OCH3+3H2O-12e-===2CO2+12H+,通入氧气的一极为正极,即B电极为正极;溶液中阳离子向正极移动,即H+从A移向B。(2)由图中信息可知,与a相连的电极上,HSO被还原为S2O,所以a电极为电源的负极,b为正极。②已知电解池的阴极室中溶液的pH在4~7之间,溶液显酸性,所以阴极的电极反应式为2HSO+2H++2e-===S2O+2H2O。③吸收NO的原理是NO与S2O反应生成氮气和HSO,离子方程式为2NO+2S2O+2H2O===N2+4HSO。
(3)由图可知,电解时Cl-失去电子转化为HClO,HClO可氧化NH3生成N2,则d连接电源正极为阳极,a为负极,阳极反应式为Cl--2e-+H2O===H++HClO。(4)该电池工作时的反应为4VB2+11O2===4B2O3+2V2O5,碱性条件下,VB2极发生氧化反应,反应得到B2O3、V2O5,有OH-参与反应,同时有H2O生成,电极反应式为2VB2+22OH--22e-===V2O5+2B2O3+11H2O;B装置为电解池,阳极生成氧气,根据电子转移守恒可知生成氧气的物质的量为=0.01 mol,生成气体总物质的量为=0.02 mol,故生成氢气的物质的量为0.01 mol,由电子转移守恒知,电解前CuSO4的物质的量为=0.01 mol,故电解前CuSO4溶液的物质的量浓度为=0.05 mol·L-1。
