第6章 常用的金属和盐 随堂练习—2021-2022学年九年级化学沪教版(上海)第二学期(word版有答案)
文档属性
| 名称 | 第6章 常用的金属和盐 随堂练习—2021-2022学年九年级化学沪教版(上海)第二学期(word版有答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 201.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-13 21:51:19 | ||
图片预览



文档简介
第6章《常用的金属和盐》随堂练习
一、单选题
1.某种新型“防盗玻璃”为多层结构,每层中间嵌有极细的金属线,当玻璃被击碎时,产生电信号,与金属线相连的警报系统就会立刻报警,这利用了金属的
A.延展性 B.导热性 C.弹性 D.导电性
2.小玲家的水稻出现了倒伏现象,急需施用的化肥是( )
A.CO(NH2)2 B.Ca3(PO4)2 C.K2SO4 D.NH4Cl
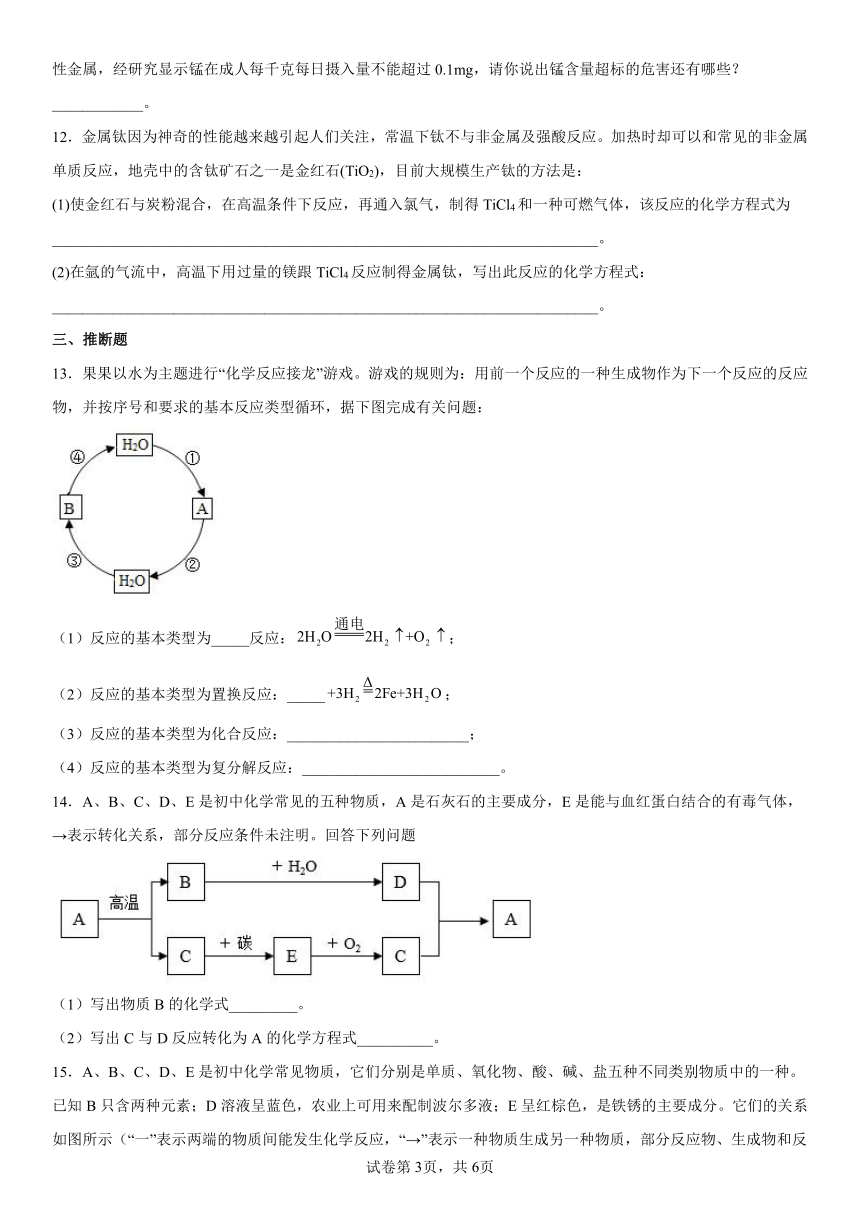
3.为比较X、Y、Z三种金属活动性大小,进行如图所示的实验。下列实验结论正确的是( )
A.X>Y>Z
B.Z>Y>X
C.Y>X、Y>Z
D.X>Y、Z>Y
4.在一个密闭容器中,有甲、乙、丙、丁、戊五种物质,在一定条件下发生反应,测得反应前后各物质的质量变化量如图所示(图中正数表示物质质量的增加量,负数表示物质质量的减少是,0表示物质质量不变),下列说法正确的是
A.该反应一定属于置换反应
B.戊一定是该反应的催化剂
C.参加反应的乙、丙的质量比一定为48:23
D.该反应中甲、丁的相对分子质量之比一定为44:27
5.银是一种银白色金属,密度较大,具有良好的导电性,长期放置会被氧化而发黑。其中属于银的化学性质的是
A.银白色 B.密度较大 C.导电性良好 D.能被氧化
6.国产大飞机C919机壳采用了先进的铝锂合金材料。已知金属锂(Li)的活动性比铝强。下列有关说法错误的是( )。
A.铝锂合金硬度大,密度小
B.锂能与盐酸反应,放出热量,生成氢气
C.锂能与氧气反应,生成的Li2O中Li显+2价
D.铝在空气中表面会形成致密的氧化膜
7.下列物质可通过金属与稀盐酸反应直接得到的是( )
A.CuCl2 B.AgCl C.ZnCl2 D.FeCl3
8.下列关于碳酸钙的说法错误的是
A.大理石的主要成分是碳酸钙
B.实验室常用碳酸钙与稀硫酸反应制取CO2
C.碳酸钙可用作补钙剂
D.石灰浆粉刷墙壁,“出汗”后变成碳酸钙
9.NH4NO3是一种化学肥料,某NH4NO3溶液的pH=4.以下说法错误的是( )
A.NH4NO3是一种复合肥料
B.NH4NO3不能与熟石灰混合使用
C.久施NH4NO3的土壤可能被酸化
D.盐溶液也可能使酸碱指示剂变色
10.现有甲、乙、丙三种金属,采用将其中的一种金属分别放入另外两种金属的硫酸盐溶液中的方法进行实验,得到三种金属间的转化关系(如下图所示)。则三种金属的活动性由强到弱的顺序是( )
A.乙、甲、丙 B.乙、丙、甲 C.丙、甲、乙 D.丙、乙、甲
二、简答题
11.苏泊尔是中国唯一一家炊具类的大型上市公司,以生产不锈钢锅具为主业,近日曝光旗下200元以下的不锈钢锅具低于国家卫生标准。则回答问题:
(1)不锈钢属于一种_____材料,其主要合金元素中镍和铬的含量分别是18%和8%,主要起到_______作用,请举例说明不锈钢的主要用途有_________。
(2)如果不锈钢产品中的锰含量超标,镍含量不达标,可能严重影响相关产品的使用效果和寿命,锰是一种过渡性金属,经研究显示锰在成人每千克每日摄入量不能超过0.1mg,请你说出锰含量超标的危害还有哪些?____________。
12.金属钛因为神奇的性能越来越引起人们关注,常温下钛不与非金属及强酸反应。加热时却可以和常见的非金属单质反应,地壳中的含钛矿石之一是金红石(TiO2),目前大规模生产钛的方法是:
(1)使金红石与炭粉混合,在高温条件下反应,再通入氯气,制得TiCl4和一种可燃气体,该反应的化学方程式为________________________________________________________________________。
(2)在氩的气流中,高温下用过量的镁跟TiCl4反应制得金属钛,写出此反应的化学方程式:________________________________________________________________________。
三、推断题
13.果果以水为主题进行“化学反应接龙”游戏。游戏的规则为:用前一个反应的一种生成物作为下一个反应的反应物,并按序号和要求的基本反应类型循环,据下图完成有关问题:
(1)反应的基本类型为_____反应:;
(2)反应的基本类型为置换反应:_____;
(3)反应的基本类型为化合反应:________________________;
(4)反应的基本类型为复分解反应:__________________________。
14.A、B、C、D、E是初中化学常见的五种物质,A是石灰石的主要成分,E是能与血红蛋白结合的有毒气体,→表示转化关系,部分反应条件未注明。回答下列问题
(1)写出物质B的化学式_________。
(2)写出C与D反应转化为A的化学方程式__________。
15.A、B、C、D、E是初中化学常见物质,它们分别是单质、氧化物、酸、碱、盐五种不同类别物质中的一种。已知B只含两种元素;D溶液呈蓝色,农业上可用来配制波尔多液;E呈红棕色,是铁锈的主要成分。它们的关系如图所示(“一”表示两端的物质间能发生化学反应,“→”表示一种物质生成另一种物质,部分反应物、生成物和反应条件已略去)。请回答:
(1)物质C所属的类别是________。
(2)写出A与D反应的化学方程式_______________。
(3)B与C反应的基本类型是______反应。
(4)B与E的反应在生产中的用途是____________。
四、实验题
16.A~F六种物质共含H、C、O、N、Ca、Cu六种元素,分别为非金属单质、金属氧化物、非金属氧化物、酸、碱、盐中的一种。其中,A为温室气体,BC均为黑色固体,盐中不含金属。相邻物质之间能发生化学反应。
(1)A的固体俗称是_______________;
(2)E与F反应的现象是______________________________;
(3)C与D反应的化学方程式________________________,属于________反应(填基本反应类型)。
17.有一包白色粉末,其中含有CuSO4、BaCl2,NaOH,Na2CO3中的一种或几种.某化学小组为确定白色粉末的成分,进行了如下实验:
(I)取一定量的白色粉末,加入足量水,震荡,得到无色透明溶液;
(II)取少量(I)的溶液,加入足量盐酸,有气泡产生.(提示:Na2CO3的水溶液呈碱性)
(1)该白色粉末中肯定含有什么物质_____?可能含有什么物质______?
(2)为确定可能含有的物质是否存在,还需要做什么实验_______?请写出简要的实验步骤.
18.兴趣实验能激发同学们学习化学实验,某同学用图1装置进行实验,先后将两种溶液快速全部推入,用数字化传感器测得一段时间内压强变化如图2所示:
(1)先推入的液体是NaOH溶液,判断的依据是什么?_____________
(2)cd段压强变大,其原因是什么?(用化学方程式解释)。_____________
(3)实验反思:欲证明C点处反应后的生成物,除了用盐酸还可以用不同类别的物质是什么?(写一种即可)。_____________
五、计算题
19.市售的食用纯碱往往含有少量氯化钠,探究小组以某品牌食用纯碱为样品测定其中Na2CO3的质量分数,实验过程如图:
请分析实验过程,回答:
(1)写出相关反应的化学方程式______。
(2)实验中加入“过量”CaCl2溶液,目的是______。
(3)若取用样品的质量为2.2g,且实验过程中无质量损失,最终得到沉淀的质量为2g。则2.2g纯碱样品中Na2CO3的质量为______克,该品牌食用纯碱中Na2CO3的质量分数为______。
20.铝在生活生产中具有广泛的用途。
(1)铝箔是现代生活中常见的包装材料,防止久了,其银白色光泽会变暗淡,故又称假银箔,铝箔放置很久表面暗淡的原因是____________。
(2)小新用放置很久的铝箔与稀盐酸反应,产生氢气质量和反应时间关系如图所示。
现象:在t1~t2时间段产生气泡的速度逐渐放慢,到反应停止时,铝箔还有大量剩余,问题:t2~t3时间段产生气泡速度放慢的原因是________。
(3)为进一步测量铝箔中单质铝的质量分数,小新取3.0g铝箔样品与100g稀盐酸充分反应,铝箔完全溶解后剩余溶液的总质量为102.7g,计算样品中单质铝的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.C
3.A
4.C
5.D
6.C
7.C
8.B
9.A
10.C
11. 金属 抗氧化性和耐腐蚀 可制作医疗器具和炊具等 对人体有害,损害神经系统功能,不能用于防锈等
12.
13. 分解 Fe2O3 Ca(OH)2+2HCl=CaCl2+2H2O
14. CaO CO2 + Ca(OH)2 = CaCO3↓+ H2O
15. 碱 Fe+CuSO4=Cu+FeSO4 复分解 除锈
16. 干冰 有刺激性气味(氨味) CuO+2HNO3==Cu(NO3)2+H2O 复分解
17. Na2CO3 NaOH 取少量(Ⅰ)的溶液,加入足量的氯化钙溶液,静置,然后取上层清夜滴加酚酞试液
18. 依据气压图像,CO2气体与NaOH溶液反应,气体减少,气压变小 含有Ca2+或Ba2+盐溶液
19.(1)
(2)碳酸钠完全反应,使实验结果更准确
(3)解:设2.2g纯碱样品中碳酸钠的质量为x。
x=2.12g
该品牌食用纯碱中碳酸钠的质量分数=
答:2.2g纯碱样品中碳酸钠的质量是21.2g。该品牌食用纯碱中Na2CO3的质量分数是96.4%。
20.(1)铝箔与空气中的氧气反应生成氧化铝
(2)随着反应的进行,盐酸被消耗,稀盐酸的浓度(溶质质量分数)逐渐降低
(3)生成氢气的质量为3.0g+100g-102.7g=0.3g。设参加反应铝的质量为x
x=2.7g;
样品中单质铝的质量分数为。
答:样品中单质铝的质量分数为90%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.某种新型“防盗玻璃”为多层结构,每层中间嵌有极细的金属线,当玻璃被击碎时,产生电信号,与金属线相连的警报系统就会立刻报警,这利用了金属的
A.延展性 B.导热性 C.弹性 D.导电性
2.小玲家的水稻出现了倒伏现象,急需施用的化肥是( )
A.CO(NH2)2 B.Ca3(PO4)2 C.K2SO4 D.NH4Cl
3.为比较X、Y、Z三种金属活动性大小,进行如图所示的实验。下列实验结论正确的是( )
A.X>Y>Z
B.Z>Y>X
C.Y>X、Y>Z
D.X>Y、Z>Y
4.在一个密闭容器中,有甲、乙、丙、丁、戊五种物质,在一定条件下发生反应,测得反应前后各物质的质量变化量如图所示(图中正数表示物质质量的增加量,负数表示物质质量的减少是,0表示物质质量不变),下列说法正确的是
A.该反应一定属于置换反应
B.戊一定是该反应的催化剂
C.参加反应的乙、丙的质量比一定为48:23
D.该反应中甲、丁的相对分子质量之比一定为44:27
5.银是一种银白色金属,密度较大,具有良好的导电性,长期放置会被氧化而发黑。其中属于银的化学性质的是
A.银白色 B.密度较大 C.导电性良好 D.能被氧化
6.国产大飞机C919机壳采用了先进的铝锂合金材料。已知金属锂(Li)的活动性比铝强。下列有关说法错误的是( )。
A.铝锂合金硬度大,密度小
B.锂能与盐酸反应,放出热量,生成氢气
C.锂能与氧气反应,生成的Li2O中Li显+2价
D.铝在空气中表面会形成致密的氧化膜
7.下列物质可通过金属与稀盐酸反应直接得到的是( )
A.CuCl2 B.AgCl C.ZnCl2 D.FeCl3
8.下列关于碳酸钙的说法错误的是
A.大理石的主要成分是碳酸钙
B.实验室常用碳酸钙与稀硫酸反应制取CO2
C.碳酸钙可用作补钙剂
D.石灰浆粉刷墙壁,“出汗”后变成碳酸钙
9.NH4NO3是一种化学肥料,某NH4NO3溶液的pH=4.以下说法错误的是( )
A.NH4NO3是一种复合肥料
B.NH4NO3不能与熟石灰混合使用
C.久施NH4NO3的土壤可能被酸化
D.盐溶液也可能使酸碱指示剂变色
10.现有甲、乙、丙三种金属,采用将其中的一种金属分别放入另外两种金属的硫酸盐溶液中的方法进行实验,得到三种金属间的转化关系(如下图所示)。则三种金属的活动性由强到弱的顺序是( )
A.乙、甲、丙 B.乙、丙、甲 C.丙、甲、乙 D.丙、乙、甲
二、简答题
11.苏泊尔是中国唯一一家炊具类的大型上市公司,以生产不锈钢锅具为主业,近日曝光旗下200元以下的不锈钢锅具低于国家卫生标准。则回答问题:
(1)不锈钢属于一种_____材料,其主要合金元素中镍和铬的含量分别是18%和8%,主要起到_______作用,请举例说明不锈钢的主要用途有_________。
(2)如果不锈钢产品中的锰含量超标,镍含量不达标,可能严重影响相关产品的使用效果和寿命,锰是一种过渡性金属,经研究显示锰在成人每千克每日摄入量不能超过0.1mg,请你说出锰含量超标的危害还有哪些?____________。
12.金属钛因为神奇的性能越来越引起人们关注,常温下钛不与非金属及强酸反应。加热时却可以和常见的非金属单质反应,地壳中的含钛矿石之一是金红石(TiO2),目前大规模生产钛的方法是:
(1)使金红石与炭粉混合,在高温条件下反应,再通入氯气,制得TiCl4和一种可燃气体,该反应的化学方程式为________________________________________________________________________。
(2)在氩的气流中,高温下用过量的镁跟TiCl4反应制得金属钛,写出此反应的化学方程式:________________________________________________________________________。
三、推断题
13.果果以水为主题进行“化学反应接龙”游戏。游戏的规则为:用前一个反应的一种生成物作为下一个反应的反应物,并按序号和要求的基本反应类型循环,据下图完成有关问题:
(1)反应的基本类型为_____反应:;
(2)反应的基本类型为置换反应:_____;
(3)反应的基本类型为化合反应:________________________;
(4)反应的基本类型为复分解反应:__________________________。
14.A、B、C、D、E是初中化学常见的五种物质,A是石灰石的主要成分,E是能与血红蛋白结合的有毒气体,→表示转化关系,部分反应条件未注明。回答下列问题
(1)写出物质B的化学式_________。
(2)写出C与D反应转化为A的化学方程式__________。
15.A、B、C、D、E是初中化学常见物质,它们分别是单质、氧化物、酸、碱、盐五种不同类别物质中的一种。已知B只含两种元素;D溶液呈蓝色,农业上可用来配制波尔多液;E呈红棕色,是铁锈的主要成分。它们的关系如图所示(“一”表示两端的物质间能发生化学反应,“→”表示一种物质生成另一种物质,部分反应物、生成物和反应条件已略去)。请回答:
(1)物质C所属的类别是________。
(2)写出A与D反应的化学方程式_______________。
(3)B与C反应的基本类型是______反应。
(4)B与E的反应在生产中的用途是____________。
四、实验题
16.A~F六种物质共含H、C、O、N、Ca、Cu六种元素,分别为非金属单质、金属氧化物、非金属氧化物、酸、碱、盐中的一种。其中,A为温室气体,BC均为黑色固体,盐中不含金属。相邻物质之间能发生化学反应。
(1)A的固体俗称是_______________;
(2)E与F反应的现象是______________________________;
(3)C与D反应的化学方程式________________________,属于________反应(填基本反应类型)。
17.有一包白色粉末,其中含有CuSO4、BaCl2,NaOH,Na2CO3中的一种或几种.某化学小组为确定白色粉末的成分,进行了如下实验:
(I)取一定量的白色粉末,加入足量水,震荡,得到无色透明溶液;
(II)取少量(I)的溶液,加入足量盐酸,有气泡产生.(提示:Na2CO3的水溶液呈碱性)
(1)该白色粉末中肯定含有什么物质_____?可能含有什么物质______?
(2)为确定可能含有的物质是否存在,还需要做什么实验_______?请写出简要的实验步骤.
18.兴趣实验能激发同学们学习化学实验,某同学用图1装置进行实验,先后将两种溶液快速全部推入,用数字化传感器测得一段时间内压强变化如图2所示:
(1)先推入的液体是NaOH溶液,判断的依据是什么?_____________
(2)cd段压强变大,其原因是什么?(用化学方程式解释)。_____________
(3)实验反思:欲证明C点处反应后的生成物,除了用盐酸还可以用不同类别的物质是什么?(写一种即可)。_____________
五、计算题
19.市售的食用纯碱往往含有少量氯化钠,探究小组以某品牌食用纯碱为样品测定其中Na2CO3的质量分数,实验过程如图:
请分析实验过程,回答:
(1)写出相关反应的化学方程式______。
(2)实验中加入“过量”CaCl2溶液,目的是______。
(3)若取用样品的质量为2.2g,且实验过程中无质量损失,最终得到沉淀的质量为2g。则2.2g纯碱样品中Na2CO3的质量为______克,该品牌食用纯碱中Na2CO3的质量分数为______。
20.铝在生活生产中具有广泛的用途。
(1)铝箔是现代生活中常见的包装材料,防止久了,其银白色光泽会变暗淡,故又称假银箔,铝箔放置很久表面暗淡的原因是____________。
(2)小新用放置很久的铝箔与稀盐酸反应,产生氢气质量和反应时间关系如图所示。
现象:在t1~t2时间段产生气泡的速度逐渐放慢,到反应停止时,铝箔还有大量剩余,问题:t2~t3时间段产生气泡速度放慢的原因是________。
(3)为进一步测量铝箔中单质铝的质量分数,小新取3.0g铝箔样品与100g稀盐酸充分反应,铝箔完全溶解后剩余溶液的总质量为102.7g,计算样品中单质铝的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.C
3.A
4.C
5.D
6.C
7.C
8.B
9.A
10.C
11. 金属 抗氧化性和耐腐蚀 可制作医疗器具和炊具等 对人体有害,损害神经系统功能,不能用于防锈等
12.
13. 分解 Fe2O3 Ca(OH)2+2HCl=CaCl2+2H2O
14. CaO CO2 + Ca(OH)2 = CaCO3↓+ H2O
15. 碱 Fe+CuSO4=Cu+FeSO4 复分解 除锈
16. 干冰 有刺激性气味(氨味) CuO+2HNO3==Cu(NO3)2+H2O 复分解
17. Na2CO3 NaOH 取少量(Ⅰ)的溶液,加入足量的氯化钙溶液,静置,然后取上层清夜滴加酚酞试液
18. 依据气压图像,CO2气体与NaOH溶液反应,气体减少,气压变小 含有Ca2+或Ba2+盐溶液
19.(1)
(2)碳酸钠完全反应,使实验结果更准确
(3)解:设2.2g纯碱样品中碳酸钠的质量为x。
x=2.12g
该品牌食用纯碱中碳酸钠的质量分数=
答:2.2g纯碱样品中碳酸钠的质量是21.2g。该品牌食用纯碱中Na2CO3的质量分数是96.4%。
20.(1)铝箔与空气中的氧气反应生成氧化铝
(2)随着反应的进行,盐酸被消耗,稀盐酸的浓度(溶质质量分数)逐渐降低
(3)生成氢气的质量为3.0g+100g-102.7g=0.3g。设参加反应铝的质量为x
x=2.7g;
样品中单质铝的质量分数为。
答:样品中单质铝的质量分数为90%。
答案第1页,共2页
答案第1页,共2页
