第六单元 常用的金属和盐基础练习---2021-2022学年九年级化学沪教版(上海)第二学期(word版有答案)
文档属性
| 名称 | 第六单元 常用的金属和盐基础练习---2021-2022学年九年级化学沪教版(上海)第二学期(word版有答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 131.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-14 10:01:21 | ||
图片预览



文档简介
第6章《常用的金属和盐》基础练习
一、单选题
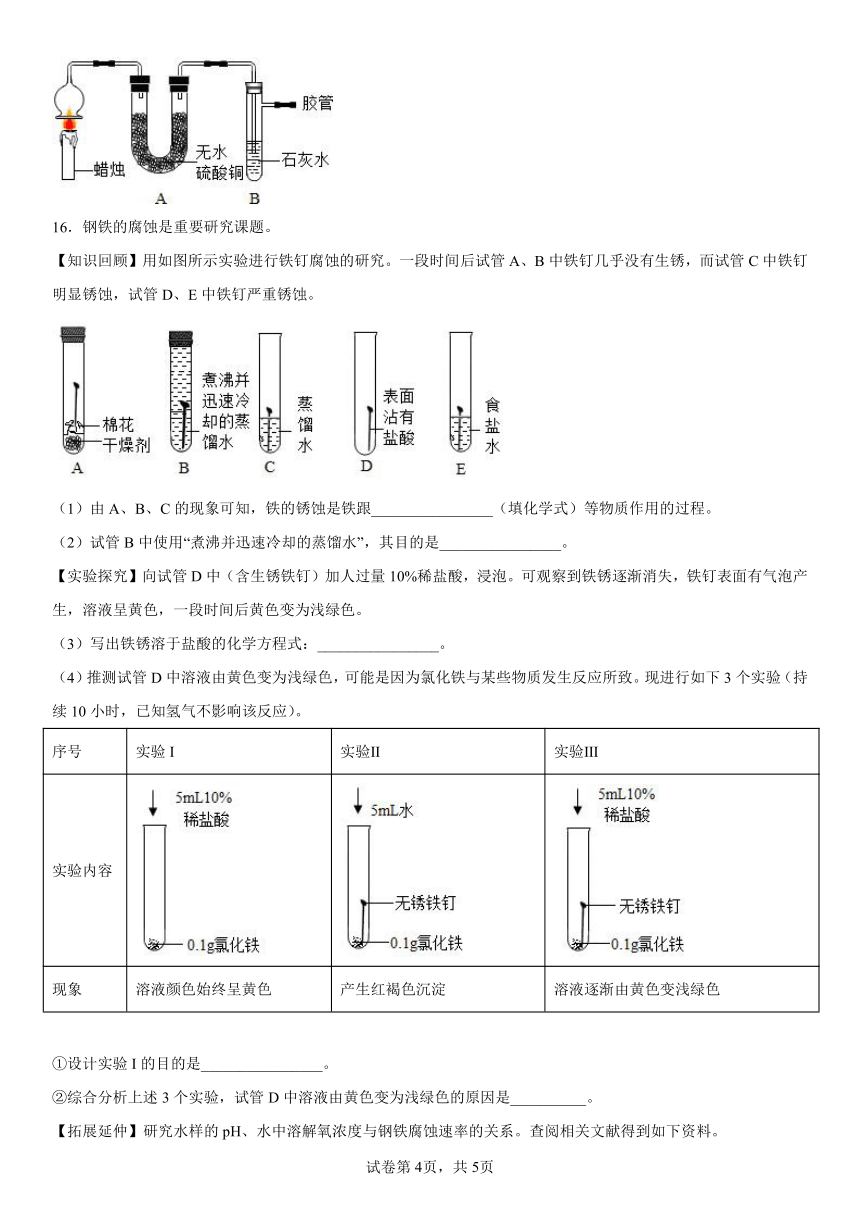
1.生活中金属材料得到越来越广泛的应用,下列属于金属共性的是( )
A.熔点高 B.良好的导电性
C.硬度大 D.银白色的光泽
2.食品安全无小事,下列做法正确的是( )
A.用硫酸铜溶液浸泡粽叶,包出的粽子色泽艳丽,营养丰富
B.在制作面包时添加适量的碳酸氢钠,可使面包松软可口
C.为了预防甲状腺肿大,在食品中添加大量的碘元素
D.用亚硝酸钠代替食盐腌制腊肉
3.银是一种银白色金属,密度较大,具有良好的导电性,长期放置会被氧化而发黑。其中属于银的化学性质的是
A.银白色 B.密度较大 C.导电性良好 D.能被氧化
4.下列金属中,不能从CuSO4溶液中置换出Cu的是
A.Zn B.Al C.Ag D.Fe
5.忘盖瓶塞的氢氧化钠溶液可能变质。下表中分析与设计错误的是
选项 问题 分析与设计
A 为何变质 2NaOH + CO2 = Na2CO3 + H2O
B 是否变质 取样,加入足量稀盐酸,观察是否产生气泡
C 是否全部变质 取样,加入足量氯化钙溶液,观察产生沉淀多少
D 如何除去杂质 取样,加入适量氢氧化钙溶液,过滤
A.A B.B C.C D.D
6.某固体粉末可能由氢氧化钠、氢氧化钙、碳酸钠和碳酸钙中的一种或几种组成,进行如下实验:①取少量固体加入足量的水,搅拌,有不溶物;②过滤,向滤液中加入盐酸,有气泡产生。下列对固体粉末成分的判断中,不正确的是
A.一定在碳酸钠 B.可能有氢氧化钠
C.一定有碳酸钙 D.可能有氢氧化钙
7.下列物质的用途中,利用其物理性质的是( )
A.铜用于制作导线 B.一氧化碳用于炼铁 C.天然气用作燃料 D.氧气用于气焊
8.下列试剂中,能把稀硫酸、KOH溶液、CaCl2溶液一次性鉴别出来的是
A.KCl溶液 B.K2CO3溶液
C.稀盐酸 D.NaNO3溶液
9.工业上利用赤铁矿石(主要成分是Fe2O3,还含少量SiO2等杂质)冶炼生铁的过程如图所示,下列说法不正确的是
A.CaSiO3中硅元素显+4价
B.高炉气体中SO2会形成酸雨,不能直接排放到空气中
C.原料中焦炭的作用之一是生成具有还原性的物质CO
D.高炉炼铁的原理是,该反应属于置换反应
二、简答题
10.我们知道铁在潮湿的空气中会发生锈蚀,为了研究这一现象,进行了如图所示的实验。
(1)能证明铁生锈一定有氧气参加的是(填序号) ___________,
(2)写出防止铁生锈的一种方法_____________。
11.金属材料应用广泛,如电路板中常用到焊锡、铜、银、铁等.
(1)焊锡与其组成金属相比具有_____的特性,可用来焊接电子元件.
(2)将Cu片插入AgNO3溶液中,发生反应的化学方程式为_____.
(3)若要验证Cu、Ag、Fe的活动性强弱,可选择的试剂组是_____(填序号).
A Fe、Cu、Ag、稀硫酸
B Cu、Ag、FeSO4溶液
C Fe、Ag、CuSO4溶液.
三、推断题
12.已知A、B、C、D四种物质之间存在以下转化关系。其中C是密度最小的气体,D是相对分子质量最小的氧化物。试回答:
(1)写出A、C、D三种物质的化学式:A_______、C________、D________。浅绿色溶液B中溶质的化学式____________。
(2)写出C→D的化学方程式___________。
13.A、B、C、D、E五种物质中含有同一种金属元素,转化关系如图所示(图中“→”表示物质间的转化能一步实现,部分反应物、生成物和反应条件均已略去)其中A是磁铁矿的主要成分,B是单质,C是铁锈。请回答下列问题:
(1)若A与一种氧化物反应生成单质B,则反应的化学方程式为_____。
(2)当B作为金属材料制成金属制品时,防止其可能转化为C的方法是_____(写一种)。
(3)当D→E为化合反应时,化学反应方程式为______。
(4)若B与某盐溶液发生置换反应生成E,其化学反应方程式为______。
14.实验室有三瓶化肥未贴标签,只知道他们分别是碳酸氢铵(NH4HCO3)、氯化铵(NH4Cl)和尿素[CO(NH2)2]中的一种.为鉴别三种化肥,某同学分别取少量样品编号为A、B、C,并进行如下实验(此处箭头表示得出实验结论)
根据上述实验回答:
(1)写出三种化肥的名称:A____;B____;C____.
(2)如果实验Ⅱ中B、C两种样品没有量取,对实验结果___(填“有”或“无”)影响.
(3)常温下如要鉴别B、C两种样品,____(填“能”或“不能”)采取闻气味的方法.
(4)由实验和查阅资料可知,人们在施用铵态氮肥时,若遇到碱性物质,会使铵态氮肥转化为氨气,氨气进入大气后与雨水作用,可能形成“碱雨”.“碱雨”中碱的化学式为___。
四、实验题
15.小杰设计了如下图所示装置(铁架台等固定装置略去)来验证石蜡中含碳、氢两种元素。装置A中可观察到_______________,证明石蜡中含有__________元素;装置B中可观察到__________,证明石蜡中含有______________元素。
16.钢铁的腐蚀是重要研究课题。
【知识回顾】用如图所示实验进行铁钉腐蚀的研究。一段时间后试管A、B中铁钉几乎没有生锈,而试管C中铁钉明显锈蚀,试管D、E中铁钉严重锈蚀。
(1)由A、B、C的现象可知,铁的锈蚀是铁跟________________(填化学式)等物质作用的过程。
(2)试管B中使用“煮沸并迅速冷却的蒸馏水”,其目的是________________。
【实验探究】向试管D中(含生锈铁钉)加人过量10%稀盐酸,浸泡。可观察到铁锈逐渐消失,铁钉表面有气泡产生,溶液呈黄色,一段时间后黄色变为浅绿色。
(3)写出铁锈溶于盐酸的化学方程式:________________。
(4)推测试管D中溶液由黄色变为浅绿色,可能是因为氯化铁与某些物质发生反应所致。现进行如下3个实验(持续10小时,已知氢气不影响该反应)。
序号 实验I 实验Ⅱ 实验Ⅲ
实验内容
现象 溶液颜色始终呈黄色 产生红褐色沉淀 溶液逐渐由黄色变浅绿色
①设计实验I的目的是________________。
②综合分析上述3个实验,试管D中溶液由黄色变为浅绿色的原因是__________。
【拓展延仲】研究水样的pH、水中溶解氧浓度与钢铁腐蚀速率的关系。查阅相关文献得到如下资料。
(5)如图表示水样温度22℃、氧含量6mL·L-1时,钢铁腐蚀速率与水样pH的关系。当pH<4时,钢铁腐蚀速率明显增大的原因是___________________。
(6)如图表示温度22℃、pH=7时,钢铁腐蚀速率与水中溶解氧浓度的关系。当溶解氧超过20mL·L-1时,钢铁腐蚀速率明显下降的原因可能是________________。
五、计算题
17.某碳酸钠样品中混有少量氯化钠,根据如图所示信息计算该样品中碳酸钠的质量分数。(计算结果精确到0.1%)(反应的化学方程式:CaCl2+Na2CO3===CaCO3↓+2NaCl)
18.镁、锌、铁三种金属各30g,分别与足量盐酸反应,生成氢气的质量各是多少?如果反应后各生成氢气30g,则需要这三种金属的质量各是多少?
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.B
3.D
4.C
5.C
6.C
7.A
8.B
9.D
10. ①② 刷油漆(合理即可)
11. 熔点低 Cu+2AgNO3=2Ag+Cu(NO3)2 C
12.(1) Fe H2 H2O FeSO4
(2)
13. 刷漆
14. 尿素 碳酸氢铵 氯化铵 无 不能 NH3.H2O
15. 白色固体变成蓝色 氢 澄清石灰水变浑浊 碳
16. O2、H2O 除去蒸馏水中溶解的氧气且防止氧气再溶于水 探究FeCl3能否与盐酸反应生成FeCl2 酸性条件下,FeCl3与铁钉发生反应生成FeCl2 钢铁与水样中的H+发生反应 钢铁表面生成较致密的氧化膜,阻碍O2、H2O与钢铁的接触
17.设该样品中碳酸钠的质量为x。
CaCl2+Na2CO3===CaCO3↓+2NaCl
106 100
x 5.0 g
= x=5.3 g
样品中碳酸钠的质量分数为×100%=70.7%
答:该样品中碳酸钠的质量分数为70.7%。
18.设30g镁、锌、铁与足量盐酸反应生成的氢气的质量分别为x、y、z
解得:x=2. 5g
解得:y=0. 92g
解得:z=1. 07g
答:镁、锌、铁与盐酸反应,生成氢气的质量分别是2. 5g、0. 92g、1. 07g;
设反应后各生成氢气30g,设需要镁、锌、铁的质量各是a、b、c
解得:a=360g
解得:b=975g
解得:c=840g
答:镁、锌、铁与盐酸反应,需要金属的质量分别是360g、975g、840g。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.生活中金属材料得到越来越广泛的应用,下列属于金属共性的是( )
A.熔点高 B.良好的导电性
C.硬度大 D.银白色的光泽
2.食品安全无小事,下列做法正确的是( )
A.用硫酸铜溶液浸泡粽叶,包出的粽子色泽艳丽,营养丰富
B.在制作面包时添加适量的碳酸氢钠,可使面包松软可口
C.为了预防甲状腺肿大,在食品中添加大量的碘元素
D.用亚硝酸钠代替食盐腌制腊肉
3.银是一种银白色金属,密度较大,具有良好的导电性,长期放置会被氧化而发黑。其中属于银的化学性质的是
A.银白色 B.密度较大 C.导电性良好 D.能被氧化
4.下列金属中,不能从CuSO4溶液中置换出Cu的是
A.Zn B.Al C.Ag D.Fe
5.忘盖瓶塞的氢氧化钠溶液可能变质。下表中分析与设计错误的是
选项 问题 分析与设计
A 为何变质 2NaOH + CO2 = Na2CO3 + H2O
B 是否变质 取样,加入足量稀盐酸,观察是否产生气泡
C 是否全部变质 取样,加入足量氯化钙溶液,观察产生沉淀多少
D 如何除去杂质 取样,加入适量氢氧化钙溶液,过滤
A.A B.B C.C D.D
6.某固体粉末可能由氢氧化钠、氢氧化钙、碳酸钠和碳酸钙中的一种或几种组成,进行如下实验:①取少量固体加入足量的水,搅拌,有不溶物;②过滤,向滤液中加入盐酸,有气泡产生。下列对固体粉末成分的判断中,不正确的是
A.一定在碳酸钠 B.可能有氢氧化钠
C.一定有碳酸钙 D.可能有氢氧化钙
7.下列物质的用途中,利用其物理性质的是( )
A.铜用于制作导线 B.一氧化碳用于炼铁 C.天然气用作燃料 D.氧气用于气焊
8.下列试剂中,能把稀硫酸、KOH溶液、CaCl2溶液一次性鉴别出来的是
A.KCl溶液 B.K2CO3溶液
C.稀盐酸 D.NaNO3溶液
9.工业上利用赤铁矿石(主要成分是Fe2O3,还含少量SiO2等杂质)冶炼生铁的过程如图所示,下列说法不正确的是
A.CaSiO3中硅元素显+4价
B.高炉气体中SO2会形成酸雨,不能直接排放到空气中
C.原料中焦炭的作用之一是生成具有还原性的物质CO
D.高炉炼铁的原理是,该反应属于置换反应
二、简答题
10.我们知道铁在潮湿的空气中会发生锈蚀,为了研究这一现象,进行了如图所示的实验。
(1)能证明铁生锈一定有氧气参加的是(填序号) ___________,
(2)写出防止铁生锈的一种方法_____________。
11.金属材料应用广泛,如电路板中常用到焊锡、铜、银、铁等.
(1)焊锡与其组成金属相比具有_____的特性,可用来焊接电子元件.
(2)将Cu片插入AgNO3溶液中,发生反应的化学方程式为_____.
(3)若要验证Cu、Ag、Fe的活动性强弱,可选择的试剂组是_____(填序号).
A Fe、Cu、Ag、稀硫酸
B Cu、Ag、FeSO4溶液
C Fe、Ag、CuSO4溶液.
三、推断题
12.已知A、B、C、D四种物质之间存在以下转化关系。其中C是密度最小的气体,D是相对分子质量最小的氧化物。试回答:
(1)写出A、C、D三种物质的化学式:A_______、C________、D________。浅绿色溶液B中溶质的化学式____________。
(2)写出C→D的化学方程式___________。
13.A、B、C、D、E五种物质中含有同一种金属元素,转化关系如图所示(图中“→”表示物质间的转化能一步实现,部分反应物、生成物和反应条件均已略去)其中A是磁铁矿的主要成分,B是单质,C是铁锈。请回答下列问题:
(1)若A与一种氧化物反应生成单质B,则反应的化学方程式为_____。
(2)当B作为金属材料制成金属制品时,防止其可能转化为C的方法是_____(写一种)。
(3)当D→E为化合反应时,化学反应方程式为______。
(4)若B与某盐溶液发生置换反应生成E,其化学反应方程式为______。
14.实验室有三瓶化肥未贴标签,只知道他们分别是碳酸氢铵(NH4HCO3)、氯化铵(NH4Cl)和尿素[CO(NH2)2]中的一种.为鉴别三种化肥,某同学分别取少量样品编号为A、B、C,并进行如下实验(此处箭头表示得出实验结论)
根据上述实验回答:
(1)写出三种化肥的名称:A____;B____;C____.
(2)如果实验Ⅱ中B、C两种样品没有量取,对实验结果___(填“有”或“无”)影响.
(3)常温下如要鉴别B、C两种样品,____(填“能”或“不能”)采取闻气味的方法.
(4)由实验和查阅资料可知,人们在施用铵态氮肥时,若遇到碱性物质,会使铵态氮肥转化为氨气,氨气进入大气后与雨水作用,可能形成“碱雨”.“碱雨”中碱的化学式为___。
四、实验题
15.小杰设计了如下图所示装置(铁架台等固定装置略去)来验证石蜡中含碳、氢两种元素。装置A中可观察到_______________,证明石蜡中含有__________元素;装置B中可观察到__________,证明石蜡中含有______________元素。
16.钢铁的腐蚀是重要研究课题。
【知识回顾】用如图所示实验进行铁钉腐蚀的研究。一段时间后试管A、B中铁钉几乎没有生锈,而试管C中铁钉明显锈蚀,试管D、E中铁钉严重锈蚀。
(1)由A、B、C的现象可知,铁的锈蚀是铁跟________________(填化学式)等物质作用的过程。
(2)试管B中使用“煮沸并迅速冷却的蒸馏水”,其目的是________________。
【实验探究】向试管D中(含生锈铁钉)加人过量10%稀盐酸,浸泡。可观察到铁锈逐渐消失,铁钉表面有气泡产生,溶液呈黄色,一段时间后黄色变为浅绿色。
(3)写出铁锈溶于盐酸的化学方程式:________________。
(4)推测试管D中溶液由黄色变为浅绿色,可能是因为氯化铁与某些物质发生反应所致。现进行如下3个实验(持续10小时,已知氢气不影响该反应)。
序号 实验I 实验Ⅱ 实验Ⅲ
实验内容
现象 溶液颜色始终呈黄色 产生红褐色沉淀 溶液逐渐由黄色变浅绿色
①设计实验I的目的是________________。
②综合分析上述3个实验,试管D中溶液由黄色变为浅绿色的原因是__________。
【拓展延仲】研究水样的pH、水中溶解氧浓度与钢铁腐蚀速率的关系。查阅相关文献得到如下资料。
(5)如图表示水样温度22℃、氧含量6mL·L-1时,钢铁腐蚀速率与水样pH的关系。当pH<4时,钢铁腐蚀速率明显增大的原因是___________________。
(6)如图表示温度22℃、pH=7时,钢铁腐蚀速率与水中溶解氧浓度的关系。当溶解氧超过20mL·L-1时,钢铁腐蚀速率明显下降的原因可能是________________。
五、计算题
17.某碳酸钠样品中混有少量氯化钠,根据如图所示信息计算该样品中碳酸钠的质量分数。(计算结果精确到0.1%)(反应的化学方程式:CaCl2+Na2CO3===CaCO3↓+2NaCl)
18.镁、锌、铁三种金属各30g,分别与足量盐酸反应,生成氢气的质量各是多少?如果反应后各生成氢气30g,则需要这三种金属的质量各是多少?
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.B
3.D
4.C
5.C
6.C
7.A
8.B
9.D
10. ①② 刷油漆(合理即可)
11. 熔点低 Cu+2AgNO3=2Ag+Cu(NO3)2 C
12.(1) Fe H2 H2O FeSO4
(2)
13. 刷漆
14. 尿素 碳酸氢铵 氯化铵 无 不能 NH3.H2O
15. 白色固体变成蓝色 氢 澄清石灰水变浑浊 碳
16. O2、H2O 除去蒸馏水中溶解的氧气且防止氧气再溶于水 探究FeCl3能否与盐酸反应生成FeCl2 酸性条件下,FeCl3与铁钉发生反应生成FeCl2 钢铁与水样中的H+发生反应 钢铁表面生成较致密的氧化膜,阻碍O2、H2O与钢铁的接触
17.设该样品中碳酸钠的质量为x。
CaCl2+Na2CO3===CaCO3↓+2NaCl
106 100
x 5.0 g
= x=5.3 g
样品中碳酸钠的质量分数为×100%=70.7%
答:该样品中碳酸钠的质量分数为70.7%。
18.设30g镁、锌、铁与足量盐酸反应生成的氢气的质量分别为x、y、z
解得:x=2. 5g
解得:y=0. 92g
解得:z=1. 07g
答:镁、锌、铁与盐酸反应,生成氢气的质量分别是2. 5g、0. 92g、1. 07g;
设反应后各生成氢气30g,设需要镁、锌、铁的质量各是a、b、c
解得:a=360g
解得:b=975g
解得:c=840g
答:镁、锌、铁与盐酸反应,需要金属的质量分别是360g、975g、840g。
答案第1页,共2页
答案第1页,共2页
