11.1生活中常见的盐(第5课时)课件(共21张PPT)
文档属性
| 名称 | 11.1生活中常见的盐(第5课时)课件(共21张PPT) |
|
|
| 格式 | pptx | ||
| 文件大小 | 29.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-14 00:00:00 | ||
图片预览







文档简介
(共21张PPT)
课题1 生活中常见的盐
第十一单元 盐 化肥
九年级化学下册课件(人教版)
第5课时
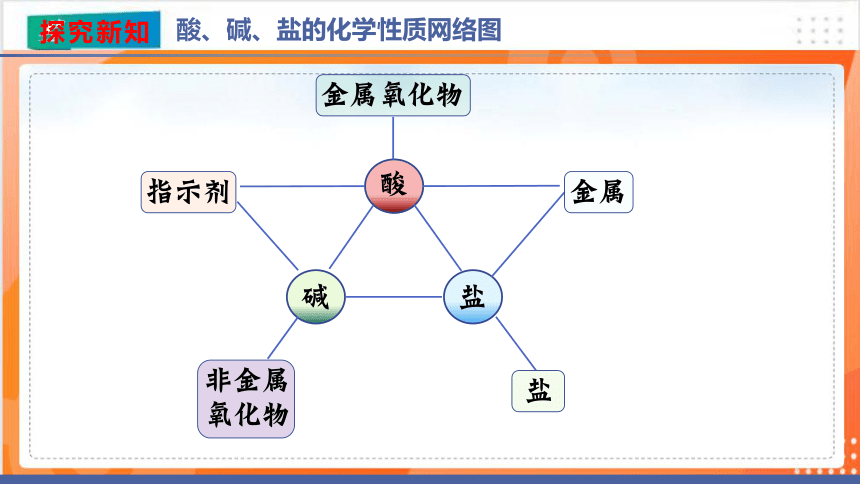
酸、碱、盐的化学性质网络图
酸
碱
盐
金属
指示剂
金属氧化物
非金属
氧化物
盐
探究新知
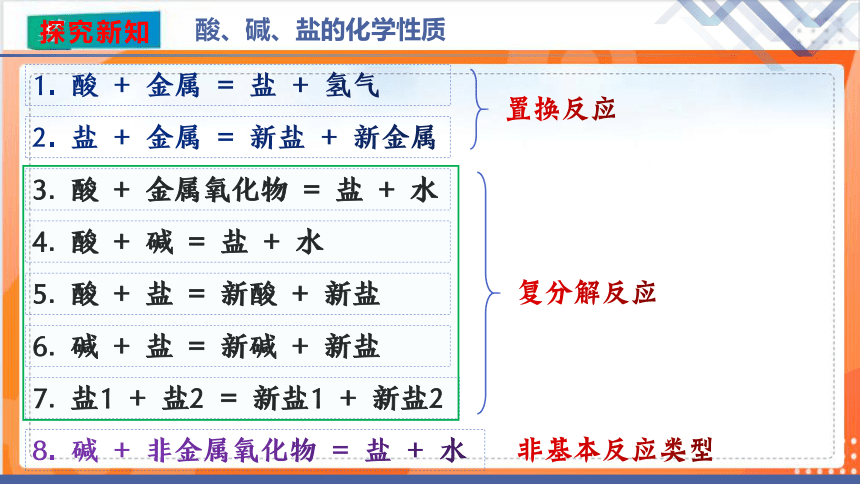
酸、碱、盐的化学性质
1. 酸 + 金属 = 盐 + 氢气
4. 酸 + 碱 = 盐 + 水
3. 酸 + 金属氧化物 = 盐 + 水
5. 酸 + 盐 = 新酸 + 新盐
8. 碱 + 非金属氧化物 = 盐 + 水
6. 碱 + 盐 = 新碱 + 新盐
2. 盐 + 金属 = 新盐 + 新金属
7. 盐1 + 盐2 = 新盐1 + 新盐2
置换反应
复分解反应
非基本反应类型
探究新知
讨论交流:哪些反应可以生成盐
盐
酸+金属氧化物
碱+非金属氧化物
酸+金属
盐+金属
酸+碱
酸+盐
碱+盐
盐+盐
1.下列白色固体仅用水就能鉴别,说出它们溶解时的现象。
NaCl
(溶于水,形成蓝色溶液)
(溶于水,放出热量,温度升高)
(不溶于水,形成悬浊液)
(溶于水,吸收热量,温度降低)
(溶于水,形成无色溶液)
NaOH
NH4Cl
CuSO4
CaCO3
酸、碱、盐性质的应用--物质的鉴别
酸、碱、盐性质的应用--物质的鉴别
2. 鉴别 HCl 和 NaOH可以选择哪些试剂?
石蕊溶液
酚酞溶液
活泼金属
碳酸盐、碳酸氢盐
含Cu2+、 Fe3+的可溶性盐
pH试纸
检验酸碱性
检验H+
检验OH-
酸、碱、盐性质的应用--物质的鉴别
3. 要验证氢氧化钠是否变质,可以选择哪些试剂?
稀盐酸
注意:
检验氢氧化钠是否变质,即检验Na2CO3的存在。
不能选择指示剂,因为NaOH和Na2CO3溶液均为碱性。
CaCl2
BaCl2
稀硫酸
有气泡则变质
有沉淀则变质
课堂精练
下列试剂能将稀硫酸、氯化钠溶液、澄清石灰水三种溶液一步鉴别出来的是:
A.稀盐酸 B.碳酸钠溶液
C.二氧化碳 D.无色酚酞溶液
B
下列各组溶液,仅用组内相互滴加的方法即可鉴别,说出具体的鉴别方法
FeCl3 KOH HCl NaCl
KNO3 BaCl2 NaOH CuSO4
K2CO3 H2SO4 HNO3 BaCl2
Na2CO3 NaOH HCl BaCl2
酸、碱、盐性质的应用--物质的鉴别
下列各组溶液,仅用组内相互滴加的方法即可鉴别,说出具体的鉴别方法
FeCl3 KOH HCl NaCl
酸、碱、盐性质的应用--物质的鉴别
①FeCl3溶液为黄色
②KOH能与FeCl3反应生成红褐色沉淀
③HCl能使Fe(OH)3沉淀溶解
下列各组溶液,仅用组内相互滴加的方法即可鉴别,说出具体的鉴别方法
KNO3 BaCl2 NaOH CuSO4
酸、碱、盐性质的应用--物质的鉴别
①CuSO4溶液为蓝色
②NaOH能与CuSO4反应生成蓝色沉淀
③BaCl2能与CuSO4反应生成白色沉淀
下列各组溶液,仅用组内相互滴加的方法即可鉴别,说出具体的鉴别方法
Na2CO3 NaOH HCl BaCl2
酸、碱、盐性质的应用--物质的鉴别
①Na2CO3与BaCl2反应生成白色沉淀
在相互滴加的过程中,既能生成气体又能生成沉淀的是Na2CO3
只生成沉淀的是BaCl2 ;只生成气体的是HCl,无现象的是NaOH
②Na2CO3与HCl反应生成无色气体
下列各组溶液,仅用组内相互滴加的方法即可鉴别,说出具体的鉴别方法
K2CO3 H2SO4 HNO3 BaCl2
酸、碱、盐性质的应用--物质的鉴别
①BaCl2与K2CO3反应生成白色沉淀【BaCO3】
②BaCl2与H2SO4反应生成白色沉淀【BaSO4】
③HNO3能与使BaCO3沉淀溶解
在相互滴加的过程中,能两次生成沉淀的是BaCl2,不能生成沉淀的是HNO3,能生成一次沉淀且沉淀能溶于硝酸的是K2CO3,能生成一次沉淀且沉淀不能溶于硝酸的是H2SO4 。
碱 ←→ 盐
酸、碱、盐性质的应用--物质的转化
①NaOH NaCl
③NaOH Na2SO4
②NaOH NaNO3
④NaOH Na2CO3
HCl
H2SO4
HNO3
CO2
Na2CO3 NaOH
Ba(OH)2
Ca(OH)2
Na2SO4 NaOH
Ba(OH)2
Ca(OH)2
酸、碱、盐性质的应用--物质的转化
CuSO4 Cu(OH)2
NaOH
FeCl3 Fe(OH)3
NaOH
其他可溶性碱
其他可溶性碱
② Cu(OH)2 CuSO4
H2SO4
③ Fe(OH)3 FeCl3
HCl
碱 ←→ 盐
盐 ←→ 盐
酸、碱、盐性质的应用--物质的转化
Ba(NO3)2
①Na2SO4 NaNO3
②NaCl NaNO3
③ Na2CO3 NaNO3
④ CuCl2 KCl
⑤ BaCO3 BaCl2
AgNO3
Ba(NO3)2
Ca(NO3)2
KOH
HCl
①KNO3 → K2CO3
②NaNO3 → Na2SO4
③NaCl→ Na2CO3
下列物质的转化不能经过一步实现,说明其原因。
酸、碱、盐性质的应用--物质的转化
KNO3和NaNO3中的Na+ 、K+、NO3-
不能与其他离子结合成沉淀,因此不能发生复分解反应。
加入的盐要含有CO32-,同时要与Cl-结合成沉淀,就得含有Ag+。而碳酸银不溶于水,不能与其他盐发生复分解反应
课堂精练
通过一步化学反应,不能实现下列物质间转化的是:
A. CuCl2→Cu(OH)2
B. MgO→MgCl2
C. Ba(NO3)2→Ba(OH)2
D. NaCl→NaNO3
C
https://www.21cnjy.com/help/help_extract.php
课题1 生活中常见的盐
第十一单元 盐 化肥
九年级化学下册课件(人教版)
第5课时
酸、碱、盐的化学性质网络图
酸
碱
盐
金属
指示剂
金属氧化物
非金属
氧化物
盐
探究新知
酸、碱、盐的化学性质
1. 酸 + 金属 = 盐 + 氢气
4. 酸 + 碱 = 盐 + 水
3. 酸 + 金属氧化物 = 盐 + 水
5. 酸 + 盐 = 新酸 + 新盐
8. 碱 + 非金属氧化物 = 盐 + 水
6. 碱 + 盐 = 新碱 + 新盐
2. 盐 + 金属 = 新盐 + 新金属
7. 盐1 + 盐2 = 新盐1 + 新盐2
置换反应
复分解反应
非基本反应类型
探究新知
讨论交流:哪些反应可以生成盐
盐
酸+金属氧化物
碱+非金属氧化物
酸+金属
盐+金属
酸+碱
酸+盐
碱+盐
盐+盐
1.下列白色固体仅用水就能鉴别,说出它们溶解时的现象。
NaCl
(溶于水,形成蓝色溶液)
(溶于水,放出热量,温度升高)
(不溶于水,形成悬浊液)
(溶于水,吸收热量,温度降低)
(溶于水,形成无色溶液)
NaOH
NH4Cl
CuSO4
CaCO3
酸、碱、盐性质的应用--物质的鉴别
酸、碱、盐性质的应用--物质的鉴别
2. 鉴别 HCl 和 NaOH可以选择哪些试剂?
石蕊溶液
酚酞溶液
活泼金属
碳酸盐、碳酸氢盐
含Cu2+、 Fe3+的可溶性盐
pH试纸
检验酸碱性
检验H+
检验OH-
酸、碱、盐性质的应用--物质的鉴别
3. 要验证氢氧化钠是否变质,可以选择哪些试剂?
稀盐酸
注意:
检验氢氧化钠是否变质,即检验Na2CO3的存在。
不能选择指示剂,因为NaOH和Na2CO3溶液均为碱性。
CaCl2
BaCl2
稀硫酸
有气泡则变质
有沉淀则变质
课堂精练
下列试剂能将稀硫酸、氯化钠溶液、澄清石灰水三种溶液一步鉴别出来的是:
A.稀盐酸 B.碳酸钠溶液
C.二氧化碳 D.无色酚酞溶液
B
下列各组溶液,仅用组内相互滴加的方法即可鉴别,说出具体的鉴别方法
FeCl3 KOH HCl NaCl
KNO3 BaCl2 NaOH CuSO4
K2CO3 H2SO4 HNO3 BaCl2
Na2CO3 NaOH HCl BaCl2
酸、碱、盐性质的应用--物质的鉴别
下列各组溶液,仅用组内相互滴加的方法即可鉴别,说出具体的鉴别方法
FeCl3 KOH HCl NaCl
酸、碱、盐性质的应用--物质的鉴别
①FeCl3溶液为黄色
②KOH能与FeCl3反应生成红褐色沉淀
③HCl能使Fe(OH)3沉淀溶解
下列各组溶液,仅用组内相互滴加的方法即可鉴别,说出具体的鉴别方法
KNO3 BaCl2 NaOH CuSO4
酸、碱、盐性质的应用--物质的鉴别
①CuSO4溶液为蓝色
②NaOH能与CuSO4反应生成蓝色沉淀
③BaCl2能与CuSO4反应生成白色沉淀
下列各组溶液,仅用组内相互滴加的方法即可鉴别,说出具体的鉴别方法
Na2CO3 NaOH HCl BaCl2
酸、碱、盐性质的应用--物质的鉴别
①Na2CO3与BaCl2反应生成白色沉淀
在相互滴加的过程中,既能生成气体又能生成沉淀的是Na2CO3
只生成沉淀的是BaCl2 ;只生成气体的是HCl,无现象的是NaOH
②Na2CO3与HCl反应生成无色气体
下列各组溶液,仅用组内相互滴加的方法即可鉴别,说出具体的鉴别方法
K2CO3 H2SO4 HNO3 BaCl2
酸、碱、盐性质的应用--物质的鉴别
①BaCl2与K2CO3反应生成白色沉淀【BaCO3】
②BaCl2与H2SO4反应生成白色沉淀【BaSO4】
③HNO3能与使BaCO3沉淀溶解
在相互滴加的过程中,能两次生成沉淀的是BaCl2,不能生成沉淀的是HNO3,能生成一次沉淀且沉淀能溶于硝酸的是K2CO3,能生成一次沉淀且沉淀不能溶于硝酸的是H2SO4 。
碱 ←→ 盐
酸、碱、盐性质的应用--物质的转化
①NaOH NaCl
③NaOH Na2SO4
②NaOH NaNO3
④NaOH Na2CO3
HCl
H2SO4
HNO3
CO2
Na2CO3 NaOH
Ba(OH)2
Ca(OH)2
Na2SO4 NaOH
Ba(OH)2
Ca(OH)2
酸、碱、盐性质的应用--物质的转化
CuSO4 Cu(OH)2
NaOH
FeCl3 Fe(OH)3
NaOH
其他可溶性碱
其他可溶性碱
② Cu(OH)2 CuSO4
H2SO4
③ Fe(OH)3 FeCl3
HCl
碱 ←→ 盐
盐 ←→ 盐
酸、碱、盐性质的应用--物质的转化
Ba(NO3)2
①Na2SO4 NaNO3
②NaCl NaNO3
③ Na2CO3 NaNO3
④ CuCl2 KCl
⑤ BaCO3 BaCl2
AgNO3
Ba(NO3)2
Ca(NO3)2
KOH
HCl
①KNO3 → K2CO3
②NaNO3 → Na2SO4
③NaCl→ Na2CO3
下列物质的转化不能经过一步实现,说明其原因。
酸、碱、盐性质的应用--物质的转化
KNO3和NaNO3中的Na+ 、K+、NO3-
不能与其他离子结合成沉淀,因此不能发生复分解反应。
加入的盐要含有CO32-,同时要与Cl-结合成沉淀,就得含有Ag+。而碳酸银不溶于水,不能与其他盐发生复分解反应
课堂精练
通过一步化学反应,不能实现下列物质间转化的是:
A. CuCl2→Cu(OH)2
B. MgO→MgCl2
C. Ba(NO3)2→Ba(OH)2
D. NaCl→NaNO3
C
https://www.21cnjy.com/help/help_extract.php
同课章节目录
