江苏省徐州市宁海学校高一2012年12月月考化学试题(无答案)
文档属性
| 名称 | 江苏省徐州市宁海学校高一2012年12月月考化学试题(无答案) |  | |
| 格式 | zip | ||
| 文件大小 | 107.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-12-30 09:46:23 | ||
图片预览

文档简介
徐州市宁海学校2012—2013学年度第一学期十二月学情检测
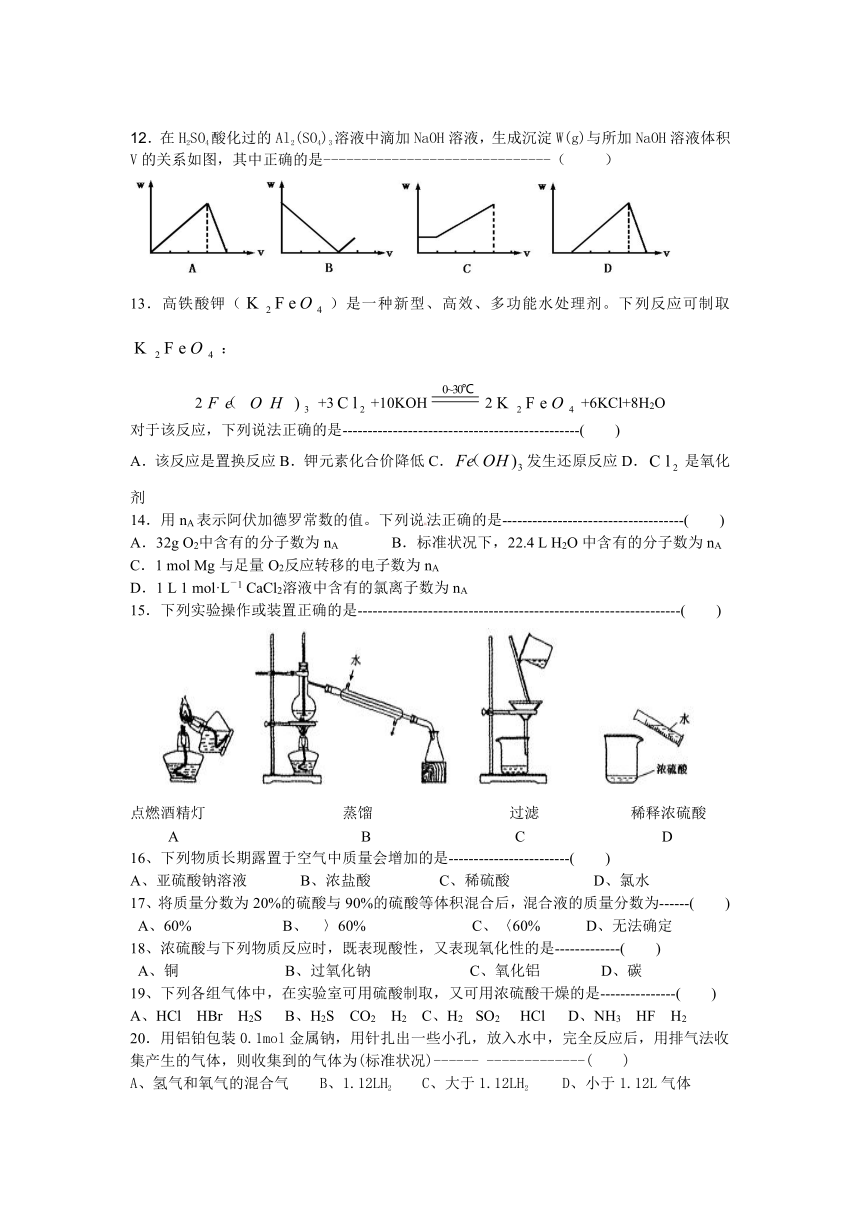
高一化学试卷
考试时间:100mins(12月28日9:30—10:30)
可能用到相对原子质量:
H 1 C、12 O、16 N、14 S、32 Ca 40 Cl 35.5 K 39 He 4 Fe56 Na 23 Mg 24 Fe 56 Zn 65 Al 27
一、单选题(本题包括20小题,每小题3分,共60分,每小题只有一个选项符合题意)
1.硅是带来人类文明的重要元素之一。下列物质中主要成分是硅酸盐的是----------( )
A.陶瓷 B.金刚石 C.水晶 D.大理石
2.用生石灰中和法阻止海水酸化是人们的一种设想。生石灰(CaO)属于-----------------( )
A.酸 B.碱 C.盐 D.氧化物
3.小明血液化验单中“葡萄糖”一项的结果为4.94×10-3 mol·L-1。这里的“4.94×10-3 mol·L-1”表示葡萄糖的---------------------------------( )
A.物质的量 B.摩尔质量 C.质量分数 D.物质的量浓度
4.常温下,下列物质可以用铝制容器盛装的是--------------------------------------------------( )
A.氢氧化钠溶液 B.稀硫酸 C.浓盐酸 D.浓硫酸
5.高铁的快速发展方便了人们的出行。工业上利用铝热反应焊接钢轨间的缝隙,反应方程式如下:2Al+Fe2O32Fe+Al2O3,其中Fe2O3是-----------------------------------( )
A.氧化剂 B.还原剂 C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
6.下列有关物质用途的说法错误的是------------------------------------------------------------( )
A.过氧化钠可用作潜艇里氧气的来源 B.单质硅是光导纤维的主要成分
C.乙醇可用作燃料 D.食醋可用于清除暖水瓶中的水垢
7.下列实验方法正确的是--------------------------------------------------------------------------( )
A.用NaOH溶液鉴别SO2和CO2 B.用丁达尔效应鉴别FeCl3溶液和Fe(OH)3胶体
C.用Na2CO3溶液鉴别HCl溶液和H2SO4溶液 D.用焰色反应鉴别NaCl和NaNO3
8.下列试剂能用玻璃塞试剂瓶保存的是---------------------------------------------------------( )
A.氢氧化钠溶液 B.硅酸钠溶液 C.浓盐酸 D.碳酸钠溶液
9、能证明SO2具有漂白性的是--------------------------------------------------------------------( )
A、SO2通入紫色的酸性KMnO4溶液中,发现紫色褪去B、SO2通入品红溶液中,红色褪去
C、显红色的酚酞通入SO2后红色褪去 D、SO2通入溴水中橙色褪去
10、检验SO2气体中是否混有CO2气体。可采用的方法是----------------------------------( )
A、通过品红溶液 B、通过澄清石灰水
C、先通过NaOH溶液再通过澄清石灰水 D、先通过酸性KMnO4溶液再通过澄清石灰水
11.下列反应的离子方程式书写正确的是---------------------------------------------------------( )
A.钠和水反应Na+H2O=Na++OH-+H2↑
B.盐酸与氢氧化钠溶液反应H++OH-=H2O
C.三氯化铁腐蚀印刷线路板Fe3++Cu=Fe2++Cu2+
D.盐酸与碳酸钙反应制备二氧化碳CO32-+2H+=CO2↑+H2O
12.在H2SO4酸化过的Al2(SO4)3溶液中滴加NaOH溶液,生成沉淀W(g)与所加NaOH溶液体积V的关系如图,其中正确的是------------------------------( )
13.高铁酸钾()是一种新型、高效、多功能水处理剂。下列反应可制取:
2+3+10KOH2+6KCl+8H2O
对于该反应,下列说法正确的是-----------------------------------------------( )
A.该反应是置换反应B.钾元素化合价降低C.发生还原反应D.是氧化剂
14.用nA表示阿伏加德罗常数的值。下列说法正确的是------------------------------------( )
A.32g O2中含有的分子数为nA B.标准状况下,22.4 L H2O中含有的分子数为nA
C.1 mol Mg与足量O2反应转移的电子数为nA
D.1 L 1 mol·L-1 CaCl2溶液中含有的氯离子数为nA
15.下列实验操作或装置正确的是----------------------------------------------------------------( )
点燃酒精灯 蒸馏 过滤 稀释浓硫酸
A B C D
16、下列物质长期露置于空气中质量会增加的是------------------------( )
A、亚硫酸钠溶液 B、浓盐酸 C、稀硫酸 D、氯水
17、将质量分数为20%的硫酸与90%的硫酸等体积混合后,混合液的质量分数为------( )
A、60% B、 〉60% C、〈60% D、无法确定
18、浓硫酸与下列物质反应时,既表现酸性,又表现氧化性的是-------------( )
A、铜 B、过氧化钠 C、氧化铝 D、碳
19、下列各组气体中,在实验室可用硫酸制取,又可用浓硫酸干燥的是---------------( )
A、HCl HBr H2S B、H2S CO2 H2 C、H2 SO2 HCl D、NH3 HF H2
20.用铝铂包装0.1mol金属钠,用针扎出一些小孔,放入水中,完全反应后,用排气法收
集产生的气体,则收集到的气体为(标准状况)------ -------------( )
A、氢气和氧气的混合气 B、1.12LH2 C、大于1.12LH2 D、小于1.12L气体
21、将铜片与浓硫酸共热,把生成的气体通入下列溶液中,能和溶质反应,最后得到无色澄清溶液的是-------------------------------------------------------- ( )
A、亚硫酸氢钠溶液 B、氢硫酸 C、氢氧化钠溶液 D、紫色石蕊溶液
22.某溶液中可能含有下列6种离子中的某几种:、、、、、。为确认溶液组成进行如下实验:(1)200mL上述溶液,加入足量溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4、30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是---------------------------------------------------------------------------------( )
A.一定存在、、,可能存在、、
B.一定存在、、、,一定不存在、
C.c()=0.01mol·L-1,>
D.如果上述6种离子都存在,则c()>
23、50ml18mol/l硫酸的溶液中加入足量的铜片并加热,被还原的硫酸的物质的量是-( )
A、小于0.45mol B、等于0.9mol C、大于0.5 mol小于0.9 mol D、等于0.45mol一、选择题(每题只有一个正确答案,每题2分,共60分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
题号
13
14
15
16
17
18
19
20
21
22
23
24
答案
题号
25
26
27
28
29
30
答案
24、玻璃是重要的硅酸盐产品。生产玻璃时,石灰石与石英反应的化学方程式为 。
25、保持洁净安全的生存环境已成为全人类的共识,人与自然要和谐相处。pH<
的雨水称为酸雨;向煤中加入适量的 (填化学式),可以大大减少燃物产物中SO2的量。
26.实验室常采用下列方法制取气体A、B,①Na2SO3与浓硫酸反应产生气体A;气体A具
有刺激性气味且可以使品红溶液褪色,经加热后又变红;②MnO2与浓盐酸在加热条件下产生气体B;试回答下列问题:
(1)分别写出两种气体的化学式:A__________________、B___________。
(2)写出制取以上两种气体的化学方程式:①________ _
②________________________ _。
(3)把气体A和B按物质的量之比1∶1通入水中,生成两种强酸,试写出该反应的离子方程式:_____________,其中________是还原剂,________是氧化剂。
(4)气体A和潮湿的气体B皆可作漂白剂,若用两者(体积比1∶1)同时漂白一种物质时,漂白效果会______。A.增强 B.不变 C.减弱 D.以上都有可能
27.下图是一些常见的单质.化合物之间的转化关系图,有些反应中的部分物质被略去。常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质。反应①②均为工业上的重要反应。
请回答下列问题:(1)K的化学式为__________。(2)写出B与C高温反应生成E和F的化学方程式:______________。(3)写出D与J的稀溶液反应生成G的离子方程式:______________。
高一化学试卷
考试时间:100mins(12月28日9:30—10:30)
可能用到相对原子质量:
H 1 C、12 O、16 N、14 S、32 Ca 40 Cl 35.5 K 39 He 4 Fe56 Na 23 Mg 24 Fe 56 Zn 65 Al 27
一、单选题(本题包括20小题,每小题3分,共60分,每小题只有一个选项符合题意)
1.硅是带来人类文明的重要元素之一。下列物质中主要成分是硅酸盐的是----------( )
A.陶瓷 B.金刚石 C.水晶 D.大理石
2.用生石灰中和法阻止海水酸化是人们的一种设想。生石灰(CaO)属于-----------------( )
A.酸 B.碱 C.盐 D.氧化物
3.小明血液化验单中“葡萄糖”一项的结果为4.94×10-3 mol·L-1。这里的“4.94×10-3 mol·L-1”表示葡萄糖的---------------------------------( )
A.物质的量 B.摩尔质量 C.质量分数 D.物质的量浓度
4.常温下,下列物质可以用铝制容器盛装的是--------------------------------------------------( )
A.氢氧化钠溶液 B.稀硫酸 C.浓盐酸 D.浓硫酸
5.高铁的快速发展方便了人们的出行。工业上利用铝热反应焊接钢轨间的缝隙,反应方程式如下:2Al+Fe2O32Fe+Al2O3,其中Fe2O3是-----------------------------------( )
A.氧化剂 B.还原剂 C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
6.下列有关物质用途的说法错误的是------------------------------------------------------------( )
A.过氧化钠可用作潜艇里氧气的来源 B.单质硅是光导纤维的主要成分
C.乙醇可用作燃料 D.食醋可用于清除暖水瓶中的水垢
7.下列实验方法正确的是--------------------------------------------------------------------------( )
A.用NaOH溶液鉴别SO2和CO2 B.用丁达尔效应鉴别FeCl3溶液和Fe(OH)3胶体
C.用Na2CO3溶液鉴别HCl溶液和H2SO4溶液 D.用焰色反应鉴别NaCl和NaNO3
8.下列试剂能用玻璃塞试剂瓶保存的是---------------------------------------------------------( )
A.氢氧化钠溶液 B.硅酸钠溶液 C.浓盐酸 D.碳酸钠溶液
9、能证明SO2具有漂白性的是--------------------------------------------------------------------( )
A、SO2通入紫色的酸性KMnO4溶液中,发现紫色褪去B、SO2通入品红溶液中,红色褪去
C、显红色的酚酞通入SO2后红色褪去 D、SO2通入溴水中橙色褪去
10、检验SO2气体中是否混有CO2气体。可采用的方法是----------------------------------( )
A、通过品红溶液 B、通过澄清石灰水
C、先通过NaOH溶液再通过澄清石灰水 D、先通过酸性KMnO4溶液再通过澄清石灰水
11.下列反应的离子方程式书写正确的是---------------------------------------------------------( )
A.钠和水反应Na+H2O=Na++OH-+H2↑
B.盐酸与氢氧化钠溶液反应H++OH-=H2O
C.三氯化铁腐蚀印刷线路板Fe3++Cu=Fe2++Cu2+
D.盐酸与碳酸钙反应制备二氧化碳CO32-+2H+=CO2↑+H2O
12.在H2SO4酸化过的Al2(SO4)3溶液中滴加NaOH溶液,生成沉淀W(g)与所加NaOH溶液体积V的关系如图,其中正确的是------------------------------( )
13.高铁酸钾()是一种新型、高效、多功能水处理剂。下列反应可制取:
2+3+10KOH2+6KCl+8H2O
对于该反应,下列说法正确的是-----------------------------------------------( )
A.该反应是置换反应B.钾元素化合价降低C.发生还原反应D.是氧化剂
14.用nA表示阿伏加德罗常数的值。下列说法正确的是------------------------------------( )
A.32g O2中含有的分子数为nA B.标准状况下,22.4 L H2O中含有的分子数为nA
C.1 mol Mg与足量O2反应转移的电子数为nA
D.1 L 1 mol·L-1 CaCl2溶液中含有的氯离子数为nA
15.下列实验操作或装置正确的是----------------------------------------------------------------( )
点燃酒精灯 蒸馏 过滤 稀释浓硫酸
A B C D
16、下列物质长期露置于空气中质量会增加的是------------------------( )
A、亚硫酸钠溶液 B、浓盐酸 C、稀硫酸 D、氯水
17、将质量分数为20%的硫酸与90%的硫酸等体积混合后,混合液的质量分数为------( )
A、60% B、 〉60% C、〈60% D、无法确定
18、浓硫酸与下列物质反应时,既表现酸性,又表现氧化性的是-------------( )
A、铜 B、过氧化钠 C、氧化铝 D、碳
19、下列各组气体中,在实验室可用硫酸制取,又可用浓硫酸干燥的是---------------( )
A、HCl HBr H2S B、H2S CO2 H2 C、H2 SO2 HCl D、NH3 HF H2
20.用铝铂包装0.1mol金属钠,用针扎出一些小孔,放入水中,完全反应后,用排气法收
集产生的气体,则收集到的气体为(标准状况)------ -------------( )
A、氢气和氧气的混合气 B、1.12LH2 C、大于1.12LH2 D、小于1.12L气体
21、将铜片与浓硫酸共热,把生成的气体通入下列溶液中,能和溶质反应,最后得到无色澄清溶液的是-------------------------------------------------------- ( )
A、亚硫酸氢钠溶液 B、氢硫酸 C、氢氧化钠溶液 D、紫色石蕊溶液
22.某溶液中可能含有下列6种离子中的某几种:、、、、、。为确认溶液组成进行如下实验:(1)200mL上述溶液,加入足量溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4、30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是---------------------------------------------------------------------------------( )
A.一定存在、、,可能存在、、
B.一定存在、、、,一定不存在、
C.c()=0.01mol·L-1,>
D.如果上述6种离子都存在,则c()>
23、50ml18mol/l硫酸的溶液中加入足量的铜片并加热,被还原的硫酸的物质的量是-( )
A、小于0.45mol B、等于0.9mol C、大于0.5 mol小于0.9 mol D、等于0.45mol一、选择题(每题只有一个正确答案,每题2分,共60分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
题号
13
14
15
16
17
18
19
20
21
22
23
24
答案
题号
25
26
27
28
29
30
答案
24、玻璃是重要的硅酸盐产品。生产玻璃时,石灰石与石英反应的化学方程式为 。
25、保持洁净安全的生存环境已成为全人类的共识,人与自然要和谐相处。pH<
的雨水称为酸雨;向煤中加入适量的 (填化学式),可以大大减少燃物产物中SO2的量。
26.实验室常采用下列方法制取气体A、B,①Na2SO3与浓硫酸反应产生气体A;气体A具
有刺激性气味且可以使品红溶液褪色,经加热后又变红;②MnO2与浓盐酸在加热条件下产生气体B;试回答下列问题:
(1)分别写出两种气体的化学式:A__________________、B___________。
(2)写出制取以上两种气体的化学方程式:①________ _
②________________________ _。
(3)把气体A和B按物质的量之比1∶1通入水中,生成两种强酸,试写出该反应的离子方程式:_____________,其中________是还原剂,________是氧化剂。
(4)气体A和潮湿的气体B皆可作漂白剂,若用两者(体积比1∶1)同时漂白一种物质时,漂白效果会______。A.增强 B.不变 C.减弱 D.以上都有可能
27.下图是一些常见的单质.化合物之间的转化关系图,有些反应中的部分物质被略去。常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质。反应①②均为工业上的重要反应。
请回答下列问题:(1)K的化学式为__________。(2)写出B与C高温反应生成E和F的化学方程式:______________。(3)写出D与J的稀溶液反应生成G的离子方程式:______________。
同课章节目录
