第12章盐同步练习—2021-2022学年九年级化学京改版(2013)下册(word版 含答案)
文档属性
| 名称 | 第12章盐同步练习—2021-2022学年九年级化学京改版(2013)下册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 134.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-16 08:12:46 | ||
图片预览


文档简介
第12章盐同步练习2021-2022学年九年级化学京改版(2013)下册
一、单选题
1.下列物质的性质与用途,不相匹配的是( )
A.氧气可以支持燃烧 工业上可用作燃料
B.氮气的化学性质定稳 工业上可用作焊接保护气
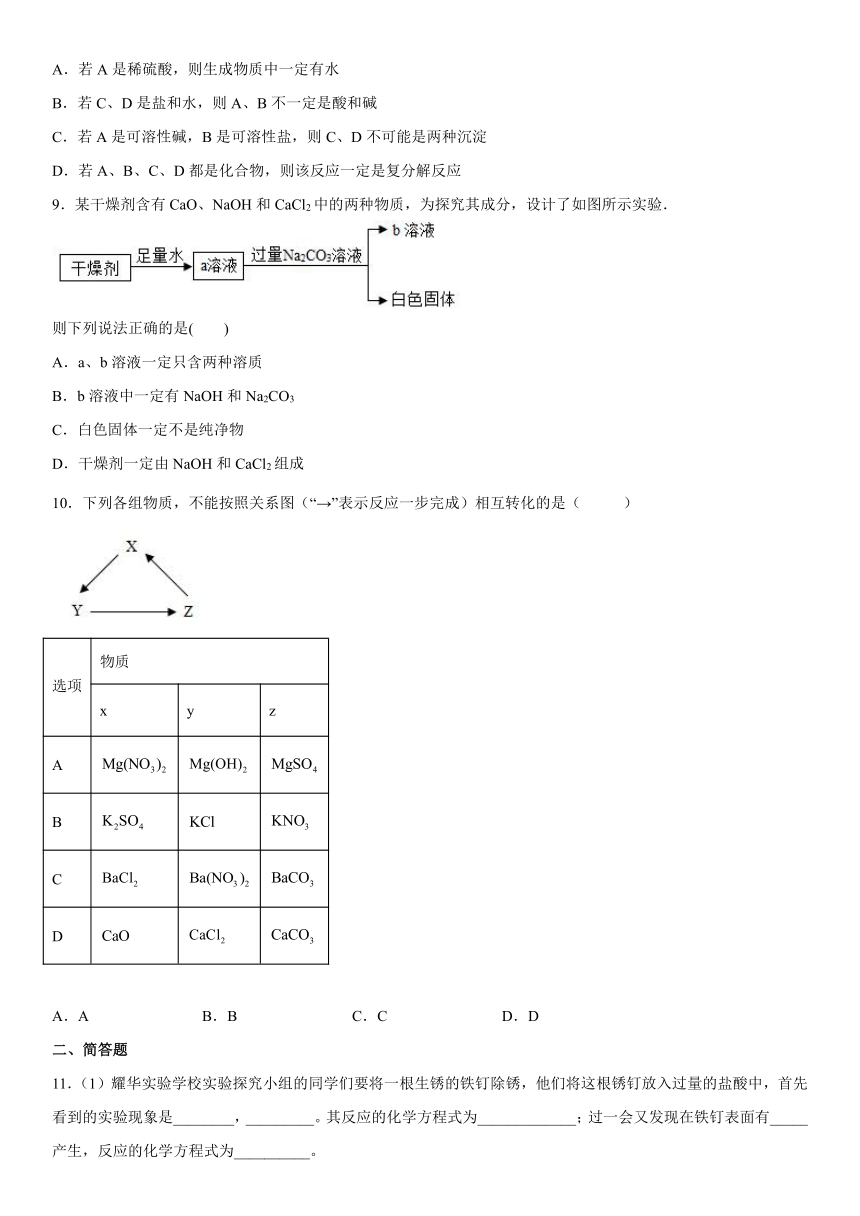
C.白醋含有醋酸,显酸性 家庭中可用作除水垢
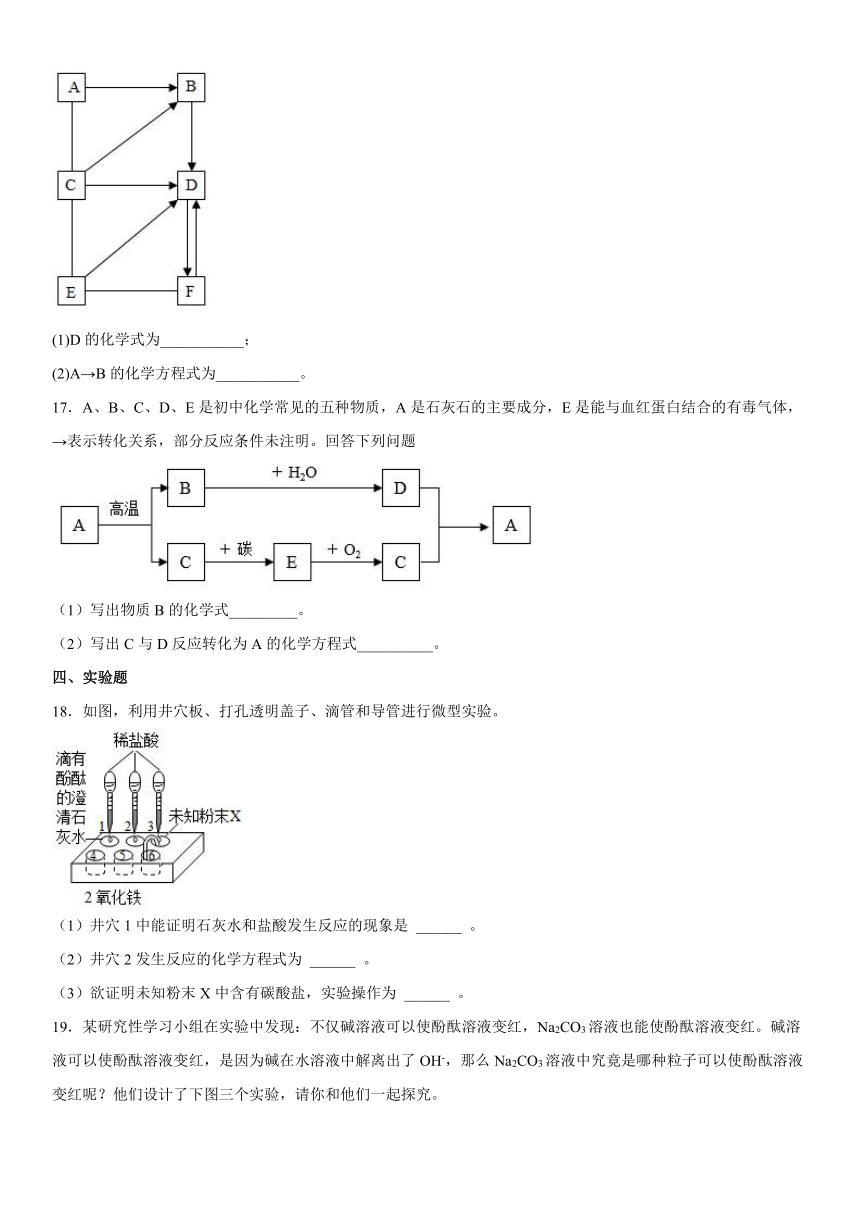
D.硫酸钡既不溶于水,也不与酸反应 医疗上可用于“钡餐”造影
2.叶子发黄的水稻易倒伏,专家建议施用含钾的复合肥料。下列肥料符合要求的是
A.NH4NO3 B.KNO3 C.NH4H2PO4 D.K2SO4
3.某pH=12的无色溶液中大量存在的离子有Na+、Ba2+、NO、X,则X可能是
A.Cu2+ B.Cl- C.H+ D.SO
4.合理使用化肥,有利于农作物的生长和减少环境污染。下列有关化肥的说法不正确的是
A.为保证高产尽量多施用化肥
B.不能将氯化铵与碱性物质混合施用
C.KNO3是一种常用的复合肥料
D.提倡将农家肥与化肥综合使用
5.下列物质的性质与用途具有对应关系的是
A.碳酸钙难溶于水,可用作补钙剂
B.浓硫酸有腐蚀性,实验室可用作干燥剂
C.活性炭有吸附性,可除去水中色素和异味
D.二氧化碳能与水反应,可作制冷剂用于人工降雨
6.对CO2、C2H2、H2CO3、Ca(HCO3)2、Na2CO3五种物质的判断,正确的是
A.C2H2、H2CO3都是有机物
B.CO2、H2CO3都属于氧化物
C.Ca(HCO3)2、Na2CO3都属于盐
D.H2CO3、Na2CO3溶液都显酸性
7.下列说法不正确的是( )
A.细铁丝在氧气中燃烧时,火星四射,生成黑色固体
B.红磷在空气中燃烧产生大量的白雾
C.硫在氧气中燃烧生成有刺激性气味的气体
D.少量氯化铵与少量熟石灰粉末混合、研磨,放出刺激性气味气体
8.对化学反应A+B=C+D的下列说法中正确的是( )
A.若A是稀硫酸,则生成物质中一定有水
B.若C、D是盐和水,则A、B不一定是酸和碱
C.若A是可溶性碱,B是可溶性盐,则C、D不可能是两种沉淀
D.若A、B、C、D都是化合物,则该反应一定是复分解反应
9.某干燥剂含有CaO、NaOH和CaCl2中的两种物质,为探究其成分,设计了如图所示实验.
则下列说法正确的是( )
A.a、b溶液一定只含两种溶质
B.b溶液中一定有NaOH和Na2CO3
C.白色固体一定不是纯净物
D.干燥剂一定由NaOH和CaCl2组成
10.下列各组物质,不能按照关系图(“→”表示反应一步完成)相互转化的是( )
选项 物质
x y z
A
B
C
D
A.A B.B C.C D.D
二、简答题
11.(1)耀华实验学校实验探究小组的同学们要将一根生锈的铁钉除锈,他们将这根锈钉放入过量的盐酸中,首先看到的实验现象是________,_________。其反应的化学方程式为_____________;过一会又发现在铁钉表面有_____产生,反应的化学方程式为__________。
(2)硫酸和盐酸是实验室常用的试剂,也是重要的化工原料,它们既有相似之处,又有不同之点。
①它们水溶液的 pH 都__________(选填“>”“=”或“<”)7。
②它们都能除铁锈,写出硫酸与铁锈的主要成分反应的化学方程式___________。
③它们都能与碱反应生成盐和水,该类反应叫__________反应,其化学反应基本类型是复分解反应。
④打开两瓶分别盛有浓硫酸和浓盐酸的试剂瓶,瓶口出现白雾的是盛有______的试剂瓶,白雾形成的原因是___________。
12.在一只大烧杯里盛有10%的CuSO4水溶液,插入两个电极,同时在电路中连接一个灯泡,若在这时接通电源,请回答下列问题。
(1)灯泡是否会发亮?为什么?
(2)往烧杯中逐滴加入适量的Ba(OH)2溶液,灯泡亮度有何变化?为什么?
(3)当两种物质恰好完全反应时,会有什么现象?为什么?
(4)继续加入Ba(OH)2溶液,灯泡亮度又将如何变化?
13.为了除去粗盐中的CaCl2、MgCl2、Na2SO4等可溶性杂质,进行如下操作:① 溶解;②依次加过量的BaCl2、NaOH、Na2CO3溶液;③过滤;④加适量盐酸;
⑤蒸发结晶。其中加入Na2CO3溶液的作用是___________; 操作③中所用到的玻璃仪器为______, 该操作得到的固体有CaCO3、BaCO3和___________。
三、推断题
14.宇轩同学在厨房里取得一种白色粉末A,到化学实验室进行探究,结果如图:
请回答下列问题:
(1)若A不含氢元素,则A与澄清石灰水反应的化学方程式为_______,其反应的基本类型是_______。
(2)若A含有氢元素,则它与盐酸反应的化学方程式为_______。
(3)B溶液中含有的微粒为_______。(用化学用语填空)
15.现有 X、Y、Z三瓶溶液,它们分别是Na2CO3溶液,FeCl3溶液及CuSO4溶液的任一种,分别取样滴加Ca(OH)2溶液:产生红褐色沉淀的是X溶液;产生白色沉淀的是Y溶液,产生蓝色沉淀的是Z溶液。试推断:X是___________;Y是____________;Z是___________。
16.已知A~F为初中化学常见的六种物质,B~F为五种不同类别的物质(指单质、氧化物、酸、碱、盐),D为常见的溶剂,各种物质间的反应和转化关系如图所示(“一”表示相连的两种物质之间可以发生反应,“→”表示一种物质可以转化为另一种物质,反应条件、部分反应物和生成物已略去)。
(1)D的化学式为___________;
(2)A→B的化学方程式为___________。
17.A、B、C、D、E是初中化学常见的五种物质,A是石灰石的主要成分,E是能与血红蛋白结合的有毒气体,→表示转化关系,部分反应条件未注明。回答下列问题
(1)写出物质B的化学式_________。
(2)写出C与D反应转化为A的化学方程式__________。
四、实验题
18.如图,利用井穴板、打孔透明盖子、滴管和导管进行微型实验。
(1)井穴1中能证明石灰水和盐酸发生反应的现象是 ______ 。
(2)井穴2发生反应的化学方程式为 ______ 。
(3)欲证明未知粉末X中含有碳酸盐,实验操作为 ______ 。
19.某研究性学习小组在实验中发现:不仅碱溶液可以使酚酞溶液变红,Na2CO3溶液也能使酚酞溶液变红。碱溶液可以使酚酞溶液变红,是因为碱在水溶液中解离出了OH-,那么Na2CO3溶液中究竟是哪种粒子可以使酚酞溶液变红呢?他们设计了下图三个实验,请你和他们一起探究。
(1)实验Ⅰ可以证明_____。
(2)实验Ⅱ加入蒸馏水的目的是_____。小组内有同学认为实验Ⅱ没必要做,你认为他们的理由是_____。
(3)实验Ⅲ滴入Na2CO3溶液,振荡,酚酞溶液变红,向变红后的溶液中再逐渐滴入过量的CaCl2溶液,红色逐渐消失,同时还观察到_____现象。由实验Ⅰ、Ⅱ、Ⅲ得出结论:CO32-可以使酚酞溶液变红。
(4)小组同学在与老师交流上述结论时,老师说:“其实Na2CO3溶液能使酚酞溶液变红也是由于溶液中存在OH-。”你认为Na2CO3溶液存在OH-的原因是_____。
20.工业烧碱具有较好的杀菌消毒作用且廉价易得,但工业烧碱中含有一种杂质碳酸钠。某科学学习小组同学围绕工业“烧碱”样品纯度测定问题,展开了讨论与探究。
【原理思路】利用Na2CO3与稀H2SO4反应产生CO2,通过CO2质量的测定,确定样品中碳酸钠的质量,从而计算工业“烧碱”样品纯度。
【实验方案】根据以上思路,小科设计的方案是:利用如图甲的装置(固定装置省略),通过测定反应前后整套装置和药品的总质量的减少量确定CO2质量。
(1)小科按该方案进行测定,加入足量稀硫酸充分反应后,发现最终测得碳酸钠的质量明显偏低。你认为导致测得的“碳酸钠”的质量明显偏低的原因是______;
【方案改进】为减少误差,小组同学经讨论,对小科方案进行改进,设计了如图乙的实验方案(固定装置省略)。通过测定反应前后D质量的变化。
(2)图乙B装置中样品在与足量稀硫酸反应前和停止反应后,都要鼓入足量的空气,在反应前通空气时,a、b、c三个弹簧夹的控制方法是______。
(3)若撤去图乙中的A和E装置,则测得工业“烧碱”的纯度将______(选填“偏高”“偏低”或“无影响”)。
(4)按改进后的图乙实验方案进行实验,发现测得的工业“烧碱”的纯度明显偏高,从实验操作上分析产生上述结果的原因是______(写出一种即可)。
五、计算题
21.长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁。某研究性学习小组为测定水垢中碳酸钙的质量分数,将100.0g稀盐酸加人到10.0g水垢中。恰好完全反应后,容器内剩余物质的质量为106.7g。请回答:
(1)生成CO2气体的质量为________g。
(2)求测得水垢中碳酸钙的质量分数。
22.化学兴趣小组为测定某小苏打样品(含NaCl杂质)中碳酸氢钠的含量,进行以下实验:称取10.0g样品,放入锥形瓶中,加水溶解。向该溶液中分两次加入稀盐酸,发生反应,锥形瓶及溶液质量的变化如图所示(忽略CO2在水中的溶解)。请计算:
(1)NaCl的化学式量为______。
(2)当第一次加入40.0g盐酸时,产生二氧化碳的质量是______g。
(3)样品中 NaHCO3的质量分数。
23.在100 g的某盐酸中加入硝酸银溶液,反应为AgNO3+HCl=HNO3+AgCl↓,至恰好完全反应,经过滤、洗涤、干燥、称量得到质量为28.7 g的AgCl沉淀,求盐酸的溶质质量分数。
试卷第1页,共3页
参考答案:
1.A
2.B
3.B
4.A
5.C
6.C
7.B
8.B
9.B
10.B
11.铁锈逐渐消失 溶液由无色变成浅黄色 Fe2O3+6HCl═2FeCl3+3H2O 气泡 Fe+2HCl═FeCl2+H2↑ < Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O 中和反应 浓盐酸 浓盐酸挥发出的氯化氢气体遇到空气中水蒸气形成的盐酸小液滴
12. (1)在CuSO4水溶液中存在着大量的和,当接通电源时,自由离子定向移动而导电,所以灯泡会发亮;(2)当向烧杯中逐滴滴入Ba(OH)2溶液时,灯泡逐渐变暗。原因是随着Ba(OH)2溶液加入,生成Cu(OH)2和BaSO4沉淀,致使溶液中的离子逐渐减少,灯泡变暗。反应原理为;(3)当两种物质完全反应时,灯泡熄灭。因为此时溶液中的离子几乎全部沉淀了;(4)继续加入Ba(OH)2溶液,灯泡由暗变明,此时,溶液中存在Ba(OH)2电离产生的离子,故溶液又能导电了
13. 除去杂质 CaCl2 和过量的 BaCl2 烧杯、玻璃棒、漏斗 Mg(OH)2 和 BaSO4
14. 复分解反应 Na+、Cl- 、H2O
15. FeCl3溶液 Na2CO3溶液 CuSO4溶液
16.(1)H2O
(2)Fe+2HCl=FeCl2+H2↑(其他答案合理即可)
17. CaO CO2 + Ca(OH)2 = CaCO3↓+ H2O
18. 红色溶液变成无色 6HCl+Fe2O3=2FeCl3 +3H2O 在孔穴6中加入澄清石灰水,将稀盐酸挤入孔穴3
19. Na+不会使酚酞溶液变红 探究水分子是否能使酚酞溶液变红 酚酞溶液中就有水分子(或氯化钠溶液中含有水分子) 白色沉淀 碳酸根离子与水反应生成OH-(合理即可)
20.(1)反应生成的二氧化碳部分留在装置中
(2)打开ab,关闭c
(3)偏低
(4)反应后没有鼓入足量的空气
21.(1)3.3;
(2)解:设水垢中碳酸钙的质量分数为x
x=75%。
答:水垢中碳酸钙的质量分数为75%。
22.(1)58.5
(2)4.4g
(3)解:设碳酸氢钠质量分数为x。
x=84%
答:样品中 NaHCO3的质量分数84%。
23.7.3%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列物质的性质与用途,不相匹配的是( )
A.氧气可以支持燃烧 工业上可用作燃料
B.氮气的化学性质定稳 工业上可用作焊接保护气
C.白醋含有醋酸,显酸性 家庭中可用作除水垢
D.硫酸钡既不溶于水,也不与酸反应 医疗上可用于“钡餐”造影
2.叶子发黄的水稻易倒伏,专家建议施用含钾的复合肥料。下列肥料符合要求的是
A.NH4NO3 B.KNO3 C.NH4H2PO4 D.K2SO4
3.某pH=12的无色溶液中大量存在的离子有Na+、Ba2+、NO、X,则X可能是
A.Cu2+ B.Cl- C.H+ D.SO
4.合理使用化肥,有利于农作物的生长和减少环境污染。下列有关化肥的说法不正确的是
A.为保证高产尽量多施用化肥
B.不能将氯化铵与碱性物质混合施用
C.KNO3是一种常用的复合肥料
D.提倡将农家肥与化肥综合使用
5.下列物质的性质与用途具有对应关系的是
A.碳酸钙难溶于水,可用作补钙剂
B.浓硫酸有腐蚀性,实验室可用作干燥剂
C.活性炭有吸附性,可除去水中色素和异味
D.二氧化碳能与水反应,可作制冷剂用于人工降雨
6.对CO2、C2H2、H2CO3、Ca(HCO3)2、Na2CO3五种物质的判断,正确的是
A.C2H2、H2CO3都是有机物
B.CO2、H2CO3都属于氧化物
C.Ca(HCO3)2、Na2CO3都属于盐
D.H2CO3、Na2CO3溶液都显酸性
7.下列说法不正确的是( )
A.细铁丝在氧气中燃烧时,火星四射,生成黑色固体
B.红磷在空气中燃烧产生大量的白雾
C.硫在氧气中燃烧生成有刺激性气味的气体
D.少量氯化铵与少量熟石灰粉末混合、研磨,放出刺激性气味气体
8.对化学反应A+B=C+D的下列说法中正确的是( )
A.若A是稀硫酸,则生成物质中一定有水
B.若C、D是盐和水,则A、B不一定是酸和碱
C.若A是可溶性碱,B是可溶性盐,则C、D不可能是两种沉淀
D.若A、B、C、D都是化合物,则该反应一定是复分解反应
9.某干燥剂含有CaO、NaOH和CaCl2中的两种物质,为探究其成分,设计了如图所示实验.
则下列说法正确的是( )
A.a、b溶液一定只含两种溶质
B.b溶液中一定有NaOH和Na2CO3
C.白色固体一定不是纯净物
D.干燥剂一定由NaOH和CaCl2组成
10.下列各组物质,不能按照关系图(“→”表示反应一步完成)相互转化的是( )
选项 物质
x y z
A
B
C
D
A.A B.B C.C D.D
二、简答题
11.(1)耀华实验学校实验探究小组的同学们要将一根生锈的铁钉除锈,他们将这根锈钉放入过量的盐酸中,首先看到的实验现象是________,_________。其反应的化学方程式为_____________;过一会又发现在铁钉表面有_____产生,反应的化学方程式为__________。
(2)硫酸和盐酸是实验室常用的试剂,也是重要的化工原料,它们既有相似之处,又有不同之点。
①它们水溶液的 pH 都__________(选填“>”“=”或“<”)7。
②它们都能除铁锈,写出硫酸与铁锈的主要成分反应的化学方程式___________。
③它们都能与碱反应生成盐和水,该类反应叫__________反应,其化学反应基本类型是复分解反应。
④打开两瓶分别盛有浓硫酸和浓盐酸的试剂瓶,瓶口出现白雾的是盛有______的试剂瓶,白雾形成的原因是___________。
12.在一只大烧杯里盛有10%的CuSO4水溶液,插入两个电极,同时在电路中连接一个灯泡,若在这时接通电源,请回答下列问题。
(1)灯泡是否会发亮?为什么?
(2)往烧杯中逐滴加入适量的Ba(OH)2溶液,灯泡亮度有何变化?为什么?
(3)当两种物质恰好完全反应时,会有什么现象?为什么?
(4)继续加入Ba(OH)2溶液,灯泡亮度又将如何变化?
13.为了除去粗盐中的CaCl2、MgCl2、Na2SO4等可溶性杂质,进行如下操作:① 溶解;②依次加过量的BaCl2、NaOH、Na2CO3溶液;③过滤;④加适量盐酸;
⑤蒸发结晶。其中加入Na2CO3溶液的作用是___________; 操作③中所用到的玻璃仪器为______, 该操作得到的固体有CaCO3、BaCO3和___________。
三、推断题
14.宇轩同学在厨房里取得一种白色粉末A,到化学实验室进行探究,结果如图:
请回答下列问题:
(1)若A不含氢元素,则A与澄清石灰水反应的化学方程式为_______,其反应的基本类型是_______。
(2)若A含有氢元素,则它与盐酸反应的化学方程式为_______。
(3)B溶液中含有的微粒为_______。(用化学用语填空)
15.现有 X、Y、Z三瓶溶液,它们分别是Na2CO3溶液,FeCl3溶液及CuSO4溶液的任一种,分别取样滴加Ca(OH)2溶液:产生红褐色沉淀的是X溶液;产生白色沉淀的是Y溶液,产生蓝色沉淀的是Z溶液。试推断:X是___________;Y是____________;Z是___________。
16.已知A~F为初中化学常见的六种物质,B~F为五种不同类别的物质(指单质、氧化物、酸、碱、盐),D为常见的溶剂,各种物质间的反应和转化关系如图所示(“一”表示相连的两种物质之间可以发生反应,“→”表示一种物质可以转化为另一种物质,反应条件、部分反应物和生成物已略去)。
(1)D的化学式为___________;
(2)A→B的化学方程式为___________。
17.A、B、C、D、E是初中化学常见的五种物质,A是石灰石的主要成分,E是能与血红蛋白结合的有毒气体,→表示转化关系,部分反应条件未注明。回答下列问题
(1)写出物质B的化学式_________。
(2)写出C与D反应转化为A的化学方程式__________。
四、实验题
18.如图,利用井穴板、打孔透明盖子、滴管和导管进行微型实验。
(1)井穴1中能证明石灰水和盐酸发生反应的现象是 ______ 。
(2)井穴2发生反应的化学方程式为 ______ 。
(3)欲证明未知粉末X中含有碳酸盐,实验操作为 ______ 。
19.某研究性学习小组在实验中发现:不仅碱溶液可以使酚酞溶液变红,Na2CO3溶液也能使酚酞溶液变红。碱溶液可以使酚酞溶液变红,是因为碱在水溶液中解离出了OH-,那么Na2CO3溶液中究竟是哪种粒子可以使酚酞溶液变红呢?他们设计了下图三个实验,请你和他们一起探究。
(1)实验Ⅰ可以证明_____。
(2)实验Ⅱ加入蒸馏水的目的是_____。小组内有同学认为实验Ⅱ没必要做,你认为他们的理由是_____。
(3)实验Ⅲ滴入Na2CO3溶液,振荡,酚酞溶液变红,向变红后的溶液中再逐渐滴入过量的CaCl2溶液,红色逐渐消失,同时还观察到_____现象。由实验Ⅰ、Ⅱ、Ⅲ得出结论:CO32-可以使酚酞溶液变红。
(4)小组同学在与老师交流上述结论时,老师说:“其实Na2CO3溶液能使酚酞溶液变红也是由于溶液中存在OH-。”你认为Na2CO3溶液存在OH-的原因是_____。
20.工业烧碱具有较好的杀菌消毒作用且廉价易得,但工业烧碱中含有一种杂质碳酸钠。某科学学习小组同学围绕工业“烧碱”样品纯度测定问题,展开了讨论与探究。
【原理思路】利用Na2CO3与稀H2SO4反应产生CO2,通过CO2质量的测定,确定样品中碳酸钠的质量,从而计算工业“烧碱”样品纯度。
【实验方案】根据以上思路,小科设计的方案是:利用如图甲的装置(固定装置省略),通过测定反应前后整套装置和药品的总质量的减少量确定CO2质量。
(1)小科按该方案进行测定,加入足量稀硫酸充分反应后,发现最终测得碳酸钠的质量明显偏低。你认为导致测得的“碳酸钠”的质量明显偏低的原因是______;
【方案改进】为减少误差,小组同学经讨论,对小科方案进行改进,设计了如图乙的实验方案(固定装置省略)。通过测定反应前后D质量的变化。
(2)图乙B装置中样品在与足量稀硫酸反应前和停止反应后,都要鼓入足量的空气,在反应前通空气时,a、b、c三个弹簧夹的控制方法是______。
(3)若撤去图乙中的A和E装置,则测得工业“烧碱”的纯度将______(选填“偏高”“偏低”或“无影响”)。
(4)按改进后的图乙实验方案进行实验,发现测得的工业“烧碱”的纯度明显偏高,从实验操作上分析产生上述结果的原因是______(写出一种即可)。
五、计算题
21.长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁。某研究性学习小组为测定水垢中碳酸钙的质量分数,将100.0g稀盐酸加人到10.0g水垢中。恰好完全反应后,容器内剩余物质的质量为106.7g。请回答:
(1)生成CO2气体的质量为________g。
(2)求测得水垢中碳酸钙的质量分数。
22.化学兴趣小组为测定某小苏打样品(含NaCl杂质)中碳酸氢钠的含量,进行以下实验:称取10.0g样品,放入锥形瓶中,加水溶解。向该溶液中分两次加入稀盐酸,发生反应,锥形瓶及溶液质量的变化如图所示(忽略CO2在水中的溶解)。请计算:
(1)NaCl的化学式量为______。
(2)当第一次加入40.0g盐酸时,产生二氧化碳的质量是______g。
(3)样品中 NaHCO3的质量分数。
23.在100 g的某盐酸中加入硝酸银溶液,反应为AgNO3+HCl=HNO3+AgCl↓,至恰好完全反应,经过滤、洗涤、干燥、称量得到质量为28.7 g的AgCl沉淀,求盐酸的溶质质量分数。
试卷第1页,共3页
参考答案:
1.A
2.B
3.B
4.A
5.C
6.C
7.B
8.B
9.B
10.B
11.铁锈逐渐消失 溶液由无色变成浅黄色 Fe2O3+6HCl═2FeCl3+3H2O 气泡 Fe+2HCl═FeCl2+H2↑ < Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O 中和反应 浓盐酸 浓盐酸挥发出的氯化氢气体遇到空气中水蒸气形成的盐酸小液滴
12. (1)在CuSO4水溶液中存在着大量的和,当接通电源时,自由离子定向移动而导电,所以灯泡会发亮;(2)当向烧杯中逐滴滴入Ba(OH)2溶液时,灯泡逐渐变暗。原因是随着Ba(OH)2溶液加入,生成Cu(OH)2和BaSO4沉淀,致使溶液中的离子逐渐减少,灯泡变暗。反应原理为;(3)当两种物质完全反应时,灯泡熄灭。因为此时溶液中的离子几乎全部沉淀了;(4)继续加入Ba(OH)2溶液,灯泡由暗变明,此时,溶液中存在Ba(OH)2电离产生的离子,故溶液又能导电了
13. 除去杂质 CaCl2 和过量的 BaCl2 烧杯、玻璃棒、漏斗 Mg(OH)2 和 BaSO4
14. 复分解反应 Na+、Cl- 、H2O
15. FeCl3溶液 Na2CO3溶液 CuSO4溶液
16.(1)H2O
(2)Fe+2HCl=FeCl2+H2↑(其他答案合理即可)
17. CaO CO2 + Ca(OH)2 = CaCO3↓+ H2O
18. 红色溶液变成无色 6HCl+Fe2O3=2FeCl3 +3H2O 在孔穴6中加入澄清石灰水,将稀盐酸挤入孔穴3
19. Na+不会使酚酞溶液变红 探究水分子是否能使酚酞溶液变红 酚酞溶液中就有水分子(或氯化钠溶液中含有水分子) 白色沉淀 碳酸根离子与水反应生成OH-(合理即可)
20.(1)反应生成的二氧化碳部分留在装置中
(2)打开ab,关闭c
(3)偏低
(4)反应后没有鼓入足量的空气
21.(1)3.3;
(2)解:设水垢中碳酸钙的质量分数为x
x=75%。
答:水垢中碳酸钙的质量分数为75%。
22.(1)58.5
(2)4.4g
(3)解:设碳酸氢钠质量分数为x。
x=84%
答:样品中 NaHCO3的质量分数84%。
23.7.3%
答案第1页,共2页
答案第1页,共2页
